基于细胞形变量和介电泳力的癌细胞分离装置及控制系统的制作方法
本发明涉及细胞分选分离技术领域,特别涉及一种基于细胞形变量和介电泳力的癌细胞分离装置及控制系统。
背景技术:
癌症是一种严重危害人类健康的重大疾病,其发病率和死亡率呈逐年上升的趋势。对于相同来源的细胞,发生癌变的细胞比正常细胞更软,更容易产生变形,更易于癌症发生转移。长期以来,机械表型一直被认为是量化细胞中生理和病理起源的功能变化的无标记方法。这种方法已经在细胞分化和恶性转移的背景下得到验证,并催生了许多基础研究方法的发展。其中,单细胞的变形性的改变可以作为一种生物学研究的重要指标。相对于生物分子标记物,这种无标记的可变形性的指标不需要染色、抗体处理等一些预处理步骤,可节省更多的操作成本。
细胞在癌变的过程中,细胞的变形性质就已经发生了变化。处于不同癌变阶段的细胞,其变形能力是不同的。这表明通过测量细胞的刚度,原则上可以区分处于不同癌变程度的细胞,这为监控癌症从侵袭前到侵袭的发生发展提供了一种可能。细胞的变形性可以作为细胞癌变的敏感标志,因此测量细胞刚度具有重要的临床意义。目前检测细胞变形性的方法主要有原子力显微镜方法、微管吸吮技术、细胞压痕、激光衍射法、流体剪切法等。这些测量方法各有优缺点,如微管吸吮方法是目前研究细胞力学常用的方法之一,但是此方法一次只能反映单个细胞变形性,检测速率低(10-100个细胞/h),不适合临床应用;而原子力显微镜方法操作复杂,设备昂贵,检测速率同样很低。因此设计一种高通量的癌细胞形变量的方法是十分有必要的。高通量检测病变部位细胞的刚度,不仅可以判断病人处于癌症的阶段,并且可以根据细胞刚度的不同,对细胞进行分离。
虽然检测细胞形变量的方法很多,但是这些方法仅仅检测细胞的刚度,未考虑将细胞的这种无标记的特征作为癌细胞分离的依据。基于细胞的变形性特征作为分离标志对于癌症的研究和诊断有重大的潜在意义,可用于癌症的分期、复发检测、癌症抗药性的分子分析等。
目前,现有的细胞分离技术如离心法和过滤法耗费时间长、产率低、需要的样本量大,不适合微量珍贵样品的分析;基于抗体的方法能够得到特定类型的细胞却需要复杂的处理过程。如今,微流控芯片的微通道缩小到微米级,可以精确操控微尺度的流体,样品以及试剂的消耗量得以大大降低,反应时间大大缩短,非常适合细胞分离。随着微流控技术的发展,介电泳力技术被引入到微流控芯片上,用于微粒、液滴以及细胞的分离和操纵。对于介电泳力技术来说,其通过在非均匀电场中使微粒产生极化现象,在介电泳力的作用下驱使细胞运动。介电泳力的大小与被操纵的粒子的尺寸成比例,根据不同细胞在微流控芯片中所受介电泳力的差异,从而实现对细胞的分离。基于介电泳力的微流控芯片用于细胞的分离有诸多优点,首先,不需要染色或者抗体处理;其次,生物相容性好,不会对细胞产生损伤;最后,便于控制,可以通过调节施加电场的电压和频率改变细胞的所受的介电泳力,因此对细胞进行分离比较灵活。
尽管基于介电泳力的分离方法有诸多优点,但是却不能根据标记物分离特定目标的细胞。
技术实现要素:
本发明的目的是提供一种基于细胞形变量和介电泳力的癌细胞分离装置及控制系统,能够快速检测细胞的形变量,并根据癌细胞与正常细胞形变量的不同将癌细胞从病人血液样本中分离出来。
为实现上述目的,本发明提供了如下方案:
一种基于细胞形变量和介电泳力的癌细胞分离装置,所述癌细胞分离装置包括细胞储液器、注射微泵、led灯、细胞形变量检测芯片、癌细胞分离芯片、cmos高速摄像机以及处理器;
所述细胞储液器内放置细胞悬浮液;所述细胞悬浮液为待检测细胞;
所述注射微泵的一端伸入所述细胞储液器内,所述注射微泵的另一端通过聚合物管与所述细胞形变量检测芯片的入口端相连;所述细胞形变量检测芯片的出口端与所述癌细胞分离芯片的变形细胞入口端相连;所述癌细胞分离芯片还设有鞘流入口端、正常细胞出口端和癌细胞出口端;
所述led灯设置在所述细胞形变量检测芯片上且对所述细胞形变量检测芯片内的变形细胞进行照射,所述cmos高速摄像机设置在所述细胞形变量检测芯片下且对所述细胞形变量检测芯片内的变形细胞进行拍摄;
所述处理器的输入端与所述cmos高速摄像机连接,所述处理器的输出端与所述癌细胞分离芯片内的电极连接。
可选的,所述细胞形变量检测芯片包括第一玻璃基底和含有微缩通道的盖片;所述微缩通道依次包括第一通道、收缩通道和第二通道;所述收缩通道的横截面为正方形;所述收缩通道的横截面的尺寸为25μm*25μm;所述第一通道和所述第二通道的直径均为1.5mm。
可选的,所述微缩通道的长度为5mm。
可选的,所述癌细胞分离芯片包括第二玻璃基底和含有微通道的盖片;在所述微通道的内壁一侧镶嵌多个齿状结构的电极,且相邻电极的极性相反;所述电极产生的介电泳力作用于所述微通道内的变形细胞。
可选的,所述微通道的高为60μm,所述微通道的宽度为3mm;所述第二玻璃基底的厚度为500μm。
可选的,所述电极是通过将200nm厚的铂电极溅射在20nm厚的钛粘合层上,然后通过剥离图案化后形成。
可选的,所述电极上铺一层多孔水凝胶层。
可选的,所述癌细胞分离装置还包括连接通道;所述细胞形变量检测芯片的出口端通过所述连接通道与所述癌细胞分离芯片的变形细胞入口端相连。
可选的,所述注射微泵用于提供驱动力。
本发明还提供了一种基于细胞形变量和介电泳力的癌细胞分离控制系统,所述癌细胞分离控制系统包括:
所述cmos高速摄像机用于捕捉细胞形变量检测芯片内的变形细胞图像;
所述处理器包括处理模块和判断模块;
所述处理模块,与所述cmos高速摄像机连接,用于获取所述变形细胞图像,并对所述变形细胞图像进行处理,确定变形细胞的形变量;
所述判断模块,与所述电极连接,用于判断所述变形细胞的形变量是否大于预先存储在所述处理器的设定阈值,并当所述变形细胞的形变量大于所述设定阈值时输出驱动信号,将所述驱动信号传输至所述电极以驱动所述电极产生介电泳力使所述变形细胞流向癌细胞分离芯片的癌细胞出口端;当所述变形细胞的形变量小于或者等于所述设定阈值时不输出驱动信号,所述变形细胞流向所述癌细胞分离芯片的正常细胞出口端;所述设定阈值为正常细胞形变量与癌细胞形变量的分界值。
根据本发明提供的具体实施例,本发明公开了以下技术效果:
本发明提供了一种基于细胞形变量和介电泳力的癌细胞分离装置及控制系统,该装置包括内放置细胞悬浮液的细胞储液器、注射微泵;注射微泵的一端伸入细胞储液器内,另一端与细胞形变量检测芯片的入口端相连;细胞形变量检测芯片的出口端与癌细胞分离芯片的变形细胞入口端相连;癌细胞分离芯片还设有鞘流入口端、正常细胞出口端和癌细胞出口端;led灯设置在细胞形变量检测芯片上;cmos高速摄像机设置在细胞形变量检测芯片下来捕捉细胞形变量检测芯片内的变形细胞图像;处理器的输入端与cmos高速摄像机连接,处理器的输出端与癌细胞分离芯片的电极连接;该处理器根据获取的变形细胞图像确定变形细胞的形变量,并根据变形细胞的形变量确定该变形细胞是否为癌细胞,若是则处理器输出驱动信号驱动电极产生介电泳力使变形细胞流向癌细胞出口端。应用本发明,能够快速检测细胞的形变量,并根据癌细胞与正常细胞形变量的不同将癌细胞从病人血液样本中分离出来。
附图说明
为了更清楚地说明本发明实施例或现有技术中的技术方案,下面将对实施例中所需要使用的附图作简单地介绍,显而易见地,下面描述中的附图仅仅是本发明的一些实施例,对于本领域普通技术人员来讲,在不付出创造性劳动的前提下,还可以根据这些附图获得其他的附图。
图1为本发明实施例基于细胞形变量和介电泳力的癌细胞分离装置的结构示意图;
图2为本发明细胞形变量检测芯片的结构示意图以及收缩通道的局部放大图;
图3为本发明癌细胞形分离芯片的结构示意图。
具体实施方式
下面将结合本发明实施例中的附图,对本发明实施例中的技术方案进行清楚、完整地描述,显然,所描述的实施例仅仅是本发明一部分实施例,而不是全部的实施例。基于本发明中的实施例,本领域普通技术人员在没有做出创造性劳动前提下所获得的所有其他实施例,都属于本发明保护的范围。
由于细胞的变形性可作为一种无标记的方法用于癌细胞的识别,因此本发明提供了一种基于细胞形变量和介电泳力的癌细胞分离装置及控制系统,在检测样本细胞变形性的同时根据癌细胞和正常细胞的形变量的差异,将癌细胞从样本中分离出来。
为使本发明的上述目的、特征以及优点能够更加明显易懂,下面结合附图以及具体实施方式对本发明作进一步详细的说明。
图1为本发明实施例基于细胞形变量和介电泳力的癌细胞分离装置的结构示意图。
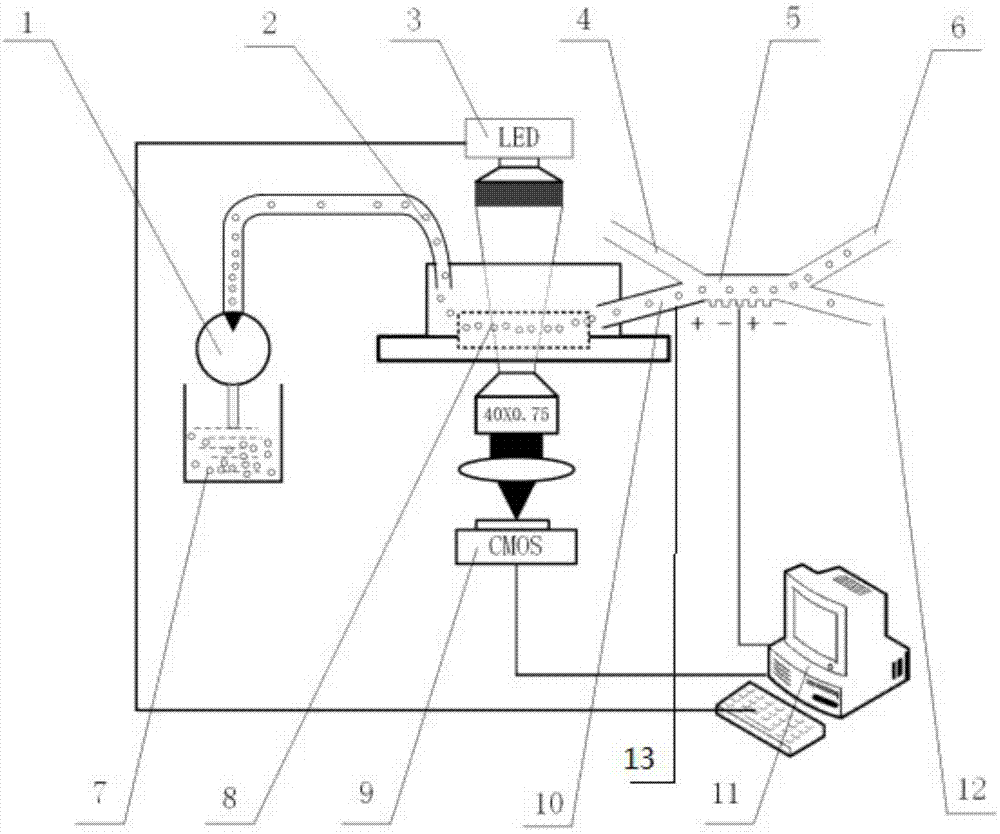
如图1所示,本发明实施例提供的基于细胞形变量和介电泳力的癌细胞分离装置包括注射微泵1、聚合物管2、led灯3、癌细胞分离芯片5、细胞储液器7、细胞形变量检测芯片8、cmos高速摄像机9、连接通道10以及处理器11;所述癌细胞分离芯片5设有变形细胞入口端13、鞘流入口端4、癌细胞出口端6和正常细胞出口端12。
所述细胞储液器7内放置细胞悬浮液;所述细胞悬浮液为待检测细胞。
所述注射微泵1的一端伸入所述细胞储液器7内,所述注射微泵1的另一端通过所述聚合物管2与所述细胞形变量检测芯片8的入口端相连;所述细胞形变量检测芯片8的出口端通过连接通道10与所述癌细胞分离芯片5的变形细胞入口端13。
所述led灯3设置在所述细胞形变量检测芯片8上且对所述细胞形变量检测芯片8内的变形细胞进行照射,所述cmos高速摄像机9设置在所述细胞形变量检测芯片8下且对所述细胞形变量检测芯片8内的变形细胞进行拍摄。
所述处理器11的输入端与所述cmos高速摄像机9连接,所述处理器11的输出端与所述癌细胞分离芯片5内的电极连接。
所述注射微泵1提供驱动力:所述注射微泵1安装在细胞形变量检测芯片8的入口端外面,通过聚合物管2与细胞形变量检测芯片8的入口端相连,保证密封性和生物相容性。将细胞储液器7中配置好的细胞悬浮液通过压力驱动进入细胞形变量检测芯片8内,并驱使细胞悬浮液在细胞形变量检测芯片8的微缩通道中流动。
图2为本发明细胞形变量检测芯片的结构示意图以及收缩通道的局部放大图,如图2所示,所述细胞形变量检测芯片8包括第一玻璃基底和含有微缩通道的盖片,两者通过等离子处理5分钟后键合;所述微缩通道依次包括第一通道、收缩通道和第二通道;所述收缩通道的横截面为正方形,所述收缩通道的横截面的尺寸为25μm*25μm,此设计主要是为了保证细胞的尺寸占微缩通道尺寸的50%-90%,保证同一时间只允许通过单个细胞。所述第一通道和所述第二通道的直径均为1.5mm。所述微缩通道的长度为5mm。微缩通道采用聚二甲基硅氧烷(pdms)材料,并标准光刻工艺制备而成。
细胞悬浮液通过细胞形变量检测芯片8的入口端进入微缩通道,在收缩通道检测细胞形变量,最后从细胞形变量检测芯片8的出口端流出。细胞流过收缩通道时,通过剪切应力和压力梯度而发生变形。
cmos高速摄像机9实时捕捉变形细胞图像,并将变形细胞图像发送至处理器11。通过处理器11内预先编写的算法获得细胞流过微缩通道时细胞的轮廓面积以及周长,计算变形细胞的形变量。处理器11内预先存储形变量的临界值,作为下一步癌细胞分离的依据,如果样本中检测到细胞的形变量大于临界尺寸,处理器11输出驱动信号,否则没有。
图3为本发明癌细胞形分离芯片的结构示意图,如图3所示,所述癌细胞分离芯片5包括第二玻璃基底和含有微通道的盖片。微通道的高为60μm,宽度为3mm。第二玻璃基底的厚度为500μm。癌细胞分离芯片5的微通道的材料仍然采用聚二甲基硅氧烷(pdms)。
微通道的制备工艺为:采用标准光刻工艺,通过构建20μm厚的su-8层,在电极顶部产生微通道。
在微通道内壁一侧镶嵌有多个齿状结构的电极,且正负电极交叉布置,用于在微通道内产生介电泳力;所述电极产生的介电泳力作用于所述微通道内的变形细胞。
癌细胞分离芯片5的微通道壁上的电极为铂金属,铂是一种惰性金属,在做电极时本身并不参与电极反应。
为了不损伤细胞,在铂电极上铺一层多孔水凝胶层,这样可以避免变形细胞与电极之间接触。
电极的制备工艺为:将200nm厚的铂电极溅射在20nm厚的钛粘合层上,并通过剥离进一步图案化,最终形成电极。
癌细胞分离芯片5分别有两个入口和两个出口,其中,变形细胞入口端13与细胞形变量检测芯片8的出口端相连,鞘流入口端4则通入不含有细胞的悬浮液(鞘流),在流体力作用下保证细胞悬浮液始终保持在含有电极的微通道壁的一侧,容易受到介电泳力的作用。两个出口分别为癌细胞出口端6和正常细胞出口端12。
上述的癌细胞形变量检测后,对每个细胞都会得到一个具体的形变量数据;根据设定的形变量的临界值,癌细胞的形变量会超过临界值,这时处理器11就会产生一个脉冲信号(驱动信号)发送给电极,使其产生介电泳力驱动癌细胞移向癌细胞出口端6;正常细胞的形变量小于临界值,处理器11不会产生激励信号,正常细胞沿着流速方向流向正常细胞出口端12。
本发明实施例提供的装置的使用过程为:
首先细胞储液器7放置细胞悬浮液,注射微泵1通过聚合物管2连接在细胞形变量检测芯片8上;在注射微泵1的压力作用下细胞进入细胞形变量检测芯片8,cmos高速摄像机9实时获得细胞的形变图像,与此同时处理器11进行图像分析,计算得到细胞的形变量;细胞形变量检测后,细胞悬浮液通过连接通道10进入癌细胞分离芯片5;形变量满足要求的癌细胞会触发电极工作,在介电泳力的作用下癌细胞移向癌细胞出口端6,而正常细胞在自然状态下流向正常细胞出口端12。
实施例二
本发明实施例提供了一种基于细胞形变量的癌细胞分离控制系统,此癌细胞分离控制系统应用于实施例一提供的装置上,所述癌细胞分离控制系统包括:所述cmos高速摄像机9用于捕捉细胞形变量检测芯片8内的变形细胞图像。
所述处理器11包括处理模块和判断模块。
所述处理模块,与所述cmos高速摄像机9连接,用于获取所述变形细胞图像,并对所述变形细胞图像进行处理,确定变形细胞的形变量。
所述判断模块,与所述电极连接,用于判断所述变形细胞的形变量是否大于预先存储在所述处理器的设定阈值,并当所述变形细胞的形变量大于所述设定阈值时输出驱动信号,将所述驱动信号传输至所述电极以驱动所述电极产生介电泳力使所述变形细胞流向癌细胞分离芯片5的癌细胞出口端6;当所述变形细胞的形变量小于或者等于所述设定阈值时不输出驱动信号,所述变形细胞流向所述癌细胞分离芯片5的正常细胞出口端12;所述设定阈值为正常细胞形变量与癌细胞形变量的分界值。
实施例三
本发明实施例提供了测量癌细胞形变量并基于介电泳力技术对其进行分离方法,具体实现步骤如下:
a、细胞的准备:提前准备好需要检测的血液样本,样本在115g下离心5min,然后重新悬浮在磷酸盐缓冲液(pbs)中,使得细胞最终的浓度为106cells/ml,每次检测只需100μl细胞悬浮液就满足要求了。配置等渗溶液,使实验时细胞悬浮液的电导率为0.55s/m。在将细胞悬浮液从细胞储液器7吸入1ml的注射微泵1之前,细胞悬浮液要放置在37℃下保持细胞活性。
b、实验装置准备:通过用乙醇(70%)和去离子水冲洗来彻底清洁注射器微泵1、聚合物管2以及细胞形变量检测芯片8、细胞分离芯片5的通道。在开始测量之前,流量在恒定流速下稳定2min。所有的数据采集都是在细胞形状达到稳定状态的300μm长的收缩部位的后部进行的。cmos高速摄像机9工作参数设置为曝光时间为1μs、工作帧数为4000f.p.s、感兴趣区域为250*80pixels。
c、工作时,注射微泵1维持细胞稀释液流速在0.04μl/s。细胞悬浮液在注射微泵1的驱动下通过聚合物管2进入细胞形变量检测芯片8。细胞形变量检测芯片8的微缩通道的收缩通道的变形细胞用脉冲高功率的led灯3照射,并用cmos高速摄像机9对微缩通道内变细胞进行成像。为了减少细胞通过微缩通道收缩孔时图像出现模糊,使用脉冲电流控制led灯3对样品进行照明,cmos高速摄像机9的快门触发脉冲以确保同步的图像曝光。
d、将cmos高速摄像机9获得的每一帧图像转换为灰度图。然后处理器11根据细胞与背景的程度进行阈值处理,进行canny边缘化提取,获得变形细胞的轮廓,最后计算变形细胞的轮廓面积和周长,确定变形细胞的形变量。
e、从细胞形变量检测芯片8流出的每一个细胞都得到对应的形变量。根据不同细胞系癌变细胞形变量的不同,设定正常细胞和癌变细胞形变量的临界值,作为下一步癌细胞分离的判断依据。
f、当细胞形变量检测芯片8处检测到样本中细胞的形变量大于分离的临界值时,认定该细胞为需要分离的癌细胞。鞘流入口端4的流速稍大于变形细胞入口端13的流速,保证变形细胞贴近电极一侧,使变形细胞容易受到介电泳力的影响。癌细胞分离芯片5的电极得到一个驱动信号,此时电极就会得到电压10vpp,驱动频率15khz。癌细胞在介电泳力的作用下,流向癌细胞出口端6。
g、当细胞形变量检测芯片8处检测到样本中细胞的形变量小于分离的临界值时,认定该细胞为正常细胞,电极不会得到任何信号。正常细胞在微通道中正常流动,流向正常细胞出口端12。
h、分别从癌细胞出口端6和正常细胞出口端12取出分离好的细胞,就能得到从样本中分离好的癌细胞和正常细胞。
本发明与现有技术相比较,具有如下显而易见的突出实质性特点和显著优点:
1)本发明可以在测量细胞的变形性的基础上对癌细胞进行分选,实现癌细胞形变量的检测和癌细胞分离的两种功能。
2)本发明检测细胞的形变量可以实现高通量,满足临床大量样本分析的需求。
3)对癌细胞进行分选是以其自身的机械特性作为依据的,是一种无标记的分离方法,这种无标记特性使得分离细胞比简单利用介电泳力进行癌细胞分离特异性高。
4)本发明的方法所需的设备简单可靠、操作简便。
具体个例对本发明的原理及实施方式进行了阐述,以上实施例的说明只是用于帮助理解本发明的方法及其核心思想;同时,对于本领域的一般技术人员,依据本发明的思想,在具体实施方式及应用范围上均会有改变之处。综上所述,本说明书内容不应理解为对本发明的限制。
- 还没有人留言评论。精彩留言会获得点赞!