一种基于声流体力学的血液分离装置
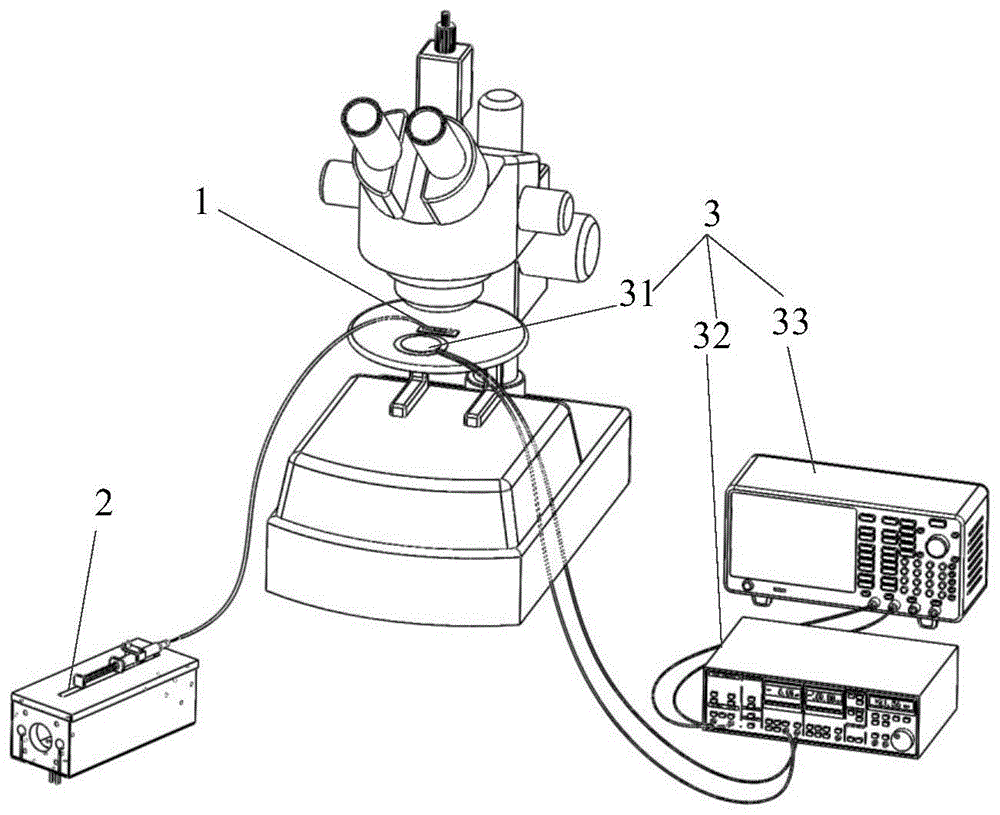
本申请涉及生物医学技术领域,尤其涉及一种基于声流体力学的血液分离装置。
背景技术:
细菌感染往往会引发多种疾病,不仅发病率高而且经常引发危重病情,因而需要及时诊治。目前,寻找细菌性疾病的根源大多需要先从细胞和细菌的混合物(如血液)中分离出特定细菌,再对该特定细菌进行分析处理,因而细菌分离技术在临床医学、生物工程等领域具有重大意义。
传统的细菌分离技术是在琼脂培养基中进行培养分离,此种方法需耗费大量时间,且要求操作人员具有较高的技术水平。目前,常采用离心技术对试样进行分离,然而试样在操作过程中经常会由于所受离心力过大而出现破裂的情况,导致细胞失活;且在分离时,需频繁开启和关闭设备来观察试样,了解试样分离的进展,由此也增大了设备的运行负担,缩减了设备的使用寿命;并且,离心技术需手动拿取试管进行观察,不仅操作繁琐,还增大了试样被污染的风险,影响试样的分离效果;再者,离心技术的分离精度较低。
此外,还有基于光镊技术的分离方法,但长时间激光照射会大量产热,从而损伤试样的活性;而基于磁场技术的方法,则需要被操作对象具备磁性;且上述两种方法的系统复杂,成本昂贵,因此上述两种方法实用性也较低。
在临床血液样本中,血液粘度高、成分复杂,却又急需分析结果,因此如何在不破坏试样结构的前提下,还能简单且高效地将目标细菌从血液中分离出来,是目前亟待解决的技术问题。
技术实现要素:
本申请旨在提供一种基于声流体力学的血液分离装置,所述血液分离装置不仅对血液中的微粒无损伤、可控性强,且能够简单高效地将目标细菌从血液中分离出来。
为了实现上述目的,本申请提供一种基于声流体力学的血液分离装置,包括:微流控芯片、微流泵和声波驱动系统。
所述微流控芯片包括微流道和玻璃基片,所述微流道键合在所述玻璃基片上。
所述微流道包括进口端、微流道腔室和出口端,所述微流道腔室的底面设置有阵列排布的微孔。
所述微流泵连接所述进口端,用于控制所述微流道中微流体的流速,并形成流场推力。
所述声波驱动系统包括压电换能器,所述压电换能器固定于所述玻璃基片表面,用于驱动阵列排布的微孔振动,产生声流捕获力。
所述微流体在所述微流泵的作用下,通过所述进口端进入所述微流道中,由阵列排布的微孔将所述微流体中大粒径的微粒捕获。
优选的,所述微流道腔室为矩形,长度为10mm、宽度为1mm、深度为0.2mm。
优选的,所述微孔的直径为100μm,深度为80μm;相邻的所述微孔之间的间距为100μm。
优选的,所述微流道腔室的棱角及棱边处均采用倒圆角设计。
优选的,所述压电换能器通过环氧树脂固定于所述玻璃基片表面,且紧贴所述微流道。
优选的,所述微流道采用聚二甲基硅氧烷材质,并利用模具一体成形。
优选的,所述进口端包括进口通道,所述进口通道的一端连接于所述微流道腔室的一端,所述进口通道的另一端构造有圆孔状的进管接口,所述进管接口连接所述微流泵;所述出口端包括出口通道,所述出口通道的一端连接于所述微流道腔室的另一端,所述出口通道的另一端构造有圆孔状的出管接口。
优选的,述进口通道和所述出口通道的宽度设置为200μm,深度与所述微流道腔室的深度一致;所述进管接口和所述出管接口的直径均为1mm。
优选的,所述声波驱动系统还包括连接所述压电换能器的信号发生器,用于产生设定波形的信号。
优选的,所述声波驱动系统还包括电压放大器,所述电压放大器连接于所述信号发生器和所述压电换能器之间,用于放大所述信号发生器所产生的信号。
本申请基于不同粒径的微粒在声流场所受的声流场力不同来进行分离,通过控制微粒所受声流捕获力与外加流场推力的大小,以实现粒径相对大的微粒被捕获,粒径相对小的微粒随流场游走。本申请所述的血液分离装置不仅对血液中的微粒无损伤、可控性强,且能够简单高效地将目标细菌从血液中分离出来。
附图说明
为了更清楚地说明本申请的技术方案,下面将对实施例中所需要使用的附图作简单地介绍,显而易见地,对于本领域普通技术人员而言,在不付出创造性劳动的前提下,还可以根据这些附图获得其他的附图。
图1为本申请实施例提供的应用场景图;
图2为本申请实施例提供的基于声流体力学的血液分离装置的结构示意图;
图3为本申请实施例提供的微流道的结构示意图;
图4为本申请实施例提供的基于声流体力学的血液分离装置的侧视图;
图5为本申请实施例提供的基于声流体力学的血液分离装置的分离示意图。
图中:1-微流控芯片,11-微流道,12-玻璃基片,111-进口端,1111-进口通道,1112-进管接口,112-微流道腔室,1121-微孔,113-出口端,1131-出口通道,1132-出管接口,2-微流泵,3-声波驱动系统,31-压电换能器,32-电压放大器,33-信号发生器。
具体实施方式
下面将结合本申请实施例中的附图,对本申请实施例中的技术方案进行完整、清楚的描述。显然,所描述的实施例仅仅是本申请一部分实施例,而不是全部的实施例。基于本申请中的实施例,本领域普通技术人员在没有做出创造性劳动前提下所获得的所有其他实施例,都属于本申请保护的范围。
参见图1,为本申请实施例提供的应用场景图。本申请实施例提供一种基于声流体力学的血液分离装置,包括:微流控芯片1、微流泵2和声波驱动系统3。在实际使用过程中,所述微流控芯片1设置于显微镜载物台上,所述微流泵2通过软管连接所述微流控芯片1,所述声波驱动系统3的压电换能器31固定于所述微流控芯片1上。所述微流泵2通过软管将微流体注入所述微流控芯片1中,所述微流体中的微粒在流场推力和所述声波驱动系统3产生的声流捕获力作用下进行分离,具体分离情况可以通过显微镜进行观察。
具体的,参见图2,所述微流控芯片1包括微流道11和玻璃基片12,所述微流道11键合在所述玻璃基片12上。
参见图3,本申请实施例中,所述微流道11包括进口端111、微流道腔室112和出口端113。所述微流道腔室112为矩形,且底面设置有阵列排布的圆柱体状微孔1121。本申请实施例采用透明封闭的微流道腔室112,以便于随时观测微粒的运动状态以及分离情况。
优选的,所述进口端111包括进口通道1111,所述进口通道1111的一端连接于所述微流道腔室112的一端,所述进口通道1111的另一端构造有圆孔状的进管接口1112,所述进管接口1112连接所述微流泵2,用于实现血液样本的注入;所述出口端113包括出口通道1131,所述出口通道1131的一端连接于所述微流道腔室112的另一端,所述出口通道1131的另一端构造有圆孔状的出管接口1132,用于将分离出的细菌微粒送至收集器皿中。
本申请实施例中,所述微流泵2连接所述进口端111,用于控制所述微流道11中微流体的流速,并形成流场推力。
参见图1、图2和图3,本申请实施例中,所述声波驱动系统3包括依次连接的压电换能器31、电压放大器32和信号发生器33,所述压电换能器31通过环氧树脂固定于所述玻璃基片12表面,且紧贴所述微流道11,用于驱动阵列排布的微孔1121振动,并产生声流捕获力;所述信号发生器33用于产生设定波形的信号;所述电压放大器32用于放大所述信号发生器33所产生的信号。
本申请实施例中,所述微流体在所述微流泵2的作用下,通过所述进口端111进入所述微流道11中,在声流场力的作用下,由阵列排布的微孔1121将所述微流体中粒径相对大的微粒捕获,粒径相对小的微粒则随微流体通过所述出口端113流出血液分离装置,进入收集器皿。
本申请实施例中,微流控芯片1的设计原理具体如下:首先,在信号发生器33和电压放大器32的驱动下,压电换能器31将电信号转化为机械信号,并产生振动。由于压电换能器31、玻璃基片12和微流道11三者粘接在一起,因此振动信号最后可传递至微流道腔室112底面阵列排布的微孔1121中。参见图4,由于粘性耗散,微孔1121周围产生压力差,并在微孔1121内外形成两种方向相反的微声流,在此被称之为孔内声流和孔外声流,利用这两种声流,该微流控芯片1具备捕获和分离功能。
利用孔外声流的运动特性,位于微孔1121附近的微粒能够在斯托克斯拖曳力fd(由声流场产生,主要力)和声辐射力frad(由声场产生,次要力)共同作用下,被捕获到微孔1121中;之后在孔内声流的作用下,微粒可以牢牢地固定在微孔1121中。
其中:
fd=6πηr(<v2>-u);
具体的,r表示微粒半径,urad表示声辐射力势,
参见图5,当不同大小的微粒以相同的流速在微流道11内运动时,运动中的微粒主要受两种作用力,声流的捕获力和流场施加的推力。其中,声流的捕获力主要表现为斯托克斯拖曳力fd和声辐射力frad,而从上述计算公式中可以看出,斯托克斯拖曳力fd和声辐射力frad均与微粒半径有着密切关系,即半径大的微粒所受的力更大。因此,当作用在微粒上的声流的捕获力大于流场施加的推力时,微粒就被捕获;反之,微粒就随着流场一起向前运动,以此实现不同大小微粒的分离操作。
优选的,本实施申请例中,考虑到实验样本的大小和制造精度,矩形微流道腔室112的长度为10mm、宽度为1mm、深度为0.2mm;同时在其内部底面设计的阵列排布的微孔1121为圆柱形状,所述微孔1121的直径为100μm,深度为80μm,相邻微孔1121之间的间距为100μm。
优选的,本实施申请例中,所述微流道腔室112的棱角及棱边处均采用倒圆角设计,主要是为了避免直角构造产生的声流对后续实验分析造成影响。
优选的,本申请实施例中,所述微流道11采用聚二甲基硅氧烷材质,并利用模具一体成形。聚二甲基硅氧烷是用于制造微流控芯片1的理想材料之一,具有热稳定性高、生物兼容性强、透气透光性好,且易于在显微镜下观察的特性。
优选的,本实施实施例中,所述进口通道1111和所述出口通道1131的宽度设置为200μm,深度与所述微流道腔室112的深度一致,以便于流体的运动更顺畅;所述进管接口1112和所述出管接口1132的直径均为1mm。
在临床检测中,血液样本中以血细胞和细菌为主,其中血细胞又以红细胞和白细胞为主,红细胞粒径为6-10μm,白细胞粒径为7-20μm,而大多数细菌的粒径都小于5μm。
基于上述原理,本申请实施例所述的血液分离装置的分离原理为:所述微流泵2通过进管接口1112将血液样本以一定的速度注入到微流道11中,此时血液中各种成分(以血细胞和细菌为主)均受到外部流场的推力而向出口方向运动;当声场开启时,微流控芯片1内阵列排布的微孔1121随之振动,并在其周围产生涡流,此时,流经微孔1121附近的血细胞和细菌除了受到流场推力之外,还受到主要包含斯托克斯拖曳力fd和声辐射力frad的声流捕获力。在相同的流速下,血细胞和细菌受到同样大小的流场推力,但由于血细胞的粒径大于细菌的粒径,因而血细胞受到的声流捕获力大于细菌所受的声流捕获力。通过控制压电换能器31的振动强度,使作用在血细胞上的声流捕获力大于流场推力,而该流场推力大于作用在细菌微粒上的声流捕获力,从而使粒径相对大一些的血细胞被微孔1121捕获并固定在微孔1121中,而粒径相对小一些的细菌微粒就随着流场一起向前运动,通过出管接口1132进入收集器皿,以此实现了从血液中分离出细菌微粒的操作。
进一步的,在分离出目标细菌微粒的基础上,还能通过上述原理对细菌微粒进一步分离,比如分离细菌微粒中的革兰氏阴阳性菌。由于革兰氏阴阳性菌的大小差异不明显,可通过在分离操作前用修饰gn6适体的微球(10μm)与革兰阴性菌结合,以此增大革兰阴性菌的尺寸,再利用本申请实施例所述的血液分离装置进行分离。其中,gn6适体的特异性在于它只与革兰阴性菌结合而不与革兰阳性菌结合。
本申请实施例中,目标细菌并不限定于某一种细菌微粒,只要细菌微粒的粒径与血液中其他微粒的粒径存在较大差异,就能通过本申请实施例所述的血液分离装置进行分离。
基于声流体力学的分离技术在细菌分离应用中显示了巨大的潜力,相比于其他常用的细菌分离方式,其有着以下的一些优势。
优势一:目前声波发生与驱动设备成熟,装置相对简单,操作容易,声波频率与振幅控制易于实现,而且对操作人员无需长时间的培训。
优势二:声波驱动属于非接触操作方式,即不与流体直接接触,同时对操作对象的几何、电磁学、光学、化学等性质无特殊要求,且驱动过程中也不会改变介质的性质,表现出良好的生物兼容性。
优势三:声波驱动作为一种高效、高能、清洁(不污染流体)、低成本的手段,根据其固有的非线性特性设计特殊的声学结构能够实现对微流体及微粒的复杂控制,为实现微粒在高粘度和高等离子强度的生物介质中的运动提供了新途径。
本申请实施例基于不同粒径的微粒在声流场所受的声流场力不同来进行分离,通过控制微粒所受声流捕获力与外加流场推力的大小,以实现粒径相对大的微粒被捕获,粒径相对小的微粒随流场游走。并且,本申请实施例不仅能实现血液中血细胞和细菌的分离,还能进一步实现细菌中革兰阳性菌和革兰阴性菌的分离。同时,实验装置简单,成本低廉,且对操作人员的技术要求不高。
由以上技术方案可知,本申请提供一种基于声流体力学的血液分离装置,所述血液分离装置不仅对血液中的微粒无损伤、可控性强,且能够简单高效地将目标细菌从血液中分离出来。
以上结合具体实施方式和范例性实例对本申请进行了详细说明,不过这些说明并不能理解为对本申请的限制。本领域技术人员理解,在不偏离本申请精神和范围的情况下,可以对本申请技术方案及其实施方式进行多种等价替换、修饰或改进,这些均落入本申请的范围内。本申请的保护范围以所附权利要求为准。
- 还没有人留言评论。精彩留言会获得点赞!