用于生成治疗递送平台的方法
相关申请的交叉引用
本申请要求于2018年10月21日提交的标题为“作为疫苗递送平台的细胞外囊泡和胞外体的微流体按需捕获、负载和光致释放(microfluidicon-demandcapture,loading,andphoto-releaseofextracellularvesiclesandexosomesasvaccinedeliveryplatform)”的美国临时专利申请系列号62/748,470的优先权,其全部内容通过援引并入本文。
联邦资助的研究或开发
本发明是在usda国家食品与农业研究所(nationalinstituteoffoodandagriculture)授予的2017-67021-26600和国立卫生研究院(nationalinstitutesofhealth)授予的gm103638的政府支持下完成的。政府拥有本发明的某些权利。
序列表
以下申请包含计算机可读格式(crf)的序列表,其作为ascii格式的文本文件提交,标题为“序列表”,创建于2019年10月21日,为12kb。crf的内容通过援引并入本文。
发明背景
发明领域
本公开总体上涉及用于收获用于递送生物活性治疗剂的完整的载体或递送运载体(deliveryvehicle)的微流体装置和方法,所述生物活性治疗剂诸如肽或蛋白质、核苷酸和其他活性剂(例如,化学物质和药物)。
相关技术的描述
在所有可递送的细胞和纳米颗粒中,活细胞来源的细胞外囊泡,特别是30~150nm的纳米尺寸范围内的胞外体(exosome),近几十年来已经在细胞间通讯中示出重要作用。免疫细胞来源的胞外体在调控免疫刺激或抑制、驱动炎症、自身免疫和感染性疾病病理学中已有充分的记录。胞外体的形成开始于内体(endosome)作为细胞内囊泡的创建。胞外体通过源自用于细胞分泌的多泡体(mvb)而不同于其他膜来源的微泡。因此,胞外体包含特定的蛋白质和核酸,并且代表它们在亲本细胞中形成时的其亲本细胞状态和功能。在胞外体的许多亚型中,具有mhci类和ii类分子以及其他共刺激分子的内在有效负载的免疫原性胞外体能够介导免疫应答,这为开发可用于癌症疫苗、免疫治疗递送以及与体内运输相关的其他递送的新型递送平台打开了机遇。
与其他纳米尺寸的递送系统诸如脂质、聚合物、金和二氧化硅材料相比,胞外体是活细胞来源的、具有内在有效负载的高度生物相容性纳米载体,并且在负载期望抗原用于有效递送中展示出更强大的灵活性。胞外体还消除了过敏反应,无需担心携带毒力因子,并避免了递送期间的降解或损失。然而,基于胞外体的疫苗的开发受到获得纯免疫原性胞外体中的重大技术困难的阻碍。胞外体的不同亚型可能会混淆对区分不同细胞信息的研究。另一方面,通过膜表面或内部负载的胞外体的分子工程化可以为开发新型抗原胞外体提供尚未使用的资源。
作为新兴的递送运载体的生物工程化胞外体在开发新一代癌症疫苗中已经受到了广泛关注,包括最近的ii期试验,该试验使用负载有mhci/ii限制的癌症抗原的ifn-dc来源的胞外体,以促进在非小细胞肺癌患者中基于t细胞和自然杀伤(nk)细胞的免疫应答。不幸的是,当前的胞外体工程化方法,诸如亲本细胞的转染或挤出,以及分泌的胞外体的膜透化,遭受低产量、低纯度和耗时的操作。需要产生胞外体的方法以解决该瓶颈问题。由于在自动化和高效物质运输中的固有特征,微流体系统克服了台式系统的许多缺点,并且在胞外体的分离、检测和分子谱分析中示出了卓越的性能。然而,尚未探索过使用微流体平台的胞外体的分子工程化。目前,大多数报道的处理胞外体的工作不是质量小就是与固体表面/颗粒结合,并且它们对于下游治疗制剂无法保持完整。
技术实现要素:
本文描述了方法和微流体装置以工程化各种生物载体或递送运载体,诸如细胞、细胞外囊泡和胞外体,和膜或脂质颗粒,以及聚合物颗粒。这些载体可以使用本发明的方法和装置捕获,用活性剂负载(表面修饰或包封),并且然后作为完整的、工程化载体释放,用于递送各种治疗化合物和生物活性剂。工程化载体可用于诊断、预后、伴随测定(companionassay)、药物和治疗剂、免疫治疗和疫苗递送、和组织递送以及与活性剂的体内运输相关的其他用途。本文所描述的实施方式是关于胞外体的示例。然而,应认识到,胞外体代表了特别具有挑战性的生物靶标,使得可以预期该平台可应用于其他类似结构————以液体核和膜或双层为特征的囊泡或类囊泡结构————包括细胞(包括t细胞)、微粒体等。这些生物靶标,其然后被工程化为载体或递送运载体,也可以表征为纳米载体。
本文提供的是完整的工程化纳米载体的按需捕获、负载和光致释放的微流体分析装置和方法。该微流体装置可以实现细胞外囊泡特别是胞外体的实时收获和抗原修饰,随后按需向下游释放完整的胞外体。还公开了用可光致断裂的亲和探针(活性部分)功能化的磁性纳米颗粒,用于经由光触发捕获和按需释放mhc-i阳性胞外体。亲和探针可以包括抗原肽、抗体、适配体、纳米抗体和其他基于亲和力的探针。可以在空间和时间上以95%或更高的效率良好地控制修饰/负载的胞外体在微流体装置中的光致释放。这样的功能性流线型微流体细胞培养系统通过使用刺激介导其亲本细胞生长或在产生的胞外体表面上直接分子工程化来允许对胞外体的抗原工程化。已经从亲本细胞的相同种群中发现了胞外体亚型的异质性。释放的胞外体亚型包含不同的分子和生物学特性,用于不同的细胞调控。所公开的方法可以捕获、负载和释放具有更多靶向治疗功能的胞外体的特定亚型。可以在本公开的方法中使用的用于捕获、负载和释放的载体包括细胞、细胞外囊泡和胞外体、和膜或脂质颗粒以及聚合物颗粒,其可以包封药物(小分子化合物)、基因和生物活性治疗剂。本文已证实了一般用于开发癌症疫苗但由于降解而难以递送的几种肿瘤抗原肽(例如,gp-100、mage-a3和mart-1)的概念验证。微流体装置在工程化免疫原性胞外体(mhci+)中示出高效率,同时,向下游光致释放完整的功能性胞外体。还已经证实了通过抗原呈递细胞的工程化胞外体的细胞摄取,与非工程化胞外体相比,其表现出很大改进的内化能力。特别地,通过攻击从2pmel1转基因小鼠的脾脏纯化的cd8t细胞,与非工程化胞外体相比,工程化胞外体示出显著更高的激活t细胞的激活率(至少30%)。我们还评估了用于治疗牛呼吸道合胞病毒(brsv)感染的使用转基因小鼠的用于体外刺激t细胞的抗微生物肽工程化免疫原性胞外体的效力程度。用brsv靶向肽(肽4:m187-195肽naitnakii,seqidno:4)工程化的胞外体具有在激活的树突状细胞存在下激活brsvm-特异性t细胞的能力。
因此,工程化胞外体对于癌症免疫治疗和传染性疾病的疫苗接种中的应用是可行的且功能性的。用于生产工程化囊泡的便捷且低成本的微流体平台不仅提供了高效生产纯化的、富集的治疗囊泡的可行策略,而且还充当用于理解可变的肽工程化胞外体在抗肿瘤免疫应答、癌症免疫治疗和用于治疗感染的疫苗接种中的作用的研究工具。
在特定的方面,本文公开的微流体装置可以包括细胞培养室,所述细胞培养室的尺寸设计为使生物材料保持在三维构型中;混合通道,所述混合通道流体连接至所述细胞培养室,并且包括沿所述混合通道设置的多个样品入口通道,其中所述细胞培养室的宽度与所述混合通道的最大横截面尺寸的比率为至少5:1;隔离通道,所述隔离通道限定了自所述混合通道至隔离出口的流体流动的路径;以及收集室,所述收集室流体连接至所述隔离出口,并且包括可操作地偶联至所述收集室以在所述收集室内产生磁场的磁体。
在其他方面,微流体装置可以包括细胞培养室,所述细胞培养室包括细胞培养入口和细胞培养出口;流体入口通道和颗粒入口通道,其中所述细胞培养出口、所述流体入口通道和所述颗粒入口通道在混合交叉点处流体汇聚;混合通道,所述混合通道流体连接至所述混合交叉点并且限定了自所述混合交叉点至混合出口的流体流动的路径,其中所述细胞培养室的宽度与所述混合通道的最大横截面尺寸的比率为至少5:1;以及收集室,所述收集室流体连接至所述混合出口,并且包括可操作地偶联至所述收集室以在所述收集室内产生磁场的磁体。在这些方面,混合通道可以包括设置在混合交叉点和混合出口之间的隔离通道。
微流体装置中的隔离通道可以具有诱导湍流的几何形状,以便混合装置中流动的流体。例如,微流体装置中的隔离通道可以具有蛇形的几何形状。隔离通道可以进一步包括一个或多个通道收缩域,其宽度减小以产生局部的涡旋流动分布。在某些实施方式中,隔离通道可以包括多个通道收缩域,优选至少5个通道收缩域。
如本文所描述,微流体装置包括细胞室和混合通道。细胞室和混合通道可具有高度和宽度。混合通道的高度和宽度可以各自为至少50微米,优选50至500微米之间。细胞培养室宽度与混合通道的最大横截面尺寸的比率可以为5:1至500:1、5:1至200:1、5:1至100:1、5:1至20:1,优选6:1至12:1。细胞培养室可以具有约200微升或更大,优选约200微升至约1毫升的容积。
本文公开的微流体装置可以进一步包括可操作地偶联至该装置的泵。
还公开了使用该装置用于捕获样品溶液中的靶标、负载和按需光致释放的方法,可用于收获完整的递送载体。这样的载体可以是细胞、细胞外囊泡和胞外体、和膜或脂质颗粒以及聚合物颗粒,其可以包封药物、基因和生物活性治疗剂。特别地,这种捕获、负载和光致释放的集成的且连续的方法可以在微流体装置中产生工程化胞外体。该方法包括将包含胞外体(或其他靶标)的生物样品引入至混合通道中,并将所述胞外体与免疫磁性颗粒和洗涤缓冲液混合以形成混合物;允许所述胞外体与所述免疫磁性颗粒反应和亲和结合;以及通过在收集室内施加磁场来收集与所述免疫磁性颗粒结合的胞外体。用于生产工程化胞外体的方法可以包括将细胞引入至微流体装置的细胞培养室中,并首先在允许释放胞外体的条件下培养所述细胞。这可以在用于捕获和负载的同一微流体装置中在线实施。
从中释放胞外体的细胞可以选自树突状细胞、干细胞、免疫细胞、巨核细胞系祖细胞、巨噬细胞或其他活细胞。
结合至胞外体的免疫磁性颗粒可以包括结合至亲和探针的磁性颗粒,该亲和探针用于经由包括可光致断裂的接头的部分来捕获胞外体。如本文所描述,用于捕获胞外体的亲和探针可以包括用于捕获胞外体的抗原肽、抗体、适配体或其抗原表位。抗原肽的合适实例包括:mage-a3、gp-100、her-2、p53、psa-1或mart-1。包括可光致断裂的接头的部分可以包括结合至免疫磁性颗粒并在另一端经由可光致断裂的接头附接至亲和探针的生物素。亲和探针靶向在靶标上的表面蛋白(例如,免疫刺激分子或标志物)。合适的免疫刺激分子包括mhci类分子、mhcii类分子、白介素、tnfα、ifnγ、rantes、g-csf、m-csf、ifnα、ctapiii、ena-78、gro、i-309、pf-4、ip-10、ld-78、mgsa、mip-1α、mip-1β及其组合。优选地,亲和探针本身是优先结合至靶标上的表面蛋白的抗原部分(肽)。
混合后,免疫磁性颗粒捕获/结合样品中的胞外体(或其他靶标)。例如,使用位于邻近收集室的磁体将免疫磁性颗粒固定在装置中。然后用包含活性部分的缓冲溶液洗涤并孵育固定的珠粒/胞外体复合物,该活性部分用于表面负载至捕获的胞外体上或内部包封,如下文更详细地描述的。该方法可以进一步包括从免疫磁性颗粒光解断裂捕获的、修饰的胞外体,释放包括活性剂(抗原肽或其抗原表位)的完整的、工程化胞外体。
用于生产工程化生物靶标诸如胞外体的方法可以使用本文公开的微流体装置执行。在一些实施方式中,该方法是实时实施的。在一种或多种实施方式中,该方法是流线型(又名“连续”)的,使得生物靶标的捕获、负载和释放发生在同一装置/容器中(即,不必在容器或反应管之间转移或移动,而是在线沿微流体通道和在线捕获/工程化室)。因此,可以使用汇聚在单个微流体通道处的各种入口一个接一个地,并且优选基本上一个立即接另一个地连续实施步骤的每一步。换句话说,该方法涉及免疫磁珠负载,随后立即或几乎同时进行样品负载,随后负载要附接或负载至捕获的靶标中的活性剂。负载至微流体装置中的每种组分都从相应的入口汇聚至单个微流体通道中,随后是通过位于邻近室的磁体“自动”保留在入口下游的捕获/工程化室中。当流体混合物流动通过通道并且然后通过室时,相应的反应是实时发生的(即,捕获和负载)。然后,将光施加到室可以释放工程化靶标。应认识到,流线型的过程比传统的台式方法快得多。优选地,从在相应的入口处负载样品/珠粒到在出口处收集释放的工程化靶标的过程可以在总计大约2小时内、更优选大约90分钟内、以及更优选大约1小时内完成。
还公开了包括工程化胞外体,特别是免疫原性胞外体复合物的组合物。该免疫原性胞外体复合物可以包括缀合至胞外体表面的抗原肽或其抗原表位,其中,与天然胞外体相比,该免疫原性胞外体复合物激活t细胞至少30%。这样的抗原肽或抗原表位的抗原负载可以在混合并捕获胞外体后执行,以用抗原肽完全包覆胞外体表面。该组合物可以使用本文公开的方法制备。因此,通过包括以下的方法制备免疫原性胞外体复合物:将细胞引入至微流体装置的细胞培养室中;在允许释放工程化胞外体的条件下培养细胞;将工程化胞外体引入至混合通道,并将工程化胞外体与免疫磁性颗粒和洗涤缓冲液混合以形成用于胞外体捕获/结合的混合物;然后在收集室内施加磁场以收集分离的胞外体,允许与包含抗原肽的负载缓冲液反应以形成免疫原性胞外体复合物;以及施加uv光以破坏可光致断裂的接头,用于在微流体装置的出口处收集免疫原性胞外体复合物。
还公开了包括免疫原性胞外体复合物的药物组合物。负载靶标可以是药物、基因和生物活性治疗剂。公开了在受试者中治疗疾病的方法,该方法包括向受试者给药包括免疫原性胞外体复合物的药物组合物。在某些实施方式中,该疾病可以是感染。在一些实例中,该疾病可以是癌症。当待治疗的疾病是癌症时,该方法可以进一步包括给药化学治疗剂。
附图的简要说明
本专利或申请文件包含至少一幅彩色附图。经要求并支付必要费用后,该局将提供具有彩色附图的本专利或专利申请公布的副本。
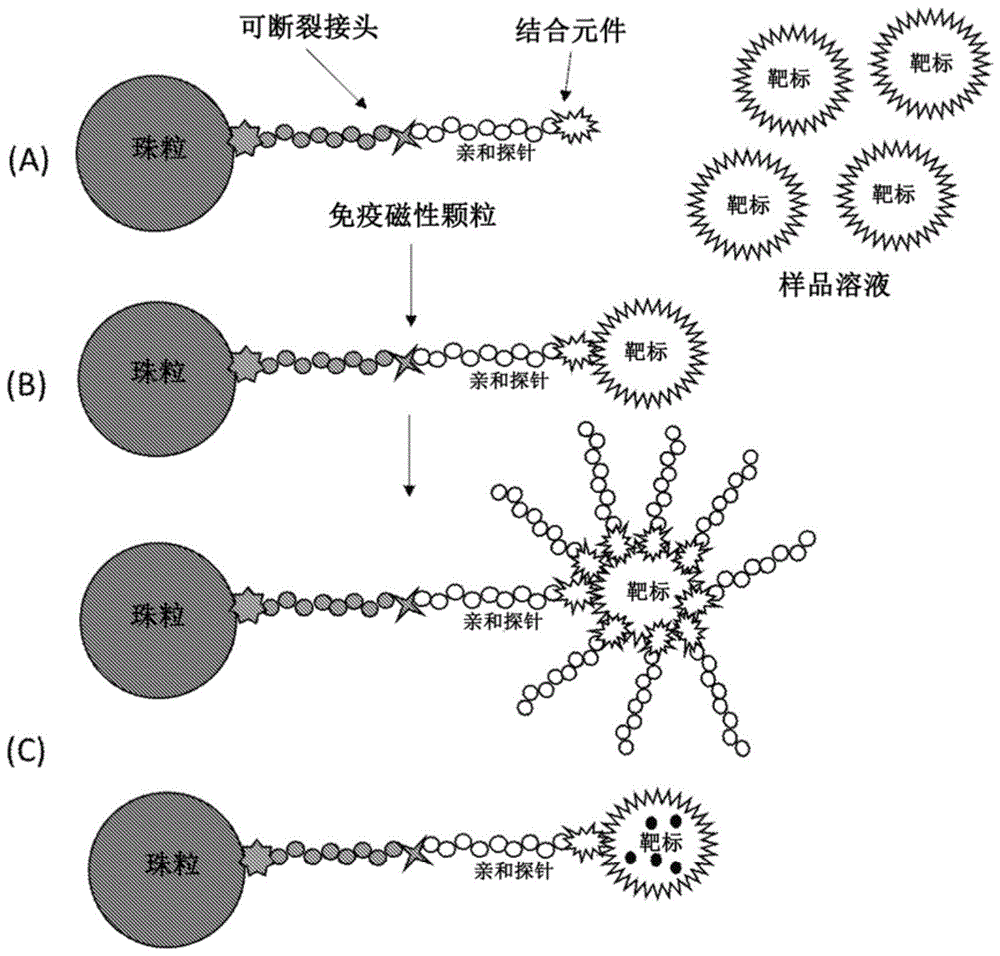
图1说明了(a)免疫磁性珠粒与样品溶液混合,(b)使用免疫磁性珠粒捕获样品溶液中的靶标;以及(c)将抗原或活性剂负载至捕获的靶标上或内部。
图2a说明了(a)向珠粒/靶标复合物施加光或激活辐射,以及(b)用活性剂或抗原部分修饰表面的工程化靶标(载体的)的光致释放。
图2b说明了(a)向珠粒/靶标复合物施加光或激活辐射,以及(b)在内部负载有活性剂的工程化靶标(载体)的光致释放。
图3是3d打印成型的pdms微流体培养芯片的过程概述的说明,该芯片用于在激活抗肿瘤应答中应用的抗原胞外体的流线型工程化。
图4说明了微流体装置的实施方式。
图5示出了以下图像:(a)微流体通道和流动;(b)与微珠粒混合;(d)细胞形态;和(e)释放的胞外体的sem图像。
图6说明了微流体装置的实施方式。
图7a示出了mhc-i阳性免疫原性胞外体的免疫磁捕获和按需光致释放的说明。
图7b示出了与用于结合和光致释放荧光标记的免疫原性胞外体的可光致断裂的免疫磁性珠粒缀合的三种肿瘤靶向肽抗原的表征。将mhc-i抗体用作阳性对照,以比较mhc-1阳性胞外体和肿瘤靶向肽之间的结合强度。
图8a示出了从免疫磁性捕获珠粒按需光致释放捕获的胞外体的性能的表征。阳性对照是由光致释放免疫磁性珠粒捕获的荧光标记的抗体。阴性对照是没有可光致断裂的接头的免疫磁性珠粒。
图8b示出了捕获有胞外体的光致释放免疫磁性珠粒的表面的sem图像。由于真空样品制备,胞外体颗粒看上去呈杯状。
图8c示出了在光致断裂后光致释放免疫磁性珠粒的表面的sem图像。
图8d示出了uv暴露时间对光致断裂效率的影响的表征。
图8e示出了工程化胞外体和非工程化胞外体之间的胞外体尺寸分布的纳米颗粒追踪分析。
图9a示出了与非工程化胞外体相比,dc摄取肿瘤靶向抗原(tta)肽、gp-100表面工程化胞外体的共聚焦显微镜图像。每小时拍摄一张图像,用于追踪由dc(用dapi染色细胞核)摄取的绿色荧光标记的胞外体。
图9b示出了通过elisa测量监测48小时的细胞因子ifn-γ从dc培养物中的释放,进行非工程化胞外体和gp-100工程化胞外体之间的比较。
图10a描绘了来自具有增加浓度的gp100工程化胞外体的包含t细胞+激活的jaws细胞的孔中的代表性流动图。
图10b描绘了来自所有三种培养条件的累积数据,其示出了刺激下的cd8+t细胞分裂速率。结果代表每种培养条件下使用重复孔的2个独立实验。
图11描绘了来自具有增加浓度的牛呼吸道合胞病毒(brsv)抗微生物肽工程化胞外体的包含t细胞和激活的jaws细胞的孔的流式细胞术图,用于描绘免疫原性效力。
图12a说明了用于生产集成有细胞培养和下游胞外体分离、表面工程化和按需光致释放的3d模具的3d打印方法。
图12b示出了复制pdms微流体装置的结果。
图13示出了uv暴露对胞外体分子在蛋白质、dna和rna方面的含量的副作用的研究结果。
图14示出了在不同刺激条件下的树突状单核细胞培养物:没有任何刺激的树突状单核细胞(阴性对照;第一张图像);pwm蛋白刺激(阳性对照;第二张图像);以及gp-100工程化胞外体刺激(最后一张图像)。
具体实施方式
提供本公开的以下描述作为能够最好地教导本公开的当前已知的一种或多种实施方式。为此,相关领域的技术人员将认识并理解,可以对本文描述的本发明的各种实施方式进行许多改变,同时仍然获得本公开的有益结果。还将显而易见的是,可以通过选择本公开的一些特征而不利用其他特征来获得本公开的一些期望益处。因此,本领域技术人员将认识到,对本公开的许多修改和调整是可能的,并且在某些情况下甚至可以是期望的,并且是本公开的一部分。因此,提供以下描述作为本公开的原理的说明而不是对其的限制。
术语
除非另有定义,否则本文使用的所有技术和科学术语具有与本发明所属领域的普通技术人员通常所理解的相同含义。提供以下定义用于完全理解本说明书中使用的术语。
公开了用于制备所公开的组合物的组分以及用于本文公开的方法中的组合物本身。本文公开了这些和其他材料,并且应当理解,当这些材料的组合、子集、相互作用、组等被公开时,尽管这些化合物的各自各种单独的和共同的组合以及排列的特定参考可能未明确公开,但各自都在本文中进行了特别考虑和描述。例如,如果公开并讨论了特定的流体通道,并且讨论了可以对流体通道进行的一些修改,则除非特别指出相反状况,否则特别考虑了流体通道的各自和每个组合和排列以及可能的修改。因此,如果公开了一类流体通道a、b和c以及一类流体通道d、e和f以及组合流体通道的实例,或者,例如公开了包括a-d的组合流体通道,那么即使没有单独陈述每一个,每一个也都被单独和共同考虑,意为组合a-e、a-f、b-d、b-e、b-f、c-d、c-e和c-f都被认为是公开的。同样,还公开了这些的任何子集或组合。因此,例如,将认为a-e、b-f和c-e的子组是公开的。此概念应用于本申请的所有方面,包括但不限于制造和使用所公开的组合物的方法中的步骤。因此,如果存在可以执行的各种额外的步骤,则应当理解,这些额外的步骤中的每一个都可以用本公开的方法的任何特定实施方式或实施方式的组合来执行。
应当理解,本文公开的装置具有某些功能。公开了用于执行本公开的功能的某些结构要求,并且应当理解,存在与公开的结构相关的可以执行相同功能的各种结构,并且这些结构最终将获得相同的结果。
除非另有明确说明,否则绝不旨在将本文所述的任何方法解释为要求按照特定顺序执行其步骤。因此,在方法权利要求没有明确陈述要遵循的步骤的顺序下,或者在权利要求或说明书中没有另外特别说明步骤被限制为特定的顺序下,绝不旨在在任何方面推断出顺序。这适用于任何可能的非明示的解释依据,包括:有关步骤的布置或操作流程的逻辑问题;源自语法组织或标点符号的简单含义;以及说明书中描述的实施方式的数量或类型。
除非上下文另有明确指出,否则如说明书和权利要求书所用,单数形式“一个(a)”,“一种(an)”和“该/所述(the)”包括复数引用。例如,术语“(一个/种)试剂”包括多种试剂,包括其混合物。
如本文所用,术语“可以”、“可”、“可以任选地”和“可任选地”可互换使用,并且意指包括条件发生的情况以及条件没有发生的情况。因此,例如,制剂“可以包括赋形剂”的陈述意指包括在其中制剂包括赋形剂的情况以及在其中制剂不包括赋形剂的情况。
范围可以表达为从“约”一个特定值,和/或至“约”另一特定值。当表达这样的范围时,另一实施方式包括从一个特定值和/或至另一特定值。类似地,当通过使用先行词“约”将值表达为近似时,应当理解,特定值形成另一实施方式。还应当理解,范围的各自端点相对于另一端点以及独立于另一端点都是重要的。还应当理解,存在本文公开的一些值,并且除了该值本身之外,本文还公开了各自值为“约”该特定值。例如,如果公开值“10”,则也公开了“约10”。
术语“上游”和“下游”是指装置内相对于另一位置和流体流动方向的位置。如本文所用,术语“上游”是指相对于第二位置位于与流体流动方向相反的方向的第一位置。相反,如本文所用,术语“下游”是指相对于第一位置位于沿着流体流动方向的方向的第二位置。
方法
参考图1,本文描述的一般方法涉及多个免疫磁性颗粒(珠粒),其与怀疑包含靶标的样品溶液混合。在一些实施方式中,从受试者收集并制备生物样品用于该方法,例如,通过用缓冲液稀释、浓缩等。在一些实施方式中,将细胞收集并在培养物中扩增。在一些实施方式中,收集细胞并在将胞外体或其他细胞外囊泡或类囊泡结构释放到培养物中的条件下培养。在任何情况下,免疫磁性颗粒包含自颗粒表面延伸以捕获靶标的可光致断裂的接头和亲和探针(并且优选多个可光致断裂的接头,各自具有相应的亲和探针)。使免疫磁性颗粒与样品溶液接触一段时间,以充分使靶标(如果存在于样品中)与自免疫磁性颗粒延伸的亲和探针相互作用。在图1中,为了易于说明,描绘了具有单个接头的单个珠粒;然而,在实践中,每个免疫磁性颗粒将包覆有多个接头(优选基本上颗粒/珠粒的整个表面积都包覆有接头)。此外,图1中的相对尺寸不是按比例的,而是出于说明目的放大的。在实践中,珠粒/颗粒优选是靶标的至少5倍大(例如,在胞外体的情况下,其在30-150nm的直径范围,珠粒优选500nm或更大)。这样,多个靶标(例如,胞外体)将在单个珠粒/颗粒的表面上被捕获。为了便于参考,图1使用单个珠粒和靶标相互作用。如图1(a)所示出,将珠粒和样品溶液混合足够的时间段(例如,在微流体装置中的混合室或通道中)。如果靶标存在于样品溶液中,则它将被珠粒(并且特别是经由珠粒的可光致断裂的接头自珠粒延伸的亲和探针)捕获,如图1(b)中说明。本文描述了示例性的可光致断裂的接头,并且可以包括线性链,该线性链的一端包括生物素或类似部分用于附接至颗粒,并且另一端包括胺部分用于附接至亲和探针。优选的接头具有以下结构,其中,虚线表示光暴露期间断裂的键,以及“结合基团”代表用于将接头(直接或经由功能化的表面包覆,例如,抗生物素蛋白)附接至珠粒的部分(例如,生物素):
尽管本文描述了各种实施方式,但是亲和“探针”典型地是对靶标具有特异性并识别靶标的寡肽序列,诸如识别并充当靶标上的表面蛋白的受体的肽。如本文所用,短语“对……特异性”旨在区分亲和探针与分子间的非特异性结合或反应,并且意指亲和探针可以相互作用的特异性靶标的集合是有限的,并且在一些情况下甚至是排他的,使得除了靶标(并且特别地,其指定的一种或多种表面蛋白)之外,不会以可观的速率与任何其他分子发生结合。短寡肽序列优选用于亲和探针,其包括对靶标具有高特异性的序列片段。更优选地,如本文更详细地描述和在工作实施例中所证明的,在结合后,亲和探针和表面蛋白创建了增强靶标的免疫原性潜力的复合物。
将具有捕获的靶标(例如,胞外体)的珠粒固定在微流体装置中。可以在捕获靶标之前或之后固定珠粒。如本文其他地方所描述,可以通过将磁体置于邻近微流体装置中的收集或工程化室来实现。当样品溶液和珠粒溶液流经微流体通道时,珠粒和靶标相互作用,从而捕获靶标。当溶液流经时,磁性珠粒被固定在收集或工程化室中(从而也固定了捕获的靶标)。如图1(c)说明,然后通过将多个活性剂(例如,抗原肽)附接至靶标表面或者用药物、化学物质、核苷酸或其他生物活性剂(例如,crisprcas9)负载靶标来工程化捕获的靶标。对于表面修饰,在微流体装置中,用包含多个活性剂的缓冲溶液洗涤并孵育固定的珠粒/靶标复合物,该活性剂具有对存在于靶标表面的表面蛋白有特异性的至少一种部分。优选地,用于表面负载的活性剂或部分与被选择作为用于免疫磁性颗粒中的亲和探针的化合物是相同的“类型”(例如,包括相同的寡肽)。将固定的珠粒/靶标复合物与活性剂孵育一段时间,以充分使活性剂与捕获的靶标相互作用。优选地,负载至微流体装置中的活性剂的浓度使得靶标的基本上整个表面包覆有活性剂(例如,优选地,基本上所有的靶标表面蛋白都被活性剂结合)。代替表面修饰,图1(c)还描绘了一种替代方案,其中可以将活性剂负载至靶标中。这可以通过以下实施:在微流体装置中,用包含待负载的活性剂的缓冲溶液连同清洁剂或化学转染试剂一起洗涤并孵育固定的珠粒/靶标复合物,以诱导用于活性剂负载的靶标中的孔形成,随后用缓冲液洗涤以移除试剂并封闭孔。在任一实施方式中,然后洗掉过量的活性剂,留下用免疫磁性珠粒固定的工程化靶标。
参考图2a,然后可以通过将固定的珠粒/靶标复合物暴露于适当波长的激活辐射(例如,光)以断裂可光致断裂的接头来释放工程化靶标。此过程释放了工程化靶标连同仍与靶标结合的亲和探针,其现在充当修饰在靶标表面上的活性剂的工程化载体或递送运载体。同样地,在图2b中,可以使用相同的光致释放过程来释放内部负载有活性剂的靶标。可以将洗涤缓冲液引入至微流体装置中,以将释放的靶标输送到下游,以在微流体装置的出口处收集。有利地,本发明的实施方式中的光致释放步骤以15分钟或更短、优选约13分钟或更短、更优选约12分钟或更短的暴露时间实施。如在工作实施例中所证明的,在约10分钟的暴露时间内优选地释放/断裂大约100%的捕获靶标。
应认识到,由于已经将磁性珠粒固定在工程化室中,因此不需要单独的步骤来将靶标从溶液中的磁性珠粒分离。而是,在暴露后,捕获的靶标和珠粒之间的接头断裂,从而释放工程化靶标,该靶标自固定的珠粒向下游流动至微流体装置的出口。然后可以将已经用活性部分工程化的释放的靶标(又名“工程化载体”)自微流体装置的出口收集用于分析和治疗用途或者直接转移至进一步的室或收集装置中。应认识到,随后可以通过去除微流体装置中的磁场使得免疫磁性珠粒不再被磁性固定,从而收集免疫磁性珠粒用于再次使用。珠粒可以被洗涤至下游并从出口收集。
如所指出的,此过程可以有利地在微流体装置中进行,并且作为连续、集成、在线的方法,用于从样品中分离、捕获、工程化和释放完整的靶标,诸如胞外体,作为治疗载体或递送运载体。
装置
细胞外囊泡(≤1μm),特别是胞外体(30-150nm),是用于介导细胞信号转导的新兴货物。然而,由于耗时(>10h)且极其繁琐的分离方案,标准台式方法(例如,超速离心和过滤)缺乏在其他微囊泡亚型中特异性地处理免疫原性胞外体的能力。本公开通过提供引入流线型微流体平台的装置用于自芯片上培养的细胞培养基中直接收获、抗原修饰和光致释放免疫原性细胞外囊泡和胞外体,解决了本领域的需求。这些装置提供了抗原胞外体的自动且快速的细胞培养生产,可用于免疫治疗,诸如癌症免疫治疗。如图3的概述所描绘,本文公开的装置能够实现胞外体的实时收获和抗原修饰,与随后的按需光致释放至下游。
现在转向图4,本文公开了微流体装置(200)包括:细胞培养室(210),所述细胞培养室(210)的尺寸设计为使生物材料保持在三维构型中;混合通道(220),所述混合通道(220)流体连接至所述细胞培养室,并且包括沿所述混合通道设置的多个样品入口通道(222、224、226),其中,所述细胞培养室(210)的宽度与所述混合通道(220)的最大横截面尺寸的比率为至少5:1;隔离通道(230),所述隔离通道(230)限定了自所述混合通道(220)至隔离出口(234)的流体流动的路径;以及收集室(240),所述收集室(240)流体连接至所述隔离出口(234),并且包括可操作地偶联至所述收集室以在所述收集室(240)内产生磁场的磁体。
本公开的装置可以通过装置内的组分的尺寸和尺寸的比较(例如,比率)来描述。在一些实施方式中,细胞培养室(210)具有的容积为约200微升或更大(例如,200微升或更大、250微升或更大、300微升或更大、350微升或更大、400微升或更大、450微升或更大、500微升或更大、550微升或更大、600微升或更大、650微升或更大、700微升或更大、750微升或更大、800微升或更大、850微升或更大、900微升或更大、950微升或更大或者1微升或更大)。在一些实施方式中,细胞培养室(210)具有的容积为约1000微升或更小(例如,950微升或更小、900微升或更小、850微升或更小、800微升或更小、750微升或更小、700微升或更小、650微升或更小、600微升或更小、650微升或更小、550微升或更小、500微升或更小、450微升或更小、400微升或更小、350微升或更小、300微升或更小、250微升或更小或者200微升或更小)。在一些实施方式中,细胞培养室(210)具有的容积为约200微升至约1毫升(例如,200微升至900微升、200微升至750微升、200微升至500微升、300微升至750微升或350微升至约500微升)。在一些实施方式中,细胞培养室具有足够的容积,使得顶部可以保持敞开,以用于施加用于流体交换并将流体推到下游收集通道的塞(诸如pdms制造的指推塞)。
在一些实施方式中,细胞培养室具有高度和宽度。细胞培养室可以具有的高度为至少500微米(例如,500微米或更大、600微米或更大、650微米或更大、700微米或更大、750微米或更大、800微米或更大、850微米或更大、900微米或更大、950微米或更大或者1000微米或更大)。在一些实施方式中,细胞培养室具有的高度为1000微米或更小(例如,950微米或更小、900微米或更小、850微米或更小、800微米或更小、750微米或更小、700微米或更小、650微米或更小、600微米或更小或者500微米或更小)。在一些实施方式中,细胞培养室具有的高度为500微米至1000微米(例如,600微米至1000微米、750微米至1000微米或800微米至1000微米)。
细胞培养室可以具有的宽度为至少200微米(例如,250微米或更大、275微米或更大、300微米或更大、350微米或更大、400微米或更大、450微米或更大、500微米或更大、550微米或更大或者600微米或更大)。在一些实施方式中,细胞培养室具有的宽度为1000微米或更小(例如,小于1000微米、750微米或更小、小于750微米、600微米或更小、550微米或更小或者500微米或更小)。在一些实施方式中,细胞培养室具有的宽度为250微米至1000微米(例如,250微米至750微米、250微米至500微米、300微米至750微米或300微米至500微米)。
如本文所描述,混合通道(220)流体连接至细胞培养室,并且包括沿混合通道设置的多个样品入口通道(222、224、226)。多个样品入口通道可以包括流体连接至细胞培养室并限定用于将流体自细胞培养室引入至混合通道的路径的细胞培养入口通道(本文中也称为b-入口,222)。多个样品入口通道可以进一步包括限定用于将颗粒引入至混合通道的路径的颗粒入口通道(本文中也称为a-入口,224)。多个样品入口通道可以进一步包括限定用于将流体(诸如,洗涤缓冲液)引入至混合通道的路径的流体入口通道(本文中也称为c-入口,226)。多个样品入口通道可以是任何布置。例如,细胞培养入口通道可以在颗粒入口通道的上游,颗粒入口通道在流体入口通道的上游。在其他实例中,颗粒入口通道可以在细胞培养入口通道的上游,细胞培养入口通道在流体入口通道的上游。
细胞培养入口通道、颗粒入口通道和流体入口通道可以在混合交叉点处流体汇聚。细胞培养入口通道形成流体从细胞培养室流动至混合交叉点的路径。颗粒入口通道形成流体从颗粒入口流动至混合交叉点的路径。流体入口通道形成流体从流体入口流动至混合交叉点的路径。如本文所用,流体流动的路径可以在图中通过箭头图形化地表示,以表明通过流体流动的路径的流体流动的方向。
包括细胞培养入口通道、颗粒入口通道和流体入口通道的混合通道具有高度和宽度。在一些实施方式中,混合通道具有的高度为至少50微米(例如,75微米或更大、100微米或更大、120微米或更大、150微米或更大、175微米或更大、200微米或更大、250微米或更大、300微米或更大、350微米或更大、400微米或更大或者500微米或更大)。在一些实施方式中,混合通道具有的高度为500微米或更小(例如,小于500微米、450微米或更小、400微米或更小、小于400微米、350微米或更小、300微米或更小、小于300微米、275微米或更小、250微米或更小、200微米或更小、150微米或更小、100微米或更小或者50微米或更小)。在一些实施方式中,混合通道具有的高度为50微米至500微米(例如,100微米至500微米、200微米至500微米、100微米至350微米或200微米至500微米)。
混合通道可以具有的宽度为至少50微米(例如,75微米或更大、100微米或更大、120微米或更大、150微米或更大、175微米或更大、200微米或更大、250微米或更大、300微米或更大、350微米或更大、400微米或更大或者500微米或更大)。在一些实施方式中,混合通道具有的宽度为500微米或更小(例如,小于500微米、450微米或更小、400微米或更小、小于400微米、350微米或更小、300微米或更小、小于300微米、275微米或更小、250微米或更小、200微米或更小、150微米或更小、100微米或更小或者50微米或更小)。在一些实施方式中,混合通道具有的宽度为50微米至500微米(例如,100微米至500微米、200微米至500微米、100微米至350微米或200微米至500微米)。
培养室宽度与混合通道的最大横截面尺寸的比率为至少2:1、至少3:1、至少4:1、至少5:1、至少6:1、至少7:1、至少8:1、至少9:1、至少10:1、至少12:1、至少15:1、至少18:1、至少20:1、至少25:1、至少50:1、至少75:1、至少100:1、至少150:1、至少200:1、至少250:1、至少300:1、至少350:1、至少400:1、至少450:1或至少500:1。在一些实施方式中,培养室宽度与混合通道的最大横截面尺寸的比率为5:1至500:1、5:1至200:1、5:1至100:1、2:1至25:1、5:1至20:1、5:1至15:1、6:1至25:1、6:1至20:1、6:1至12:1、8:1至25:1或10:1至25:1。培养室宽度与混合通道的最大横截面尺寸的比率大于一(例如2:1),这限定了在混合通道入口处通道宽度变窄。
在一些实施方式中,微流体装置中的一个或多个通道可以包括促进流经该装置的流体的混合的流体混合机构。流体混合机构诱导湍流,以便混合流动的流体。合适的混合机构包括蛇形或曲折的通道、通道凸部或凹部、通道弯曲,以及其他已知的机构。
在一些实施方式中,流体混合机构可以存在于微流体装置的混合通道和/或隔离通道中。例如,微流体装置可以包括将混合通道流体连接至隔离出口的隔离通道。隔离通道可以形成混合通道的一部分或可以是分离的。在一些实施方式中,隔离通道限定了流体自混合通道流动至隔离出口的路径。隔离通道可以包括蛇形的几何形状,其随流体合并增强混合。参照图4,可以将具有蛇形几何形状的隔离通道(230)置于装置内的有利于流体混合的位置处,例如,在混合交叉点和收集室之间。在一些实施方式中,将隔离通道置于紧邻混合交叉点(例如,下游紧邻)处。
与混合通道宽度相比,隔离通道可以具有相似或变窄的宽度。在一些实施方式中,与混合通道宽度相比,隔离通道可以通过至少几种方式具有变窄的宽度。例如,隔离通道可以包括设置在隔离通道入口和隔离通道出口之间的隔离通道内的一个或多个通道收缩域(参见,例如,图4中的隔离通道中形成变窄宽度的通道收缩域(232))。通道收缩域可以产生在装置中流动的流体的局部涡旋流动分布。在一些实施方式中,隔离通道包括至少一个、至少两个、至少三个、至少四个、至少五个、至少六个、至少七个、至少八个、至少九个或至少十个通道收缩域。任何一个或多个通道收缩域可以是通道侧壁中的凸部和/或凹部。凸部和/或凹部可以具有任何形状,例如圆形、线形、三角形、不规则等。凸部和/或凹部可以环绕通道的内壁(例如,作为环),或者一个或多个凸部和/或凹部可以位于通道的一个或多个内侧壁上。在期望时,包括通道收缩域可增加流体流动湍流和流体混合。
本文公开的装置可以包括流体连接至隔离出口(234)的收集室(240)。在一些实施方式中,装置可以进一步包括可操作地偶联至收集室以在收集室内产生磁场的磁体。磁体可以是能够在收集室内提供磁场的任何磁体。在一些实施方式中,磁场可以包括振荡磁场。振荡磁场是随时间规律地(例如,自动周期性规律)或不规律地(例如,通过基于用户的控制)变化的磁场。振荡磁场包括在南北磁极的空间方向中的动态变化,使得磁场的方向随时间变化。这样的变化可以是周期性的或不规律的。包括能够在收集室内提供振荡磁场的振荡磁体可以在收集室内诱导磁性探针(例如,磁性珠粒或颗粒)沿磁场的方向在收集室内动态地移动。由于磁场的方向改变,收集室内的磁性颗粒的定向移动也会改变。这可以用于促进存在于收集室中的流体中的磁性颗粒和靶标之间的相互作用(和缔合/结合)。在一些实施方式中,磁场可以从永磁体获得。当不使用时可以移除永磁体,例如,以关闭磁场。
在一些实施方式中,磁体可以具有任何形状,诸如环形形状。在一些实施方式中,磁体包括亥姆霍兹线圈或永磁体。
磁场可以存在于收集室的整个宽度之上。在一些实施方式中,磁场可以在收集室的一部分之上,例如在收集室的整个宽度的至少50%、至少60%、至少70%、至少80%、至少90%或至少95%之上。进一步,磁场可以在微流体装置的其他部分之上。例如,磁场可以在混合通道、混合交叉点、颗粒入口通道或其他组分的部分或全部中的一个或多个之上。
在一些实施方式中,装置可以包括可操作地偶联至微流体装置的泵。泵可以是能够在装置内诱导流体流动的本领域已知的任何泵。在一些实施方式中,泵可以在装置内施加负压,从而牵引流体通过通道。合适的泵的实例可以在us20170065978和us20170001197中找到,其各自以其全部内容通过援引并入。
现在转向图6,还公开了包括以下的微流体装置(2000):细胞培养室(2100),所述细胞培养室(2100)包括细胞培养入口(2102)和细胞培养出口(2104);流体入口通道(2202)和颗粒入口通道(2204),其中,所述细胞培养出口(2104)、所述流体入口通道(2202)和所述颗粒入口通道(2204)在混合交叉点(2200)处流体汇聚;混合通道(2300),所述混合通道(2300)流体连接至所述混合交叉点(2200),并且限定了从所述混合交叉点至混合出口的流体流动的路径,其中,所述细胞培养室(2100)的宽度与所述混合通道(2300)的最大横截面尺寸的比率为至少5:1;以及收集室(2400),所述收集室(2400)流体连接至所述混合出口,并且包括可操作地偶联至所述收集室(2400)以在所述收集室内产生磁场的磁体。混合通道(2300)可以包括设置在混合交叉点(2200)和混合出口之间的隔离通道(2302)。
本文提供的微流体装置的另一方面涉及多路复用的微流体装置,其包含两组或更多组包括以下的室和/或通道:细胞培养室、混合通道、隔离通道和收集室。在单个微流体装置上配置两个或更多个这样的通道和/或室可以增加样品处理通量和/或允许平行处理不同成分或操作的至少两种样品或样品的部分。两个或更多个室和/或通道可以串联、并联或以其组合来布置。
在平行多路复用微流体装置的一些实施方式中,两个或更多个混合通道可以具有设置在同一微流体装置上的分离的样品入口。这样的布置可以应用于多个流体样品。替代地,多个混合通道可以连接至相同的样品入口,以平行处理相同的流体样品。另外,两个或更多个混合通道可以具有设置在同一微流体装置上或连接至同一出口的分离的出口。在一种或多种实施方式中,预期多路复用微流体装置具有多达96个样品入口。
本公开的微流体装置可以与本文公开的各种组合物、装置、方法、产品和应用结合使用。在一些实施方式中,微流体装置可以是独立运行的微流体装置。在一些实施方式中,可以将一个或多个微流体装置集成为设备、模块或系统的一部分。在其他实施方式中,可以将一个或多个微流体装置流体偶联至设备、模块或系统。
仅作为示例,可以将一个或多个微流体装置和/或多路复用的微流体装置流体偶联至检测模块。如本文所用,术语“流体偶联”是指以适当的方式连接的两个或更多个装置和/或模块,使得流体可以从一个装置或模块传递或流动至另一装置或模块。当两个或更多个装置和/或模块流体偶联在一起时,在两个或更多个装置和/或模块之间可以存在额外的装置和/或模块。
替代地,可以将两个或更多个装置和/或模块中的两个连接,使得流体可以在没有任何中间装置或模块下直接从第一装置或模块传递或流动至第二装置或模块。可以将两个或更多个装置或模块流体偶联,例如通过使用管子、导管、通道、管道或其任何组合将第一装置或模块的出口连接至第二装置或模块的入口。
检测模块可以进行本文公开的任何检测方法或本领域已知的其他方法。在一些实施方式中,在检测样品以进行分析之前,检测模块可以包括样品处理模块。例如,胞外体(包括或不包括免疫磁性颗粒)可以在通过显微镜检测之前进行免疫染色。检测模块的实例可以包括但不限于显微镜(例如,明视野显微镜、荧光显微镜或共聚焦显微镜)、分光光度计(例如,紫外可见分光光度计)、细胞计数器、生物空腔激光器(参见,例如,gourleyetal.,j.phys.d:appl.phys.36:r228-r239(2003))、质谱仪、成像系统、亲和柱、颗粒分选仪例如荧光激活的细胞分选仪、毛细管电泳、样品存储装置和样品制备装置。在一些实施方式中,计算机系统可以连接至检测模块,例如,以促进样品处理、检测和/或分析的过程。
制造方法
本文所描述的装置可以由与流体样品相容的任何材料制成。在一些实施方式中,本文所描述的用于制造装置的材料可以被磁场穿透。在一些实施方式中,用于制造本文所描述的装置的材料可以是基本上透明的,使得其中的样品可以原位被光致断裂,或者其可以在显微镜下观察,例如用于原位分析磁性标记的胞外体。可用于制造本文所描述的微流体装置的示例性材料可以包括但不限于玻璃、共聚物、聚合物或其任何组合。示例性聚合物包括但不限于聚氨酯、橡胶、成型塑料、聚甲基丙烯酸甲酯(pmma)、聚碳酸酯、聚四氟乙烯(teflontm)、聚氯乙烯(pvc)、聚二甲基硅氧烷(pdms)、聚砜和基于醚的脂肪族聚氨酯。
在制造本文所描述的微流体装置的任何实施方式中所使用的方法可以随使用的材料而变化,并且包括3d打印方法、软刻蚀方法、微组装、体微加工方法、表面微加工方法、标准平版印刷方法、湿法刻蚀、反应离子刻蚀、等离子刻蚀、立体平版印刷和激光化学三维书写方法、实物体印刷、机械加工、模块化组装方法、复制成型方法、注塑成型方法、热成型方法、激光烧蚀方法、方法的组合和本领域已知的其他方法。
在特定的实施方式中,本文所描述的微流体装置可以使用3d打印机制造。例如,制造微流体装置的方法可以包括提供包括基体、壁和顶部磁体保持架的三件pdms模具,如图7所示。模具可以通过3d打印机打印出来。模具可以用20nm厚的sportline钯包覆,随后使用本领域已知的方法进行组装。pdms细胞室的尺寸可以调整使得当在填充时,细胞培养室具有用于室塞的开口端。pdms可以由接头试剂以10:1的比率进行浇铸,并在40℃的温度下孵育6小时。在pdms固化后,它可以轻松剥离。芯片的入口和出口可以通过使用打孔器打孔。然后可以将pdms芯片在40℃温度下在热垫上后粘合5min。可以使用di水清洁芯片,并通过加压釜灭菌(在121℃下30min)。
使用方法
如本文所讨论,公开的微流体装置可以用于分离、捕获、工程化和释放工程化细胞外囊泡和各种类囊泡生物结构。在某些实施方式中,工程化细胞外囊泡是免疫原性胞外体。如本文所用,术语“胞外体”通常是指源自以下的外部释放的囊泡:内体隔室或任何细胞,例如肿瘤细胞(例如,前列腺癌细胞)和免疫细胞(例如,抗原呈递细胞,诸如树突状细胞、巨噬细胞、肥大细胞,t淋巴细胞或b淋巴细胞)。胞外体通常是具有约20-150nm尺寸的膜囊泡,其从包括以下的各种不同细胞类型中释放:肿瘤细胞、红血细胞、血小板、淋巴细胞和树突状细胞。胞外体可以通过从晚期内体的膜内陷和出芽而形成。它们可以积聚在胞质多泡体(mvb)中,从这里它们可以通过与质膜融合而被释放。不希望受到理论的束缚,囊泡脱落的过程在增殖的细胞诸如癌细胞中特别活跃,在这里释放可以连续发生。当自肿瘤细胞释放时,胞外体可以促进侵袭和迁移。因此,在一些实施方式中,本文所描述的免疫磁性颗粒可用于捕获源自癌细胞的胞外体。根据细胞来源,胞外体可以募集可能不同于质膜的各种细胞蛋白,包括mhc分子、四次穿膜蛋白、黏附分子和金属蛋白酶。在胞外体的许多亚型中,具有mhci类和ii类分子以及其他共刺激分子的内在有效负载的免疫原性胞外体能够介导免疫应答,这为开发新型癌症疫苗和免疫治疗中的递送打开了机遇。
因此,本文还提供了在本文公开的微流体装置中生产免疫原性胞外体的方法。生产免疫原性胞外体复合物的方法可以包括将细胞引入微流体装置的细胞培养室中。细胞培养室中的细胞可以包括可以自其中获得细胞外囊泡的任何细胞。这样的细胞包括树突状细胞、干细胞、免疫细胞、巨核细胞系祖细胞、巨噬细胞或其组合。
用于生产免疫原性胞外体的方法可以进一步包括在允许释放胞外体的条件下培养细胞。在一些实施方式中,该方法可以包括通过使用本领域已知的刺激介导它们的亲本细胞生长来富集或扩增存在于细胞样品中的胞外体的数量。用于培养亲本细胞以生产胞外体的常规方法是本领域已知的,并且可以用于本文公开的方法中。在一些实施方式中,可以将细胞培养一段时间,例如至少约30min、至少约45min、至少约1小时、至少约2小时、至少约3小时、至少约5小时、至少约6小时、至少约8小时、至少约10小时、至少约12小时、至少约15小时、至少约18小时、至少约20小时、至少约24小时、至少约30小时、至少约36小时、至少约40小时或至少约48小时。
用于生产免疫原性胞外体复合物的方法可以进一步包括将包括胞外体的细胞培养物与用于捕获胞外体的免疫磁性颗粒和洗涤溶液混合以形成混合物。在一些实施方式中,该方法包括将来自细胞培养物的胞外体引入至混合通道中,并将胞外体与免疫磁性颗粒和洗涤缓冲液混合以形成混合物。可以将免疫磁性颗粒经由颗粒入口通道引入至混合通道中,并将洗涤缓冲液经由流体入口通道引入至混合通道中。
免疫磁性颗粒可以选择性地结合至存在于细胞培养物中的胞外体,以形成胞外体结合的免疫磁性颗粒。因此,该方法可以包括允许胞外体与免疫磁性颗粒反应。免疫磁性颗粒可以包括磁性颗粒并且可以是任何形状,包括但不限于球形、棒形、椭圆形、圆柱形和盘形。在一些实施方式中,具有基本上球形形状和限定的表面化学的磁性颗粒可以用于使化学凝集和非特异性结合最小化。如本文所用,术语“磁性颗粒”可以是指被磁场梯度吸引或排斥或具有非零磁化率的纳米或微米尺度颗粒。磁性颗粒可以是铁磁性的、顺磁性的或超顺磁性的。在一些实施方式中,磁性颗粒可以是超顺磁性的。
磁性颗粒可以在1nm至5微米的尺寸范围。例如,磁性颗粒可以为约500nm至约5微米的尺寸。在一些实施方式中,磁性颗粒可以为约1微米至约5微米的尺寸。在一些实施方式中,磁性颗粒可以为约1微米至约3微米的尺寸。磁性颗粒是可以使用磁场和/或磁场梯度来操纵的一类颗粒。这样的颗粒一般由磁性元素诸如铁、镍和钴及它们的氧化物化合物组成。磁性颗粒(包括纳米颗粒或微粒)是众所周知的,并且用于其制备的方法已在本领域中进行了描述。磁性颗粒也是广泛并可商购的。特别优选的颗粒是具有氧化石墨烯层或包括氧化石墨烯纳米片的涂层的磁性颗粒,如在提交于2017年10月9日的us2018/0100853中所述,其全部内容通过援引并入本文。
磁性颗粒可以包覆有包括各自的亲和探针(分子)的多个接头,用于捕获对磁性没有不利影响的靶标(诸如抗原肽或其抗原表位)。在这方面,磁性颗粒可以用有机部分或官能团以及可光致断裂的接头功能化,该接头可以将磁性颗粒连接至相应的亲和探针以捕获胞外体。这样的有机部分或官能团通常可以包括直接键或原子诸如氧或硫、单元诸如氨基基团、羧酸基团、环氧基基团、甲苯磺酰基基团、类二氧化硅基团、羰基基团、酰胺基团、so、so2、so2nh、ss或原子链。
在某些实施方式中,磁性颗粒可以包覆有亲和结合对中的一个成员,该亲和结合对可以促进磁性颗粒与亲和探针的缀合以捕获胞外体。术语“亲和结合对”或“结合对”是指彼此特异性结合的第一和第二分子。结合对的一个成员与待连接的第一部分缀合,而第二成员与待连接的第二部分缀合。示例性的结合对包括与相应抗体或其结合部分或片段(例如,地高辛和抗地高辛;小鼠免疫球蛋白和山羊抗小鼠免疫球蛋白)组合的任何半抗原或抗原化合物,以及非免疫结合对(例如,生物素-抗生物素蛋白、生物素-链霉抗生物素蛋白、生物素-中性抗生物素蛋白、激素[例如,甲状腺素和皮质醇-激素结合蛋白、受体-受体激动剂、受体-受体拮抗剂(例如,乙酰胆碱受体-乙酰胆碱或其类似物)、igg-蛋白a、igg-蛋白g、igg合成的蛋白ag、凝集素-碳水化合物、酶-酶辅因子、酶-酶抑制剂和能够形成核酸双链体的互补寡核苷酸对)等。结合对还可以包括带负电的第一分子和带正电的第二分子。
使用结合对缀合的一个实例是生物素-抗生物素蛋白、生物素-链霉抗生物素蛋白或生物素-中性抗生物素蛋白缀合。因此,在一些实施方式中,磁性颗粒可以包覆有可以与生物素化的键缀合以用作捕获分子的类抗生物素蛋白分子(例如,链霉抗生物素蛋白或中性抗生物素蛋白)。
在一些实施方式中,磁性颗粒可以用可断裂的化学部分进一步功能化,该可断裂的化学部分可以将磁性颗粒连接至亲和探针以捕获胞外体,并且易受外部施加的断裂剂/条件的影响,例如,uv光、ph、氧化还原电位或降解性分子诸如酶的存在。在特定的实例中,可断裂的接头可以在一个功能性末端处与结合对的成员(诸如生物素)缀合以连接至磁性颗粒,并且另一功能性末端提供用于捕获胞外体的亲和探针。因此,在将胞外体结合的磁性颗粒从流体样品中分离之后,如果需要,可以通过断裂磁性颗粒和亲和探针之间的可断裂的化学部分,将胞外体从磁性颗粒中分离。
示例性的可断裂的连接基团包括但不限于可光致断裂和氧化还原可断裂的连接基团(例如,-oc(o)nh-、-s-s-和-c(r)2-s-s-,其中,r是h或c1-c6烷基);磷酸盐基可断裂的连接基团(例如,-o-p(o)(or)-o-、-o-p(s)(or)-o-和-o-p(s)(h)-s-,其中,r为任选取代的直链或支链c1-c10烷基);酸可断裂的连接基团(例如,腙、酯和氨基酸的酯、-c=nn-和-oc(o)-);酯基可断裂的连接基团(例如,-c(o)o-);肽基可断裂的连接基团(例如,通过酶诸如细胞中的肽酶和蛋白酶断裂的连接基团,例如,-nhchrac(o)nhchrbc(o)-,其中,ra和rb是两个相邻氨基酸的r基团)。
在一些实施方式中,可断裂的连接基团是可以通过uv光断裂的可光致断裂的基团。可光致断裂的基团的特定实例包括邻硝基苄基衍生物和苄基磺酰基,诸如6-硝基藜芦基氧羰基(nvoc)、2-硝基苄氧羰基(nboc)、α,α-二甲基-二甲氧基苄氧羰基(ddz)、邻硝基苄基(onb)、1-(2-硝基苯基)乙基(npe)、α-羧基-2-硝基苄基(cnb)、4,5-二甲氧基-2-硝基苄基(dmnb)、l-(4,5-二甲氧基-2-硝基苯基)乙基(dmnpe)、5-羧甲氧基-2-硝基苄基(cmnb)和(5-羧甲氧基-2-硝基苄基)氧基)羰基(cmncbz)。应认识到,选择芳族核上的取代基以调整吸收的波长,给电子基团(例如,甲氧基)通常导致更长的波长吸收。例如,通过将两个甲氧基残基分别添加至4,5-二甲氧基-2-硝基苄基和1-(4,5-二甲氧基-2-硝基苯基)乙基中来修饰硝基苄基(nb)和硝基苯基乙基(npe),从而增加吸收波长范围至340-360nm。可光移除的保护基团的额外实例包括包含与硝基基团邻位的苄基氢的多取代的硝基芳族化合物,其中,取代基可以包括烷氧基、烷基、卤素、芳基、烯基、硝基、卤素或氢。可以使用的其他材料包括邻-羟基-α-甲基肉桂酰基衍生物,基于香豆素系统的可光致断裂的基团,诸如bhc(诸如美国专利no.6,472,541中所描述的,其公开通过援引并入本文),包括php基团的可光致断裂的基团(诸如在givensetal.,j.am.chem.soc.1222687-2697(2000)中所描述的,其公开通过援引并入本文),酮洛芬衍生的接头,其他邻位-硝基芳族核骨架包括在杂狄尔斯-阿尔德反应(heterodielsalderreaction)中诱捕亚硝基副产物的那些(通常在美国专利申请no.2010/0105120中讨论,其公开通过援引并入本文),硝基二苯并呋喃(ndbf)发色团或重氮-叠氮化物。可光致断裂的基团的进一步实例可以在例如patchornik,j.am.chem.soc.(1970)92:6333和amitetal.,j.org.chem.(1974)39:192中找到,其公开通过援引并入本文。
如上文所描述,可光致断裂的基团是其与分子(诸如在一个功能性末端处与结合对的成员例如生物素并且另一功能性末端与亲和探针)的共价连接通过暴露于适当波长的光而断裂的基团。在一方面,当缀合物经受紫外光或近紫外光时,发生亲和探针和/或结合对的释放。例如,亲和探针的光致释放可以在约200至380nm范围的波长下发生(确切的波长或波长范围将取决于所使用的特定可光致断裂的基团,并且可以是,例如,200、210、220、230、240、250、260、270、280、290、300、310、320、330、340、350、360、370或380或它们之间的某个范围)。在另一方面,当缀合物经受可见光时,可以发生亲和探针的释放。例如,亲和探针的光致释放可以在约380至780nm范围的波长下发生(确切的波长或波长范围将取决于所使用的特定可光致断裂的基团,并且可以是,例如,380、400、450、500、550、600、650、700、750或780,或两者之间的某个范围)。
如本文所描述,磁性颗粒进一步包括亲和探针(本文中也称为用于捕获胞外体的分子或捕获分子)。如本文所用,术语“亲和探针”或“捕获分子”是指任何分子、细胞或颗粒材料。包括磁性颗粒的合适的亲和探针在us20170065978和us20170001197中描述,其各自以其全部内容通过援引并入。亲和探针可以包括特异性结合目的靶标(胞外体或其他细胞外囊泡)的结合元件。例如,结合元件可以是核酸低聚物、抗体、酶、激素、生长因子、细胞因子(例如,炎性细胞因子)、蛋白质、肽、朊病毒、凝集素、寡核苷酸、碳水化合物、脂质、分子和化学毒素或其他对靶标具有高亲和力和高特异性的结合元件,以及对靶标上的指定表面蛋白具有特异性的结合元件。可以通过本领域已知的方法经由可断裂的接头将一个或多个结合元件(例如,肽)连接至磁性颗粒。通常,结合元件与靶标特别是胞外体或其他细胞外囊泡具有的亲和常数(ka)大于约105m-1(例如,106m-1、107m-1、108m-1、109m-1、1010m-1、1011m-1和1012m-1或更高)。
在某些实施方式中,亲和探针包括抗原肽或其抗原表位。如本文所用,术语“抗原”是指分子或分子的部分,其能够被选择性结合剂诸如抗体结合,并且另外能够被用于动物以引发能够结合至该抗原的表位的抗体的产生。抗原可以具有一个或多个表位。术语“抗原”还可以指能够被抗体或t细胞受体(tcr)(如果由mhc分子呈递)结合的分子。如本文所用,术语“抗原”还涵盖t细胞表位。抗原另外能够被免疫系统识别和/或能够诱导体液免疫应答和/或细胞免疫应答,从而导致b-和/或t-淋巴细胞的激活。抗原可以具有一个或多个表位(b-和t-表位)。上文所指的特异性反应旨在表明抗原将优选地通常以高度选择性的方式与其相应的抗体或tcr反应,并且不与可能由其他抗原诱发的多种其他抗体或tcr反应。本文所用的抗原也可以是几种单独抗原的混合物。
如上文所述,亲和探针(抗原)可以是蛋白质或肽。在一些实施方式中,蛋白质或肽可以是能够激活免疫细胞和/或启动免疫应答、结合稀有细胞例如循环肿瘤细胞、干细胞和/或微生物的基本上任何蛋白质。仅作为实例,如果靶标物种是癌症,则可以用于生成癌症亲和探针的示例性蛋白质或肽或其他分子可以包括但不限于mage-a3、gp-100、her-2、p53、psa-1或mart-1、egfr、ercc1、cxcr4、epcam、cea、erbb-2、e-钙黏着蛋白、黏蛋白-1、细胞角蛋白、psa、psma、rrm1、雄激素受体、雌激素受体、孕酮受体、igf1、cmet、eml4或白细胞相关受体(lar)。
在一些实施方式中,亲和探针可以是抗体或其部分,或类抗体分子。在一些实施方式中,捕获分子可以是对稀有细胞例如循环肿瘤细胞、干细胞和/或微生物生物标志物的检测有特异性的抗体或其部分或者类抗体分子。在一些实施方式中,亲和探针可以是适配体。在一些实施方式中,亲和探针可以是dna或rna适配体。在一些实施方式中,亲和探针可以是细胞表面受体配体。示例性的细胞表面受体配体包括,例如,细胞表面受体结合肽、细胞表面受体结合糖肽、细胞表面受体结合蛋白、细胞表面受体结合糖蛋白、细胞表面受体结合有机化合物和细胞表面受体结合药物。额外的细胞表面受体配体包括但不限于细胞因子、生长因子、激素、抗体和血管生成因子。在一些实施方式中,可以结合至稀有细胞例如循环肿瘤细胞、干细胞和/或微生物的任何本领域公认的细胞表面受体配体都可以用作本文所描述的磁性颗粒上的亲和探针。在一种或多种实施方式中,选择亲和探针以靶向存在于靶标(例如胞外体)的表面上的免疫刺激分子,诸如mhci类分子、mhcii类分子、白介素、tnfα、ifnγ、rantes、g-csf、m-csf、ifnα、ctapiii、ena-78、gro、i-309、pf-4、ip-10、ld-78、mgsa、mip-1α、mip-1β及其组合。更优选地,在结合亲和探针(以及随后释放靶标)后,包括结合的亲和探针的所得工程化靶标增强了释放的靶标的免疫原性潜力。例如,mhci类表面蛋白通过亲和探针的结合创建了复合物,该复合物将(在治疗用途中)增强抗原呈递细胞对工程化靶标的识别和摄取,以刺激和激活免疫系统。该肽优选地为15个氨基酸残基或更少的长度,更优选13个残基或更少的长度,甚至更优选12个残基或甚至11个残基或更少的长度。
示例性亲和探针包括下表中列出的那些:
应认识到,适合用于亲和探针的前述肽也是用于表面负载至工程化靶标上的活性剂或部分的示例。
免疫磁性颗粒(即与亲和探针结合的磁性颗粒)优选地在混合过程之前形成。例如,将亲和探针(例如,经由可断裂的接头结合至生物素的抗原肽)和链霉抗生物素蛋白包覆的磁性颗粒混合在一起有效的一段时间,用于生物素化的亲和探针连接,以基本上完全包覆抗生物素蛋白包覆的颗粒的整个表面。
因此,优选地,在添加包含胞外体的细胞培养物之前,将亲和探针添加至链霉抗生物素蛋白包覆的磁性颗粒一段时间。在这样的实施方式中,可以首先将亲和探针添加至链霉抗生物素蛋白包覆的磁性颗粒中一段时间,以足以使至少一部分添加量的亲和探针与链霉抗生物素蛋白包覆的磁性颗粒结合(并且优选地完全结合亲和探针,从而用从其延伸的探针连接物包覆颗粒的整个表面)。
然后将存在于包含胞外体的细胞培养物中的胞外体添加至同一流体样品中,其中,胞外体可以结合至已经与链霉抗生物素蛋白包覆的磁性颗粒形成缀合物的亲和探针。
在一些实施方式中,可以单独形成免疫磁性颗粒,然后将免疫磁性颗粒引入至装置的混合通道中。
需要添加至样品中的免疫磁性颗粒的量可取决于许多因素,包括但不限于待处理样品的体积、可与亲和探针缀合的磁性颗粒的价、存在的胞外体的预期丰度及其任何组合。过高量的免疫磁性颗粒添加至装置中可能引起微流体装置内的非特异性结合和/或堵塞。免疫磁性颗粒的过低量可能导致低捕获效率。本领域技术人员可以确定免疫磁性颗粒和捕获分子的浓度。
可以允许胞外体与免疫磁性颗粒混合任何一段时间,例如数秒、数分钟或数小时。在一些实施方式中,胞外体可以与免疫磁性颗粒混合至少约1min、至少约2min、至少约5min、至少约10min、至少约15min、至少约30min、至少约1小时、至少约2小时或更长。基于包括但不限于免疫磁性颗粒与胞外体的亲和力、浓度、混合温度和/或混合速度的许多因素,本领域普通技术人员可以容易地确定混合时间的最佳时间。然而,在一种或多种实施方式中,将胞外体与颗粒混合1小时或更短。
可以将胞外体和免疫磁性颗粒以任何流速引入微流体装置的样品入口,该流速提供混合物保留在本文所描述的微流体装置的混合通道和隔离通道中的足够的停留时间。在一些实施方式中,可以以0.1ul/min至1ul/min之间的流速引入样品。可以通过技术人员已知的任何方法将样品流体引入至微流体装置的入口。例如,可以将流量发生器连接至本文所描述的微流体装置的入口和出口中的至少一个。流量发生器的非限制性实例可以包括蠕动泵、注射泵和可通常用于使流体流经微流体装置的任何本领域公认的泵。
生产免疫原性工程化靶标的方法可以进一步包括通过在收集或工程化室内施加磁场来捕获结合至免疫磁性颗粒的胞外体。在一些实施方式中,磁体具有足以创建磁场梯度的强磁场强度,以引起磁性标记的胞外体从收集室中的流体样品中分离。固定的磁性标记的胞外体可以从微流体装置中移除用于进一步加工。优选地,如本文所讨论的,将捕获的胞外体进一步工程化并在表面上或内部负载额外的活性部分。随后,该方法包括光解断裂结合至免疫磁性颗粒的胞外体,以释放包覆有活性部分或内部负载有活性剂的完整胞外体。
释放的靶标(胞外体)可以作为药物组合物提供。药物组合物可以包括免疫原性胞外体和药学上可接受的赋形剂。应认识到,可以定制活性部分以提供针对靶标病症的特异性适应性免疫应答,或者可以更通常地选择活性部分以激活针对各种感染或病症的先天性免疫系统。
本文所描述的方法可以用于实时处理样品。例如,该方法允许胞外体的实时、连续收获和抗原修饰,以及随后按需光致释放至下游。
如本文所描述,该方法可用于生产免疫原性胞外体复合物或其他免疫原性类囊泡结构。在某些实施方式中,免疫原性胞外体复合物可以包括缀合至胞外体表面的抗原肽。用于制造免疫原性胞外体复合物的本文描述的方法提供了具有比非工程化胞外体显著更高的t细胞的激活率的复合物。在一些实例中,与天然胞外体相比,免疫原性胞外体复合物可以激活t细胞的至少20%、至少25%、至少30%、至少35%、至少40%、至少45%、至少50%、至少55%、至少60%、至少65%、至少70%、至少75%、至少80%、至少85%或至少90%。由于提高的激活率,本文所描述的免疫原性复合物可以用于癌症免疫治疗。
因此,公开了使用免疫原性复合物在受试者中治疗疾病的方法。该方法可以包括向受试者给药包括免疫原性复合物的组合物。在一些实施方式中,该疾病可以是感染。在一些实例中,该疾病可以是癌症。该方法可以进一步包括给药已经负载至靶标中的化学治疗剂。
在阅读了本文的公开和以下工作实施例后,本发明的各种实施方式的额外优点对于本领域技术人员将是显而易见的。应认识到,除非本文另外指出,否则本文描述的各种实施方式不必相互排斥。例如,在一种实施方式中描述或描绘的特征也可以被包括在其他实施方式中,但是不一定被包括。因此,本发明涵盖本文描述的特定实施方式的各种组合和/或集成。
如本文所用,短语“和/或”,当在两个或更多个项目的列表中使用时,意指可以单独应用所列出的项目中的任何一个,或者可以应用所列出的项目中的两个或更多个的任何组合。例如,如果将组合物描述为包含或不包括组分a、b和/或c,则该组合物可以包含或不包括单独a;单独b;单独c;a和b的组合;a和c的组合;b和c的组合;或a、b和c的组合。
本说明书还使用数值范围来量化与本发明的各种实施方式相关的某些参数。应当理解,当提供数值范围时,这样的范围解释为为仅陈述该范围的下限值的权利要求限制以及仅陈述该范围的上限值的权利要求限制提供文字支持。例如,公开的约10至约100的数值范围为陈述“大于约10”(无上限)的权利要求和陈述“小于约100”(无下限)的权利要求提供了文字支持。
所附权利要求的装置、系统和方法不受本文描述的特定装置、系统和方法的范围限制,其旨在作为权利要求的一些方面的说明。功能上等效的任何装置、系统和方法均旨在落入本权利要求的范围内。除了本文示出和描述的那些之外,装置、系统和方法的各种修改旨在落入所附权利要求的范围内。进一步,尽管仅特别描述了本文公开的某些代表性装置、系统和方法步骤,但是即使没有特别陈述,装置、系统和方法步骤的其他组合也旨在落入所附权利要求的范围内。因此,步骤、元件、组分或成分的组合可以在本文中明确或较少提及,然而,即使没有明确说明,步骤、元件、组分和成分的其他组合也包括在内。
如本文所用,术语“包含”及其变体与术语“包括”及其变体同义使用,并且是开放的、非限制性术语。尽管本文已使用术语“包含”和“包括”来描述各种实施方式,但是可以使用术语“基本上由...组成”和“由...组成”来代替“包含”和“包括”以提供本发明的更特定的实施方式,并且也被公开。除非另有说明,否则至少应理解,并且不是试图将等同原则的应用限制于权利要求的范围,说明书和权利要求书中使用的所有表达几何形状、尺寸等的数字应根据有效数字的数目和普通的四舍五入方法来解释。
除非另有限定,否则本文所用的所有技术和科学术语具有与所公开发明所属领域的技术人员通常理解的相同含义。本文引用的出版物以及它们所引用的材料通过援引特别并入。
借助于非限制性说明,以下给出本公开的某些实施方式的实例。
实施例
以下实施例阐述了根据本发明的方法。然而,应当理解,这些实施例以说明的方式提供,并且其中的任何内容都不应视为对本发明总体范围的限制。
实施例1:对癌症免疫治疗的胞外体的微流体按需工程化
摘要:细胞外纳米囊泡(≤1μm),特别是胞外体(30-150nm),是介导细胞通讯的新兴递送系统,已观察到其通过将亲本细胞信号传导蛋白或肿瘤抗原呈递至免疫细胞来启动免疫应答。在此实例中,提供了流线型微流体细胞培养平台,用于直接在一个工作流中进行表面工程化胞外体的收获、抗原修饰和光致释放。pdms微流体细胞培养平台是自3d打印的模具复制的。通过在胞外体表面上工程化抗原肽(例如,gp-100、mart-1、mega-a3),可以实现有效的抗原呈递和t细胞激活。这已经通过使用源于人血液的白细胞的芯片上培养物进行用黑素瘤肿瘤肽实时工程化分泌的胞外体而得到了证明。测试了从2pmel1转基因小鼠的脾脏中纯化的gp100特异性cd8t细胞。与非工程化胞外体相比,观测到了由工程化胞外体诱导的显著更高的t细胞激活水平(~30%)。这种微流体平台作为自动化和高度集成的细胞培养装置,用于快速并且实时地生产可推进癌症免疫治疗的治疗性胞外体。
方法和材料
3d打印和微流体装置制造:提供了用于pdms芯片制造的三件模具,包括基体、壁和顶部磁体保持架。模具是通过使用
芯片上细胞培养和胞外体收集、工程化和释放:首先用蒸馏水清洁细胞盒(8mm盖玻片),并在生物罩内空气干燥。然后,将它们在121℃下加压釜处理30min。将盒置于24孔板中,并将500μl的0.1mg/ml氢溴酸聚-d-赖氨酸(mpbiomedicals)添加至每个孔中,并在室温下孵育5min。将1ml的md水添加至每个孔3min,并重复两次以清洁细胞盒,并然后放置在生物罩内空气干燥并储存以备将来使用。
将4μlβ2-微球蛋白(sigma-aldrich)和10μl每种蛋白质(gp100、mage-a3和mart-1)与186μl1×pbs混合至修饰溶液中,最终体积为200μl。将b-入口保持封闭,并且将修饰溶液从a-入口以及将洗涤缓冲液从c-入口泵送通过芯片,以1μl/min的体积流速持续10min,和0.1μl/min持续10min,以及设置成静态另外10min。从a-入口和c-入口两者均以1μl/min的体积流速进行洗涤步骤15min。移除底部磁体,并打开近uv以处理主室10min。采用从a-入口和c-入口的另一洗涤步骤,以1μl/min的体积流速持续20min,以自出口收集约20μl的崩解的胞外体。
超速离心和胞外体染色:将收集的20μl胞外体添加至超速离心管中,并稀释至1ml的最终体积,用于在1,500rcf下离心30min(thermoscientifictmsorvalltmmtx)。将上清液移除并转移至新鲜的超速离心管中。然后将混合物以100,000rcf的速度处理1小时。通过用于常规细胞膜标记的pkh67绿色荧光细胞连接midi试剂盒(pkh67greenfluorescentcelllinkermidikit)(sigma-aldrich)对胞外体进行染色。用2μl的pkh67和1ml的稀释剂c制备染色溶液。弃去试管中的任何残留溶液,并添加1ml稀释剂c以用软移液管重悬。染色的溶液至超速离心管,用移液管混合,并在室温下反应3.5min。添加2ml的fbs(胞外体耗尽)以淬灭游离染料。添加1.5ml的0.971m蔗糖溶液用于密度梯度离心。添加另外的6.5ml完全培养基以将体积增加至10ml。将超速离心机设定为100,000rcf下1小时。弃去上清液,并小心洗涤染色环而不到达环的中心。添加另外的2ml的1xpbs以重悬沉淀。超速离心机以100,000rcf的速度运行另外1小时。吸去上清液,并且添加另外100μl的1xpbs以重悬沉淀。所有步骤均保持在无菌条件下,并且将1μl青霉素-链霉素(
胞外体摄取:通过使用atcc配制的rpmi-1640培养基(
结果
用于在线收获胞外体的3d打印成型的微流体细胞培养装置:已经开发了用于使用3d打印的模具制造基于pdms的芯片上细胞培养微流体装置的简便且低成本的方法。培养芯片包含具有1mm直径和0.5mm高度的芯片上细胞培养室,用于芯片上生长细胞并在下游收集源自培养培养基的胞外体。细胞培养室在顶部保持敞开,以应用pdms制造的指推塞,其用于培养基交换并将培养基推至下游收集通道。细胞培养室的底部具有约200μm宽和200μm高的出口通道(b-入口),用于引入培养培养基以与免疫磁性分离珠粒(a-入口)混合。c-入口用于引入由注射泵驱动的洗涤缓冲液。图4证明了在使用荧光染料溶液的荧光显微镜的观察下,通过a-入口和b-入口的混合过程并且退出至胞外体隔离通道(蛇形通道)。图5(b)记录了在蛇形通道内混合的免疫磁性珠粒。在培养装置中培养源于人血液的白细胞,具有图5(c)中示出的形态。仍观察到很少的红血细胞呈杯状。从芯片的出口处分离、捕获和光致释放分泌的胞外体,并通过图5(d)中示出的sem成像表征。
可光致断裂的接头在两端与生物素和nhs化学的双功能缀合。生物素基团将可光致断裂的接头锚定在链霉抗生物素蛋白免疫磁性珠粒的表面,并且nhs基团经由伯胺缀合mhc-i肽,如图7a示出。mhci类分子是由两条多肽链α和β2-微球蛋白组成的异二聚体。两条链经由b2m和α3结构域的相互作用非共价连接。折叠其他两个结构域α1和α2以构成用于结合至8-10个氨基酸肽(mhc-i结合肽)的凹槽。mhc-i/肽结合复合物将呈现至细胞毒性t细胞,随后用于触发免疫系统的即时应答。一旦mhc-i阳性胞外体被肿瘤靶向抗原(tta)肽捕获并由具有磁场的捕获室中的免疫磁性珠粒保留,则具有饱和tta肽的抗原负载缓冲液将经由c-入口引入,以完全结合并占据其余可用的mhc-i肽结合位点。这种抗原表面工程化过程可以大幅提高tta肽对捕获的mhc-i阳性胞外体的负载量,并增强激活t细胞的效力。
进一步表征的是mhc-i肽修饰的光致释放免疫磁性珠粒与用荧光标记的mch-i阳性胞外体之间的结合强度,如图7b所示。mhc-i抗体充当评估肿瘤靶向抗原肽和mhc-i阳性胞外体之间的结合强度的阳性对照。由于mhc-i/肽复合物之间更强的结合强度,它具有更高的激活t细胞抗肿瘤应答的潜力。gp-100已示出具有更强的形成mhc-i/肽复合物的能力,并且结合强度甚至比mhc-i抗体更强(95%相对84.8%)。
在图8a-8e中表征了按需光致释放的性能。在阳性对照和阴性对照之间比较,通过在倒置荧光显微镜下测量珠粒聚集体的荧光强度,来捕获并释放荧光标记的胞外体。sem成像方法用于确认光致释放过程。通过比较在光致断裂之前和之后的珠粒表面的sem成像,在珠粒表面上不存在可识别的胞外体颗粒,这表明好的光致释放性能。还表征了uv暴露时间,在8分钟uv暴露内达到98%的光致断裂率。评估了工程化胞外体和非工程化胞外体的尺寸分布,示出胞外体的合适的尺寸范围在50nm-200nm之间,从而证实工程化胞外体保持了良好的完整性。
研究了uv暴露对胞外体分子含量的副作用,示出在10分钟uv处理下,在胞外体蛋白质、dna和rna方面不能检测到变化(图13)。
为了评估经由按需光致释放自微流体细胞培养装置中释放的工程化胞外体的效力和完整性,收获并用绿色荧光标记来自芯片出口的胞外体。将gp-100工程化胞外体和非工程化胞外体与树突状单核细胞孵育,以每隔一小时监测细胞摄取。然后固定细胞,并用dapi对细胞核染色。图9a中示出的绿点是标记的胞外体,其大量分布在细胞核周围。细胞摄取开始于一小时内,并且摄取速度比非工程化胞外体要快得多。4小时后,观察到工程化胞外体和非工程化胞外体两者均由溶酶体途径清除。该观察结果表明,gp-100工程化胞外体对树突状单核细胞摄取更具活性。使用elisa,通过将gp-100工程化胞外体与树突状单核细胞温育来监测细胞因子ifn-γ的表达。与非工程化胞外体的孵育相比,在连续监测后48小时,ifn-γ的表达水平要高得多,增加了几乎2倍。图9b中的灰色虚线表示使用pwm蛋白作为刺激物的阳性对照。刺激后的树突状细胞形态在图14中示出。与无刺激的阴性对照相比,pwm蛋白和gp-100工程化胞外体两者均对转变为圆形漂浮树突状细胞产生了显著影响。与对照pwm蛋白刺激相比,gp-100工程化胞外体示出对于细胞因子ifn-γ的产生更高的刺激率。
进一步研究了gp-100工程化胞外体激活经历增殖和细胞溶解的cd8+t细胞的效力。观察到,在激活的树突状细胞存在下,gp-100工程化胞外体具有激活转基因t细胞的能力。gp100特异性cd8t细胞通过磁性细胞分选自2pmel1转基因小鼠的脾脏纯化,并用细胞示踪紫(celltraceviolet)增殖染料标记。将纯化的t细胞单独培养(仅t细胞),并与初始
还研究了牛呼吸道合胞病毒(brsv)的免疫原性效力。将t细胞和激活的jaws细胞与浓度增加的brsv抗微生物肽工程化胞外体(用肽4:m187-195肽naitnakii,seqidno:4工程化的胞外体)孵育。cd8+t细胞增殖的免疫刺激对工程化胞外体的剂量呈线性响应,其比使用高剂量肽疫苗更有效。在激活的树突状细胞存在下,brsv工程化胞外体具有激活brsvm-特异性t细胞的能力。用在quila为佐剂中的20nmbrsvm187-196皮下免疫c57bl/6小鼠两次。最终免疫后至少4周,将动物安乐死并收集脾脏。通过磁性细胞分离将cd8+t细胞和cd11c+脾脏树突状细胞分离。用细胞示踪紫增殖染料标记cd8+t细胞。将纯化的t细胞单独培养(仅t细胞),或与cd11c+脾脏dc(t细胞+dc)以3:1的比率混合。保留dc细胞不受刺激或用200ng/mllps处理以诱导dc激活。将使用上述微流体平台用brsv肽负载的工程化胞外体以增加比率的胞外体:树突状细胞(25、50和100)添加至t细胞培养物中。阴性对照孔未接受胞外体。阳性对照孔用1nm或5nm纯m187-196肽处理。将细胞和胞外体共培养5天,并然后通过流式细胞术以细胞示踪紫稀释作为增殖的量度来分析cd8t细胞。结果示于图11中。所有结果都支持,所公开的用于捕获、抗原负载和光致释放的方法可以有效地产生抗微生物肽工程化胞外体,从而导致以高效力成功激活t细胞。
实施例2:工程化胞外体的体内给药
上述免疫原性效力研究使用转基因小鼠,对该转基因小鼠使用专有公开的方法注射工程化胞外体。将胞外体使用上文描述的流线型/连续微流体过程在表面上用gp-100或brsvm187-196肽工程化,并悬浮于pbs缓冲液中,以通过尾部进行体内腹腔内注射。我们没有观察到来自注射小鼠的注射部位反应或不良反应(注射部位肿胀、刺激等)。在注射后的前72小时,每天两次观察小鼠,并且未观察到不良反应,表明了工程化胞外体和相关组合物的一般体内安全性。
序列表
<110>堪萨斯大学(theuniversityofkansas)
堪萨斯州立大学研究基金会(kansasstateuniversityresearchfoundation)
<120>用于生成治疗递送平台的方法
<130>ppi21170858us
<150>us62/748,470
<151>2018-10-21
<160>59
<170>patentinversion3.5
<210>1
<211>8
<212>prt
<213>人工序列
<220>
<223>合成肽
<400>1
serileileasnpheglulysleu
15
<210>2
<211>9
<212>prt
<213>人工序列
<220>
<223>合成肽
<400>2
sertyrileglyserileasnasnile
15
<210>3
<211>9
<212>prt
<213>人工序列
<220>
<223>合成肽
<400>3
lystyrlysasnalavalthrgluleu
15
<210>4
<211>9
<212>prt
<213>人工序列
<220>
<223>合成肽
<400>4
asnalailethrasnalalysileile
15
<210>5
<211>9
<212>prt
<213>人工序列
<220>
<223>合成肽
<400>5
glualaaspprothrglyhissertyr
15
<210>6
<211>9
<212>prt
<213>人工序列
<220>
<223>合成肽
<400>6
gluvalaspproileglyhisleutyr
15
<210>7
<211>9
<212>prt
<213>人工序列
<220>
<223>合成肽
<400>7
glyleutyraspglymetgluhisleu
15
<210>8
<211>9
<212>prt
<213>人工序列
<220>
<223>合成肽
<400>8
lysvalalagluleuvalhispheleu
15
<210>9
<211>9
<212>prt
<213>人工序列
<220>
<223>合成肽
<400>9
lysvalleuglutyrvalilelysval
15
<210>10
<211>9
<212>prt
<213>人工序列
<220>
<223>合成肽
<400>10
pheleutrpglyproargalaleuval
15
<210>11
<211>10
<212>prt
<213>人工序列
<220>
<223>合成肽
<400>11
lysvalalaglugluleuvalhispheleu
1510
<210>12
<211>10
<212>prt
<213>人工序列
<220>
<223>合成肽
<400>12
tyrleuglnleuvalpheglyilegluval
1510
<210>13
<211>10
<212>prt
<213>人工序列
<220>
<223>合成肽
<400>13
glyvaltyraspglyarggluhisthrval
1510
<210>14
<211>9
<212>prt
<213>人工序列
<220>
<223>合成肽
<400>14
lysvalvalglupheleualametleu
15
<210>15
<211>10
<212>prt
<213>人工序列
<220>
<223>合成肽
<400>15
leuleupheglyleualaleuilegluval
1510
<210>16
<211>9
<212>prt
<213>人工序列
<220>
<223>合成肽
<400>16
alaleulysaspvalglugluargval
15
<210>17
<211>9
<212>prt
<213>人工序列
<220>
<223>合成肽
<400>17
thrpheproaspleuglusergluphe
15
<210>18
<211>8
<212>prt
<213>人工序列
<220>
<223>合成肽
<400>18
hisasnthrglntyrcysasnleu
15
<210>19
<211>9
<212>prt
<213>人工序列
<220>
<223>合成肽
<400>19
lysleuglncysvalaspleuhisval
15
<210>20
<211>11
<212>prt
<213>人工序列
<220>
<223>合成肽
<400>20
glyvalthrtyralacysphevalserasnleu
1510
<210>21
<211>9
<212>prt
<213>人工序列
<220>
<223>合成肽
<400>21
thrtyralacysphevalserasnleu
15
<210>22
<211>9
<212>prt
<213>人工序列
<220>
<223>合成肽
<400>22
hisleuserthralaphealaargval
15
<210>23
<211>9
<212>prt
<213>人工序列
<220>
<223>合成肽
<400>23
ileleuhisasnglyalatyrserleu
15
<210>24
<211>9
<212>prt
<213>人工序列
<220>
<223>合成肽
<400>24
thrtyrleuprothrasnalaserleu
15
<210>25
<211>9
<212>prt
<213>人工序列
<220>
<223>合成肽
<400>25
ileleuhisaspglyalatyrserleu
15
<210>26
<211>9
<212>prt
<213>人工序列
<220>
<223>合成肽
<400>26
thrtyrvalproalaasnalaserleu
15
<210>27
<211>9
<212>prt
<213>人工序列
<220>
<223>合成肽
<400>27
ilemetaspglnvalpropheserval
15
<210>28
<211>9
<212>prt
<213>人工序列
<220>
<223>合成肽
<400>28
valtyrphepheleuproasphisleu
15
<210>29
<211>9
<212>prt
<213>人工序列
<220>
<223>合成肽
<400>29
lysthrtrpglyglntyrtrpglnval
15
<210>30
<211>10
<212>prt
<213>人工序列
<220>
<223>合成肽
<400>30
valleutyrargtyrglyserpheserval
1510
<210>31
<211>9
<212>prt
<213>人工序列
<220>
<223>合成肽
<400>31
ilethraspglnvalpropheserval
15
<210>32
<211>9
<212>prt
<213>人工序列
<220>
<223>合成肽
<400>32
tyrleugluproglyprovalthrval
15
<210>33
<211>9
<212>prt
<213>人工序列
<220>
<223>合成肽
<400>33
tyrleugluproglyprovalthrala
15
<210>34
<211>9
<212>prt
<213>人工序列
<220>
<223>合成肽
<400>34
lysvalproargasnglnasptrpleu
15
<210>35
<211>9
<212>prt
<213>人工序列
<220>
<223>合成肽
<400>35
alaleuleualavalglyalathrlys
15
<210>36
<211>9
<212>prt
<213>人工序列
<220>
<223>合成肽
<400>36
valtyrphepheleuproasphisleu
15
<210>37
<211>9
<212>prt
<213>人工序列
<220>
<223>合成肽
<400>37
lysilepheglyserleualapheleu
15
<210>38
<211>9
<212>prt
<213>人工序列
<220>
<223>合成肽
<400>38
leuleuglyargasnserphegluval
15
<210>39
<211>11
<212>prt
<213>人工序列
<220>
<223>合成肽
<400>39
glyleualaproproglnhisleuileargval
1510
<210>40
<211>9
<212>prt
<213>人工序列
<220>
<223>合成肽
<400>40
serleuproproproglythrargval
15
<210>41
<211>9
<212>prt
<213>人工序列
<220>
<223>合成肽
<400>41
lysleucysprovalglnleutrpval
15
<210>42
<211>9
<212>prt
<213>人工序列
<220>
<223>合成肽
<400>42
argmetproglualaalaproproval
15
<210>43
<211>9
<212>prt
<213>人工序列
<220>
<223>合成肽
<400>43
tyrleuglysertyrglypheargleu
15
<210>44
<211>9
<212>prt
<213>人工序列
<220>
<223>合成肽
<400>44
pheleuglytyrleuileleuglyval
15
<210>45
<211>9
<212>prt
<213>人工序列
<220>
<223>合成肽
<400>45
alaleupheaspilegluserlysval
15
<210>46
<211>9
<212>prt
<213>人工序列
<220>
<223>合成肽
<400>46
alaleuglnproglythralaleuleu
15
<210>47
<211>10
<212>prt
<213>人工序列
<220>
<223>合成肽
<400>47
gluleualaglyileglyileleuthrval
1510
<210>48
<211>10
<212>prt
<213>人工序列
<220>
<223>合成肽
<400>48
pheleuthrprolyslysleuglncysval
1510
<210>49
<211>9
<212>prt
<213>人工序列
<220>
<223>合成肽
<400>49
leuleuleuleuthrvalleuthrval
15
<210>50
<211>9
<212>prt
<213>人工序列
<220>
<223>合成肽
<400>50
glyleumetgluglumetseralaleu
15
<210>51
<211>9
<212>prt
<213>人工序列
<220>
<223>合成肽
<400>51
argleuleuglngluthrgluleuval
15
<210>52
<211>10
<212>prt
<213>人工序列
<220>
<223>合成肽
<400>52
leuilealahisasnglnvalargglnval
1510
<210>53
<211>10
<212>prt
<213>人工序列
<220>
<223>合成肽
<400>53
valileserasnaspvalcysalaglnval
1510
<210>54
<211>9
<212>prt
<213>人工序列
<220>
<223>合成肽
<400>54
cystyralaserglytrpglyserile
15
<210>55
<211>9
<212>prt
<213>人工序列
<220>
<223>合成肽
<400>55
hiscysileargasnlysservalile
15
<210>56
<211>10
<212>prt
<213>人工序列
<220>
<223>合成肽
<400>56
lysleupheglythrserglyglnlysthr
1510
<210>57
<211>10
<212>prt
<213>人工序列
<220>
<223>合成肽
<400>57
tyrleuasnthrvalglnprothrcysval
1510
<210>58
<211>9
<212>prt
<213>人工序列
<220>
<223>合成肽
<400>58
valileleuthrasnproilesermet
15
<210>59
<211>10
<212>prt
<213>人工序列
<220>
<223>合成肽
<400>59
pheserasnserthrasnaspileleuile
1510
- 还没有人留言评论。精彩留言会获得点赞!