具有图形编码的磁性微芯片、其制备方法及应用与流程
本申请涉及一种悬浮微芯片,特别是一种具有图形编码的磁性微芯片及其制备工艺。
背景技术:
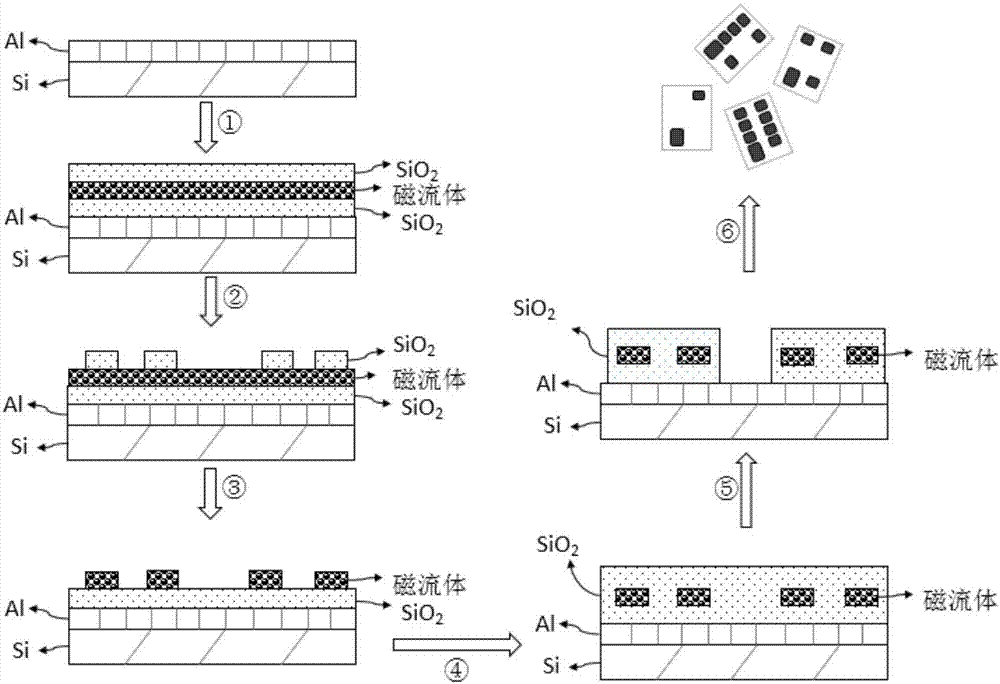
:复杂的生命活动往往是一组作为核心执行元件的生物分子协同作用的结果。众多疾病在分子水平上留下的指纹印记(fingerprint)也往往是由多个生物标识物所共同决定。换言之,多个标识物集合所呈现的“模式特征”(patterncharacteristics)比单一分子具备更强的与特定生理、病理现象的相关性。据估计(nature,2011.469(7329):p.156-157),已有数千个生物标识物被记载于约15万篇文献中,其中获批在临床上使用的常见标识物大约有100~200种。相对于单个生物标识物,由多种特征分子组成的生物标识物集合能够以更为全面、精确和高效的方式,为早期诊断、疾病分型、风险预测、用药选择、病程监测、预后评估等方面的临床工作提供至关重要的指示信息。在生命科学研究中,对多个生物标识物的分析常用于揭示生物信号通路的作用机制。此外,现代药物研究也大量引入多重生物标识物检测用于对药物效能和毒性的评估。随着精准医学时代的来临,对大量标本中多个生物标识物进行精确定量将日益成为现代诊断学、治疗学、药物研发以及转化医学等领域不可或缺的主流分析任务。多重生物检测技术是满足规模化并行生物分析需求的得力工具。无疑,一些经典的单重检测技术(如酶联免疫法、免疫印迹法、实时定量pcr等)通过大量繁复操作也能完成对多种分析物的定量,但仍难以克服以下主要障碍:针对不同分析物分别采样导致巨大的后勤负担(样品收集、记录、储存、运输等);同一标本必须被分配给多个不同的检测使用,而其有限的体积很难做到全部兼顾(尤其是肿瘤科和儿科标本);整套检测成本昂贵、人力耗费巨大;及时完成全部检测项目面临巨大压力。以hpv(人乳头瘤病毒)检测为例,目前发现的约30多种可感染人生殖道黏膜的hpv中有14种经who及irac确认的高危型很容易导致宫颈癌的发生。考虑到必要的对照,以及3次重复,整个检测需要做大约60个常规的pcr反应,随之而来的成本和操作量的负担使其难以在临床单位推广。面对临床诊断和医药研发应用中日益增长的自动化高通量多重检测需求,常规技术的单重检测模式已经成为制约数据产出效率的瓶颈。而多重检测无需分离标本即可在一次运行中完成全部检测,不仅显著降低了检测的耗费、缩短了检测周期,而且有利于样品处理的标准化和测量方法的自动化。悬浮芯片是一种利用混悬在液相中的分类编码微芯片作为反应及信号检测载体的技术。其核心特征在于所使用的微球具有独特的、可被机器识别的编码。目前应用最广泛的悬浮微芯片技术主要有荧光编码微球技术以及条码磁珠技术等,但这些悬浮微芯片普遍存在制备工艺复杂、成本高等缺陷。本案发明人亦曾经开发了一种基于高反射多层介电堆叠镀膜的编码图形悬浮芯片,其编码与基底之间的光学对比度主要取决于高反射镀膜的反射效果。在常用的白光照明条件下,需要针对具体光源的光强分布进行膜系设计,并且需要多次高精度镀膜工艺才能达到预期的反射效果,工艺难度大、制造成本高。技术实现要素:本申请的主要目的在于提供一种具有图形编码的磁性微芯片、其制备方法及应用,以克服现有技术中的不足。为实现前述发明目的,本申请采用的技术方案包括:本申请实施例提供了一种具有图形编码的磁性微芯片的制备方法,其包括:提供透明基材层;在所述透明基材层上覆设磁流体(curedferrofluid)形成的薄膜;至少去除所述薄膜中的部分基载液,从而至少使所述薄膜部分固化,形成磁流体层;对所述磁流体层进行加工,形成可用作图形编码的不透光微结构;以透明材料包覆所述不透光微结构,形成所述磁性微芯片。在一些较佳实施方案中,所述的制备方法包括:在所述透明基材层上涂覆磁流体而形成所述的薄膜,加热使所述薄膜中的至少部分基载液被除去,从而形成所述磁流体层。本申请实施例还提供了一种具有图形编码的磁性微芯片,其包括:图形编码,包括一个以上不透光微结构,所述不透光微结构主要由磁性固体颗粒聚集形成的胶体聚集体组成,其中相邻磁性固体颗粒之间至少被有机分子和/或无机分子隔离;以及,透明封装材料,至少用以包裹所述不透光微结构。在一些较佳实施方案中,每一磁性微芯片中所有不透光微结构组合形成一组二维图形。优选的,至少两个不同磁性微芯片所含的二维图形是几何上可区分的。进一步的,所述不透光微结构由磁流体在脱除至少部分的基载液后形成。优选的,所述有机分子和/或无机分子包括来源于磁流体的界面活性剂分子和/或基载液分子。本申请实施例还提供了所述具有图形编码的磁性微芯片的用途。与现有技术相比,本申请的优点包括:(1)本申请提供的具有图形编码的磁性微芯片可采用微加工工艺制成,其加工精度、重复性高,不同批次、或同一批次不同个体在尺寸上的差异可以忽略不计,可有效保障检测结果的准确性,因而能大幅提升分析质量(例如数据重复性)。(2)本申请提供的具有图形编码的磁性微芯片的磁性来自于固化的磁流体,这一引入磁性材料的方式不仅经济,而且非常简便易行,无需精密设备,且每片晶圆的处理时间可控制在数分钟内。(3)本申请提供的具有图形编码的磁性微芯片可具有较小的尺寸,例如可接近于传统的生物分析用微球,在液体中的悬浮能力以及其表面的反应动力学都更有利于对分析物的捕获,从而实现更高的检测灵敏度和特异性,而且因单个磁性微芯片的尺寸小,利于微加工制作,产量更高,成本更低。(4)本申请提供的具有图形编码的磁性微芯片优选采用二氧化硅作为基材,其无需额外的亲生物修饰即可方便的连接用于捕获分析物分子的功能配体,例如各种分子探针等,可以进一步扩展所述磁性微芯片在生物领域的应用范围。附图说明为了更清楚地说明本申请实施例或现有技术中的技术方案,下面将对实施例或现有技术描述中所需要使用的附图作简单地介绍,显而易见地,下面描述中的附图仅仅是本申请中记载的一些实施例,对于本领域普通技术人员来讲,在不付出创造性劳动的前提下,还可以根据这些附图获得其他的附图。图1是本申请一典型实施方案中一种具有图形编码的磁性微芯片的主视图。图2是本申请一典型实施方案中一种具有图形编码的磁性微芯片的制备工艺流程图。图3a-图3b分别是本申请一实施例中两种表面覆盖有图案化刻蚀掩模的磁流体层的金相显微镜照片。图4a-图4b分别是本申请一实施例中两种经图形化刻蚀后的磁流体层的金相显微镜照片。图5a-图5b分别是本申请一实施例中两类具有图形编码的磁性微芯片的金相显微镜照片。图6是本申请一实施例中所获具有图形编码的磁性微芯片分散于液相体系时的光学显微镜照片。图7是本申请一实施例中具有图形编码的磁性微芯片于磁场中的照片。图8是本申请一典型实施方案中利用所述具有图形编码的磁性微芯片在微孔板中对多样品进行多重检测的示意图。图9是本申请实施例2中利用磁性微芯片进行hpv检测的灵敏度的表征图。图10是本申请实施例3中包含磁性微芯片的检测体系的明场图像。图11是本申请实施例3中包含磁性微芯片的检测体系的荧光图像。图12是本申请实施例3中利用磁性微芯片进行检测的特异性表征图。图13是本申请实施例3中利用磁性微芯片进行检测的多重检测灵敏度表征图。图14是本申请实施例3中利用磁性微芯片进行多重检测的信号响应表征图。具体实施方式为使本申请的目的、技术方案和优点更加清楚,下面结合附图对本申请的具体实施方式进行详细说明。这些优选实施方式的示例在附图中进行了例示。附图中所示和根据附图描述的本申请的实施方式仅仅是示例性的,并且本申请并不限于这些实施方式。在此,还需要说明的是,为了避免因不必要的细节而模糊了本申请,在附图中仅仅示出了与根据本申请的方案密切相关的结构和/或处理步骤,而省略了与本申请关系不大的其他细节。本申请实施例的一个方面提供了一种具有图形编码的磁性微芯片的制备方法,包括:提供透明基材层;在所述透明基材层上覆设磁流体形成的薄膜;至少去除所述薄膜中的部分基载液,从而至少使所述薄膜部分固化,形成磁流体层;对所述磁流体层进行加工,形成可用作图形编码的不透光微结构;以透明材料包覆所述不透光微结构,形成所述磁性微芯片。在一些较佳实施方案中,所述的制备方法包括:在所述透明基材层上涂覆磁流体而形成所述的薄膜,加热使所述薄膜中的至少部分基载液被除去,从而形成所述磁流体层。其中,对于加热的温度、时间等,本领域技术人员可以依据磁流体中基载液的含量、类型和需要去除的基载液的比例等而很容易的确定。在本申请中,所述磁流体包括磁性固体颗粒、界面活性剂以及基载液,所述基载液足以与所述界面活性剂分散所述磁性固体颗粒而形成胶体悬浮液。更进一步的,所述磁流体是由直径为纳米量级(10nm以下)的磁性固体颗粒、基载液(也叫媒体)以及界面活性剂三者混合而成的一种稳定的胶状液体,该流体在静态时无磁性吸引力,当外加磁场作用时,才表现出磁性。其中,基载液系作为连续相,而磁性固体颗粒系作为不连续相或分散相。较为优选的,所述磁性固体颗粒的粒径为1nm~1000nm。其中,所述磁流体可以选用业界已知的各种合适类型,例如可以选自铁氧体系磁流体、金属系磁流体、氮化铁系磁流体中的任一种或两种以上的组合,且不限于此。进一步的,所述铁氧体系磁流体的材质可以包括fe3o4、γ-fe2o3、mefe2o4中的任意一种或两种以上的组合,其中me至少选自co、ni、mn或zn等,且不限于此。进一步的,所述金属系磁流体包括由ni、co、fe中的任意一种或两种以上的组合形成的金属微粒等,且不限于此。本申请中所述的磁流体可以通过研磨法,解胶法,热分解法,放电法等业界已知的方式制备(参阅“磁流体及其应用”,《机械》1991年01期)。进一步的,在本申请的所述磁流体层中,相邻磁性固体颗粒至少被来源于所述磁流体的有机分子和/或无机分子隔离。优选的,所述有机分子和/或无机分子包括来源于磁流体的界面活性剂分子和/或基载液分子。作为较佳的具体实施方案之一,所述磁流体层包含50v/v%~99v/v%磁性固体颗粒、0.5v/v%~50v/v%界面活性剂分子、0.5v/v%~50v/v%基载液分子。优选的,所述磁流体层包含75v/v%~99v/v%磁性固体颗粒、0.5v/v%~15v/v%界面活性剂分子、0.5v/v%~15v/v%基载液分子。其中,由部分基载液被除去的磁流体形成的所述磁流体层,亦可认为是一种固化的磁流体,其仍然保持磁流体的超顺磁性等特性。较为优选的,所述不透光微结构的厚度为10nm~1000nm。若所述不透明结构的厚度过大,会使磁流体用量增大,亦会带来延长磁流体芯片的加工时间和增加芯片的整体厚度等不利影响,而若所述不透明结构的厚度过小,则有可能使其不具所需的光阻隔能力,亦即可能使所述磁性微芯片在光学通道中,透明部分和不透明部分不能被足够清晰的区分,从而使图形编码无法被准确的辨识。在一些实施方案中,所述的制备方法还可包括:在所述磁流体层上设置图案化刻蚀掩模,并对所述磁流体层进行刻蚀,形成所述不透光微结构。在一些较为具体的实施方案中,所述的制备方法可以包括:至少采用机械加工、干法刻蚀工艺和湿法刻蚀工艺中的任一种方式或两种以上方式的组合对所述磁流体层进行刻蚀,从而形成所述不透光微结构。在一些较为具体的实施方案中,所述的制备方法可以包括:于基底上设置牺牲层,在所述牺牲层上形成所述透明基材层,在所述透明基材层上均匀涂覆磁流体形成所述的薄膜。在一些较为具体的实施方案中,所述的制备方法可以包括:在以透明材料包覆所述不透光微结构后,按照设定方式对形成的器件进行分割,之后除去所述牺牲层,获得两片以上彼此独立的所述磁性微芯片。其中,将磁流体均匀涂覆在所述透明基材层上的方式可以是刮涂、旋涂、喷涂、印刷等多种方式。其中,分隔的方法可以是机械切割、激光划刻等等。对于前述牺牲层,也可以采用其它能以化学或物理方式溶解这些材料、但不会损及透明材料层和对可见光充分不透明的材料层的液剂进行相应的去除操作。另外,亦不能排除通过机械剥离、应力剥离等本领域技术人员习用的技术手段去除牺牲层。在本申请中,优选采用液剂溶解的方式去除牺牲层,比如:对于以光刻胶形成的牺牲层,所述液剂包括丙酮溶液;对于以铝形成的牺牲层,所述液剂包括稀盐酸。而对于某些高分子材料来说,完全可以藉由相应有机溶剂将其去除。采用溶解去除牺牲层的方式,可以在基本不损及磁性微芯片的情况下移除牺牲层和基底。在一些较为具体的实施方案中,所述的制备方法可以包括:通过金属镀膜工艺在所述基底上形成金属薄层作为牺牲层。优选的,所述金属薄层的材质可以包括铝等,且不限于此。较为优选的,包覆所述不透光微结构的透明材料的可见光透过率在50%以上,优选在90%以上。较为优选的,包覆所述不透光微结构的透明材料的厚度为100nm~5000nm。进一步的,所述透明基材层的材质及所述透明材料优选自生物惰性的透明材料,例如可以采用二氧化硅等,且不限于此。进一步的,对于所述磁性微芯片的形态而言,其可以是颗粒状(例如球体或矩形体等)、片状等。并且优选的,所述磁性微芯片的长度、宽度、高度中的任一者或直径为1μm~1000μm。但尤为优选的,所述磁性微芯片具有平整的二维面状结构,此种形态的磁性微芯片在加工的便利性等方面优于其它形态的磁性微芯片。进一步优选的,所述磁性微芯片的长度、宽度在100μm以内,厚度在2μm以内。更进一步优选的,所述磁性微芯片的长度、宽度为10μm~50μm,厚度为0.5μm~2μm。若所述磁性微芯片的尺寸过大,则其不易在液相体系中呈现悬浮状态,而若磁性微芯片的尺寸过小,则一方面提高了其加工难度,另一方面也不利于以光学系统进行精准的成像。在一些较为具体的实施方案中,所述的制备方法具体可以包括如下步骤:于基底上设置牺牲层,在所述牺牲层上形成所述透明基材层,在所述透明基材层上均匀涂覆磁流体形成所述的薄膜,至少去除所述薄膜中的部分基载液,从而至少使所述薄膜部分固化形成磁流体层,在所述磁流体层上设置图案化刻蚀掩模,并对所述磁流体层进行刻蚀,形成所述不透光微结构;以透明材料包覆所述不透光微结构,再按照设定方式对形成的器件进行分割,之后除去所述牺牲层,获得两片以上彼此独立的所述磁性微芯片。前述的基底可以采用各类有机、无机材料或两者的复合材料等,例如si、玻璃、金属等材质的,且不限于此。在一些较为具体的实施方案中,所述的制备方法可以包括:采用离心旋涂等方式将磁流体均匀涂覆在透明基材层上形成薄膜,之后采用加热方式去除所述薄膜中的部分基载液,从而形成所述的磁流体层。在此类实施方案中,依次利用离心旋涂以及加热这两个过程对磁流体的基载液(通常为有机溶剂)起到去除作用,前者使其被甩出晶圆表面,而后者则使其挥发。固化后,磁性固体颗粒形成胶体聚集体(colloidalaggregates),但其表面连接的界面活性剂分子以及吸附的基载液分子使磁性固体颗粒之间仍保持分离状态,从而使磁流体的超顺磁性得以保留。当然,在一些可以实施的方案中,也可以通过丝网印刷等方式直接将磁流体施加在透明基地上形成具有设定图形的薄膜,而后直接进行干燥处理,从而形成所述不透光微结构。但这种方式需要精确的控制。在本申请中,前述图形编码在可见光照明下经光学成像后即可被辨识,并可根据预设规则或程序而转化为数字编码,用于标明所在微芯片的身份(类型),通过制成不同图形即可对大量不同类型的磁性微芯片进行编码。在本申请中,每一磁性微芯片所含的图形编码可以包括由至少两个不透光微结构组合形成的至少一组二维图形。优选的,每一磁性微芯片中所有不透光微结构组合形成一组二维图形。进一步优选的,至少两个不同磁性微芯片所含的二维图形是几何上可区分的。其中,所述“几何上可区分”是指:通过任何平移、旋转、翻转等操作,均无法使任意两组图形完全重合。在一些较佳实施方案中,所述的制备方法还可进一步包括:在所述磁性微芯片表面连接用以特异性捕获靶标物质的捕捉物质。优选的,所述捕捉物质选自有机化合物和/或无机化合物。例如,所述有机化合物包括蛋白质、抗体、多肽、核酸中的任一种或两种以上的组合,且不限于此。在一些较佳实施方案中,所述的制备方法还可进一步包括:在所述磁性微芯片表面连接亲水性基团。优选的,所述亲水性基团的来源物质包括peg、葡聚糖、壳聚糖、海藻酸盐中的任一种或两种以上的组合,且不限于此。进一步的,本申请的磁性微芯片可在半导体工艺设施内通过cmos兼容工艺制得。综上,本申请的磁性微芯片可以采用前述的微加工工艺制成,不仅经济,而且非常简便易行(无需精密设备,且每片晶圆的处理时间可控制在数分钟内),同时其加工精度和重复性高,不同批次、或同一批次不同个体在尺寸上的差异可以忽略不计,如此可以保障检测结果的准确性,进而保障分析质量(例如数据重复性)。本申请实施例的另一个方面提供了一种具有图形编码的磁性微芯片,其包括:图形编码,包括一个以上不透光微结构,所述不透光微结构主要由磁性固体颗粒聚集形成的胶体聚集体组成,其中相邻磁性固体颗粒之间至少被有机分子和/或无机分子隔离;以及,透明封装材料,至少用以包裹所述不透光微结构。进一步的,所述图形编码包括由至少两个不透光微结构组合形成的至少一组二维图形。亦即,在所述磁性微芯片中,所述图形编码是以所述不透光微结构作为基本单元所组成的二维图形。优选的,每一磁性微芯片中所有不透光微结构组合形成一组二维图形。进一步的,本申请的磁性微芯片在显微镜明场透射光照明下,透明封装材料本体明亮,而不透光微结构部分晦暗,二者之间具有良好的光学对比度。尤为优选的,至少两个不同磁性微芯片所含的二维图形是几何上可区分的。其中,所述“几何上可区分”是指:通过任何平移、旋转、翻转等操作,均无法使任意两组图形完全重合。在本申请中,通过改变所述磁性微芯片中不透光微结构的排布方式(包括但不限于不透光微结构的大小、形状、位置等),即可以产生多组几何上可区分的图形。因此,每一组图形可以视为一种独特的编码。只要在明场光照条件下使用显微成像设备获得磁性微芯片的照片,再利用图像识别软件对其进行机器解码,即可快速、准确地确定每一个磁性微芯片的身份。较为优选的,所述磁性微芯片具有平整的二维面状结构。进一步的,所述不透光微结构由磁流体在脱除至少部分的基载液后形成。换言之,所述不透光微结构事实上可以被认为是固化的磁流体,其仍然保持磁流体的超顺磁性等特性。而且因固化的磁流体本身不透光,所以其形成的微结构也是不透光的。而且,对于所述不透光微结构而言,前述固化的磁流体被包裹在透明封装材料内部,因此在分散于诸如生化反应的液相体系中时,不会发生氧化等影响其顺磁性的化学反应。优选的,所述有机分子和/或无机分子包括来源于磁流体的界面活性剂分子和/或基载液分子。关于所述磁流体的组成,其可以如前文所述,此处不再赘言。进一步的,在所述不透光微结构中,相邻磁性固体颗粒至少被来源于所述磁流体的有机分子和/或无机分子隔离。优选的,所述有机分子和/或无机分子包括来源于磁流体的界面活性剂分子和/或基载液分子。在一些较佳实施方案中,所述不透光微结构包含50v/v%~99v/v%磁性固体颗粒、0.5v/v%~50v/v%界面活性剂分子、0.5v/v%~50v/v%基载液分子;尤其优选的,所述不透光微结构包含75v/v%~99v/v%磁性固体颗粒、0.5v/v%~15v/v%界面活性剂分子、0.5v/v%~15v/v%基载液分子;更为优选的,所述不透光微结构包含80v/v%~99v/v%磁性固体颗粒、0.5v/v%~10v/v%界面活性剂分子、0.5v/v%~10v/v%基载液分子。在此类实施方案中,磁性固体颗粒之间既可足够密集的聚集而使不透明结构具有所需的光线阻隔能力,又不会引起磁性固体颗粒的团聚而影响其超顺磁性。在一些较佳实施方案中,所述不透光微结构的厚度为10nm~1000nm。若所述不透明结构的厚度过大,会使磁流体用量增大,亦会带来延长磁流体芯片的加工时间等不吝影响,而若所述不透明结构的厚度过小,则有可能使其不具所需的光阻隔能力,亦即可能使所述磁性微芯片在光学通道中,透明部分和不透明部分不能被足够清晰的区分,从而使图形编码无法被准确的辨识。尤为优选的,通过使所述不透明结构具有前述较佳实施方案中述及的物质组成及厚度,还可使磁流体在用量较小的情况下,使所述不透明结构仍具有较好光阻隔性能。进一步的,对于所述磁性微芯片的形态而言,其可以是颗粒状(例如球体或矩形体等)、片状等。并且优选的,所述磁性微芯片的长度、宽度、高度中的任一者或直径为1μm~1000μm。但尤为优选的,所述磁性微芯片具有平整的二维面状结构,此种形态的磁性微芯片在加工的便利性等方面优于其它形态的磁性微芯片。进一步优选的,所述磁性微芯片的长度、宽度在100μm以内,厚度在2μm以内。更进一步优选的,所述磁性微芯片的长度、宽度为10μm~50μm,厚度为0.5μm~2μm。若所述磁性微芯片的尺寸过大,则其不易在液相体系中呈现悬浮状态,而若磁性微芯片的尺寸过小,则一方面提高了其加工难度,另一方面也不利于以光学系统进行精准的成像。而本申请中具有前述优选尺寸的磁性微芯片在液相体系中的悬浮能力以及其表面的反应动力学都更有利于对分析物的捕获,从而实现更高的检测灵敏度和特异性,另一方面也利于微加工,产量高,成本低。优选的,包覆所述不透光微结构的透明封装材料的可见光透过率在50%以上。优选的,包覆所述不透光微结构的透明封装材料的厚度为100nm~5000nm。进一步优选的,所述透明封装材料选自生物惰性的透明材料,例如可以采用二氧化硅等,如此可以使本申请的磁性微芯片在各种生物来源的样品中不会发生干扰或污染,且可以通过业界习知的偶联化学方法将各种生物分子固定在其表面,以便于与样品中特定的靶分子以及标记分子发生反应,从而使芯片表面产生可被检测到的物理信号,以达到检测目的。在一些较佳实施方案中,所述磁性微芯片表面还连接有用以特异性捕获靶标物质的捕捉物质。优选的,所述捕捉物质选自有机化合物和/或无机化合物,例如所述有机化合物可以包括蛋白质、抗体、多肽、核酸中的任一种或两种以上的组合,且不限于此。在一些较佳实施方案中,所述磁性微芯片表面还连接有亲水性基团,以提供更丰富的偶联位点、抑制特异性吸附、以及改善芯片的水力学性能。优选的,所述亲水性基团的来源物质可以包括peg、葡聚糖、壳聚糖、海藻酸盐中的任一种或两种以上的组合,且不限于此。本申请的磁性微芯片含有具有超顺磁性的固化磁流体,因此在应用时,可通过施加磁场使之运动至液相体系的容器的指定位置并被磁力固定在该处,从而实现悬浮液的固液分离,在此状态下,可以进行移液、换液、清洗等操作而不导致磁性微芯片的损失。当撤去外加磁场后,顺磁材料失去磁性,相互之间没有吸引力,磁性微芯片难以产生团聚,通过低强度的机械振荡或搅拌即可使磁性微芯片分散并重悬在液相体系中。请参阅图1所示是本申请的一种磁性微芯片的主视图。所述磁性微芯片1包括由前述固化的磁流体形成的不透光微结构11和包裹所述不透光微结构的透明封装材料12。其中,多个不透光微结构11组合形成一组二维图形,所述的二维图形系作为图形编码。当将所述的磁性微芯片以显微镜明场透射光照明时,透明封装材料本体明亮,而不透光微结构部分晦暗,二者之间具有良好的光学对比度。再通过改变不透光微结构的排布方式(例如不透光微结构的大小、形状、位置等),可以产生许多组几何上可区分的图形。因此,每一组图形可以视为一种独特的图形编码。如前所述,只要在明场光照条件下使用显微成像设备获得芯片照片,再利用图像识别软件对其进行机器解码,即可快速、准确地确定每一个磁性微芯片的身份。所述的磁性微芯片在应用时,例如在液相生化分析、检测体系中应用时,可通过施加磁场使磁性微芯片运动至容器中的指定位置并被磁力固定在该处,在此状态下可以进行移液、换液、清洗等操作而不导致磁性微芯片的损失。当撤去外加磁场后,磁性微芯片中具有顺磁性的固化磁流体失去磁性,相互之间没有吸引力,难以产生团聚,通过低强度的机械振荡或搅拌即可使磁性微芯片分散并重悬在液相中。优选的,通过采用生物惰性的透明封装材料,使得所述磁性微芯片在各种生物来源的样品中不会发生干扰或污染,且可以通过业界习知的偶联化学方法将各种生物分子(捕捉物质)固定在其表面,以便于与样品中特定的靶分子(靶标物质)以及标记分子发生反应,从而使磁性微芯片表面产生可被检测到的物理信号,以达到检测目的。因此,在一些实施方案中,于所述磁性微芯片表面可偶联有包括但不限于蛋白质、抗体、多肽、核酸、小分子、有机化合物、无机化合物等的配体分子,用于捕获样品中的分析物。优选的,还可以利用业界习知的修饰方法将一些亲水高分子如peg、葡聚糖、壳聚糖、海藻酸盐等偶联到所述磁性微芯片表面,以提供更丰富的偶联位点、抑制特异性吸附、以及改善磁性微芯片的水力学性能。本申请实施例的又一个方面还提供了所述具有图形编码的磁性微芯片的用途,例如在生物、化学、生化分析、检测领域的用途。例如,本申请实施例提供了一种物质分析方法,其包括:提供所述的具有图形编码的磁性微芯片;在所述磁性微芯片上连接至少一种捕捉物质,所述捕捉物质能够特异性捕获相应靶标物质;将所述磁性微芯片分散于可能包含靶标物质的液相体系中,并使所述磁性微芯片保持悬浮状态;使所述捕捉物质充分捕捉所述液相体系中可能存在的靶标物质;通过磁场作用将所述磁性微芯片从液相体系中取出,并在设定波长的光学通道中成像,以确定所述磁性微芯片有无捕获靶标物质和/或对所述液相体系中靶标物质的浓度进行定量分析。在一些实施方案中,所述的物质分析方法包括:至少通过机械搅动方式或交变磁场作用使所述磁性微芯片在液相体系中保持悬浮状态的。进一步的,所述液相体系中还可含有用于指示捕捉物质与靶标物质反应与否的标记性物质。优选的,所述捕捉物质和/或靶标物质上修饰有所述标记性物质。进一步的,所述设定波长的光学通道选自透射光学通道、反射光学通道、荧光通道和化学发光通道中的任意一种或两种以上的组合,但不限于此。以下结合典型实施例对本申请的技术方案作进一步的说明。适用于本申请如下各实施例的具有图形编码的磁性微芯片(亦可认为是一种具有光学图形编码的超顺磁微芯片)呈平板状(长、宽显著大于厚度),典型长、宽尺寸在100μm以内、厚度在2μm以内,例如可以是25×15×1.5μm。进一步的,所述磁性微芯片的基体材料可以为二氧化硅,其中在预先设定的多个位置上含有固化的磁流体(curedferrofluid)形成的不透光微结构。进一步的,所述磁性微芯片可在半导体工艺设施内通过cmos兼容工艺制得。进一步的,一种制备所述磁性微芯片的工艺可以如图2所示,其可以包括如下步骤:①微加工中的化学沉积以及旋涂工艺;②微加工中的光刻以及刻蚀工艺;③微加工中的化学沉积工艺;④微加工中的光刻以及刻蚀工艺;⑤微加工中的释放工艺。更为具体的,所述制备工艺可以包括:1)通过金属镀膜工艺在半导体工艺中常用的衬底(例如硅晶圆,siwafer)上形成一薄层金属铝,作为牺牲层。其中,所述的硅晶圆可以为4英寸或6英寸的,并可以采用电子束(e-beam)蒸发镀膜,所形成的金属铝层厚度可以为约100nm。2)在牺牲层上沉积一层sio2作为基底层。例如可以采用等离子增强化学蒸发沉积(pecvd)方式沉积厚度约为1500nm的sio2。3)在基底层上通过旋涂(spin-coating)的方法均匀涂布一层磁流体,并加热使之固化。所述磁流体可以通过业界习知的化学方法合成,也可以直接使用商业化产品。例如,所述的磁流体可以包括但不限于铁氧体系磁流体(如fe3o4,γ-fe2o3,mefe2o4(me=co,ni,mn,zn等金属元素);金属系磁流体(ni,co,fe等金属微粒及其它们的合金微粒);氮化铁系磁流体等。例如,可以使用分散在烷基萘中的铁氧化物纳米颗粒(ironoxidenanoparticles)构成的磁流体,并采用离心旋涂方式将之涂布在基底层上,旋涂条件可以为:匀胶机以1000rpm运行15秒,所形成的磁流体薄膜厚约为1.3μm,加热条件为120℃热板15min。在该步骤3)中,离心旋涂以及加热这两个过程对磁流体的基载液(有机溶剂)起到去除作用。前者使其被甩出晶圆表面,而后者则使其挥发。固化后,磁性固体纳米颗粒形成胶体聚集体(colloidalaggregates),但其表面连接的界面活性剂分子以及吸附的溶剂分子(基载液分子)使磁性固体颗粒之间仍保持分离状态。从而,固化后的磁流体得以保留超顺磁性。4)在固化的磁流体层上,再沉积一层sio2作为光刻保护层。5)在晶圆表面旋涂光刻胶。并通过光刻工艺(曝光、显影)将编码图形转移到光刻胶上。6)针对不同的材料选择适合的干法刻蚀工艺(如反应等离子刻蚀/rie,感应等离子刻蚀/icp等),依次刻蚀掉晶圆上未被光刻胶保护的、上述步骤4)中形成的sio2层(例如,显微镜观察结果可参阅图3a-图3b)以及前述步骤3)中形成的固化的磁流体层,暴露出前述步骤2)中形成的sio2层(例如,显微镜观察结果可参阅图4a-图4b)。7)沉积一层sio2层作为封装层,将固化的磁流体部分完全包裹在磁性微芯片内部。8)使用光刻工艺进行套刻,将每个磁性微芯片与周围的其它磁性微芯片分隔开,并暴露出步骤1)中形成的al牺牲层(例如,显微镜观察结果可以参阅图5a-图5b)。9)将晶圆置于可溶解牺牲层的溶剂(例如稀盐酸)中。牺牲层溶解后,上述微芯片从衬底上脱落进入液相中(例如,光学显微镜观察结果可以参阅图6)。由于磁性微芯片具有超顺磁性,可通过外加磁场将其从悬液状态分离(例如可以参阅图7),以便于对其进行清洗等处理。进一步的,还可根据应用需求在前述磁性微芯片的sio2表面偶联针对不同靶分子的配体(如核酸探针、抗体等),即得到可用于多重检测的磁性微芯片。显然,前述磁性微芯片制备工艺简单、经济,编码结构稳定、易于识别,有利于多重检测应用,此外其清洗、分离方式简单,有利于实现检测过程的自动化。附及,前述磁性微芯片因包含固化的磁流体,利用磁流体的若干物理特性,即:①磁流体是大量超顺磁纳米颗粒的胶体悬液,能够被外磁场强烈磁化。而撤去外磁场后,磁化作用即消失。因此,可以使用磁铁吸引液相体系中的磁性微芯片,使之从悬液中分离出来。而没有外磁场存在时,磁性微芯片又可自由悬于液相体系中。②构成磁流体的材料(例如四氧化三铁等)是不透明的,将多个固化的磁流体按特定的位置排布在透明材质的磁性微芯片中,即可构成一种类似于二维码的平面图形编码。通过改变固化的磁流体在磁性微芯片中的排布方式,即可对不同种类或用途的磁性微芯片进行编码。进一步的,可以利用多个具有不同图形编码的磁性微芯片组成悬浮阵列(suspensionarray),并将之应用于对液体样品中多个核酸、蛋白质、抗原等分子的并行检测(即多重检测,multiplexassay),其可以很方便地通过外加磁场进行分离,无需复杂的分离装置。前述磁性微芯片可应用于生物分子(包括但不限于抗原、核酸、蛋白、多肽、多糖等)的定量检测分析,例如基于抗体亲和反应的免疫检测(immunoassay)应用和基于核酸杂交反应的分子诊断(moleculardiagnostics)应用。例如,因前述磁性微芯片是采用sio2构成透明材料基底,故而对于本领域技术人员来说,可以很容易的想到采用习用的方案直接在该编码悬浮微芯片上连接生物探针分子,工序更为简洁,该生物探针分子可选自蛋白质、多肽、dna、rna、lna、pna等,但不限于此。进一步的,为利于检测,还可能需要在生物探针分子上修饰荧光标记、放射性标记或其它特异性标记等,或者在后续的液相反应体系中添加前述特异性标记等。当然,这些方案可根据实际应用的需要而选择性的采用。利用前述磁性微芯片对各种待测物分子进行检测的过程一般为:首先,利用搅拌、振荡、交变磁场等混合手段,保持足量的悬磁性微芯片悬浮于样品液体中进行反应一定时间,在此过程中,固定在其表面的探针分子将捕获对应的目标分子;而后,通过离心等手段将磁性微芯片从样品溶液中分离并进行清洗;之后,再分别在选定的光学通道中对沉降后的微芯片成像。例如,可以采用可见光通道和荧光通道对前述磁性微芯片进行光学成像。其中,可以在可见光通道可读取每一芯片的编码以确定该芯片所捕获的目标分子身份;并可以在荧光通道中可对目标分子的浓度进行定量分析。结合多种不同微芯片所得结果,即可同时实现对样品中多个待测物的检测。更为具体的,可以利用前述磁性微芯片检测生物样品中的多个核酸扩增产物(核酸检测)结合常规的聚合酶扩增反应(pcr)技术,利用磁性微芯片可以很方便地实现对同一样品中多个模板分子的扩增。由于无需使用多个荧光通道来区分不同的扩增产物,这一应用避开了现有多重pcr仪器荧光通道数的限制(一般仅为4条),能够显著提高pcr的通量;同时又无需专门设计、合成多个连接不同荧光团的探针,也无需使用昂贵的多通道实时定量pcr仪器,从而可以大幅降低使用成本。实施步骤:首先根据应用需求确定所要检测的不同模板的数量。这一数量一般可以在4到20种左右(并不局限于此,本领域技术人员可根据实际情况增减)。制备不同编码的磁性微芯片,每种编码对应一个待测的模板核酸。具体操作可以是业界悉知的。对每种编码的磁性微芯片,利用业界习知的化学修饰方法将待模板核酸的pcr引物(或探针)共价固定在其表面。例如:使用piranha溶液清洗微芯片的二氧化硅表面后,再与氨基硅烷的乙醇溶液反应使其表面氨基化,清洗后再与戊二醛水溶液反应使其表面醛基化,最后再与末端氨基修饰的引物反应使其连接在芯片表面。在进行检测前,先将上述修饰pcr引物的不同编码的磁性微芯片等量混合在一起。之后,再将此芯片混合液与pcr反应所需的其它试剂(包括dntp,聚合酶、连接酶、荧光染料等)按适当比例(根据具体的pcr反应确定,此为本领域技术人员习知)组成pcr混合液。加入样品后即可进行pcr反应。其中可使用的样品包括但不限于溶液、细胞提取物、全血、血清、尿液、唾液、法医学标本等等。具体的pcr反应形式可以根据实际情况来选择。例如,可采用固相pcr技术中最常用的桥式pcr(bridgepcr),即先将每个pcr反应所需的两条引物同时固定在对应编码的磁性微芯片表面。扩增反应的结果是在磁性微芯片上形成大量杂交的双链,常规的sybr等小分子荧光染料结合在这些双链上产生信号。又如,也可以进行等温扩增,这样能够进一步降低对pcr仪器的要求。具体可采用业界习知的滚环扩增(rca)技术。首先将待测分子的捕获探针固定在磁性微芯片表面。通过互补杂交反应捕获待测分子后,与反应液中的接头分子(adaptor)在连接酶的作用下连接成一条链。而接头分子含有的引物序列可以引发滚环扩增反应,最后导致大量的荧光探针杂交在扩增产物分子上产生信号。当pcr反应结束后,利用磁铁将反应体系进行固液分离,保留磁性微芯片,并对其反复清洗,最后将其悬于缓冲液中。从该悬浮液中取适当数量的芯片利用成像设备分别采集其在可见光和荧光两个通道下的图像,即可获得每个芯片的身份(即其检测的分子的身份)及对应的荧光强度(即待测分子的浓度,通过使用已知浓度的系列标准品同时反应所绘制的标准曲线即可算出)。更为具体的,也可以利用前述磁性微芯片结合分子信标探针进行非标记多重检测(核酸检测)对于不使用扩增反应的非标记检测,可以使用本领域习知的分子信标(molecularbeacon)作为探针。其特点在于,无需加入另外的指示剂,检测信号可直接通过目标与探针的结合事件触发。实施步骤:根据样品中待测核酸的具体情况确定其探针。本申请可使用的样品包括但不限于溶液、细胞提取物、全血、血清、尿液、唾液、法医学标本等等。针对各个待测核酸的序列,设计出特异性的分子信标。在前述磁性微芯片表面修饰相应的探针。其具体过程如前所述。检测时,将样品加入含有相应磁性微芯片的缓冲液中混合反应即可。对于修饰触发信号探针的微芯片,如分子信标,只要结合了目标分子,由于本领域习知的分子信标的工作原理,其二级结构将发生变化导致荧光团与淬灭团分离,在芯片表面就会产生荧光信号。反之如果分子信标未结合目标分子,其构象保持不变,则不会产生信号。反应结束后,再通过类似于如前所述的清洗/成像步骤识别每种磁性微芯片并获取其荧光信号,即可完成对多种待测核酸含量的检测。特别地,本申请尤其适用于以标准微孔板(microplates6、12、24、48、96、384、1536well)作为样品载体的生物分析应用,可实现对大量样品中多个待分析指标的并行检测。例如,可以利用前述磁性微芯片检测临床样品中的多个抗原蛋白质等(免疫检测),例如常规的乙肝五项检测。这样的检测可以在多孔板中进行。其实施步骤可以如下:根据应用需求确定所要检测的不同模板的数量。这一数量一般可以在4到20种左右(并不局限于此,本领域技术人员可根据实际情况增减)。制备不同编码的磁性微芯片,每种编码对应一个待测的蛋白质。检测方法可采用常规的夹心法形式。首先将每种编码的磁性微芯片表面活化,例如使用氨基硅烷对其进行氨基化(方法如前所述)。再利用业界习知的化学修饰方法(如nhs/edc法)将待测蛋白的特异抗体(一抗)共价固定在该活化表面。根据需要,也可在其后使用某种蛋白(如bsa)对芯片表面的裸露部分进行封闭,以降低非特异性吸附。前述检测方法可使用的样品包括但不限于溶液、细胞提取物、全血、血清、尿液、唾液、法医学标本等等。参阅图8所示,在检测时,可以将不同样品与各个待测蛋白对应的磁性微芯片在多孔板的不同孔中混合,在适宜的温度和振荡条件(或交变磁场)下进行孵育。在此过程中,磁性微芯片表面的一抗与溶液中的目标蛋白发生特异性的结合。孵育结束后,还可以加入另一种目标特异性的、带荧光标记抗体(二抗),通过抗原-抗体反应使此前被捕获到磁性微芯片表面的抗原分子带上荧光(但本方法的信号并不局限于此,根据需要也可使用化学发光信号等)。最后,再通过如前所述的成像步骤获得每种待测抗原的信号,从而完成定量检测。由于免疫检测的广泛性,所述的待测物并不局限于抗原蛋白,也可包括各种存在特定抗体的物质,例如药物分子、代谢物分子、病原体、细胞等,此为本领域技术人员所习知。实施例1:磁性微芯片的表面修饰及功能化1)取图2所示工艺制备的一种磁性微芯片适量(例如50-500万片,可视具体需要而定,而各磁性微芯片上的图形编码也可以依据实际应用需求而调整)置于1.5ml微量离心管中。2)用95v/v%乙醇洗涤2次。每次洗涤后,以强磁铁或微量离心管专用磁力架将芯片富集至离心管底部后,使用移液器去除上清。3)加入5wt%氨基硅烷apdms1000μl(用95%乙醇配制),振荡充分,超声片刻,置于旋涡振荡器上振摇30min。4)按步骤2)中所述方法,用无水乙醇洗涤芯片3次。5)用n,n-二甲基甲酰胺(dmf)洗涤1次,去除上清。6)在通风橱内,向管内加入10wt%丁二酸酐溶液(溶剂:dmf),在n2保护中反应6小时。7)用去离子水洗涤3次,去除上清。8)用2-8℃预冷的0.1mmes缓冲液(ph4.7)洗涤1次。9)加入新鲜配制的50mmnhs缓冲液400μl,100mmedc缓冲液400μl,(预冷溶剂0.1mmes,ph4.7)振荡充分,室温振摇30min。10)用1×pbs缓冲液(ph7.2)洗涤2次。11)加入待偶联的探针(例如抗体、核酸等),室温孵育6h或者在4℃下振摇过夜。12)用pbst(ph=7.4,含0.2%tween-20,pbs溶液配制)洗涤2次,去除上清。13)用1m的nacl溶液洗涤1次,去除上清,然后加入1000μl的1mnacl溶液中振摇反应30min。14)磁吸去除上清,于1%bsa(1×pbs溶液配制)中孵育1小时封闭。15)用1%bsain1×pbs洗涤2次,去除上清,重悬于适当溶液中,保存于2–8℃。实施例2对核酸标识物的多重检测:以高危型人乳头瘤病毒(hpv)为例人乳突瘤状病毒(humanpapillomavirushpv),属乳头多瘤空泡病毒科(papovaviridae)乳头瘤病毒属。目前已知的hpv有200多个亚型,根据其基因组的相似度可以被分为5个属(alpha,beta,gamma,muandnu)33个种。alphahpv主要感染粘膜上皮细胞,其中有十几种hpv与癌症发生有关,被称为高危型hpv。目前所有用于临床的hpv分型方法都是基于检测临床样本中的hpv核酸。hpv分型检测在宫颈癌的早期筛查,术后追踪和随访,对细胞学检测结果分流、发现高危人群,指导hpv疫苗的研究和使用等方面都具有重要的指导意义。目前常用膜反向杂交、微阵列杂交等hpv分型检测方法,检测通量和灵活性有限,数据质量和重复性不佳,还存在着杂交反应速度慢、流程复杂、耗时费力、对杂交条件的依赖度高等缺点,用于临床检测多有不便。本实施例提供的一种多重检测方法可以完全克服现有技术的前述缺陷。该多重检测方法包括如下步骤:1)利用多重pcr方法对待测样品(hpv质粒0.1ng/μl和2ng/μl胎盘基因组dna,模拟含有hpv核酸的组织提取总dna)中的5种高危型hpv基因片段(选取hpv16,18,31,33,58等五种在中国最常见的hpv)进行多重扩增,并通过修饰引物在扩增产物核酸分子一端(例如5′端)引入biotin(生物素)标记。同时,作为阳性对照,对人血红蛋白β亚基的基因(humanglobinsubunitbeta,hbb)也进行扩增。2)各取10μlpcr产物与40μl含有6种编码磁性微芯片(每种各约200片,分别带有针对其中一种hpv扩增产物的杂交探针和针对hbb的杂交探针,参照实施例1方案制备)的杂交液(5×ssc,0.05%tween20)混合,在55℃,700rpm漩涡振荡的条件下振荡孵育30分钟。此步骤中,扩增产物被各自对应的磁性微芯片表面探针所捕获。其中,各芯片上所偶联的捕获探针dna序列(5′至3′)如下表。3)磁吸分离芯片,并以100μl清洗液(1×ssc/0.01%tween20)清洗。4)加入0.2μg/ml偶联藻红蛋白(一种常用的荧光蛋白)的链霉亲和素(streptavidin-conjugatedr-phycoerythrin,sape)对芯片进行染色。此过程中,sape与被捕获至芯片上的扩增产物核酸所携带的生物素分子结合,使芯片表面带有荧光。染色后进行清洗,并将芯片重悬于清洗液中。5)每个样品取50μl转入透明底384孔板中。置于微孔板成像仪(plateimager,例如biotek公司的cytation3多功能微孔板检测仪)上,在固定的曝光条件下拍摄每个样品孔的100×放大图像(包括明场图像和pe通道荧光图像)。对图像中的芯片进行图像识别、解码和荧光信号提取,结合标准曲线,通过统计分析方法即可得出样品中hpv浓度。典型实验结果:(1)hpv分型特异性。如图下表所示,分别向含有6种芯片的混合体系中加入一种hpv质粒(共5种)和胎盘基因组dna,在每种情况下仅有所加入的hpv对应的编码芯片和hbb芯片(阳性对照)呈现高荧光信号。hbb探针16探针18探针31探针33探针35探针39ddh2o21120614099178134132gdna640711211186118146147hpv16106593611111564131160hpv18290267835310616316465hpv31353172165786726597167hpv33297948170886320980hpv3511879841092575027140hpv392111052851233981974097(2)hpv检测灵敏度。如图9所示,对hpv16灵敏度可达1copy/μl,对hpv18为0.1copy/μl,对hpv31,33,58可达10copies/μl。实施例3对细胞因子的免疫夹心法多重检测:以人血清中的人tnf,il-1β,ifnγ和fgf-19为例本实施例的检测方法包括如下步骤:1)将已经分别偶联抗人tnfα抗体、抗人il-1β抗体,抗人ifnγ抗体和抗人fgf-19抗体的4种编码磁性微芯片(可以参照实施例1方案制备)组成混合悬液。将100μl芯片悬液和100μl样品(或标准品,浓度范围在0.5pg/ml–10ng/ml)加入96孔板的一个孔内。2)将96孔板置于涡旋混合器上,以700rpm速度振荡反应。反应时间视具体需要可短至1小时(常温下)或过夜(4℃)。此步骤中,待检测的细胞因子被各自对应的磁性微芯片表面抗体所捕获。3)将96孔板置于带有磁力配件的洗板机上(如biotek公司405ls型platewasher),利用磁力配件将微芯片牢固吸附在孔板底部,并进行清洗(循环3次,每次洗液用量为250μl)。洗液为1×pbst。4)加入带有生物素标记的检测抗体(detectionantibody)100μl/孔,在涡旋混合器上反应1–2小时。此步骤中,检测抗体结合到对应的已被捕获到芯片表面的细胞因子上。5)磁力洗板机清洗(同上述步骤4)。6)加入0.5μg/mlsape100μl/孔,对芯片进行染色。7)磁力洗板机清洗(同上述步骤4)。8)置于微孔板成像仪(plateimager,例如biotek公司的cytation3多功能微孔板检测仪)上,在固定的曝光条件下拍摄每个样品孔的100×放大图像(包括明场图像和pe通道荧光图像,分别如图10、图11所示)。对图像中的芯片进行图像识别、解码和荧光信号提取,结合标准曲线,通过统计分析方法即可得出样品中各待测蛋白质浓度。典型实验结果:(1)检测特异性:参阅图12,对4种芯片混合液(其中编码#060芯片检测tnfα、#093检测人ifnγ,#111检测人il-1β,#127检测人fgf-19)分别加入1种细胞因子时,各芯片的信号响应情况。可见芯片上的非特异性干扰信号处于非常低的水平。(2)多重检测灵敏度:参阅图13,由4个细胞因子标准品检测值(同一浓度标样混合)所建立的标准曲线。最低检测限(虚线所示)分别为2.7(tnfα),0.5(ifnγ),2.1(il-1β),and4.0pg/ml(fgf-19)。(3)多重检测:参阅图14,由不同浓度的tnfα、ifnγ和il-1β组成的3份测试样品的信号响应。可见信号水平的高低与对应分析物含量水平呈现高度一致。应当理解,上述实施例仅为说明本申请的技术构思及特点,其目的在于让熟悉此项技术的人士能够了解本申请的内容并据以实施,并不能以此限制本申请的保护范围。凡根据本申请精神实质所作的等效变化或修饰,都应涵盖在本申请的保护范围之内。当前第1页12
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1