生成氨的电化学方法与流程
在1910至1920年左右开发出哈柏法(haber-bosch-process)用于由空气-氮气和氢气制备氨。如今每年制备超过1.3亿吨。氢气是通过使用来自化石来源的能量获得的。用风能或太阳能制氢的电化学方法可以替代哈柏法中的化石生成的氢。然而,作为动态储存概念的一部分,哈柏法的由二氮分子的高键能引起以下主要缺点:
a.高温(~450–550℃)
b.高压(~250–350巴)
c.单次通过催化剂的转化率低(~20%)
d.反复减压,重新加热,以运行制备周期
哈柏法的替代方案是使用氮气和氢气以电解方式产生氨,例如使用气体扩散电极。在这种设置中,在阴极提供氮气,而在阳极提供氢气。
在阴极处,通过以下反应形成氮离子n3-:
1/2n2+3e-→n3-
然后,这些氮离子迁移到阳极,在那里它们根据以下反应式与氢气反应:
3/2h2+n3-→nh3+3e-
总反应则如下:
3/2h2+1/2n2→nh3
在673k的温度下采用例如熔盐作为电解质可以达到约72%的法拉第效率η。
这种方法的主要缺点是双气体扩散电极设置。在阳极处,氢气可使金属电极通过第一步中的氢化物形成而变脆,其随后分裂成电子和质子。
在学术文献中,作为产生氨的替代方案,尝试了几种方法来实施氮化物序列(nitridesequence),其中将不同的金属(在下面的表1和2中示例性地描述了li、mg和ca)和水供入到单个电化学电解池(单元电池,cell)中。
表1:氮化物序列,步骤1
表2:氮化物序列,步骤2
碱金属li、mg、ca以及可用作替代物的sr、ba可以例如由熔盐电解制备。在锂的情况下,电解质可以例如由licl/kcl的低共熔混合物(共晶混合物)组成。在电解过程中,在阳极上形成氯气,而在阴极上形成锂。
氮化物的形成和迁移通常可以通过电解质中金属离子的存在来介导,例如,来自licl的锂离子。
金属锂(其会在阴极上形成)立即与供应的氮气反应形成氮化锂。该氮化物可溶于电解质中并移至阳极。通常(当使用licl或类似的固体电解质时)在阳极上会形成氯气。在这种情况下,当阳极是耗氢电极时,氯气立即与氢气反应形成氯化氢,氯化氢是氮离子的质子源。最终释放出氨。反应序列(顺序)可归纳为以下反应式。
阳极:cl-→1/2cl2+e-
结合成3(1/2cl2+1/2h2→hcl)
阴极:li++e-→li
结合成3li+1/2n2→li3n
总反应:li3n+3hcl→nh3+3licl
在上述反应的变体中存在几种替代途径,正如在t.murakami等人/electrochimicaacta50(2005)5423–5426中所述的那样。licl/kcl电解质和氮离子的制备与上述工艺相同。有趣的是,质子(并非氢化物)是通过注入水蒸气来提供的。因此,氨在阴极处产生。在阴极处形成氧气而不是氯气。如果阳极由碳制成,则将形成co2。
在这样的工艺中,在学术研究装置中观察到高达72%的电流效率(法拉第效率)。该电解池纯粹是实验性的,因此没有关注通过优化电解条件实现的系统效率。电流密度也低约5ma/cm2。然而,普通的商业熔盐电解槽(电解器)在高达600ma/cm2的电流密度下工作。
使用的另一种电解质例如是氢氧化锂。高于400℃的温度是驱动该工艺所必需的。然而,从长远来看,氧化物物质的引入会由于积聚而破坏电解质。
除熔盐电解质外,还使用了h+传导膜。然而,显著的氨合成仅在高于500℃的温度下观察到。
氮化锂似乎是用于还原氮气并通过质子化最终形成nh3的重要的中间媒介(中间体)。氮化锂也在室温下形成。tsuneto等人,journalofelectroanalyticalchemistry,367(1994)183-188描述了在锂电池类环境中采用处于醚类溶剂中的三氟甲磺酸锂电解质的在低温、中压下的氨的合成。
仍然需要一种用于产生氨的有效、低温、连续操作的电解系统。特别地,还需要一种电解装置,其能够可逆地操作以使电解质和/或电极的损失最小化。
发明概述
本发明人发现了一种用于以电解方式产生氨的新的替代方法,其中用hcl和/或hbr和/或hi吹扫在电解中形成的氮化物物质。本发明人进一步发现了在电解质内部形成氮化物的最佳条件,从而能够用hcl和/或hbr和/或hi进行有效的吹扫。
在第一方面,本发明涉及一种用于产生氨的电解装置,包括:
-阴极;
-阳极;
-电解质;
-电流源;
-用于氮气的供应部;和
-用于hcl和/或hbr和/或hi的供应部。
在另一方面,本发明涉及以电解方式产生氨的方法,包括
-在阴极处由氮气形成氮离子;
-在包含金属的阳极处由金属形成金属离子;
-将氮(氮化物)离子和金属离子溶解在电解质中;和
-用hcl和/或hbr和/或hi吹扫包含溶解的氮离子和金属离子的电解质。
本发明的其他方面和实施方式在从属权利要求中公开并且可从以下描述、附图和实施例中获得,但不限于此。
附图说明
附图应示出本发明的实施方式并传达对其的进一步理解。结合说明书,它们用作对本发明的概念和原理的解释。其他实施方式和所陈述的许多优点可以结合附图导出。附图的元件不一定相对于彼此成比例并且是示意性的。除非另有说明,否则在附图中用相同的附图标记表示等同的、功能相当的和作用相同的特征和部件。
图1示意性地示出了根据本发明的一种实施方式的用于产生氨的电解装置。
图2示意性地示出了根据本发明另一实施方式的用于产生氨的另一种电解装置。
图3示意性地示出了根据本发明另一实施方式的用于产生氨的又一种电解装置。
在第一方面,本发明涉及一种用于产生氨的电解装置,包括:
-阴极;
-阳极;
-电解质;
-电流源;
-用于氮气的供应部;和
-用于hcl和/或hbr和/或hi的供应部,优选用于hcl的供应部。
根据某些实施方式,不同时供应hcl、hbr和/或hi,但不排除在不同时间交替供应hcl、hbr和/或hi,例如,取决于其供应或价格。根据某些实施方式,包括用于hcl或hbr或hi、优选用于hcl的供应部。根据某些实施方式,hcl、hbr和/或hi以气态形式供应,即所述供应部用于气态hcl和/或气态hbr和/或气态hi。
在本电解装置中,阴极、阳极和电流源没有特别限制并且可以包括通常用于电解的那些。
本电解装置能够实现用于产生氨的电化学工艺序列。
总反应是(以hcl作为卤化氢的例子):
n2+6hcl→2nh3+3cl2
化学反应可关于阴极和阳极被归纳如下:
阴极
阴极可优选地由可催化由氮形成氮离子的金属制成和/或包含可催化由氮形成氮离子的金属,如铁、不锈钢、碳。例如,有效产生氨的阴极可由铁制成或至少包含铁,非常相似于哈柏法中的催化剂(在50巴下的法拉第效率(fe)59%)。
以下反应发生在阴极处:
1/2n2+3e-→n3-
形成的氮化物将扩散到电解质中并将溶解在其中。因此,优选至少一种形成氮化物/使氮化物稳定的阳离子应当存在于电解质中。在优选的实施方式中,li、mg、ca和/或mg离子存在于电解质中。
根据某些实施方式,阴极具有多孔结构,通过该多孔结构可以供应氮气和/或可以增强电流密度。
阳极
阳极优选输送使氮化物稳定的阳离子。原则上,可以使用任何阳离子,只要它可以溶解在电解质中并且优选形成氮化物盐。
使氮化物稳定的阳离子是优选的,以确保电解质的纯度。因此,阳极优选包含选自li、mg、ca、sr、ba、zn和al,优选地选自li、mg、ca、sr、ba和zn的金属,和/或其混合物和/或其合金。这些金属的氮化物在高于500℃的温度下是稳定的并且不易水解。
阳极处的反应则如下:
m→mn++ne-n=1(li),2(mg、ca、sr、ba、zn),3(al)
根据某些实施方式,金属阳极应至少包含10重量%的形成氮化物的金属,以产生足够的用于在电解质中形成氮化物的阳离子。根据某些实施方式,阳极因此包含至少10重量%,优选至少20重量%,进一步优选至少50重量%,甚至更优选至少80重量%,更优选至少90重量%,甚至更优选至少95重量%,特别优选至少99重量%的选自li、mg、ca、sr、ba、zn和al的金属,和/或其混合物和/或其合金,基于阳极的总重量。根据某些实施方式,阳极由选自li、mg、ca、sr、ba、zn和al,优选地选自li、mg、ca、sr、ba和zn的金属,和/或其混合物和/或其合金组成。
通常,氨的热稳定性限于约500℃,特别地至多约800℃,例如约630℃。因此,根据某些实施方式,形成阳极的金属和/或其混合物和/或其合金的熔点高于500℃,优选等于或高于550℃,进一步优选等于或高于600℃,特别是高于630℃,例如等于或高于650℃,从而即使在较高的氨合成温度下也可以使用固体阳极,所述较高的氨合成温度有利于氨平衡产生。
因此,根据某些实施方式,阳极材料的熔点应相对于熔融电解质更高。
这可以通过以下示例性金属实现:
同样也可以使用其混合物或合金,如果其混合物或合金具有足够的熔点的话。锌(420℃)和锂(180℃)元素的熔点低于该水平。但是,不排除这些元素是合金的一种成分。
根据某些实施方式,阳极因此包含至少10重量%,优选至少20重量%,进一步优选至少50重量%,甚至进一步优选至少80重量%,更优选至少90重量%,甚至更优选至少95重量%,特别优选至少99重量%的选自mg、ca、sr、ba和al,优选选自mg、ca、sr和ba的金属,和/或其混合物和/或其合金,基于阳极的总重量。根据某些实施方式,阳极由选自mg、ca、sr、ba和al的金属和/或其混合物和/或其合金组成。
在另一个实施方式中,阳极的金属、例如使氮化物稳定的金属可以液体形式提供,类似于氯碱工艺中的汞齐法。在这种情况下,可以使用锂或锌或它们的低熔点合金。取决于电解质的密度,该电极将在电解质容器的顶部游动或将在容器的底部流动。在这种情况下,液体阳极不会停留在一个地方,并且可以例如沉淀在空腔等中,但也可以沉淀在电解装置的底部。阴极则可以相应地布置。在液体电极的情况下,它可以例如停留在电解池的底部,然后完全浸没。作为替代,它可以漂浮在电解池上。在这种情况下,氮化物优选地在相对(相反)侧,提供并因此也受到保护。
根据某些实施方式,阳极包含至少10重量%,优选至少20重量%,进一步优选至少50重量%,甚至进一步优选至少80重量%,更优选至少90重量%,甚至更优选至少95重量%,特别优选至少99重量%的选自li和zn的金属,和/或其混合物和/或其合金,基于阳极的总重量。根据某些实施方式,阳极由选自li和zn的金属和/或其混合物和/或其合金组成。
根据某些实施方式,阳极是实心(固体)电极或是涂覆的导电片。以这种方式,可以容易地再生。
根据某些实施方式,阳极具有多孔结构,所述多孔结构可以增强通过其提供的电流密度,例如在200–1500ma/cm2。根据某些实施方式,多孔结构甚至可以允许气体吹扫通过(穿过)该结构。这种用于阳极的气体扩散电极型装置应该优选地由对hcl和/或hbr和/或hi呈惰性的材料制成,例如不锈钢。在这种情况下,根据某些实施方式,仅将中介物(催化剂、介体,mediator)金属涂覆在该载体的顶部,即在与电解质接触的阳极的外表面上。
根据某些实施方式,阳极和阴极的材料、特别是金属材料完全浸没在固体电解质中,从而可以降低氨分解的风险。根据某些实施方式,通过引线向这种完全浸没的电极提供电流,所述引线覆盖有不与氨反应并且在电解温度下不熔融的材料,例如钢。根据某些实施方式,在本发明中以这样的方式控制使用hcl和/或hbr和/或hi吹扫出氨,使得氨在再次分解氨的温度下不接触任何金属。根据某些实施方式,电解在如下的装置中进行,其中基本上避免氧气的存在,例如,通过在电解质上方的气氛中使用惰性气体如氮气和/或稀有气体。
此外,电解质也没有特别限制,可以包括用于电解产生例如氨的那些电解质。优选地,电解质中不含水,因为水会在阳极处反应。根据某些实施方式,电解质是固体电解质,例如包含盐或其混合物或者由盐或其混合物组成的电解质,优选以熔融形式,即熔融固体电解质。根据某些实施方式,电解质的熔点低于氨的分解温度。例如,可以使用标准电解质licl/kcl共晶,即licl和kcl的低共熔混合物,熔点为353℃。然而,其中licl含量例如在约30和约85mol%之间的licl和kcl的混合物也是合适的。
也可以使用其他盐混合物,例如,kcl和mgcl2的混合物,其中mgcl2含量在约25和约80mol%之间;或bacl2和licl的混合物,其中licl含量在约60和100mol%之间,或bacl2和mgcl2的混合物,其中mgcl2含量在约35和约80mol%之间。也可使用单一的盐如licl或三元盐混合物等的熔融体,只要其熔点低于氨的分解点即可。另外,可以使用除氯化物盐之外的其他盐,以单独或彼此混合和/或与氯化物盐混合的方式,例如溴化物盐,特别是当使用hbr吹扫出氨时;和/或碘化物盐,特别是当使用hi吹扫出氨时;以及其他盐如氟化物盐。用于电解质的盐没有特别限制,只要它们不与hcl和/或hbr和/或hi反应并且也不与氨反应即可。
根据某些实施方式,电解质的熔点低于630℃,优选低于600℃,进一步优选低于550℃,甚至进一步优选为500℃或更低,特别是450℃或更低,特别优选420℃或更低,例如400℃或更低。
对氮气和/或hcl和/或hbr和/或hi的供应也没有特别限制并且可以通过诸如多孔管道或穿孔管道的管道、穿孔板等进行。然而,应当优选地确保,用于供应氮气以及hcl和/或hbr和/或hi的材料不与氮气以及hcl和/或hbr和/或hi发生任何反应。虽然这对于氮气供应来说不太困难,但用于hcl和/或hbr和/或hi的供应部应当优选由对hcl和/或hbr和/或hi呈惰性的材料如不锈钢、镍基合金等制成。根据某些实施方式,氮气和/或hcl和/或hbr和/或hi的供应也可以穿过电极进行,即氮气穿过阴极进行和/或hcl和/或hbr和/或hi穿过阳极进行。在这样的实施方式中,电极(或多个电极)可以由多孔材料制成,例如至少部分地以气体扩散电极的形式。根据某些实施方式,氮气穿过阴极供应。hcl和/或hbr和/或hi可以穿过阳极或通过单独的供应部例如管道等供应。
进一步优选地,hcl和/或hbr和/或hi的供应以这样的方式引导,使得hcl和/或hbr和/或hi不能到达阳极和/或阴极,从而hcl和/或hbr和/或hi与阴极和/或阳极材料的相互作用不会发生。
在本发明中,用于产生氨的质子源是关键的并且必须与电化学相容,承受副反应的危险。因此,用于与氮化物反应的质子源选自hcl和/或hbr和/或hi,优选为气态形式和无水的。
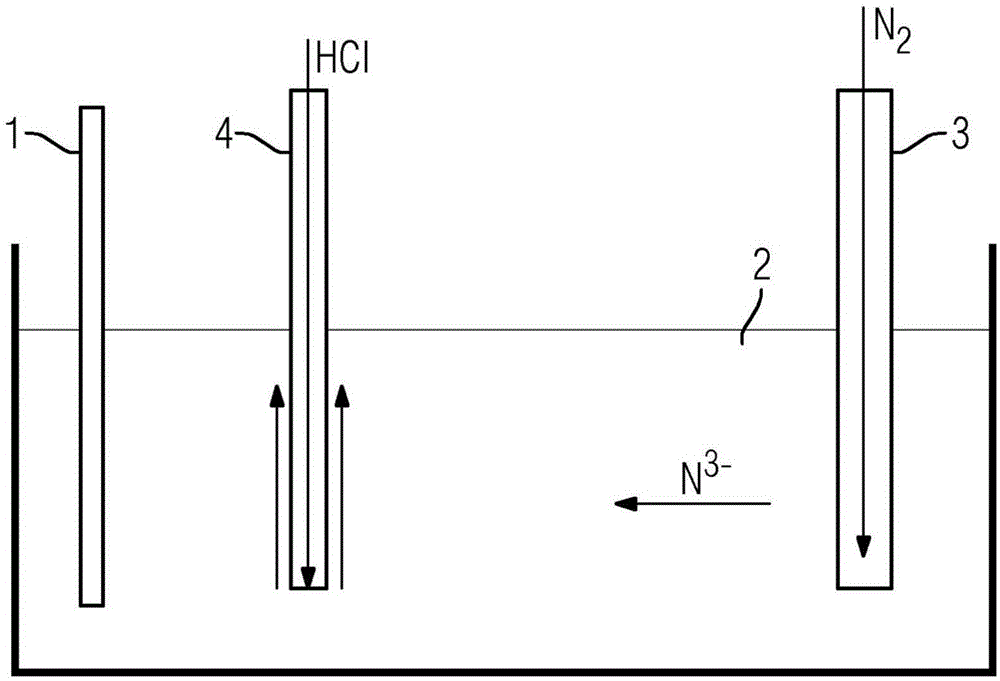
在图1至3中举例说明了用于本电解装置的不同的可能设置方式,其中hcl气体作为吹扫气体。
图1示出了如下的设置方式,其中阳极1和阴极3浸没在熔融的固体电解质2中。氮气穿过阴极3供应并在电解过程中反应形成氮离子n3-。这些氮离子朝向阳极1移动,阳极1在电解过程中部分溶解,从而在固体电解质2中形成氮化物化合物。然后,用hcl吹扫所述氮化物化合物,hcl是通过hcl供应部4供应的。图1是示意性的,当然其他电极布置方式也是可能的,例如像在具有圆形电极布置的唐士电解池(downscell)中那样,并且电极布置方式在本发明中没有特别限制。
图2与图1中的设置方式相当,并且区别仅在于阳极1至少部分地来自熔化的并形成液体阳极5的材料,在这种情况下在电解装置的底部。该液体阳极5则可以提供用于在固体电解质2中形成氮化物化合物的阳离子。
图3中的设置方式与图1中的设置方式的不同之处在于没有使用单独的hcl供应部,而是直接穿过阳极1供应hcl,该阳极1可以形成为多孔阳极,如上文所例示的。
根据某些实施方式,本发明的电解装置还包括一个或多个加热器,所述加热器可以例如提供用于熔化固体电解质的热量。加热器没有特别限制,任何合适的加热器都可以使用,直接或间接地加热电解装置。根据某些实施方式,加热器在低于630℃,优选低于600℃,进一步优选低于550℃,甚至进一步优选500℃或更低,特别是450℃或更低,特别优选420℃或更低,例如400℃或更低的温度下加热。根据某些实施方式,加热进行到至少200℃,优选250℃,进一步优选至少275℃,更优选至少300℃,甚至更优选至少355℃,特别是优选至少375℃的温度。根据某些实施方式,在电解过程中可以关闭加热器,因为用于电解的能量可以由电解装置供应。
根据某些实施方式,本电解装置还包括用于反转阴极和阳极的极性的转换器(开关)。这样,可以改变操作的极性,并且阳极可以在极性反转之后被再生,如关于本方法更详细地解释的那样。中介物,即阳极的金属可以通过反转电源的极性而原位地再生。可任选地进行改变电极。
除上述之外,本电解装置还可包括其他组件,例如,用于普通电解装置的那些组件。虽然根据某些实施方式,在本发明的电解装置中没有提供膜,但是也可以使用膜,例如可在阴极附近传导氮离子但保护阴极免受hcl和/或hbr和/或hi的膜。关于阳极可以进行类似的构思。然而,根据某些实施方式,不提供膜。
在本方法中,所有过程都可以电化学方式运行。来自可再生资源的滞留能源(strandedenergy)因此是最优选的能源。因而,根据某些实施方式,本电解装置包括至少一种可再生能源。
本发明的电解装置可特别地用于实施根据本发明的以电解方式产生氨的方法。
在第二方面,本发明涉及一种以电解方式产生氨的方法,包括:
-在阴极处由氮形成氮离子;
-在包含金属的阳极处由金属形成金属离子;
-将氮离子和金属离子溶解在电解质中;和
-用hcl和/或hbr和/或hi吹扫包含溶解的氮离子和金属离子的电解质。
根据某些实施方式,用hcl或hbr或hi,优选地hcl进行吹扫。但是,在单独的电解过程中,例如,在阳极的再生或其交换以及电解质的可能再生或改变之后,可以使用不同的吹扫方式,例如,一次hcl,而下一次hbr或hi,优选地全部为气态形式。根据某些实施方式,对包含溶解的氮离子和金属离子的电解质的吹扫是用气态hcl和/或气态hbr和/或气态hi,优选地气态hcl或气态hbr或气态hi,例如气态hcl进行的。虽然理论上也可以使用hf(在本发明中不一定排除hf),但优选使用hcl和/或hbr和/或hi,因为这些可以更容易地处理。
根据某些实施方式,hcl和/或hbr和/或hi以这样的方式供应,使得可以有效地吹扫出氨,例如以这样的化学计量如亚化学计量的方式,使得不产生氯化铵。
阴极、阳极和电解质可以是如上关于本发明第一方面的电解装置所定义的。根据某些实施方式,可以使用固体电解质,例如包含盐或其混合物或者由盐或其混合物组成的固体电解质,特别是熔融形式。
本发明描述了一种(例如熔盐)工艺序列,其中形成氮化物的金属物质可用作阳极材料,并且类似于用于产生氨的现有设置。然而,阳极不一定必须由气体扩散电极形成。
在此工艺中,由阳极产生的金属盐如mgcl2在电解质中积聚。
根据某些实施方式,金属选自li、mg、ca、sr、ba、zn和al。根据某些实施方式,将电解质加热至低于630℃,优选低于600℃,进一步优选低于550℃的温度,甚至进一步优选加热至500℃或更低的温度,例如加热至低于500℃,特别是450℃或更低,特别优选420℃或更低,例如400℃或更低的温度。在初始加热电解质用于例如熔化之后,可以不需要进一步加热,因为电解将提供所需的能量,并且甚至可能需要冷却该工艺以保持合适的温度。根据某些实施方式,氮气通过阴极、例如多孔阴极供应。根据某些实施方式,hcl和/或hbr和/或hi穿过阳极、例如多孔阳极供应。
根据某些方面,本方法包括在产生氨之后切换阳极和阴极的极性的步骤。这样,阳极可以在切换阳极和阴极的极性之后被再生。
在本发明中,阳极的金属、例如镁可以如此通过反转电源的极性来再生。
mgcl2→mg+cl2
在这种情况下,氮气还原电极将变成产氯气的阳极。
作为替代或补充,在某些实施方式中,可为更有利的是将氮气还原阴极拔出并用氯气氧化阳极代替它。
氯气可以出售或部分地根据化学计量重新使用以产生气态hcl。当交替使用或额外使用hbr和/或hi时,可以进行类似构思。
根据某些实施方式,废弃的稀释的hcl、hbr和/或hi可用于产生气态hcl、hbr和/或hi。废弃的稀释的卤化氢可以例如被电解,例如在hcl的情况下被电解为h2和cl2。现在完全干燥的这两种产品都可被燃烧以形成气态无水hcl(替代地或额外地hbr或hi)。这为本方法中的整个过程产生以下总结的反应式:
n2+6hcl→2nh3+3cl2
当然,在本方法中,也可以在产生氨之后用新的阳极替换本方法中使用的阳极。在这种情况下,电解质也可被更换,并且使用过的电解质可被回收用于在产生氨的电解过程中溶解的阳极材料的再生。
根据某些实施方式,用于电解和任选地阳极的再生的能量由可再生资源提供,所述可再生资源不受特别限制。这样,可再生能源可用于提供有用的产品,特别是氨,但也可能是氯。氨可用作肥料或用于生产肥料,也可用于生产其他产品如肼或有机产品等。
上述实施方式和教导可以合理地相互组合。本发明的其他实施方式和设计方式还包括之前或以下关于本发明的实施例给出的本发明特征的未明确描述的组合。特别地,本领域技术人员还将添加单个方面作为本发明的各个基本实施方式的改进或附加。
实施例
现在将参考本发明的几个实施例详细描述本发明。然而,这些实施例是说明性的,并不限制本发明的范围。
实施例1
在下文中,针对镁(n=2)作为阳极材料而示例性将反应列出方程式。以类似的方式,可以针对n=1和n=3来将反应列出方程式。在电解中,通过部分溶解阳极形成镁离子。
mg→mg2++2e-
如上所述,氮化物的形成发生在阴极处,其中阴极例如以气体扩散电极形式由铁制成,氮气从氮气源穿过该阴极供应。licl/kcl用作示例性固体电解质并被加热至约400℃。
在电解过程中,氮化物在电解质中富集并形成盐,例如mg3n2或li3n(因为锂离子存在于licl/kcl电解质中)。
然后通过用气态hcl(或者替代地用气态hbr或hi)吹扫电解质将氨从电解质中的氮化物盐中释放出来。
由于电解质的高温,该实施例中释放氨。如果使用过量的hcl,则升华的nh4cl可以在系统的较冷位置处分离。不过,如果温度保持足够高,并且控制hcl的量,则主要形成氨。示例性反应如下:
mg3n2+6hcl→3mgcl2+2nh3
在此过程中,mgcl2积聚在电解质中。然后,镁可以在氨产生后通过反转电源的极性而再生,如下面的反应式所示:
mgcl2→mg+cl2
在这种情况下,氮气还原电极将变成产生氯气的阳极,并且氯气可以进一步用于其他反应或用于气态hcl的再生。
本发明特别提出了一种熔融电解质方法和装置,用于从氮气以及hcl和/或hbr和/或hi、通过形成氮化物的中介物如mg,ca,sr,ba,zn或al产生氨,hcl和/或hbr和/或hi例如可由稀释的废hcl和/或hbr和/或hi来提供。其中的净反应如下:
n2+6hcl→2nh3+3cl2
所有过程都可以电化学方式运行。因此,来自可再生资源的滞留能源是最优选的能源。
中介物可以通过反转电源的极性来原位地再生。可任选地进行改变电极。
该金属仅用作系统中的“中介物”。整个过程只产生高价值的化合物,如nh3(约500欧元/吨;2016年)或氯气(约390欧元/吨;2016年)。
与通常的哈柏法合成氨相比,本方法可以在相对低的温度下进行。因此,本发明的低温反应具有在低温下产生氨的潜力。
- 还没有人留言评论。精彩留言会获得点赞!