吞噬细胞对细菌的黏附率和吞噬率的检测方法与流程
本发明属于生物领域,更具体地讲,涉及一种吞噬细胞对细菌的黏附率和吞噬率的检测方法。
背景技术:
在机体的免疫系统中,天然免疫占据着非常重要的地位,尤其是在感染早期对于控制感染扩散有着举足轻重的作用。在天然免疫中,单核-巨噬细胞是最为有效的吞噬细胞,担负着机体抵抗外来病原菌的重要功能。研究病原菌与吞噬细胞相互作用对于阐明感染性疾病发病机理有非常重要的意义。确定吞噬细胞对病原菌的黏附率和吞噬率是二者相互作用研究的第一步,对于探究吞噬细胞上与病原菌相关的黏附受体、吞噬受体和病原菌免疫逃逸能力等方面具有重要意义。
现有的吞噬细胞对细菌的黏附率和吞噬率的检测方法是用间接免疫荧光技术标记细菌后,通过激光共聚焦显微镜进行检测。主要步骤为:细菌与细胞相互作用后,用固定液固定,离心洗涤后加入针对病原菌的特异性抗体(一抗)与标本进行室温(25℃)孵育2h或4℃过夜,洗涤后加入荧光标记抗一抗的抗抗体(二抗)室温孵育30min,洗涤后激光共聚焦显微镜进行检测。激光共聚焦获取图像后需人工随机计数足够多(≥100个)细胞后,通过与细胞松弛素D(细胞松弛素D解离细胞骨架使细胞不再吞噬菌体,但不影响细菌黏附)预处理组对比,可计算出黏附率和吞噬率。与本发明相比,已有方法有明显不足,首先上述方法所需时间冗长,耗费人力、物力;其次需购买价格较贵的一抗、二抗等试剂,很不经济;而且需多次预实验确定抗体最佳稀释度,增加科研负担影响科研效率。
羧基荧光素二醋酸盐琥珀酰亚胺酯(5,6-earboxyfluores—cein diaeetate succinimidyl ester,CFDA-SE)是一种非极性分子,可自由穿透细胞膜,被胞内酯酶转化成带负电的并具有绿色荧光的氨基反应性羧基荧光素琥珀酰亚胺酯(carboxyfluorescein succinimidyl ester,CFSE)。CFDA-SE一旦进入细胞后不能从细胞中释出,并可自发不可逆地通过赖氨酸侧链获其他可利用的胺偶联到细胞 蛋白质上,不会被代谢降解,标记静止细胞的荧光可长达几个月稳定。荧光的减少只能通过细胞分裂繁殖。CFDA-SE细胞标记技术与流式细胞分选技术的结合在免疫学领域已经广泛应用于T、B淋巴细胞的增殖检测。
技术实现要素:
本发明的目的在于提供一种用CFDA-SE标记病原菌,与吞噬细胞相互作用后,可直接收集细胞用流式细胞术进行快速、准确的计算吞噬细胞对病原菌的黏附率和吞噬率的检测方法。
为实现以上目的,本发明公开以下技术方案:吞噬细胞对细菌的黏附率和吞噬率的检测方法,将吞噬细胞分为对照组,处理组和未处理组,对照组细胞用台盼蓝和细胞松弛素D处理,处理组细胞用台盼蓝或细胞松弛素D处理,未处理组细胞不作处理,用CFDA-SE标记细菌,细菌与细胞相互作用后通过流式细胞术检测吞噬细胞黏附率和吞噬率。
作为一个优选方案,吞噬细胞对细菌的黏附率和吞噬率的检测方法,包括如下步骤:
(1)将吞噬细胞分为对照组,0.4%台盼蓝处理组和未处理组,对照组细胞用20ug/ml细胞松弛素D预处理30min;
(2)用CFDA-SE标记细菌,细菌浓度为108/mL,CFDA-SE工作浓度为5μM,室温避光孵育30min,孵育期间轻柔颠倒混匀1次/10min;
(3)细菌与细胞相互作用,将步骤(2)制备好的菌体与各组吞噬细胞共同孵育,孵育完成后对照组和0.4%台盼蓝处理组均加入0.4%台盼蓝室温下孵育5min;
(4)流式细胞术检测,以对照组作为检测时的设门标准,未处理组检测结果为黏附率与吞噬率总和,0.4%台盼蓝处理组检测结果为吞噬率,由此计算出吞噬细胞对细菌的黏附率和吞噬率。
作为一个优选方案,吞噬细胞对细菌的黏附率和吞噬率的检测方法,包括如下步骤:
(1)将吞噬细胞分为对照组,细胞松弛素D处理组和未处理组,对照组和细胞松弛素D处理组细胞用20ug/ml细胞松弛素D预处理30min;
(2)用CFDA-SE标记细菌,细菌浓度为108/mL,CFDA-SE工作浓度为5μM,室温避光孵育30min,孵育期间轻柔颠倒混匀1次/10min;
(3)细菌与细胞相互作用,将步骤(2)制备好的菌体与各组吞噬细胞共同孵育,孵育完成后对照组加入0.4%台盼蓝室温下孵育5min;
(4)流式细胞术检测,以对照组作为检测时的设门标准,未处理组检测结果为黏附率与吞噬率总和,细胞松弛素D处理组检测结果为黏附率,由此计算出吞噬细胞对细菌的黏附率和吞噬率。
本发明的优点在于:本发明可以快速、准确检测出吞噬细胞对病原菌的黏附率和吞噬率,全部实验过程不超过3h。因病原菌与吞噬细胞相互作用后所需操作步骤少,可以进行大批量样本的检测,且所用试剂少而且价格经济,大大减少了科研支出。本发明不仅适用于贴壁生长的吞噬细胞,对于检测有难度的悬浮生长状态的吞噬细胞同样适用,在一定程度上拓宽了研究思路。
附图说明
图1为台盼蓝可以有效淬灭菌体内CFSE发出的荧光,试验组细菌分为无CFDA-SE标记组、CFDA-SE标记组和CFDA-SE标记后0.4%台盼蓝处理5min组三组,分别用流式细胞术进行检测。A.无CFDA-SE标记组B.CFDA-SE标记组C.CFDA-SE标记后经0.4%台盼蓝处理组。
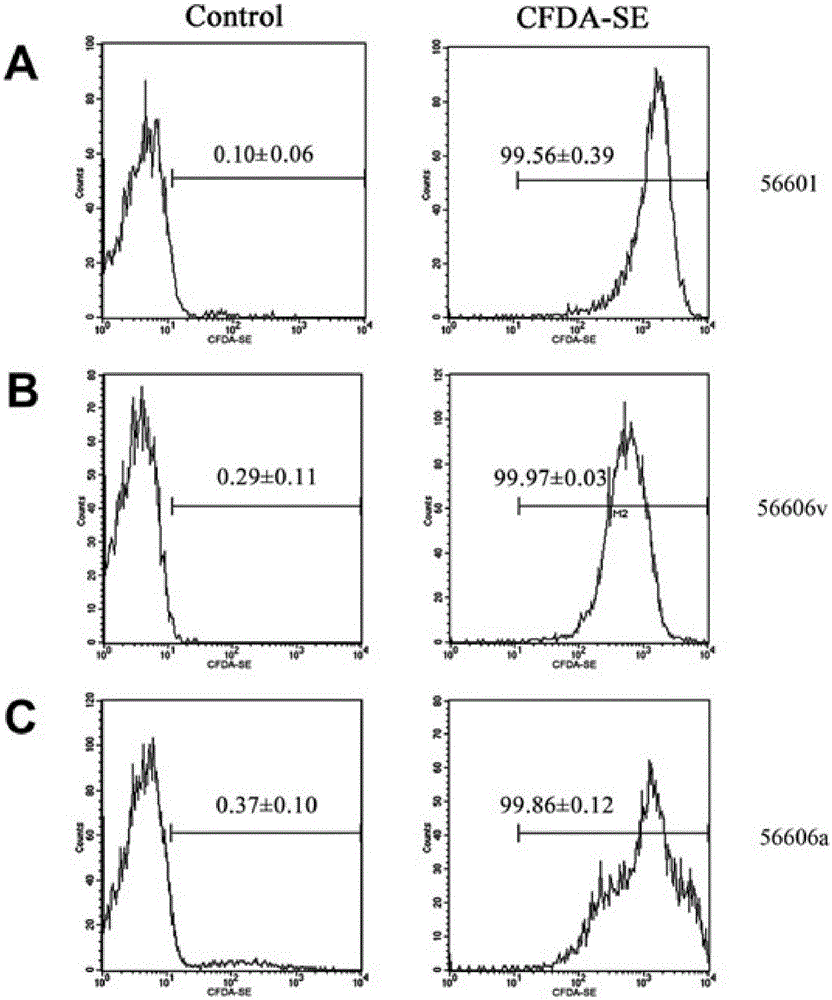
图2为CFDA-SE标记钩体效率,经流式细胞术检测,钩端螺旋体56601株、56606v株和56606a株经CFDA-SE标记后分别有99.56±0.39%、99.97±0.03%、99.86±0.12%发出绿色荧光。A.56601株B.56606v株C.56606a株。
图3为CFDA-SE标记钩体效率,经流式细胞术检测,钩端螺旋体56601株、56606v株和56606a株经CFDA-SE标记后发出较亮的绿色荧光。A.56601株B.56606v株C.56606a株。
图4为小鼠腹腔巨噬细胞RAW264.7对CFSE标记56606v株钩体黏附率和吞噬率。
具体实施方式
下面结合具体实施例,进一步阐述本发明。下述实施例中所使用的实验方 法如无特殊说明,均为常规方法。下述实施例中所用的材料、试剂等,如无特殊说明,均可从商业途径得到。应理解,这些实施例仅用于说明本发明而不用于限制本发明的范围。
实施例1.
研究发现0.4%台盼蓝与CFDA-SE标记的细菌室温下孵育5min可有效淬灭CFSE发出的荧光(图1)。
1)实验分组
实验分为对照组、0.4%台盼蓝处理组和0.4%台盼蓝未处理组三组。由于细胞有自发荧光同时CFSE经台盼蓝淬灭后荧光值高于未标记菌体(图1C),所以对照组细胞先用细胞松弛素D(20ug/ml)预处理30min使其吞噬能力被抑制,但不抑制细菌对细胞的黏附。
2)CFDA-SE标记细菌
将培养至对数期的细菌用磷酸盐缓冲液PBS洗涤后调整浓度至108/mL,加入CFDA-SE(Sigma-Aldrich,USA)使其工作浓度为5μM,室温避光孵育30min,期间轻柔颠倒混匀1次/10min。磷酸盐缓冲液洗涤2次后用4%福尔马林室温固定15min计数备用。
3)细菌与细胞相互作用
将制备好的菌体以适宜MOI(细菌细胞比例)与各组吞噬细胞共同孵育。孵育完成后对照组和0.4%台盼蓝处理组均加入0.4%台盼蓝室温下孵育5min。对照组黏附在吞噬细胞上的菌体荧光被淬灭。0.4%台盼蓝处理组加入台盼蓝处理后,因活细胞对台盼蓝有排斥作用,所以仅有细胞外黏附菌体的荧光被淬灭。
4)流式细胞术检测
以对照组作为流式细胞术检测时的设门标准,台盼蓝未处理组检测结果为黏附率与吞噬率总和,台盼蓝处理组检测结果为吞噬率,由此准确计算出吞噬细胞对病原菌的黏附率和吞噬率。
实施例2.
1)实验分组
将实验分为对照组、细胞松弛素D处理组、细胞松弛素D未处理组三组。 对照组处理同实施例1。细胞松弛素D处理组细胞用细胞松弛素D(20ug/ml)预处理30min使其吞噬能力被抑制。
2)CFDA-SE标记细菌
同实施例1。
3)细菌与细胞相互作用
将制备好的菌体以适宜MOI(细菌细胞比例)与各组吞噬细胞共同孵育。孵育完成后对照组处理同实施例1加入0.4%台盼蓝室温下孵育5min。
4)流式细胞术检测
以对照组作为流式细胞术检测时的设门标准,细胞松弛素D未处理组检测结果为黏附率和吞噬率总和,细胞松弛素D处理组检测结果为黏附率,由此准确计算出吞噬细胞对病原菌的黏附率和吞噬率。
本发明以常见病原菌钩端螺旋体(钩体)与小鼠腹腔巨噬细胞系RAW264.7相互作用为例,实验步骤采用实施例1。首先通过流式细胞术(图2)和激光共聚焦显微镜(图3)检测试验证明CFDA-SE可以非常高效率(≥99.5%)的与钩体结合发出绿色荧光且无背景。
对照组RAW264.7细胞用细胞松弛素D(20μg/ml)预处理30min,然后将CFDA-SE标记的56606v株钩体以1:100感染比例分别与对照组、0.4%台盼蓝未处理组、0.4%台盼蓝处理组相互作用1h后,用0.4%台盼蓝淬灭对照组和0.4%台盼蓝处理组细胞外黏附钩体荧光。以对照组细胞做为流式细胞术检测时的设门参数,将0.4%台盼蓝未处理组、0.4%台盼蓝处理组一同通过流式细胞术检测,结果显示胞外黏附率为2.26±1.12%,胞内吞噬率为44.67±0.03%,且实施例2结果与实施例1吻合(图4,实验重复三次以上)。
以上所述仅是本发明的优选实施方式,应当指出,对于本技术领域的普通技术人员,在不脱离本发明原理的前提下,还可以做出若干改进和润饰,这些改进和润饰也应视为本发明的保护范围。
- 还没有人留言评论。精彩留言会获得点赞!