免疫分析套组与方法与流程
本发明涉及一种免疫分析套组与方法。
背景技术:
免疫分析是指利用抗体或抗原来测定样本中待测物的存在或其浓度。在医疗与科研领域中,更是经常利用免疫分析来测定生物样本中的待测物,以供疾病诊断治疗与相关研究。因此,相关领域对于简便、快速的免疫分析平台与方法有其市场需求。
利用侧向层析检测(lateral flow assay)技术开发的试片具有成本低、检测快速、使用方便等优势,因此已广泛使用于疾病快速筛检。传统侧向层析检测试片是利用胶体金(colloidal gold)标记,使特定抗原(即,待测物)以及对该抗原专一的(specific,也解释为特异性的)抗体于感测线区域累积,当样本中抗原浓度达到阀值(cutoff value)时,累积的胶体金会产生特定颜色,使用者即可通过该特定颜色判断样本中待测物的有无。但使用胶体金呈色技术的感测灵敏度不佳,当样本中待测物浓度较低时,无法有效定性或定量检测。因此,许多侧向层析检测试片是采荧光(fluorescence)标记,并搭配紫外光激发系统,以提高感测灵敏度。然而,使用荧光标记需使用额外的光学量测设备,在操作上较为不便,也使得其应用场域受到限制。
另一方面,利用酵素免疫分析法(Enzyme-linked immunosorbent assay,ELISA)使酵素与呈色受质(substrate)反应,可以产生清晰的颜色变化,以对待测抗原进行定性或定量测定。酵素呈色具有高专一性与高灵敏度,并且不需使用复杂的光学量测设备,但缺点为步骤繁复,且试片结构较为复杂。
有鉴于此,相关领域急需提出一种简便且灵敏度高的免疫分析平台与方法。
技术实现要素:
发明内容旨在提供本揭示内容发明的简化摘要,以使阅读者对本发明揭示内容具备基本的理解。此发明内容并非本揭示发明内容的完整概述,且其用意并非在指出本发明实施例的重要/关键组件或界定本发明的范围。发明内容旨在提供本揭示内发明容的简化摘要,以使阅读者对本发明揭示内容具备基本的理解。此发明内容并非本揭示内容发明的完整概述,且其用意并非在指出本发明实施例的重要/关键组件或界定本发明的范围。
有鉴于上述问题,本发明的一实施例提出一种免疫分析套组,此种免疫分析套组操作方式简便、感测灵敏度佳,且可用于定性、半定量或定量分析。
根据本发明某些具体实施例,所述免疫分析套组包括样本预处理部、第一捕捉区域以及第一测试区域。样本预处理部包含复数个对第一待测物专一的第一酵素标记抗体;此外,样本预处理部用于接收并处理液体样本以得到第一预处理样本;第一预处理样本包含未与第一待测物结合的第一酵素标记抗体及/或第一待测物-第一酵素标记抗体复合物。第一捕捉区域包含固定于其中的对第一待测物专一的复数个第一抗体、或固定于其中的对第一酵素标记抗体专一的复数个第一待测物类似物。第一测试区域,包含与第一酵素标记抗体相应的复数个第一呈色受质,其中第一预处理样本沿着由第一捕捉区域至第一测试区域的第一液体流动路径流动。
在本发明某些具体实施例中,上述免疫分析套组还包括本体与第一薄膜,其中第一薄膜设于本体上并界定出上述第一液体流动路径。
在本发明多种具体实施例中,当第一预处理样本接触第一薄膜时,第一预处理样本沿着第一液体流动路径流动。根据某些实施方式,第一捕捉区域包含固定于其中的对第一待测物专一的该些第一抗体;此时第一预处理样本中的第一待测物-第一酵素标记抗体复合物与第一抗体结合,进而固定于第一捕捉区域中;未与第一待测物结合的第一酵素标记抗体则于第一测试区域中和第一呈色受质进行呈色反应。或者是,在另一些实施方式中,第一捕捉区域包含固定于其中的对第一酵素标记抗体专一的第一待测物类似物;此时,第一预处理样本中未与第一待测物结合的第一酵素标记抗体与第一待测物类似物结合,进而固定于第一捕捉区域中;第一待测物-第一酵素标记抗体复合物则于第一测试区域中和第一呈色受质进行呈色反应。
根据可任选的具体实施方式,上述免疫分析套组的液体样本预处理部还包括第一接合垫或样本接收垫或同时包含上述两者。第一接合垫包含第一酵素标记抗体,其可用于接收该液体样本;第一接合垫的至少一部分设于第一薄膜上,且位于第一捕捉区域在第一液体流动路径中的上游。当液体样本预处理部同时包含第一接合垫与样本接收垫时,样本接收垫的至少一部分设于第一接合垫上,且位于第一接合垫在第一液体流动路径中的上游;此时先由第一接合垫接收液体样本,而后液体样本再流入第一接合垫中。在液体样本预处理部仅包含样本接收垫的实施方式中,样本接收垫的至少一部分设于第一薄膜上,且位于第一捕捉区域在第一液体流动路径中的上游;此时由样本接收垫接收第一预处理样本。
在根据需要而采用的实施方式中,上述免疫分析套组的第一测试区域和第一捕捉区域彼此相间隔一距离。
于根据需要而采用的实施方式中,所述的第一测试区域以测试垫的形式设于第一薄膜上,或者是以涂布、转印或喷膜的形式设于该第一薄膜表面。当采用测试垫的形式时,测试垫的亲水性高于第一薄膜的亲水性。同样在根据需要而采用的实施方式中,测试垫与第一薄膜间还设有一间隔片。
在可任选的实施方式中,所述免疫分析套组的本体还包含第一吸收垫,其位于第一液体流动路径中的最下游并与第一薄膜相接触。
在有需要时,也可在上述免疫分析套组的第一薄膜上设置第二捕捉区域与第二测试区域,以便侦测液体样本中的第二种待测物(单流向式)。或者是,也可在本体上设置第二薄膜,并进一步于第二薄膜上设置第二捕捉区域与第二测试区域,以便侦测液体样本中的第二种待测物(双流向式)。上述两种设置方式也可搭配使用,以使得此处提出的免疫分析套组可用于测试三种以上的待测物。
根据某些实施方式,在用于侦测液体样本中的第一与第二待测物的免疫分析套组中,其液体样本预处理部还包含对第二待测物专一的复数个第二酵素标记抗体,以使得第一预处理样本还包含未与第二待测物结合的第二酵素标记抗体及/或由第二待测物与第二酵素标记抗体所形成的第二待测物-第二酵素标记抗体复合物。此外,所述免疫分析套组的第一薄膜上还设有第二捕捉区域及第二测试区域。第二捕捉区域包含固定于其中的对第二待测物专一的复数个第二抗体,或固定于其中的对第二酵素标记抗体专一的复数个第二待测物类似物。第二测试区域包含与第二酵素标记抗体相应的复数个第二呈色受质,且第二捕捉区域位于第二测试区域在第一液体流动路径中的上游。
在上述实施方式中,第一预处理样本沿着第一液体流动路径流动,且当第二捕捉区域包含固定于其中的对第二待测物专一的第二抗体时,第一预处理样本中的第二待测物-第二酵素标记抗体复合物与第二抗体结合而固定于第二捕捉区域中,且未与第二待测物结合的第二酵素标记抗体于第二测试区域中和第二呈色受质进行呈色反应。或者是,第一预处理样本沿着第一液体流动路径流动,且当第二捕捉区域包含固定于其中的对第二酵素标记抗体专一的第二待测物类似物时,第一预处理样本中未与第二待测物结合的第二酵素标记抗体与第二待测物类似物结合而固定于第二捕捉区域中,且第二待测物-第二酵素标记抗体复合物于第二测试区域中和第二呈色受质进行呈色反应。
在根据需要而采用的实施方式中,上述免疫分析套组的第一捕捉区域和第二捕捉区域位于相同的位置。
同样在根据需要而采用的实施方式中,上述免疫分析套组的第一测试区域位于第二捕捉区域在第一液体流动路径中的上游。或者是,上述免疫分析套组的第二捕捉区域位于第一测试区域在第一液体流动路径中的上游。
于可任选的实施方式中,上述免疫分析套组的第一酵素标记抗体中的第一酵素及第二酵素标记抗体中的第二酵素为相同的酵素;在这些实施方式中,第一呈色受质与第二呈色受质可以是相同或不同的呈色受质。或者是,上述第一酵素及第二酵素可以是不同的酵素;在这些实施方式中,第一呈色受质与第二呈色受质可以是相同或不同的呈色受质。
根据本发明内容另一些实施方式,所述的免疫分析套组为双流向式套组,且其也可用于测定液体样本中的第一与第二待测物。此时,液体样本预处理部还包含对第二待测物专一的复数个第二酵素标记抗体,以使得第一预处理样本还包含未与第二待测物结合的第二酵素标记抗体及/或由第二待测物与第二酵素标记抗体所形成的第二待测物-第二酵素标记抗体复合物。此外,免疫分析套组的本体还包含第二薄膜设于本体上,其中第二薄膜上设有第二捕捉区域及第二测试区域,且第二薄膜界定出由第二捕捉区域至第二测试区域的第二液体流动路径。第二捕捉区域包含固定于其中的对第二待测物专一的复数个第二抗体,或固定于其中的对第二酵素标记抗体专一的复数个第二待测物类似物。第二测试区域包含与第二酵素标记抗体相应的复数个第二呈色受质。于这些实施方式中,第二液体流动路径与第一液体流动路径为相反的方向。再者,所采用的第一酵素与第二酵素为相同的酵素,并可搭配相同或不同的第一与第二呈色受质;或者是,可采用不同的第一酵素与第二酵素,并搭配不同的第一与第二呈色受质。
在上述实施方式中,第二预处理样本沿着第二液体流动路径流动,且当第二捕捉区域包含固定于其中的对第二待测物专一的第二抗体时,第二预处理样本中的第二待测物-第二酵素标记抗体复合物与第二抗体结合而固定于第二捕捉区域中,且未与第二待测物结合的第二酵素标记抗体于第二测试区域中和第二呈色受质进行呈色反应。或者是,第二预处理样本沿着第二液体流动路径流动,且当第二捕捉区域包含固定于其中的对第二酵素标记抗体专一的第二待测物类似物时,第二预处理样本中未与第二待测物结合的第二酵素标记抗体与第二待测物类似物结合而固定于第二捕捉区域中,且第二待测物-第二酵素标记抗体复合物于第二测试区域中和第二呈色受质进行呈色反应。
另外,在可任选的实施方式中,所述免疫分析套组的样本预处理部还包括接合垫,用于接收液体样本。接合垫的至少一部分设于第一薄膜上,并位于第一捕捉区域在第一液体流动路径中的上游;接合垫的至少另一部份设于第二薄膜上,并位于第二捕捉区域在第二液体流动路径中的上游。于本实施方式中,接合垫包含第一酵素标记抗体及第二酵素标记抗体。
或者是,在同样可任选的实施方式中,所述免疫分析套组的样本预处理部还包括第一接合垫、第二接合垫与样本接收垫。样本接收垫用于接收液体样本,其至少一部分设于第一接合垫上,至少另一部份设于第二接合垫上,且位于第一接合垫在第一液体流动路径中的上游,并位于第二接合垫在第二液体流动路径中的上游。第一接合垫包含第一酵素标记抗体,且其至少一部分设于第一薄膜上,并位于第一捕捉区域在第一液体流动路径中的上游。第二接合垫包含第二酵素标记抗体,且其至少一部分设于第二薄膜上,并位于第二捕捉区域在第二液体流动路径中的上游。
又或者是,在根据本发明某些实施方式的免疫分析套组中,其样本预处理部还包括样本接收垫,用于接收第一预处理样本及第二预处理样本;所述样本接收垫的至少一部分设于第一薄膜上,并位于第一捕捉区域在第一液体流动路径中的上游;且样本接收垫的至少另一部份设于第二薄膜上,并位于第二捕捉区域在第二液体流动路径中的上游。
在可任选的实施方式中,所述免疫分析套组还包含第二吸收垫,其位于第二液体流动路径中的最下游并与第二薄膜相接触。
根据本发明某些具体实施方式,所述免疫分析套组可用于侦测液体样本中的第一、第二与第三待测物。此种免疫分系套组的结构系基于上述用于侦测两种待测物的双流向式套组。此时,液体样本预处理部还包含对第三待测物专一的复数个第三酵素标记抗体,以使得第一预处理样本还包含未与第三待测物结合的第三酵素标记抗体及/或由第三待测物与第三酵素标记抗体所形成的第三待测物-第三酵素标记抗体复合物。另外,在免疫分析套组的第一薄膜上还设有第三捕捉区域及第三测试区域,且第三捕捉区域位于第三测试区域在第一液体流动路径的上游。第三捕捉区域包含固定于其中的对第三待测物专一的复数个第三种抗体,或固定于其中的对第三酵素标记抗体专一的复数个第三待测物类似物。第三测试区域包含与第三酵素标记抗体相应的复数个第三呈色受质。
在上述实施方式中,第一预处理样本沿着第一液体流动路径流动,且当第三捕捉区域包含固定于其中的对第三待测物专一的第三抗体时,第一预处理样本中的第三待测物-第三酵素标记抗体复合物与第三抗体结合而固定于第三捕捉区域中,且未与第三待测物结合的第三酵素标记抗体于第三测试区域中和些第三呈色受质进行呈色反应。或者是,第一预处理样本沿着第一液体流动路径流动,且当第三捕捉区域包含固定于其中的对该第三酵素标记抗体专一的第三待测物类似物时,第一预处理样本中未与第三待测物结合的第三酵素标记抗体与第三待测物类似物结合而固定于第三捕捉区域中,且第三待测物-第三酵素标记抗体复合物于第三测试区域中和第三呈色受质进行呈色反应。
在根据需要而采用的实施方式中,所述免疫分析套组的第一捕捉区域及第三捕捉区域位于相同的位置。
于可任选的实施方式中,所述免疫分析套组的第一测试区域位于第三捕捉区域在第一液体流动路径中的上游。或者是,在其它可任选的实施方式中,所述免疫分析套组的第三捕捉区域位于第一测试区域在第一液体流动路径中的上游。
根据本发明某些实施方式,所述免疫分析套组所采用的第一酵素标记抗体中的第一酵素及第三酵素标记抗体中的第三酵素为相同的酵素;此时,可搭配使用相同或不同的第一与第三呈色受质。或者是,上述第一酵素与第三酵素为不同的酵素;此时同样可搭配相同或不同的第一与第三呈色受质。
根据本发明某些根据需要而采用的实施方式,可在上述免疫分析套组的第一或第二薄膜上设置对照区域。以设置于第一薄膜上的对照区域为例,其包含与第一酵素标记抗体相应的复数个第一呈色受质,且设于第一捕捉区域位于第一液体流动路径的上游。应当可以想到的是,所述对照区域可以对照垫的形式设于第一薄膜上,或以涂布、转印或喷膜的形式设于第一薄膜表面。
在可任选的实施方式中,所述对照区域以对照垫的形式设于第一薄膜上,且所述第一测试区以第一测试垫的形式设于第一薄膜上。此时,可在对照垫与第一薄膜间设置第一间隔片,并在第一测试垫与第一薄膜间设置第二间隔片。于进一步的实施方式中,可使对照垫的下游端突出于第一间隔片的下游端并与第一薄膜接触,且使测试垫的上游端突出于第二间隔片的上游端并与第一薄膜接触。
根据本发明某些实施方式,所述免疫分析套组为侧向式分析套组。在另一些实施方式中,可将所述分析套组设置为垂直式分析套组。
在根据需要而采用的实施方式中,所述垂直式免疫分析套组除了上文所述的样本预处理部之外,同样包含第一捕捉区与第一测试区。所述第一捕捉区域与第一测试区分别设置为第一捕捉垫与第一测试垫的形式。此外,第一捕捉垫具有相对的第一表面及第二表面,其中第一表面用于接收来自样本预处理部的第一预处理样本,且第二表面与第一捕捉垫相接触,用于界定出由第一捕捉垫至第一测试垫的第一液体流动路径。
在上述实施方式中,第一预处理样本接触第一捕捉垫时,第一预处理样本会沿着第一液体流动路径流动。当第一捕捉区域包含固定于其中的对第一待测物专一的第一抗体时,第一预处理样本中的第一待测物-第一酵素标记抗体复合物与第一抗体结合而固定于第一捕捉区域中,且未与第一待测物结合的第一酵素标记抗体于第一测试区域中和第一呈色受质进行呈色反应。或者是,当第一捕捉区域包含固定于其中的对第一酵素标记抗体专一的第一待测物类似物时,第一预处理样本中未与第一待测物结合的第一酵素标记抗体与第一待测物类似物结合而固定于第一捕捉区域中,且第一待测物-第一酵素标记抗体复合物于第一测试区域中和第一呈色受质进行呈色反应。
在根据上述实施方式的某些垂直式免疫分系套组中,样本预处理部还包括第一接合垫。第一接合垫具有相对的第一表面及第二表面,其中第一接合垫的第一表面用于接收液体样本,且第一接合垫的该第二表面与第一捕捉垫的第一表面相接触。在进一步的可任选的实施方式中,所述垂直式免疫分系套组的样本预处理部还包括样本接收垫。样本接收垫具有相对的第一表面及第二表面,其中样本接收垫的第一表面用于接收液体样本,且样本接收垫的第二表面与第一接合垫的第一表面相接触。同样在进一步的实施方式中,上述垂直式免疫分系套组还包含对照垫。所述对照垫包含与第一酵素标记抗体相应的复数个第一呈色受质,其中对照垫的一表面与第一接合垫的第二表面相接触。
在根据上述实施方式的某些垂直式免疫分系套组中,样本预处理部还包括样本接收垫。样本接收垫具有相对的第一表面及第二表面,其中样本接收垫的第一表面用于接收第一预处理样本,且样本接收垫的第二表面与第一捕捉垫的第一表面相接触。同样在进一步的实施方式中,上述垂直式免疫分系套组还包含对照垫。所述对照垫包含与第一酵素标记抗体相应的复数个第一呈色受质,其中对照垫的一表面与样本接收垫的第二表面相接触。本发明的另一实施例也是一种免疫分析套组,其操作方式简便、感测灵敏度佳,且可用于定性、半定量或定量分析。此种套组同样是通过大于分子间作用力的反应力产生呈色反应,以测定液体样本中是否含有待测物。
根据本发明多种具体实施例,所述免疫分析套组包括样本预处理部、第一捕捉区域以及第一测试区域。样本预处理部用于接收并处理液体样本以得到第一预处理样本。第一捕捉区域用于捕捉第一预处理样本中的至少一种组成物。在第一测试区域中,通过大于分子间作用力的反应力产生一呈色反应,以测定该液体样本中是否有该第一待测物。本发明的又一种实施例是关于一种免疫分析方法,此方法通过大于分子间作用力的反应力产生呈色反应,以测定液体样本中是否含有待测物;因此所述方法不但简便且具有较佳的敏感度。
根据本发明某些具体实施方式,所述免疫分析方法包含以下步骤:(1)使液体样本与复数个第一酵素标记抗体接触,以得到第一预处理样本,其中第一预处理样本包含未与第一待测物结合的第一酵素标记抗体及/或第一待测物-第一酵素标记抗体复合物;(2)使第一预处理样本与固定于第一捕捉区域中的复数个第一抗体或对第一酵素标记抗体专一的复数个第一待测物类似物接触,以使第一预处理样本中的第一待测物-第一酵素标记抗体复合物与第一抗体结合而固定于第一捕捉区域中,或藉使第一预处理样本中的第一酵素标记抗体与第一待测物类似物结合而固定于第一捕捉区域中;以及(3)于步骤(2)之后,使第一预处理样本与位于第一测试区域中的复数个第一呈色受质接触,其中第一呈色受质与第一酵素标记抗体相应,藉使未固定于第一捕捉区域中的第一酵素标记抗体或第一酵素标记抗体于第一测试区域中和第一呈色受质进行呈色反应。
在根据需要而采用的实施例中,上述免疫分析方法还包含以下步骤:比对步骤(3)的呈色反应结果与步骤(4)的呈色反应结果,以定量或半定量液体样本中第一待测物的含量。
同样在根据需要而采用的实施方式中,上述免疫分析方法还包含以下步骤:使用影像撷取装置撷取步骤(3)的呈色反应结果与步骤(4)的呈色反应结果以得到至少一影像信息;以及基于影像信息定量或半定量地计算液体样本中第一待测物的含量。
在根据需要而采用的实施例中,上述免疫分析方法还包含以下步骤:(4)使液体样本与复数个第二酵素标记抗体接触,以得到一第二预处理样本,其中第二预处理样本包含未与第二待测物结合的第二酵素标记抗体及/或由第二待测物与第二酵素标记抗体所形成的第二待测物-第二酵素标记抗体复合物;(5)使第二预处理样本与固定于第二捕捉区域中的复数个第二抗体或对第二酵素标记抗体专一的复数个第二待测物类似物接触,藉使第二预处理样本中的第二待测物-第二酵素标记抗体复合物与第二抗体结合而固定于第二捕捉区域中,或藉使第一预处理样本中的第二酵素标记抗体与第二待测物类似物结合而固定于第二捕捉区域中;(6)于步骤(5)之后,使第二预处理样本与位于第二测试区域中的复数个第二呈色受质接触,其中第二呈色受质与第二酵素标记抗体相应,藉使未固定于第一捕捉区域中的第二酵素标记抗体或第二酵素标记抗体于第二测试区域中和第二呈色受质进行呈色反应;以及(7)通过步骤(3)的呈色结果及/或步骤(6)的呈色结果,决定液体样本中是否有第一待测物及/或第二待测物。
在根据需要而采用的实施方式中,当使用所述免疫分析方法分析两种待测物时,上述步骤(1)与步骤(4)可同时进行。
根据本发明不同的实施方式,所述免疫分析方法中所用的第一酵素标记抗体中的第一酵素及第二酵素标记抗体中的第二酵素为相同的酵素;此时,可搭配使用相同或不同的第一呈色受质与第二呈色受质。
或者是,在其它可任选的实施方式中,所述免疫分析方法所采用的第一酵素与第二酵素为不同的酵素;此时也可搭配使用相同或不同的第一呈色受质与第二呈色受质。
在参阅下文实施方式后,本领域技术人员当可轻易了解本发明的基本精神及其它发明目的,以及本发明所采用的技术手段与实施方式。
附图说明
为让本发明的上述与其它目的、特征、优点与实施例能更明显易懂,所附图式的说明如下:
图1A至图7B为根据本发明不同具体实施方式的免疫分析套组的示意图;
图8为是本发明的免疫分析套组的流程图;
图9A与图9B是根据本发明一实验例所得到的分析结果;以及
图10是根据本发明另一实验例所得到的分析结果。
根据惯常的作业方式,图中各种特征与组件并未依比例绘制,其绘制方式是为了以最佳的方式呈现与本发明相关的具体特征与组件。此外,在不同图式间,以相同或相似的组件符号来表示相似的组件/部件。
具体实施方式
为了使本发明内容的叙述更加详尽与完备,下文针对了本发明的实施方式与具体实施例提出了说明性的描述;但这并非实施或运用本发明具体实施例的唯一形式。实施方式中涵盖了多个具体实施例的特征以及用于建构与操作这些具体实施例的方法步骤与其顺序。然而,也可利用其它具体实施例来达成相同或均等的功能与步骤顺序。
除非本说明书另有定义,此处所用的科学与技术词汇的含义与本领域技术人员所理解与惯用的意义相同。此外,在不和上下文冲突的情形下,本说明书所用的单数名词涵盖该名词的复数型;而所用的复数名词时也涵盖该名词的单数型。
虽然用于界定本发明较广范围的数值范围与参数皆是约略的数值,此处已尽可能精确地呈现具体实施例中的相关数值。然而,任何数值本质上不可避免地含有因个别测试方法所致的标准偏差。在此处,「约」通常指实际数值在一特定数值或范围的正负10%、5%、1%或0.5%之内。或者是,「约」一词代表实际数值落在平均值的可接受标准误差之内,根据本领域技术人员的考虑而定。除了实验例之外,或除非另有明确的说明,当可理解此处所用的所有范围、数量、数值与百分比(例如用于描述材料用量、时间长短、温度、操作条件、数量比例及其它相似者)均经过「约」的修饰。因此,除非另有相反的说明,本说明书与附随申请专利范围所揭示的数值参数皆为约略的数值,且可根据需求而改变。至少应将这些数值参数理解为所指出的有效位数与套用一般进位法所得到的数值。在此处,将数值范围表示成由一端点至另一段点或介于二端点之间;除非另有说明,此处所述的数值范围皆包含端点。
于本发明内容中,「液体样本」指任何可能带有目标待测物的液体。所述液体样本可以是取自人体或其它动物的体液,譬如尿液、血液、汗液、淋巴液、腹膜内液、粗组织提取物或均质物。或者是,所述液体样本也可以是非生物流体,例如取自环境(如河、湖)的水、或在实验室中制备、使用的溶液。
「待测物」一词包括欲侦测的分子或化合物,这些分子或化合物可以是天然或人工合成的,且所述分子或化合物可和至少一种抗体专一结合。举例来说,待测物可以是药物、荷尔蒙、酵素、生长因子、抗原、半抗原(hapten)、缺辅基蛋白(apoprotein)、凝集蛋白(lectin)、辅因子(cofactor)或其它多肽。
于本案中,「流体连通」指流体(如,液体样本)可由系统内的一结构或组件移动至另一结构或组件。应当可以想到的是,彼此间形成流体连通的结构或组件不一定是彼此相连的结构。流体在系统内移动的路径即为「流动路径」;而流动路径的「上游」系指位于与流体在流动路径中行进方向相反的方向,流动路径的「下游」则是指位于与流体在流动路径中行进方向相同的方向。
在既有的免疫分析平台中,大多透过抗体与抗原间基于分子间作用力(intermolecular forces)的结合与疏水性作用(hydrophobic interaction)来达到呈色效果。分子间作用力又称凡得瓦尔力(van der Waals forces),此种作用力的强度通常低于离子键与共价键的强度。正因如此,现有免疫分析平台的感测灵敏度通常较低;也即需要样本中存有较高浓度的待测物,才能有效侦测。
相较之下,本发明的多种实施方式提出了新颖的免疫分析套组设计,其特点之一在于通过大于分子间作用力的反应力产生呈色反应(如,酵素催化的化学呈色反应),以测定液体样本中是否含有待测物。
根据一些实施方式,此一免疫分析套组包含样本预处理部、捕捉区域与测试区域。在样本预处理部中,使液体样本和酵素标记抗体混合,当液体样本中待测物的量低于酵素标记抗体量时,经预处理的样本中含有游离的酵素标记抗体(即,未与待测物形成复合体者),当液体样本中带有待测物时,待测物会和酵素标记抗体专一结合;接着使经过预处理的样本进入捕捉区域,捕捉区域经设计可捕捉待测物-酵素标记抗体复合体或是游离的酵素标记抗体,以改变样本中酵素标记抗体的浓度;之后,在测试区域中,通过酵素催化的化学反应达到呈色的效果。本发明所采用的此种化学反应结合,相较于现有技术使用的分子间作用力,能够实现较高的感测灵敏度。此外,通过调整套组内酵素标记抗体与呈色受质间的浓度比,可以控制测试区域中呈色反应的程度,以达到理想的检测效果。如此一来,可通过测试区域颜色的变化,定性分析样本中待测物的存在与否,甚至可通过和标准色卡或套组内对照(on-chip reference)的比较以半定量或定量地分析样本中待测物的含量。
在不同实施方式中,本发明所提出的免疫分析套组可采用侧向式或垂直式结构。此外,也可根据需要,将免疫分析套组实作为三明治型(sandwich-type)或竞争型(competitive)分析套组。
下文提出多个实施例来说明本发明的某些实施方式,以利本领域技术人员实施本发明,且不应将这些实施例视为对本发明范围的限制。据信本领域技术人员在阅读了此处提出的说明后,可在不需过度解读的情形下,完整利用并实践本发明。当可理解,根据本发明不同实施例与实施方式的免疫分析套组可能含有相同或相似的组件;在以下的说明中,可能省略某些相同或相似组件的结构、功能或作用的描述。因此,在不和上下文冲突的前提下,针对一实施例或一图式所描述的结构、功能或其作动关系,也适用于其它实施例或图式。
图1A为根据本发明一具体实施例的免疫分析套组100A。如图所示,免疫分析套组100A是一种侧向式免疫分析套组,其包括样本预处理部(图中未绘示)与本体105。
免疫分析套组100A的样本预处理部包含复数个第一酵素标记抗体,且可用于接收并处理液体样本以得到第一预处理样本。根据某些根据需要而采用的实施例,样本预处理部可独立于本体105之外。譬如说,在取得液体样本之后,可先于适当容器(如,采样容器或其它容器)内使液体样本与对第一待测物专一的第一酵素标记抗体混合;如此一来,当液体样本中带有第一待测物时,第一待测物会和第一酵素标记抗体专一结合而形成复合物(以下称为第一待测物-第一酵素标记抗体复合物)。在替代性的实施例中,也可将样本预处理部设于本体105上,譬如图2A至图6所示的各种免疫分析套组。
为了方便说明,此处将经过样本预处理部处理后的液体样本称为第一预处理样本。在设计免疫分析套组时,可视情形调整样本预处理部中所含的第一酵素标记抗体的浓度或含量,以使得所述第一预处理样本含有未与第一待测物结合的第一酵素标记抗体(下文也称为游离第一酵素标记抗体)。此外,应当可以想到的是,若液体样本中包含第一待测物,第一预处理样本也会包含第一待测物-第一酵素标记抗体复合物。因此,在不同实施方式中,第一预处理样本可能仅含游离第一酵素标记抗体(此时样本中不含第一待测物)、仅含第一待测物-第一酵素标记抗体复合物(此时样本中第一待测物含量高于所用的第一酵素标记抗体量)或同时含有游离第一酵素标记抗体与第一待测物-第一酵素标记抗体复合物。以上所述也适用于本发明其它实施例,以及下文所述的第二预处理样本、第三预处理样本或其它预处理样本,下文为求简洁不再赘述。
免疫分析套组100A的本体105上设有第一薄膜110。于本实施例中,第一薄膜110上设有第一捕捉区域112及第一测试区域(于本实施例中采用第一测试垫114)。根据本发明的原理与精神,利用免疫分析套组100A进行免疫分析时,使第一预处理样本接触第一薄膜110,譬如,可将第一预处理样本倾注至第一薄膜110中的第一捕捉区域112中,或倾注到位于第一捕捉区域112上游的位置。此时液体样本会从第一捕捉区域112流动到第一测试垫114,此处将上述流动路径称为第一液体流动路径D1。另外,于本说明书中,在说明组件之间的设置关系时,也可称第一捕捉区域112位于第一测试垫114(在第一液体流动路径D1)的上游。如图1A所示,第一捕捉区域112并未和第一测试垫114紧密相邻,两者以一适当的距离彼此间隔;然本发明不限于此,在合适的情形中,第一捕捉区域112也可和第一测试垫114紧密相邻。
当可理解,为了实现在第一液体流动路径D1上的液体流动(譬如,通过毛细现象而流动),应选择可允许液体流动的材质来制备第一薄膜110。此外,由于第一薄膜110上设有多种功能性区域,第一薄膜110的材质也应可容许将特定试剂固定或包含于指定的功能区域中。譬如,第一薄膜110可以是多孔性试纸。
于某些实施方式中,免疫分析套组100A为一般所称的三明治型免疫分析套组。此时,第一捕捉区域112中包含复数个第一抗体,这些第一抗体可和第一待测物专一结合。如此一来,当第一预处理样本进入第一捕捉区域112时,第一预处理样本中的第一待测物-第一酵素标记抗体复合物(如果有的话)会和第一抗体结合而形成由第一酵素标记抗体与第一抗体将第一待测物夹设于其中的三明治结构。由于第一抗体固设在第一捕捉区域112中,且其用量经过设计使得第一预处理样本中大部分(如果不是全部的话)的第一待测物-第一酵素标记抗体复合物会因此固定在第一捕捉区域112中。接着,第一预处理样本会沿着第一液体流动路径D1移动到第一测试垫114,其中含有复数个第一呈色受质,所述第一呈色受质与第一酵素标记抗体中的第一酵素相应,可在第一酵素的催化下进行呈色反应。一般来说,在此种三明治型免疫分析套组中,当样本预处理部在开始分析前所含的第一酵素标记抗体量不变时,第一测试垫114中的呈色反应越剧烈,代表第一预处理样本中所含的游离第一酵素标记抗体越多,同时也代表液体样本中第一待测物越少。换句话说,在三明治型免疫分析套组中,第一测试垫114中颜色越浓,液体样本中第一待测含量物越低;反之,第一测试垫114中颜色越淡,液体样本中第一待测物含量越高。
应理解到,此处所述的第一抗体以及第一酵素标记抗体虽然都可和第一待测物专一结合,但第一待测物可供这两种抗体专一辨识的抗原决定位(epitope)应不相同;如此一来,在样本预处理部中所形成的第一待测物-第一酵素标记抗体复合物才能被第一抗体捕捉并固定。因此,第一抗体以及第一酵素标记抗体中的抗体部分可以来自不同的抗体,或来自同一抗体的不同互补位(paratope)。
于另一些实施方式中,免疫分析套组100A为一般所称的竞争型免疫分析套组。此时,第一捕捉区域112中包含复数个第一待测物类似物,这些第一待测物类似物也可和第一酵素标记抗体专一结合,故第一待测物和第一待测物类似物会彼此竞争与第一酵素标记抗体结合的机会。因此,当第一预处理样本进入第一捕捉区域112时,第一预处理样本中的游离第一酵素标记抗体就会和第一待测物类似物结合,进而被固定在第一捕捉区域112中。第一捕捉区域112内第一待测物类似物的含量可经过设计,藉使第一预处理样本中绝大多数(或全部)的游离第一酵素标记抗体会被固定在第一捕捉区域112中,而使得离开第一捕捉区域112的第一预处理样本中不含或可能仅含少量的游离第一酵素标记抗体。在竞争型免疫分析套组中,第一测试垫114内同样含有复数个第一呈色受质。如此一来,当第一预处理样本进入第一测试垫114中之后,第一预处理样本内的第一待测物-第一酵素标记抗体复合物(如果有的话)中的第一酵素可催化第一呈色受质的呈色反应。一般来说,在此种竞争型免疫分析套组中,当样本预处理部在开始分析前所含的第一酵素标记抗体量不变时,第一测试垫114中的呈色反应越剧烈,代表第一预处理样本中所含的第一待测物-第一酵素标记抗体复合物越多。换句话说,在竞争型免疫分析套组中,第一测试垫114中颜色越浓,液体样本中第一待测含量物越高;反之,第一测试垫114中颜色越淡,液体样本中第一待测物含量越低。
在运用竞争型架构时,所用的第一待测物类似物和第一待测物会竞争第一酵素标记抗体中的互补位,譬如,两者的互补位相同、重迭,或会彼此影响。如此一来,仅有游离的第一酵素标记抗体可和第一待测物类似物专一结合,而第一待测物-第一酵素标记抗体复合物中的抗体部分就无法与第一待测物类似物相结合。
不论是采用竞争型或三明治型的设计方式,使用者在使用本案所提出的免疫分析套组100A时,都可通过第一测试垫114所呈现的颜色,来判断第一样本中是否含有第一待测物。此外,若搭配使用标准色卡,使用者还可以透过比对第一测试垫114所呈现的颜色与色卡的颜色,对液体样本中的第一待测物进行半定量分析。
在图1A所示的免疫分析套组100A中,所述第一测试区域系以测试垫114的形式设于该第一薄膜110上。在此种实施方式中,测试垫114的亲水性较佳应高于第一薄膜110的亲水性,以使得测试垫114中第一酵素的浓度不会受到样本持续侧向流动的影响而改变,进而维持测试垫114中呈色反应的稳定性。
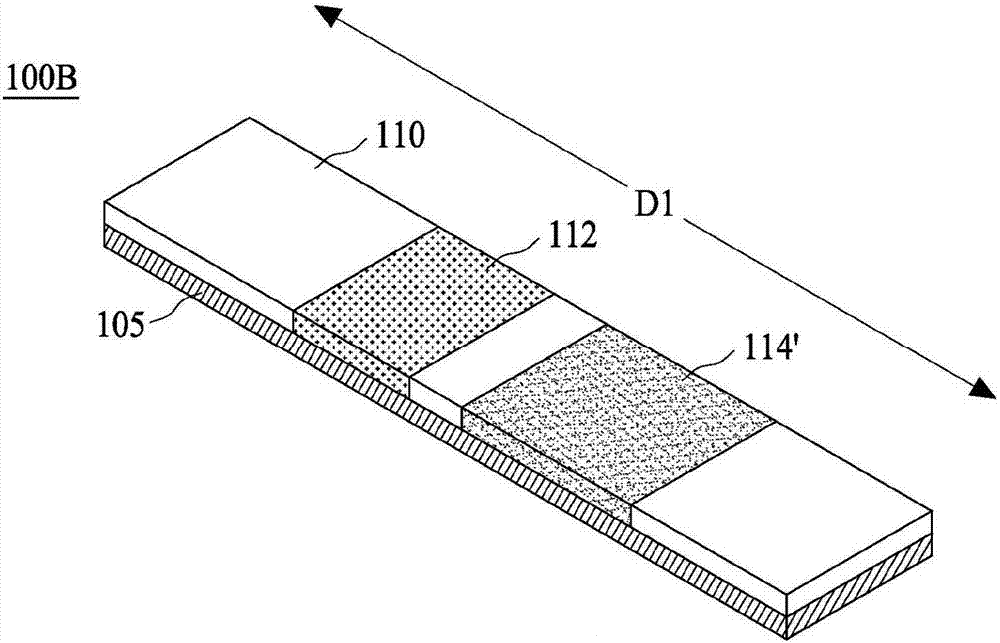
图1B揭示一种替代性的免疫分析套组100B,其与图1A所所示的免疫分析套组100A最主要的差异在于第一测试区域并非以测试垫的形式设于第一薄膜110上;反之,免疫分析套组100B的第一测试区域114’是以涂布、转印或喷膜的形式设于第一薄膜110表面。
图1C绘示另一种替代性的免疫分析套组100C,其与图1A所示的免疫分析套组100A最主要的差异在于第一测试垫114和第一薄膜110间还设有间隔片115,以降低样本流动时,测试垫114中液体回渗至下方的第一薄膜110内。另一方面,间隔片115也有利于维持试垫114中第一酵素的浓度,进而维持测试垫114中呈色反应的稳定性。具体来说,第一测试垫114的上游端和第一薄膜110直接接触,以利吸收来自捕捉区域112的第一预处理样本。如图1C所示,间隔片115的下游端可相较于测试垫114的下游端略微突出;然本发明不限于此,间隔片115与测试垫114的下游端可相互齐平,或者是测试垫114的下游端可突出于间隔片115的下游端,甚至与第一薄膜110相接触。间隔片115与测试垫114和/或第一薄膜110相接触的表面的一部或全部可具有黏着性(譬如可使用胶带或双面胶带),以利固定间隔片115的位置。也可在第一薄膜110上表面或测试垫114下表面的一部分上涂布防水材料,以作为间隔片115。
图1A至1C所绘示的各种免疫分析套组是根据本发明实施态样较为基本的例示性结构,基于上文所述的组件结构、功能与作用,可进一步发展成其它较为复杂的实施例。
以图2A所示的免疫分析套组200A为例,图中所绘示的本体205、第一薄膜210、第一捕捉区域212与第一测试垫214大致上和图1A所示的本体105、第一薄膜110、第一捕捉区域112与第一测试垫114相同。然而,免疫分析套组200A在第一测试垫214于第一液体流动路径D1的下游设有第一吸收垫250;位于该第一液体流动路径中的最下游并与该第一薄膜相接触,以吸收多余的液体。虽然图2A所示的第一吸收垫250位于第一液体流动路径D1的最下游,但本发明不限于此。同样地,图2B与图2C所绘示的免疫分析套组200B、200B也都分别设有第一吸收垫250。
图2A至2C图所示的各种免疫分析套组和图1A至1C所示免疫分析套组的另一个不同在于样本预处理部的至少一部分也设于本体205上。
以图2A为例,分析套组200A的样本预处理部包含第一接合垫216,其至少一部分设于第一薄膜210上,且位于第一捕捉区域212在第一液体流动路径D1中的上游。第一接合垫216中包含第一酵素标记抗体,因此当将液体样本倾注至第一接合垫上时,可使液体样本与第一酵素标记抗体接触,进而产生所述的第一预处理样本。而后,第一预处理样本可在第一薄膜210中沿着第一液体流动路径D1依序前进至第一捕捉区域212与第一测试垫214;第一预处理样本在第一捕捉区域212与第一测试垫214内所进行的反应,如上文参照图1A所述。
根据本发明另一种实施例,分析套组200B的样本预处理部包含样本接收垫218,如图2B所示。样本接收垫218的至少一部分设于第一薄膜210上,且位于第一捕捉区域212在第一液体流动路径D1中的上游。由于样本接收垫218中不含第一酵素标记抗体,因此在此种实施例中,可在容器中使液体样本与第一酵素标记抗体混合,以得到第一预处理样本,而后再将第一预处理样本倾注至样本接收垫218上,进而使得第一预处理样本在第一薄膜210中沿着第一液体流动路径D1依序前进至第一捕捉区域212与第一测试垫214。于根据需要而采用的实施例中,样本接收垫218为多孔结构,可用于过滤血球使得血球阻挡于样本接收垫218内,防止血球干扰呈色反应。
在图2C绘示的又另一种实施例中,分析套组200B的样本预处理部包含第一接合垫216与样本接收垫218。此时,第一接合垫216的至少一部分设于第一薄膜210上,而样本接收垫218的至少一部分则设于第一接合垫216上,且在第一液体流动路径D1中,从上游到下游的排列顺序为样本接收垫218、第一接合垫216、第一捕捉区域212与第一测试垫214。在本实施例中,可将液体样本倾注至样本接收垫218中,而后液体样本沿着第一液体流动路径D1前进到第一接合垫216,并在该处和第一酵素标记抗体接触而形成第一预处理样本;接着第一预处理样本可依序前进至第一捕捉区域212与第一测试垫214。
应当可以想到的是,虽然此处将第一测试区域绘示为第一测试垫214的形式,但2A至2C图所示的各种免疫分析套组也可将第一测试区域实作为图1B所示的涂布区域(图中未绘示);或者是第一测试垫214与第一薄膜210间也可设有上文所述的间隔片(图中未绘示)。
在另一些根据需要而采用的实施例中,本发明内容所提出的免疫套组还可设有一对照区域(或对照垫);如此一来,使用者可通过比对测试区域与对照区域的呈色结果,对待测物进行定性、半定量或定量分析。
图3A所示的免疫分析套组300A与图2C所示的免疫分析套组200C大致相同,最主要的差异在于免疫分析套组300A还包含一对照垫360。对照垫360和第一测试垫314同样包含多个第一呈色受质,但对照垫360设于第一捕捉区域312在第一液体流动路径D1的上游。如此一来,当对照垫360接收到来自样本预处理部(如,样本接收垫318与第一接合垫316)的第一预处理样本时,第一预处理样本中来自第一待测物-第一酵素标记抗体复合物以及游离第一酵素标记抗体两者的第一酵素都会催化对照垫360中的第一呈色受质使其进行呈色反应。
接着,第一预处理样本会顺着第一液体流动路径D1前进到第一捕捉区域312,此时,第一预处理样本中部分的第一酵素(第一待测物-第一酵素标记抗体复合物或游离第一酵素标记抗体,取决于免疫分析套组为竞争型或三明治型套组)可能会被固定在第一捕捉区域312内,因此使得离开第一捕捉区域312进入第一测试垫314的第一预处理样本中的第一酵素含量改变。本领域技术人员当可明白,若采用三明治型设计,且液体样本中不含第一待测物时,则离开第一捕捉区域312的第一预处理样本中第一酵素含量不会改变;下文为求简洁,在述及样本中酵素含量改变时,并未排除此种情形。
应当可以想到的是,当对照垫360和第一测试垫314内的第一酵素含量不同时,两者呈色反应的结果也会不同;因此,可通过比较对照垫360和第一测试垫314所呈现的颜色,来判定液体样本中是否含有第一待测物。另一方面,也可通过比较对照垫360和/或第一测试垫314与标准色卡的颜色,对第一待测物做半定量分析。更有甚者,可透过影像撷取装置(如:相机、数字相机、网络摄影机、智能型手机…等)取得对照垫360和第一测试垫314的影像,而后利用具备信息计算能力的处理装置(如:桌上型计算机、膝上型计算机、智能型手机、分析设备…等)分析两者颜色的差异,并对第一待测物进行定性分析。在本实施方式中,使用对照垫360的呈色结果作为套组内的对照信息,可进一步提升免疫分析的准确度。
如图所示,免疫分析套组300A的预处理部包含样本接收垫318与第一接合垫316;然而,本发明不限于此。于不同的实施例中,免疫分析套组300A的预处理部可独立于本体305之外;此时,使用者可在其它容器中处理液体样本以得到预处理样本,并将预处理样本倾注至对照垫360上或其上游的位置。又或者是,免疫分析套组300A的预处理部可仅包含第一接合垫316或样本接收垫318其中之一,此时预处理部的结构与作用分别类似上文参照图2A或2B所示。
图3A所示的免疫分析套组300A还包括吸收垫350,其设置位置与作用如上文所述。然而,免疫分析套组300A也可不含吸收垫350。
图3B绘示根据本发明某些实施方式的免疫分析套组300B的部分结构。免疫分析套组300B的结构大致上与免疫分析套组300A相似,不同之处在于第一测试垫314与第一薄膜310间设有间隔片315;且对照垫360与第一薄膜310间也设有间隔片365。所述间隔片315、365可用于防止回渗并保持第一测试垫314及对照垫360内第一酵素的浓度。如图所示,于本实施例中,对照垫360的下游端突出于间隔片365的下游端而与第一薄膜310接触;另一方面,第一测试垫314的上游端则突出于间隔片315的上游端并与第一薄膜310接触;如此一来,对照垫360与第一测试垫314可以在较为接近的时间点吸收来自第一薄膜310的第一预处理样本,以缩短对照垫360与第一测试垫314的反应时间差。或者是,在根据需要而采用的实施方式中,可以调整对照垫360与第一薄膜310接触的面积以及第一测试垫314与第一薄膜310接触的面积,以改变两者吸收第一预处理样本的速度,进而使对照垫360与第一测试垫314的反应时间趋于一致。
虽然图3B所绘示的免疫分析套组300B具有两个间隔片315、365,但本领域技术人员应当可以想到的是,也可仅在对照垫360与第一薄膜310间设置间隔片365;或仅在第一测试垫314与第一薄膜310间设置间隔片315。
除此之外,也可不将对照区域设置为对照垫360。举例来说,在图3C所示的免疫分析套组300C中,采用涂布、转印或喷膜的形式,将第一呈色受质涂布于第一薄膜310的表面,以形成对照区域360’。此种对照区域360’所执行的功能与效果大致上和对照垫360相近。当可理解,也可将此处所述的对照垫360或对照区域360’运用于本案所述的其它例示性免疫分析套组中。
本发明所提出的免疫分析套组也可用于分析两种以上的待测物。图4A所示的免疫分析套组400A即为一例。分析套组400A与图2C所示的免疫分析套组200C大致相同,最主要的差异在于免疫分析套组400A还包含了第二捕捉区域422与第二测试垫424。
当液体样本中可能含有两种待测物时,样本预处理部除了上文所述的对第一种待测物专一的第一酵素标记抗体之外,还包含对第二待测物专一的第二酵素标记抗体。以图4A为例,可将第一酵素标记抗体与第二酵素标记抗体设于第一接合垫416中。在替代性的实施方式中,第一接合垫416可能仅含一种酵素标记抗体(如,第一酵素标记抗体),而使用者可以在其它容器中先使液体样本与另一种酵素标记抗体(如,第二酵素标记抗体)混合,而后再使液体样本接触第一接合垫416。又或者是,免疫分析套组上并未设置第一接合垫416,此时,使用者可在其它容器中使液体样本同时或先后与第一酵素标记抗体及第二酵素标记抗体混合。
不论采用何种配置或操作方式,液体样本经样本预处理部处理后,所形成的第一预处理样本中包含以下一或多种成分:游离第一酵素标记抗体、第一待测物-第一酵素标记抗体复合物、游离第二酵素标记抗体以及第二待测物-第二酵素标记抗体复合物。此种第一预处理样本会顺着第一液体流动路径D1的方向前进。
如图4A所示,第一预处理样本会先流经第一捕捉区域412,此时第一预处理样本中第一酵素的含量会改变;接着在第一测试垫414中,第一呈色受质会在第一酵素的催化下进行呈色反应。
其后,第一预处理样本会前进到第二捕捉区域422。第二捕捉区域422中可固设有复数个第二抗体(三明治型)或复数个第二待测物类似物(竞争型)。由于第二抗体对第二待测物专一,第一预处理样本中的第二待测物-第二酵素标记抗体复合物(如果有的话)会被第二抗体捕捉而固定在第二捕捉区域422内。一方面,第二待测物类似物可和第二酵素标记抗体专一结合;因此第一预处理样本中的游离第二酵素标记抗体会被第二待测物类似物捕捉而固定在第二捕捉区域422内。不论采用哪一种方式,当第一预处理样本离开第二捕捉区域422时,其中的第二酵素含量会改变。接下来,第一预处理样本进入第二测试垫424中,且第二呈色受质会在第二酵素的催化下进行呈色反应。
上文所述的配置方式,仅是实现测试两种待测物的一种例示性实施例;根据本发明的原理与精神,不一定要将第二捕捉区域422与第二测试垫424都放在第一测试垫414下游。举例来说,在图4B所示的免疫分析套组400B中,将第一捕捉区域412与第二捕捉区域422设在第一测试垫414与第二测试垫424的上游。在此种情形中,是先分别改变第一预处理样本中第一酵素与第二酵素的含量之后,才分别使其在不同的测试垫中催化各自的呈色反应。
同样地,在第一测试垫414或第二测试垫424和第一薄膜410间也可设有间隔片,如上文参照图1C所述。除此之外,也可不将第一或第二测试区域设置为第一测试垫414或第二测试垫424。举例来说,可采用涂布、转印或喷膜的形式,将第一呈色受质涂布于第一薄膜410的表面,以形成第一或第二测试区域(图中未绘示)。或者是,可采用一个测试垫与一个测试区域(图中未绘示)。此种测试区域所执行的功能与效果大致上和测试垫相近。
图4A所示的免疫分析套组400A还包括吸收垫450,其设置位置与作用如上文所述。然而,免疫分析套组400A也可不含吸收垫450。
应当可以想到的是,图4B所示的第一捕捉区域412与第二捕捉区域422的位置可以互换,而第一测试垫414与第二测试垫424的位置也可以互换。不论如何配置,只要第一捕捉区域412位于第一测试垫414在第一液体流动路径D1的上游,且第二捕捉区域位422于第二测试垫424在第一液体流动路径D1的上游即可。
又或者是,可将第一捕捉区域及第二捕捉区域设于相同的位置(图中未绘示)。也即,在同一个捕捉区域中同时固设有第一与第二抗体(三明治型)或第一与第二待测物类似物(竞争型)。在此种情形中,单一捕捉区域同时改变第一预处理样本中第一酵素与第二酵素的含量,接着再分别使其进入不同的测试区域中催化各自的呈色反应。
本领域技术人员当可理解,本领域已有多种酵素可用于催化呈色受质的反应。此外,同一种酵素可用于催化多种呈色受质的呈色反应,而同一种呈色受质也可能受到多种酵素的催化而进行呈色反应。当运用本案提出的免疫分析来分析多种待测物时,可视情形选择酵素与呈色受质的种类,并根据呈色结果来判断样本中是否带有第一或第二待测物。举例来说,在免疫分析套组400A中,第一酵素与第二酵素可以是相同的酵素,此时可搭配使用相同或不同的第一与第二呈色受质;如此一来,就可通过比较第一测试区域(或测试垫,以下也相同)与第二测试区域颜色的深浅,来判断通过的第一或第二酵素浓度是否改变,以此得知样本中是否带有第一或第二待测物。另外,免疫分析套组400A也可使用不同的第一酵素与第二酵素;在此种情形中,可搭配使用相同的呈色受质,以透过不同测试区域的颜色深浅来进行判断;或可搭配不同颜色的呈色受质,以透过不同测试区域各自的颜色来进行判断。又或者是,在免疫分析套组400B中,可使用不同的第一与第二酵素,并搭配不同的第一与第二呈色受质,以透过不同测试区域各自的颜色来判断样本中是否带有第一或第二待测物。
在根据需要而采用的实施例中,也可将一或多个对照垫或对照区域设于免疫分析套组400A、400B的第一捕捉区域412及/或第二捕捉区域422的上游。
图4A、4B所示的免疫分析套组是在单一液体流动路径D1中测定两种待测物,然本发明不限于此。以图5A所示的免疫分析套组500A为例,此实施例将两组测试区域设于样本接收垫518的两侧,通过样本在不同方向的侧向层析流动来执行此处提出的免疫分析流程。
在免疫分析套组500A的本体505上设有样本接收垫518,在样本接收垫于本体505纵长方向上的两侧,各设有第一薄膜510及第二薄膜520,且样本接收垫518两端分别设于第一薄膜510及第二薄膜520上。在第一薄膜510所界定出的第一液体流动路径D1中,从上游到下游分别设有第一捕捉区域512、第一测试垫514以及第一吸收垫550;相似地,在第二薄膜520所界定出的第二液体流动路径D2中,从上游到下游分别设有第二捕捉区域522、第二测试垫524以及第二吸收垫570。
在使用免疫分析套组500A时,由于样本预处理部中仅有样本接收垫518设于本体505上,使用者可先于同一或不同容器中先后或同时使液体样本和第一酵素标记抗体、第二酵素标记抗体接触,以分别得到第一预处理样本与第二预处理样本或两者的混合物。上述第一预处理样本包含游离第一酵素标记抗体及/或第一待测物-第一酵素标记抗体复合物;而第二预处理样本包含游离第二酵素标记抗体及/或第二待测物-第二酵素标记抗体复合物。
于某些实施方式中,第一酵素与第二酵素为相同的酵素,并搭配不同的抗体而得到第一酵素标记抗体与第二酵素标记抗体,而第一测试垫514、第二测试垫524分别带有可受第一酵素/第二酵素催化的第一与第二呈色受质(两者可以相同或不同),以利进行呈色反应。于另一些实施方式中,采用不同的第一酵素与第二酵素,并搭配使用仅可受其中一种酵素催化而进行呈色反应的受质,以利区别两种待测物。
之后,将第一预处理样本与第二预处理样本或两者的混合物倾注至样本接收垫518上,此时部分样本会沿着第一液体流动路径D1流动,而另一部份则沿着第二液体流动路径D2流动。
以下为了方便说明,将沿着第一液体流动路径D1的移动的样本称为第一预处理样本;但应当可以想到的是,此一第一预处理样本中除了游离第一酵素标记抗体以及第一待测物-第一酵素标记抗体复合物之外,还可能包含游离第二酵素标记抗体以及第二待测物-第二酵素标记抗体复合物。在第一液体流动路径D1中的第一捕捉区域512与第一测试垫514是针对第一待测物及/或第一酵素标记抗体所设计,因此第一预处理样本流经第一捕捉区域512后,其内第一酵素的含量改变,并可通过第一测试垫514中呈色反应的结果,来判断液体样本中是否带有第一待测物。
另一方面,沿着第二液体流动路径D2的移动的样本称为第二预处理样本;同样地,此种第二预处理样本中除了游离第二酵素标记抗体以及第二待测物-第二酵素标记抗体复合物之外,也可能包含游离第一酵素标记抗体以及第一待测物-第一酵素标记抗体复合物。第二液体流动路径D2中的第二捕捉区域522与第二测试垫524是针对第二待测物和/或第二酵素标记抗体所设计,因此第二预处理样本流经第二捕捉区域522后,其内第二酵素的含量改变,并可通过第二测试垫524中呈色反应的结果,来判断液体样本中是否带有第二待测物。
于本实施例中,也可在第一捕捉区域512于第一液体流动路径D1的上游设置对照垫或对照区域,以作为套组内对照。
图5B绘示了另一种例示性的免疫分析套组500B,其结构大致上与图5A所示的免疫分析套组500A相同,最主要的差异在于第一预处理部还包含设于本体505上的第一接合垫516以及第二接合垫526;第一接合垫516及第二接合垫526分别设于样本接收垫518两端,且第一接合垫516及第二接合垫526分别有一端设于第一薄膜510及第二薄膜520上。于此种实施例中,使用者可将液体样本倾住于样本接收垫518上,而后部分液体样本沿着第一液体流动路径D1流入第一接合垫516,另一部份则沿着第二液体流动路径D2流入第二接合垫526。
进入第一接合垫516的液体样本和其中的第一酵素标记抗体接触后,会形成第一预处理样本,其中至少包含游离的第一酵素标记抗体及/或第一待测物-第一酵素标记抗体复合物。当可理解,当液体样本中含有第二待测物时,第一预处理样本也可能包含第二待测物,但其存在不影响后续对第一待测物的分析。
其后,第一预处理样本会沿着第一液体流动路径D1进入第一捕捉区域512,并视其为采用三明治型或竞争型设计,而将第一待测物-第一酵素标记抗体复合物或第一酵素标记抗体固定于第一捕捉区域512中,进而改变离开第一捕捉区域512进入第一测试垫514的第一预处理样本中第一酵素的含量,并使第一酵素在第一测试垫514中催化第一层色受质的呈色反应,以利判断液体样本中是否含有第一待测物。
另一方面,沿着第二液体流动路径D2流入第二接合垫526的液体样本则会在该处和其中的第二酵素标记抗体接触,以形成第二预处理样本,其中至少包含游离的第二酵素标记抗体和/或第二待测物-第二酵素标记抗体复合物。当可理解,当液体样本中含有第一待测物时,第二预处理样本也可能包含第一待测物,但其存在不影响后续对第二待测物的分析。
接着,第二预处理样本会沿着第二液体流动路径D2进入第二捕捉区域522,并视其为采用三明治型或竞争型设计,而将第二待测物-第二酵素标记抗体复合物或第二酵素标记抗体固定于第二捕捉区域522中,进而改变离开第二捕捉区域522进入第二测试垫524的第二预处理样本中第二酵素的含量,并使第二酵素在第二测试垫524中催化第二层色受质的呈色反应,以利判断液体样本中是否含有第二待测物。
图5C绘示了另一种替代性的实施方式,图中所示的免疫分析套组500C结构大致上与图5A所示的免疫分析套组500A相同,最主要的差异在于以设于本体505上的接合垫516’取代样本接收垫518。于本实施例中,接合垫516’于本体505纵长方向上的两侧各设有第一薄膜510及第二薄膜520,且接合垫516’的两端分别设于第一薄膜510及第二薄膜520上。
此一接合垫516’内包含第一酵素标记抗体及第二酵素标记抗体,因此当将液体样本倾注至接合垫516’上时,所形成的预处理样本会带有以下一或多种成分:游离第一酵素标记抗体、第一待测物-第一酵素标记抗体复合物、游离第二酵素标记抗体、第二待测物-第二酵素标记抗体复合物。上述预处理样本有部分会沿着第一液体流动路径D1流动(以下称为第一预处理样本),而另一部份则沿着第二液体流动路径D2流动(以下称为第二预处理样本)。第一与第二预处理样本在第一与第二液体流动路径D1、D2中会进行的作用与上文参照图5A所述相同,此不再赘述。
根据本发明的原理与精神,所述的免疫分析套组还可以用来检测三种以上的待测物。当使用如图4A、4B所绘示的单向式免疫分析套组时,可在第一液体流动路径D1上设置第三或更多种捕捉区域,并相应地设置第三或更多种测试垫/测试区域。另外,当使用如图5A至5C所绘示的双向式免疫分析套组时,也可在任一液体流动路径中设置两组以上的捕捉区域与测试区域组合。
图6绘示的免疫分析套组600可用于侦测四种待测物。本体605上设有样品接收垫618,样品接收垫618两端分别设于第一接合垫616与第二接合垫626上。第一接合垫616中含有第一酵素标记抗体及第三酵素标记抗体,因此部分液体样本流经第一接合垫616所形成的第一预处理样本包含以下任一种:游离第一酵素标记抗体、第一待测物-第一酵素标记抗体复合物、第三酵素标记抗体及第三待测物-第三酵素标记抗体复合物。
在第一液体流动路径D1中,第一预处理样本流经第一捕捉区域612后,其中的第一酵素含量会改变,且进入第一测试垫614的第一酵素(如果有的话)可催化第一呈色受质使其进行呈色反应。接着,第一预处理样本进入第三捕捉区域632,此时部分第三酵素会被固设于第三捕捉区域632中的第三抗体(三明治型)或第三待测物类似物(竞争型)捕捉而固定于第三捕捉区域632内,进入第三测试垫634的第三酵素(如果有的话)则可催化第三呈色受质使其进行呈色反应。
于本实施方式中,第一酵素与第三酵素可以是相同的酵素,此时应搭配使用相同的第一与第三呈色受质;如此一来,就可通过比较第三测试垫与第三测试区域颜色的深浅,来判断通过的第一或第三酵素浓度是否改变,以此得知样本中是否带有第一或第三待测物。另外,免疫分析套组600也可使用不同的第一酵素与第三酵素;在此种情形中,可搭配使用相同的呈色受质,以透过不同测试区域的颜色深浅来进行判断;或可搭配不同颜色的呈色受质,以透过不同测试区域各自的颜色来进行判断。
应当可以想到的是,也可参考图4B的配置方式,将第一捕捉区域612及第三捕捉区域632皆设于第一测试垫614及第三测试垫634的上游。此时,可使用不同的第一与第三酵素,并搭配不同的第一与第三呈色受质,以透过不同测试区域各自的颜色来判断样本中是否带有第一或第三待测物。
在根据需要而采用的实施方式中,也可将第一与第三捕捉区域设于相同的位置。此时,宜采用不同的第一与第三酵素,并分别搭配仅可受其中一中酵素催化的呈色受质。
另一方面,在第二液体流动路径D2中,第二预处理样本流经第二捕捉区域622后,其中的第二酵素含量会改变,且进入第二测试垫624的第二酵素(如果有的话)可催化第二呈色受质使其进行呈色反应。接着,第二预处理样本进入第四捕捉区域642,此时部分第四酵素会被固设于第四捕捉区域642中的第四抗体(三明治型)或第四待测物类似物(竞争型)捕捉而固定于第四捕捉区域642内,进入第四测试垫644的第四酵素(如果有的话)则可催化第四呈色受质使其进行呈色反应。
相似地,在选用第二酵素、第四酵素以及第二呈色受质、第四呈色受质时,可参考上文针对第一、第三酵素以及第一、第三呈色受质所述方式。另外,于此种双向免疫分析套组中,由于样本中的所有成分皆可沿第一液体流动路径D1与第二液体流动路径D2移动,因此不同流动路径宜选用不同的酵素与呈色受质;详见上文参见图5A所述。
第二、第四捕捉区域622、642与第二、第四测试垫624、644的其它配置方式,请参见上文针对第一、第三捕捉区域612、632与第一、第三测试垫614、634的叙述。
当可理解,在第二液体流动路径中,也可不设置第四捕捉区域642与第四测试垫644,如此即可得到用于测试三种待测物的免疫分析平台。
于本实施例中,在第一液体流动路径D1及第二液体流动路径D2的最下游分别设有可任选的吸收垫650、670。
图7A为根据本发明一具体实施例的免疫分析套组700A。如图所示,免疫分析套组700A是一种垂直式免疫分析套组,其包括,依图中所示方向由上至下:样本接收垫718、第一结合垫716、第一捕捉垫712与第一测试垫714;在此免疫分析套组700A中,液体样本顺着液体流动路径D1移动。
在本实施例中,以样本接收垫718及第一结合垫716作为样本预处理部的一种态样;然本发明不限于此。在其它实施方式中,垂直式免疫分析套组可不含样本接收垫718与第一结合垫716,或仅含其中一者。
样本接收垫718用于接收液体样本,其下表面与第一结合垫716的上表面相接触,以使液体样本沿着液体流动路径进入第一结合垫716内。第一结合垫716中设有第一酵素标记抗体,其与液体样本接触后,可形成第一预处理样本,其中含有游离第一酵素标记抗体及/或第一待测物-第一酵素标记抗体复合物。第一捕捉垫712的上表面与第一结合垫716的下表面相接触,且其中固设有第一抗体(三明治型)或第一待测物类似物(竞争型),故可改变流经第一捕捉垫712的第一预处理样本中第一酵素的含量。之后,第一预处理样本进入带有第一呈色受质的第一测试垫中,并可通过观察呈色反应结果,来判断液体样本中是否带有第一待测物。
图7B绘示了根据本发明另一具体实施例的免疫分析套组700B;相较于图7A所示的免疫分析套组700A,免疫分析套组700B还包含对照垫760,对照垫也设于第一结合垫716的下表面上。于本实施例中,液体样本经过第一结合垫716之后,有部分的第一预处理样本会进入带有第一呈色受质的对照垫760中,因此可通过对照垫的呈色反应结果,得知第一预处理样本中的第一酵素初始浓度与其相应所产生的呈色效果。另一方面,有部分的第一预处理样本会进入第一捕捉垫712中,藉使进入第一测试垫714内的第一预处理样本中的第一酵素浓度不同于第一酵素初始浓度。如此一来,可通过比较对照垫与第一测试垫的呈色反应结果,以定性、半定量或定量地分析样本中第一待测物的含量或浓度。
除了免疫分析套组之外,另一种可用于实施本发明的态样是一种免疫分析方法。根据本发明多种实施例,此一方法运用酵素与呈色受质间的化学反应作为测定手段,相较于现有技术使用抗体与抗原间的分子间作用力,本案所提出的方法能够实现较高的感测灵敏度。此外,通过调整本方法中所使用的酵素标记抗体与呈色受质间的浓度比,可以控制呈色反应的程度,以达到理想的检测效果。因此,根据本发明进一步实施例的免疫分析方法还包括通过比较呈色反应结果和标准色卡或套组内对照,以半定量或定量地分析样本中待测物的含量。
图8的流程图概要地阐述了根据本发明多种实施例的免疫分析方法800。本方法可搭配使用此处提出的免疫分析套组,但也可采用其它可用于实现本方法的免疫分析套组或平台。为了实现此一方法,所用的免疫分析套组至少需包含一薄膜,其上至少设有一或多个捕捉区域、一或多个测试区域或测试垫以及可任选的一或多个对照区域或对照垫。图8绘示了用于实作本发明免疫分析方法的多个步骤,其中可根据需要而采用的步骤以虚线框标示。
步骤S801为样本预处理步骤,在本步骤中,使液体样本与第一酵素标记抗体接触,以得到第一预处理样本。所述第一预处理样本中可包含游离的第一酵素标记抗体、由第一酵素标记抗体和第一待测物所形成的第一待测物-第一酵素标记抗体复合物,或两者的组合。
接着,在根据需要而实现的对照呈色步骤S802中,使第一预处理样本与位于对照区域中的第一呈色受质接触,以使得第一预处理样本中,来自第一待测物-第一酵素标记抗体复合物以及游离第一酵素标记抗体的第一酵素和第一呈色受质进行呈色反应。如此一来,在对照区域中的呈色结果可表示样本中所有第一酵素可催化的呈色反应程度。
其后,在酵素捕捉步骤S805中,第一预处理样本进入第一捕捉区域中。第一捕捉区域内固设有对第一待测物专一的第一抗体(三明治型)或对第一酵素标记抗体专一的复数个第一待测物类似物(竞争型)。如此一来,当第一预处理样本进入第一捕捉区域时,第一预处理样本中的第一待测物-第一酵素标记抗体复合物(三明治型)或游离第一酵素标记抗体(竞争型)会被固定在第一捕捉区域内,进而改变离开第一捕捉区域的第一预处理样本中第一酵素的含量。
在酵素捕捉步骤S805之后,第一预处理样本进入第一呈色区域中,并在该处进行测试步骤S807。具体来说,在步骤S807中,进入第一呈色区域的游离第一酵素(三明治型)或第一待测物-第一酵素标记抗体复合物(竞争型)可催化位于该区域内的第一呈色受质的呈色反应。
根据本发明某些实施例,在S805步骤之后,可通过观察第一呈色区域内呈色反应的结果,判断液体样本中是否带有第一待测物。当使用三明治型架构时,第一测试区域未出现呈色反应代表液体样本中带有第一待测物;而当采用竞争型架构时,第一测试区域出现呈色反应代表液体样本中带有第一待测物。
在根据需要而采用的实施方式中,可进一步比对第一测试区域的呈色结果以及对照区域的呈色结果,以更精确地判定液体样本中是否含有第一待测物。
此外,当使用三明治型架构时,第一测试区域的颜色越浓,液体样本中第一待测含量物越低;反之,第一测试区域的颜色越淡,液体样本中第一待测物含量越高。另一方面,当使用竞争型架构时,第一测试区域的颜色越浓,液体样本中第一待测含量物越高;反之,第一测试区域的颜色越淡,液体样本中第一待测物含量越低。
因此,在某些替代性的实施例中,可基于步骤S807的呈色结果进行半定量分析。譬如,可透过比对第一测试区域的呈色结果与标准色卡,来初步判定液体样本中第一待测物的含量(或浓度)区间。又或者是,可将对照区域与第一测试区域的呈色结果和标准色卡相比较,以初步判定液体样本中第一待测物的含量(或浓度)区间。
在另一些根据需要而实施的例子中,免疫分析方法800会进行到步骤S809,于此步骤中,使用影像撷取装置撷取步骤S803的对照呈色反应结果与步骤S807的测试呈色反应结果,以得到至少一影像信息。
接着,在定量分析步骤S811中,基于步骤S809的影像信息定量或半定量地计算液体样本中第一待测物的含量。举例来说,在步骤S811中可透过运算装置分别将S803的对照呈色反应结果与S807的测试呈色反应结果量化,而后计算两者间相对的比例,再根据样本预处理步骤S801中所用的第一酵素标记抗体的种类与用量、酵素捕捉步骤S805中所使用的第一抗体或第一待测物类似物的种类与用量及/或步骤S803与步骤S807中所用第一呈色受质的种类与用量等信息,计算出液体样本中第一待测物的含量或浓度。
根据某些实施方式,本案提出的免疫分析方法也适用于在一道分析流程中测定两种以上的待测物。
举例来说,根据某些实施方式,可在样本预处理步骤S801之前、之后或同时,使液体样本与第二酵素标记抗体接触,藉使样本中的第二待测物(如果有的话)可和第二酵素标记抗体形成第二待测物-第二酵素标记抗体复合物。以下为了方便说明,将含有游离第二酵素标记抗体及/或第二待测物-第二酵素标记抗体复合物且用于分析第二待测物含量的样本称为第二预处理样本;然而当可理解,在某些实施方式中,第一预处理样本与第二预处理样本是以混合物的形式存在,即使是在可区分第一预处理样本与第二预处理样本的情形中,两者也分别可能包含来自另外一者的某些成分。
之后,依序对第二预处理样本进行第二酵素捕捉步骤与第二测试呈色步骤;也即,使第二预处理样本通过设于一薄膜上的第二捕捉区域,以使第二预处理样本中第二酵素的浓度改变,再使第二预处理样本通过第二呈色区域以利第二酵素催化第二呈色受质的呈色反应,并根据需要进行后续定性、半定量或定量分析(详见上文针对步骤S801至S811所述)。
于不同实施方式中,酵素捕捉步骤S805和第二酵素捕捉步骤可同时进行或先后进行。此外,也可在完成酵素捕捉步骤S805和第二酵素捕捉步骤后,再进行测试呈色步骤S807与第二测试呈色步骤。另外,在进行第二酵素捕捉步骤之前,也可根据需要进行第二对照呈色步骤。
当根据此处提出的免疫分析方法测定二或更多种待测物时,选用各种试剂的考虑如上文针对免疫分析套组所述。
目前已知有多种酵素可用于催化呈色受质的呈色反应,包括但不限于:过氧化酶(peroxidase),如辣根过氧化酶(Raifort Horseradish Peroxidase,HRP);碱性磷酸酶(alkaline phosphatase);或葡萄糖氧化酶(glucose oxidase)。
可在过氧化酶催化下产生呈色反应的例示性呈色受质(chromogenic substrate)包括:邻苯二胺(o-phenylene diamine,简称OPD)、3-胺基-9-乙基咔唑(3-amino-9-ethylcarbazole,简称AEC)、4-氯-1-萘酚
(4-chloro-1-naphthol,简称4-CN)、3,3’,5,5’-四甲基联苯胺(3,3’,5,5’-tetramethylbenzidine,简称TMB)、3,3'-二胺基联苯胺(3,3'-diaminobenzidine,简称DAB)以及2,2’-联氮-二(3-乙基-苯并噻唑-6-磺酸)
(2,2'-azino-bis(3-ethylbenzthiazoline-6-sulphonate),简称ABTS)。此外,5-胺基-,2,3-二氢酞肼-1,4-二酮(5-Amino-2,3-dihydrophthalazine-1,4-dione,又称Luminol)经过氧化酶催化所得产物可发出冷光luminescence),因此也可作为此处所述的呈色受质。
可在碱性磷酸酶催化下产生呈色反应的呈色受质包括但不限于:对-硝基苯磷酸盐(p-Nitrophenyl Phosphate,简称PNPP)、萘酚(naphthol)、5-溴-4-氯-3-吲哚-磷酸(5-bromo-4-chloro-3-indolylphosphate,简称BCIP)、BCIP与四唑硝基蓝(nitroblue tetrazolium)合用(简称BCIP/NBT)以及BCIP与碘硝基四唑氯合用(p-iodonitrotetrazolium)合用(简称BCIP/INT)。
可在过葡萄糖氧化酶催化下产生呈色反应的呈色受质包括葡萄糖或其类似物。
下文提出多个实验例来说明本发明的某些方式,以利本领域技术人员实践本发明。不应将这些实施例视为对本发明范围的限制。据信本领域技术人员在阅读了此处提出的说明后,可在不需过度解读的情形下,完整利用并实践本发明。此处所引用的所有公开文献,其全文皆视为本说明书的一部分。
<<实验例1>>
于本实验例中,采用图3A所示的免疫分析套组300A的结构并使用三明治型架构,所用的待测物则为C反应蛋白(C-reactive protein),以验证本案提出的免疫分析套组的测定效果。本实验分别使用了不含待测物的样本(CRP0ug/ml)与含待测物的样本(CRP 0.3ug/ml),使样本通过免疫分析套组后,利用影像撷取设备如:相机、扫描机、手机等以及影像分析/处理软件如:Image J或Photoshop等,测定及分析处理对照垫与测试垫之间的呈色差异性(颜色深浅、色相饱和度、亮度等),并使用影像撷取设备取得对照垫与测试垫的影像。
图9A的数据显示,在对照垫中,不论是含待测物的样本还是不含待测物的样本,其光强度几乎一致。同时参照图9B的照片,可看出在两个对照垫中,呈色反应的结果非常接近。
然而,在测试垫中,不含待测物的样本其光强度仅比对照垫中略低了一点;但含待测物样本的光强度却大幅降低(图9A)。同时对照图9B的照片,可以看出含有待测物的样本,其测试垫上的呈色反应程度明显比对照垫少了许多;这意味着在捕捉区域确实能够有效改变流经该处的酵素含量。
<<实验例2>>
于本实验例中,同样采用实验例1所述的免疫分析套组架构,通过改变辣根过样化酶(HRP)浓度,来了解改变酵素浓度与测试垫中的呈色结果是否相关。
图10的折线图是以光强度对辣根过样化酶浓度的稀释倍率(kX)作图所得到的结果。由图10的数据可以看出,随着辣根过样化酶浓度的浓度减低,测试垫经呈色反应后,所发出的光强度也越低。
虽然上文实施方式中公开了本发明的具体实施例,然其并非用于限定本发明,本领域技术人员,在不悖离本发明的原理与精神的情形下,当可对其进行各种改变与修饰,因此本发明的保护范围当以附随权利要求书所界定者为准。
- 还没有人留言评论。精彩留言会获得点赞!