快速判断盐酸甲氯芬酯粉针剂质量状况的方法与流程
本发明属于医药技术领域,具体涉及一种快速判断注射用盐酸甲氯芬酯粉针剂质量状况的方法,特别是涉及一种通过激光衍射粒度分布测定来快速判断注射用盐酸甲氯芬酯粉针剂质量状况的方法。
背景技术:
盐酸甲氯芬酯(Meclofenoxate Hydrochloride)是法国国家科学研究中心Thuillier教授于1957年人工合成,其化学名称为:2-(二甲基氨基)乙基对氯苯氧基乙酸酯盐酸盐。中国从20世纪60年代起开始生产该药(曾用商品名为氯酯醒)。
临床上,盐酸甲氯芬酯是使用多年的中枢兴奋药,主要用于脑外伤昏迷、新生儿缺氧、精神错乱的治疗,并且可以用于控制因睡眠过深、觉醒警戒点较低引起的儿童遗尿等(故又称为遗尿丁)。随着研究的不断深入,人们发现氯酯醒是脑细胞代谢功能活化剂,具有清除自由基和脂褐素、促进机体代谢、保护细胞膜、增加记忆及提高智能等作用。随着上述日益深入的药理学作用的发现,该药在抗脑衰老、改进认知功能障碍、改善意识状态等方面的临床研究报道也不断涌现,临床应用范围不断扩大。
近年来,阿尔茨海默病(Alzheimer disease,AD,又称早老性痴呆、老年性痴呆)的发病率日趋上升,其相关研究日益成为老年医学研究中的热点。AD是一种以进行性记忆和认知功能损害为特征的多病因因素参与的神经退行性疾病,被列为危害老年人群健康的主要疾病之一。随着全世界范围内人口老龄化日趋严重,其发病率也在逐年上升,因此,AD必将对世界各国带来沉重的社会负担和经济负。当前大力开发研究新一代AD有效药物是国际上各研究机构及各大制药厂的热点。盐酸甲氯芬酯具有对抗氧化应激、提高脑胆碱能功能以及提高学习记忆等多种药理学作用,它在AD及各类老年痴呆治疗中的应用前景已引起老年医学工作者的关注。
目前临床上使用的盐酸甲氯芬酯的剂型主要是粉针剂,还有少量的片剂、胶囊剂在售。其中粉针剂每瓶的装量规格从60mg至250mg不等,装量规格差异较大。
本发明人长期致力于药品质量检验工作,已经发现诸多抽检的市售盐酸甲氯芬酯粉针剂存在不合格现象,特别是装量差异和含量不合格现象。但是这种不合格现象出现在成品中,似乎与生产工艺有关并且有望可以避免。因此,提供一种快速判断盐酸甲氯芬酯粉针剂质量的方法,并且期待这种方法能够为药品生产提供指导意义,仍是本领域技术人员迫切期待的。
技术实现要素:
本发明目的在于提供一种快速判断盐酸甲氯芬酯粉针剂质量的方法,特别提供一种通过激光衍射粒度分布测定来快速判断盐酸甲氯芬酯粉针剂质量状况的方法。基于此方法,本发明另一目的在于提供一种制备具有优良质量性质的盐酸甲氯芬酯粉针剂的方法。已经出人意料地发现,使用本发明方法实现了上述一个或多个方面的目的。本发明基于此发现而得以完成。
为此,本发明第一方面提供了一种快速判断盐酸甲氯芬酯粉针剂质量状况的方法,该方法包括以下步骤:
(1)提供盐酸甲氯芬酯粉针剂供试品;
(2)使用激光散射粒度分布仪,采用光散射法测定所述供试品的粒度和粒度分布,并计算供试品粒子的Dv10、Dv50、和Dv90值;
(3)以下式计算供试品粉末的径距span:
Span=(Dv90-Dv10)/Dv50;
(4)根据径距span值的结果,确定盐酸甲氯芬酯粉针剂质量状况。
根据本发明第一方面任一实施方案的方法,其中所述盐酸甲氯芬酯粉针剂是通过冷冻干燥工艺或者无菌分装工艺制备成的。对于冷冻干燥工艺制得的粉针剂,其可能呈饼状,此时在测定其粒度和粒度分布时只要简单地将其捣碎即可;对于无菌分装工艺制得的粉针剂,其通常呈粉末状,可直接用于测定。优选地,本发明所述盐酸甲氯芬酯粉针剂是通过无菌分装工艺制备成的。
根据本发明第一方面任一实施方案的方法,其中所述光散射法测定粒度和粒度分布是参照《中华人民共和国药典》2015年版四部(中华人民共和国药典2015年版四部,国家药典委员会编,中国医药科技出版社,2015.6)第132页之“0982粒度和粒度分布测定法”中的第三法(光散射法)所载的一般规范进行。进一步地所述光散射法是采用干法测定的方式进行的。
根据本发明第一方面任一实施方案的方法,其中所述盐酸甲氯芬酯粉针剂质量状况是指其各个最小包装单元之间的含药量差异或者装量差异。在一个实施方案中,所述最小包装单元是玻璃瓶,例如抗生素瓶、西林瓶等。这些玻璃瓶中可能分装了60~250mg不等的活性成分,例如分装了60mg、100mg、200mg、或250mg不等的活性成分。
根据本发明第一方面任一实施方案的方法,其中所述最小包装单元之间的含药量差异是通过以下方法测定的:测定5瓶或5瓶以上(例如5~50瓶,通常例如是5~15瓶;在本发明具体试验中如未特别说明,是测定5瓶所得结果)粉针剂中活性成分的每瓶含药量,计算每瓶活性成分的平均含药量,再以下式计算各瓶的含药量差异(%):
对于每批样品,以上述每瓶含药量、平均含药量、含药量差异(%)来评估粉针剂的品质,由于每瓶含药量、平均含药量与药品规格有关,是制剂制备时预先确定的值,因此含药量差异(%)在评估粉针剂的品质时是主要的评估指标。每瓶中活性成分的含量的测定可以采用公知方法进行,例如采用HPLC法进行。
根据本发明第一方面任一实施方案的方法,其中所述装量差异是通过以下方法测定的:测定5瓶或5瓶以上(例如5~50瓶,通常例如是5~15瓶;在本发明具体试验中如未特别说明,是测定5瓶所得结果)粉针剂中活性成分的每瓶装量,计算每瓶的平均装量,再以下式计算各瓶的装量差异(%):
对于每批样品,以上述每瓶装量、平均装量、装量差异(%)来评估粉针剂的品质,由于每瓶装量、平均装量与药品规格有关,是制剂制备时预先确定的值,因此装量差异(%)在评估粉针剂的品质时是最主要的评估指标。每瓶中活性成分的装量的测定可以采用公知方法进行,例如采用天平称重法进行。
对于采用无菌原料分装的注射用盐酸甲氯芬酯,因为瓶内的内容物均为原料药,故其最小包装单元之间含药量差异等同于装量差异。
众所周知的,对于本发明每瓶含活性成分在50~100mg范围内的这种常规装量的粉针剂而言,其含药量或装量照上述方法测定的含药量差异或装量差异值的绝对值通常需要小于等于10%才是满意的;对于200mg~250mg范围内的这种常规装量的粉针剂而言,其含药量或装量照上述方法测定的含药量差异或装量差异值的绝对值通常需要小于等于7%才是满意的,也通常是符合一般药品标准要求的。对于每瓶含活性成分在50~250mg范围内的这种常规装量的粉针剂而言,更优选的是含药量差异或装量差异的绝对值值小于等于7%,更优选的是含药量差异或装量差异值小于等于5%。
本发明人已经测定了不同生产厂家的数十批次粉针剂的径距span值和含药量差异(%)、装量差异(%),出人意料地发现,对于径距span值小于5.5的粉针剂批次,无论是其含药量差异(%)还是装量差异(%)的绝对值均小于10%(即测定的5瓶的结果均小于10%,下同),特别是大多数批次均小于7%,特别是绝大多数批次均小于5%。但是,对于径距span值大于5.5的粉针剂,例如某径距span值大于6.2的粉针剂,它们的含药量差异(%)和装量差异(%)的绝对值均显著地增加,达到10%以上(即测定的5瓶的结果均大于10%,下同),并且呈现span值越大则含药量差异(%)和装量差异(%)的绝对值亦越大的趋势。例如,有许多径距span值在6~15之间的粉针剂批次,它们的含药量差异(%)和装量差异(%)的绝对值可高达8%~22%,明显地不能满足150~500mg规格注射用粉针剂的一般药品质量要求。又例如,有许多径距span值在15~30之间的粉针剂批次,它们的含药量差异(%)和装量差异(%)的绝对值可高达13%~45%,明显地不能满足50~500mg规格注射用粉针剂的一般药品质量要求。
由于在药品检验中测定含药量差异(%)和装量差异(%)时,需要使用到较多的药品,对于粉针剂而言通常需要5~15瓶甚至更多,这对于检品的损耗是较大的,并且测定的数据量大,工作时间长,这对于药品检验是不利的。而使用本发明测定径距span值的方法,对于一批供试品,只要一瓶样品、测定一次,即可充分了解产品的含药量差异或者装量差异的质量状况。
因此,根据本发明第一方面任一实施方案的方法,其还进一步包括根据所测得的供试品径距span值来确定供试品是否满足药品质量要求的步骤。在一个实施方案中,其中所测得的供试品径距span值小于5.5时,判定粉针剂的含药量差异或者装量差异满足药品质量要求。在一个实施方案中,其中所测得的供试品径距span值大于5.5时,判定粉针剂的含药量差异或者装量差异不满足药品质量要求。
进一步地,本发明第二方面提供了一种制备盐酸甲氯芬酯粉针剂的方法,该方法包括以下步骤:
(1)制备或提供无菌的盐酸甲氯芬酯原料药;
(2)将所述盐酸甲氯芬酯原料药在无菌条件下进行粉碎,在粉碎过程中即时监测原料药颗粒的径距span值;
(3)当原料药颗粒的径距span值小于5.5时,停止粉碎;
(4)在无菌条件下,将步骤(3)所得原料药分装到玻璃瓶中,密封,即得。
根据本发明第二方面任一实施方案的方法,其中所述径距span值是采用如下方法测定的:
采用光散射法测定粉碎粉末的粒度和粒度分布,并计算粉末粒子的Dv10、Dv50、和Dv90值,以下式计算供试品粉末的径距span:
Span=(Dv90-Dv10)/Dv50。
根据本发明第二方面任一实施方案的方法,其中所述光散射法测定粒度和粒度分布是参照《中华人民共和国药典》2015年版四部(中华人民共和国药典2015年版四部,国家药典委员会编,中国医药科技出版社,2015.6)第132页之“0982粒度和粒度分布测定法”中的第三法(光散射法)所载的一般规范进行。进一步地所述光散射法是采用干法测定的方式进行的。
根据本发明第二方面任一实施方案的方法,其中步骤(4)中,每个玻璃瓶中分装的药物量为50~500mg。例如每瓶中分装了60mg、100mg、200mg、或250mg药物。
已经出人意料地发现,要获得优异的分装均匀性,只能径距span值小于5.5,都能保证含药量差异或装量差异的绝对值小于7%,而与药物颗粒的总体粒度大小无关联性。例如,在一个试验中,制备Dv50为5μm、10μm、25μm、50μm、100μm不同规格的原料粉末,但这些不同Dv50的粉末的span值均在1.9~4.1范围内,将这五种原料进行分装,所得粉针剂的含药量差异或装量差异均小于3%。
由于盐酸甲氯芬酯粉针剂用于注射给药,而盐酸甲氯芬酯的溶解性非常好,因此药物颗粒的大小对药品治疗效果无影响,因此在制备本发明盐酸甲氯芬酯粉针剂时,粉碎过程中原料药物颗粒的总体粒度大小选择范围较大,而只要监控制其span值达到期望的值即可。
本发明任一方面或该任一方面的任一实施方案所具有的任一技术特征同样适用其它任一实施方案或其它任一方面的任一实施方案,只要它们不会相互矛盾,当然在相互之间适用时,必要的话可对相应特征作适当修饰。下面对本发明的各个方面和特点作进一步的描述。
本发明所引述的所有文献,它们的全部内容通过引用并入本文,并且如果这些文献所表达的含义与本发明不一致时,以本发明的表述为准。此外,本发明使用的各种术语和短语具有本领域技术人员公知的一般含义,即便如此,本发明仍然希望在此对这些术语和短语作更详尽的说明和解释,提及的术语和短语如有与公知含义不一致的,以本发明所表述的含义为准。
激光粒度分布仪(Laser particle size analyzer)测定颗粒粒度大小和分布,其原理和方法是本领域技术人员公知的。光在传播中,波前受到与波长尺度相当的隙孔或颗粒的限制,以受限波前处各元波为源的发射在空间干涉而产生衍射和散射,衍射和散射的光能的空间(角度)分布与光波波长和隙孔或颗粒的尺度有关。用激光做光源,光为波长一定的单色光后,衍射和散射的光能的空间(角度)分布就只与粒径有关。对颗粒群的衍射,各颗粒级的多少决定着对应各特定角处获得的光能量的大小,各特定角光能量在总光能量中的比例,应反映着各颗粒级的分布丰度。按照这一思路可建立表征粒度级丰度与各特定角处获取的光能量的数学物理模型,进而研制仪器,测量光能,由特定角度测得的光能与总光能的比较推出颗粒群相应粒径级的丰度比例量。
激光粒度分析仪依据分散系统分为湿法测试仪器,干法测试仪器,干湿一体测试仪器,另有专用型仪器,例如喷雾激光粒度仪、在线激光粒度仪等。目前符合要求的激光粒度分析仪在市场上容易得到,并且药品检验机构和药厂都有大量的配置,是目前本领域的常用设备。
附图说明
图1显示了粉针剂装量差异与径距之间的相关性图。
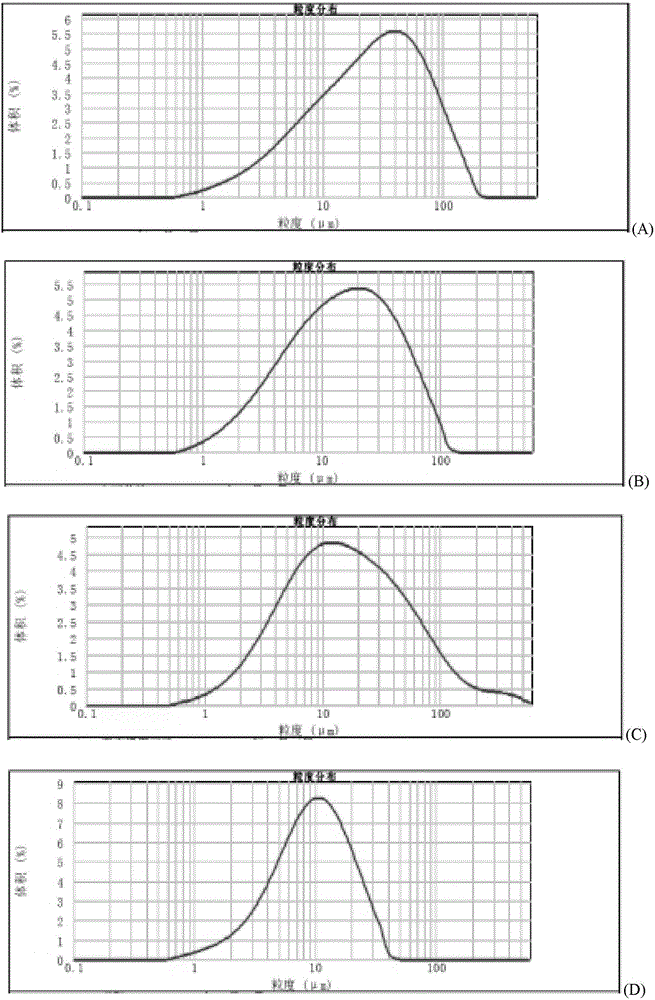
图2之(A)至(G)分别示出了部分粉针剂的典型粒度分布图。
具体实施方式
下面通过具体的实施例/实验例进一步说明本发明,但是,应当理解为,这些实施例和实验例仅仅是用于更详细具体地说明之用,而不应理解为用于以任何形式限制本发明。
本发明对试验中所使用到的材料以及试验方法进行一般性和/或具体的描述。虽然为实现本发明目的所使用的许多材料和操作方法是本领域公知的,但是本发明仍然在此作尽可能详细描述。本领域技术人员清楚,在下文中,如果未特别说明,本发明所用材料和操作方法是本领域公知的。
在本发明下文制备粉针剂时,如无特别说明,每批次处理的原料药为5kg规模量。
测定方法例1:span值测试方法
激光粒度分布仪使用Mastersizer 2000仪器(Malvern公司),照《中华人民共和国药典》2015年版四部(中华人民共和国药典2015年版四部,国家药典委员会编,中国医药科技出版社,2015.6)第132页之“0982粒度和粒度分布测定法”中的第三法(光散射法)所载的一般规范进行。测定条件为干法测定。
采用上述光散射法测定粉碎粉末的粒度和粒度分布,并计算粉末粒子的Dv10、Dv50、和Dv90值,以下式计算供试品粉末的径距span:
Span=(Dv90-Dv10)/Dv50。
测定方法例2:粉针剂的含药量差异
对于每批粉针剂,取5瓶,照《中华人民共和国药典》2015年版二部906页注射用盐酸甲氯芬酯【含量测定】项下的方法,分别测定每瓶粉针剂中活性成分的每瓶含量,再据此计算5瓶的平均含量,然后按下式计算每瓶的含药量差异(%):
测定方法例3:粉针剂的装量和装量差异
粉针剂的装量照《中华人民共和国药典》2015年版四部0102节【装量差异】中的方法测定,称得各瓶粉针的装量并可计算其平均装量。
对于每批粉针剂,取5瓶,照《中华人民共和国药典》2015年版四部0102节【装量差异】中的方法,分别测定每瓶粉针剂中的每瓶装量,然后按下式计算每瓶的装量差异(%):
制备例1:制备注射用盐酸甲氯芬酯粉针剂
(1)提供无菌的盐酸甲氯芬酯原料药;
(2)将所述盐酸甲氯芬酯原料药在无菌条件下进行粉碎,在粉碎过程中即时监测原料药颗粒的径距span值;
(3)当原料药颗粒的径距span值小于5.5时(本例为3.2,粉末的Dv50为31um),停止粉碎;
(4)在无菌条件下,将步骤(3)所得原料药分装到玻璃瓶中(每瓶250mg),密封,即得。
制备例2:制备注射用盐酸甲氯芬酯粉针剂
(1)提供无菌的盐酸甲氯芬酯原料药;
(2)将所述盐酸甲氯芬酯原料药在无菌条件下进行粉碎,在粉碎过程中即时监测原料药颗粒的径距span值;
(3)当原料药颗粒的径距span值小于5.5时(本例为2.4,粉末的Dv50为24um),停止粉碎;
(4)在无菌条件下,将步骤(3)所得原料药分装到玻璃瓶中(每瓶100mg),密封,即得。
制备例3:制备注射用盐酸甲氯芬酯粉针剂
(1)提供无菌的盐酸甲氯芬酯原料药;
(2)将所述盐酸甲氯芬酯原料药在无菌条件下进行粉碎,在粉碎过程中即时监测原料药颗粒的径距span值;
(3)当原料药颗粒的径距span值小于5.5时(本例为5.3,粉末的Dv50为37um),停止粉碎;
(4)在无菌条件下,将步骤(3)所得原料药分装到玻璃瓶中(每瓶500mg),密封,即得。
制备例4:制备注射用盐酸甲氯芬酯粉针剂
(1)提供无菌的盐酸甲氯芬酯原料药;
(2)将所述盐酸甲氯芬酯原料药在无菌条件下进行粉碎,在粉碎过程中即时监测原料药颗粒的径距span值;
(3)当原料药颗粒的径距span值小于5.5时(本例为2.6,粉末的Dv50为28um),停止粉碎;
(4)在无菌条件下,将步骤(3)所得原料药分装到玻璃瓶中(每瓶250mg),密封,即得。
制备例5:制备注射用盐酸甲氯芬酯粉针剂
(1)提供无菌的盐酸甲氯芬酯原料药;
(2)将所述盐酸甲氯芬酯原料药在无菌条件下进行粉碎,在粉碎过程中即时监测原料药颗粒的径距span值;
(3)当原料药颗粒的径距span值小于5.5时(本例为4.4,粉末的Dv50为45um),停止粉碎;
(4)在无菌条件下,将步骤(3)所得原料药分装到玻璃瓶中(每瓶200mg),密封,即得。
对于以上制备例1至制备例5制备的五批粉针,照上文测定方法例2和测定方法例3,求算每批粉针的含药量差异和装量差异。结果显示,对于每一批粉针,所测定的5瓶样品的含药量差异均小于4%,均在1.8~3.4%范围内;对于每一批粉针,所测定的5瓶样品的装量差异均小于4%,均在1.6~3.9%范围内。
制备例6:制备注射用盐酸甲氯芬酯粉针剂
(1)提供无菌的盐酸甲氯芬酯原料药;
(2)将所述盐酸甲氯芬酯原料药在无菌条件下进行粉碎,在粉碎过程中即时监测原料药颗粒的径距span值;
(3)当原料药颗粒的径距span值大于5.5时(本例为8.4,粉末的Dv50为35um),停止粉碎;
(4)在无菌条件下,将步骤(3)所得原料药分装到玻璃瓶中(每瓶250mg),密封,即得。经测定,该批5瓶粉针剂的含药量差异均在8.8~13.1%范围内,5瓶粉针剂的装量差异均在8.2~13.5%范围内。
制备例7:制备注射用盐酸甲氯芬酯粉针剂
(1)提供无菌的盐酸甲氯芬酯原料药;
(2)将所述盐酸甲氯芬酯原料药在无菌条件下进行粉碎,在粉碎过程中即时监测原料药颗粒的径距span值;
(3)当原料药颗粒的径距span值大于5.5时(本例为6.7,粉末的Dv50为22um),停止粉碎;
(4)在无菌条件下,将步骤(3)所得原料药分装到玻璃瓶中(每瓶100mg),密封,即得。经测定,该批5瓶粉针剂的含药量差异均在8.3~13.6%范围内,5瓶粉针剂的装量差异均在9.1~12.2%范围内。
制备例8:制备注射用盐酸甲氯芬酯粉针剂
(1)提供无菌的盐酸甲氯芬酯原料药;
(2)将所述盐酸甲氯芬酯原料药在无菌条件下进行粉碎,在粉碎过程中即时监测原料药颗粒的径距span值;
(3)当原料药颗粒的径距span值大于5.5时(本例为11.4,粉末的Dv50为13um),停止粉碎;
(4)在无菌条件下,将步骤(3)所得原料药分装到玻璃瓶中(每瓶500mg),密封,即得。经测定,该批5瓶粉针剂的含药量差异均在9.5~16.2%范围内,5瓶粉针剂的装量差异均在9.2~14.7%范围内。
制备例9:制备注射用盐酸甲氯芬酯粉针剂
(1)提供无菌的盐酸甲氯芬酯原料药;
(2)将所述盐酸甲氯芬酯原料药在无菌条件下进行粉碎,在粉碎过程中即时监测原料药颗粒的径距span值;
(3)当原料药颗粒的径距span值大于5.5时(本例为21.4,粉末的Dv50为110um),停止粉碎;
(4)在无菌条件下,将步骤(3)所得原料药分装到玻璃瓶中(每瓶250mg),密封,即得。经测定,该批5瓶粉针剂的含药量差异均在18.3~26.6%范围内,5瓶粉针剂的装量差异均在16.8~24.5%范围内。
制备例10:制备注射用盐酸甲氯芬酯粉针剂
(1)提供无菌的盐酸甲氯芬酯原料药;
(2)将所述盐酸甲氯芬酯原料药在无菌条件下进行粉碎,在粉碎过程中即时监测原料药颗粒的径距span值;
(3)当原料药颗粒的径距span值大于5.5时(本例为16.2,粉末的Dv50为70um),停止粉碎;
(4)在无菌条件下,将步骤(3)所得原料药分装到玻璃瓶中(每瓶200mg),密封,即得。经测定,该批5瓶粉针剂的含药量差异均在14.6~19.4%范围内,5瓶粉针剂的装量差异均在15.6~17.6%范围内。
检测例1:市售品性质考察
从市场抽检的不同企业生产的不同批次的盐酸甲氯芬酯粉针剂,包括L公司、Q公司、LK公司等的22批粉针剂,它们的标示装量有100mg/瓶、200mg/瓶、250mg/瓶的不同分装规格,并且均是通过无菌分装方式生产。
对于这22批粉针剂,测定每批粉针的径距span值、含药量差异、装量差异。各公司不同批次的产品span值有大(大于5.5)有小(小于5.5),并且据信这些生产厂商的原料药均是外购并直接无菌分装的不同批次的原料药;这些不同span值的批次的粉针剂,其含药量差异和装量差异亦呈现显著的偏向性,具体结果如下:
(a)4批span值在1.6~2.2范围内的粉针,它们每批所测5瓶的含药量差异均在1.1%~1.9%范围内,每批所测5瓶的装量差异均在1.3%~1.8%范围内;这几批粉针的Dv50值分别在12~60um的宽范围内各不相同;另外,经检测,这几批粉针有2种不同的晶型;
(b)5批span值在2.5~5.1范围内的粉针,它们每批所测5瓶的含药量差异均在1.8%~3.2%范围内,每批所测5瓶的装量差异均在2.1%~3.5%范围内;这几批粉针的Dv50值分别在14~120um的宽范围内各不相同;另外,经检测,这几批粉针有3种不同的晶型;
(c)6批span值在6.8~9.5范围内的粉针,它们每批所测5瓶的含药量差异均在8.7%~15.4%范围内,每批所测5瓶的装量差异均在9.1%~14.8%范围内;这几批粉针的Dv50值分别在12~65um的宽范围内各不相同;另外,经检测,这几批粉针有3种不同的晶型;
(d)5批span值在10.3~14.4范围内的粉针,它们每批所测5瓶的含药量差异均在16.2%~23.7%范围内,每批所测5瓶的装量差异均在17.9%~24.8%范围内;这几批粉针的Dv50值分别在10~40um的宽范围内各不相同;
(e)2批span值为18.3和23.6的粉针,它们每批所测5瓶的含药量差异均在22.6%~27.4%范围内,每批所测5瓶的装量差异均在24.1%~26.9%范围内;这几批粉针的Dv50值分别在15~70um的宽范围内各不相同;
(f)L公司有1批粉针在以上(a)组、2批粉针在以上(b)组、1批粉针在以上(d)组,且各批使用不同批次的原料药生产;Q公司有2批粉针在以上(a)组、2批粉针在以上(b)组、3批粉针在以上(d)组,且各批使用不同批次的原料药生产;LK公司有1批粉针在以上(a)组、1批粉针在以上(b)组、1批粉针在以上(d)组,且各批使用不同批次的原料药生产。
本检测例1表明,优异的含药量差异和装量差异的粉针均具有低的span值,但是与药物颗粒的Dv50值、晶型等无关。
检测例2:市售品性质考察
另外地,从市场抽检的不同企业生产的不同批次的盐酸甲氯芬酯粉针剂,包括5个公司的19批粉针剂,它们的标示装量有100mg/瓶、200mg/瓶、250mg/瓶的不同分装规格,并且均是通过无菌分装方式生产。
测定它们的径距,以及装量差异(以其平均值给出),以径距为纵坐标,装量差异为横坐标绘图,结果如图1所示。从图中结果可见,8批不同厂商的产品径距在1.8~4.2范围内,它们的装量差异均在0.6%~3.1%范围内;5批不同厂商的产品径距在6~13范围内,它们的装量差异均在8%~13%范围内;6批不同厂商的产品径距在21~31范围内,它们的装量差异均在15%~31%范围内。
另外,图2之(A)至(G)分别示出了以上19批粉针试验中一部分产品的典型粒度分布图,即,(A)为Q公司产品(批号20141201,0.25g)粒度分布图,(B)为P公司产品(批号13150401,0.25g)粒度分布图,(C)为T公司产品(批号140402,0.25g)粒度分布图,(D)为R公司产品(批号15042001,0.25g)粒度分布图,(E)为L公司产品(批号150201,0.25g)粒度分布图,(F)为L公司产品(批号150501,0.1g)粒度分布图,(G)为Q公司产品(批号20140401,0.25g)粒度分布图。各图中横坐标是粒度(um),纵坐标是体积百分数。从图2中可见,即使是呈现双峰分布的(E)、(F)、(G)三者,它们在图1中均呈现本发明关于装量差异(其显然地与含药量差异高度相关)-径距之间的关系。
- 还没有人留言评论。精彩留言会获得点赞!