一种鉴定地层水和/或地表水水型的分析方法与流程
本发明是关于一种鉴定地层水和/或地表水水型的分析方法,特别是一种用于地表水和油气藏条件下的地层水类型分析方法,属于石油天然气勘探开发地质分析技术。
背景技术:
在油气藏勘探开发过程中客观准确地判断地层水及地表水水型对确定储集岩在油气藏形成过程经历的地质环境具有指导作用。天然水是自然界中非人为因素形成的地表水和地层水的统称。
地层水是指储存在地下岩石中的可动水和束缚水,包括油气层中的边水、底水、层间水及水层水和温泉水。地层水主要有四种来源:一是沉积水,指沉积物堆积过程中保存于其中的水,其含盐量和化学成分受控于原环境;二是渗入水,指大气降水等渗入岩层中的地表水,渗入水可淡化地下高矿化度水;三是深层水,指来源于地壳深部的高矿化度高温水;四是转化水,指沉积成岩和烃类形成过程中,粘土转化脱出的层间水及有机质向烃类转化时分解出的水。目前的地层水是上述四种来源水的混合水,甚至是与地表水的再混合水。
地表水是天然汇集形成的水资源,包括自然降水、雪山和冰川融水、沼泽水、江水、河水、湖水和海水。实际上有很大比例的地表水与埋藏较浅的地层水以露头或泉眼等形式相互沟通,因此严格意义上的地表水与部分浅层地层水是很难区分的。为了避免概念上的混淆,本发明在之后所提的地层水在没有特别说明时均指广义地层水,即天然水,并涵盖了狭义地表水和狭义地层水。
地层水分类主要源于前苏联化学家苏林(1946年,苏林撰写的《天然水系中的油田水》一书,由石油工业出版社出版),苏林分类是2016年石油行业实施的地层水水型划分标准(中华人民共和国石油行业标准《油田水分析方法》SY/T 5523-2016)。苏林根据Na++K+离子与Cl-离子的当量浓度比(等于单位电荷毫摩尔浓度比),结合成因系数将地层水划分为NaHCO3、Na2SO4、MgCl2和CaCl2四种水型(表1)。
表1苏林地层水分类
地层水无论按矿化度、含盐量、硬度或是氯离子浓度进行分类,都只是对总离子或指定离子含量高低的简单分类,没有与地层水的地质环境建立客观联系,对油气田的勘探开发缺乏指向性。苏林分类虽然在不同程度上规避了其他分类中存在的主要不足,但其自身依然存在诸多缺陷,主要表现在以下两个方面:
一是苏林分类中不含自然界中极为普遍的NaCl和Ca(HCO3)2等水型。比如,苏林分类忽略了Na++K+和Cl-离子单位电荷毫摩尔浓度近乎对等或NaCl+KCl在水中的配伍离子单位电荷毫摩尔分数占绝对优势(如大于等于80%)时特定的极具代表性的NaCl形成环境;
二是苏林分类忽略了部分优势离子在地质环境中的指向作用,比如,当地层水中Na++K+离子单位电荷毫摩尔浓度远大于Cl-离子,HCO3-+CO32-和Ca2+离子单位电荷毫摩尔浓度也都明显高于SO42-离子以及Mg2+离子单位电荷毫摩尔浓度时,苏林分类只能划分出NaHCO3水型或Na2SO4水型,不会划分出实际存在的Ca(HCO3)2水型,这就必然造成苏林分类确定的水型与实际情况存在明显差异,甚至出现命名和概念上的混乱,如MgCl2本是大洋海水水型,有时在内陆河流、淡水湖泊中也会出现苏林分类中的MgCl2水型,从而造成地表水、地层水水型在分类上的混乱。
技术实现要素:
本发明的一个目的是根据目前苏林地层水分类中存在的问题,提供一种鉴定地层水和/或地表水水型的分析方法,客观地确定地层水和地表水水型划分,为认识和研究油气藏地层水特征提供了一条新途径。
依据本发明所述的技术方案,本发明提供了一种鉴定地层水和/或地表水水型的分析方法,该方法包括步骤:
1)取水样;
2)检测水样中Na+、K+、Mg2+、Ca2+、Cl-、SO42-、HCO3-、CO32-的离子矿化度(S·Ci,单位mg/L)及离子化学结构式的量(在数值上等于离子的相对原子质量)(Mi,单位g/mol);
3)根据在步骤2)中获得的Na+、K+、Mg2+、Ca2+、Cl-、SO42-、HCO3-、CO32-的离子矿化度(S·Ci)和相应离子的原子质量(Mi)计算与离子含量相关的离子毫摩尔浓度、离子单位电荷毫摩尔浓度、离子单位电荷毫摩尔分数、离子单位电荷毫摩尔浓度比、综合成因系数、综合判断系数六类数据,从而鉴定水样的水型。
本发明的方法可客观地确定地层水和地表水水型,尤其适用于确定烃类储集岩孔隙中的地层水和地表水水型,为认识和研究油气藏地层水特征提供了一条新途径。
根据本发明的具体实施方案,本发明的方法中,所述取水样步骤包括利用地质勘探开发设备和/或地面采集设备采集地层水和/或地表水。
根据本发明的具体实施方案,本发明的方法中,根据在步骤2)中获得的Na+、K+、Mg2+、Ca2+、Cl-、SO42-、HCO3-、CO32-的离子矿化度(S·Ci)和相应离子的原子质量(Mi)计算与离子含量相关的离子毫摩尔浓度、离子单位电荷毫摩尔浓度、离子单位电荷毫摩尔分数、离子单位电荷毫摩尔浓度比、综合成因系数、综合判断系数六类数据按照以下方法进行:
根据在步骤2)中获得的Na+、K+、Mg2+、Ca2+、Cl-、SO42-、HCO3-、CO32-离子矿化度(S·Ci)和相应离子的原子质量(Mi)来获得离子毫摩尔浓度(Ci)和配伍后的NaCl+KCl在水中的离子毫摩尔浓度(CNaCl);
根据离子的化合价(xi)和在步骤3)中获得的离子毫摩尔浓度来获得离子单位电荷毫摩尔浓度(U·Ci)和总离子单位电荷毫摩尔浓度(U·C)及配伍后的NaCl+KCl在水中的离子单位电荷毫摩尔浓度(U·CNaCl);
根据离子单位电荷毫摩尔浓度获得离子单位电荷毫摩尔分数(Wi)和配伍的NaCl+KCl在水样中的离子单位电荷毫摩尔分数(WNaCl);
根据离子单位电荷毫摩尔分数(Wi)获得离子的单位电荷毫摩尔浓度比(R1、R2、R3)、综合成因系数(O、O1、O2、O3、O4)和综合判断系数(X1、X2、X3、X4、X5、Xmax、Y1、Y2、Y3、Y4、Y5、Ymax)。
更具体地,本发明的方法中,与离子含量相关的离子毫摩尔浓度、离子单位电荷毫摩尔浓度、离子单位电荷毫摩尔分数、离子单位电荷毫摩尔浓度比符合按照以下公式得出的数值:
离子毫摩尔浓度(Ci)和配伍后的NaCl+KCl在水中的离子毫摩尔浓度(CNaCl):
CNaCl=2(C1+C2),(C1+C2≤C5) (2)
CNaCl=2C5,(C1+C2>C5) (3)
式中:
Ci——第i种离子(i=1、2、3、4、5、6、7、8,其中1代表Na+、2代表K+、3代表Mg2+、4代表Ca2+、5代表Cl-、6代表SO42-、7代表HCO3-、8代表CO32-)毫摩尔浓度,mmol/L;
CNaCl——配伍后的NaCl+KCl在水中的离子毫摩尔浓度,mmol/L;
S·Ci——第i种离子矿化度,mg/L;
Mi——第i种离子或分子化学结构式的量(在数值上等于离子的相对原子质量M1=22.98977、M2=39.0983、M3=24.305、M4=40.078、M5=35.4527、M6=96.06272、M7=61.01693、M8=60.00899),g/mol;
离子单位电荷毫摩尔浓度(U·Ci)和总离子单位电荷毫摩尔浓度(U·C)及配伍后的NaCl+KCl在水中的离子单位电荷毫摩尔浓度(U·CNaCl):
U·Ci=xiCi (4)
式中:
U·C——地层水中8种常见离子的总单位电荷毫摩尔浓度,mmol/L;
U·Ci——地层水中第i种离子单位电荷毫摩尔浓度,mmol/L;
U·CNaCl——配伍后的NaCl+KCl在水中的离子单位电荷毫摩尔浓度,mmol/L;
xi——第i种离子或酸根的化合价(x1=1,x2=1,x3=2,x4=2,x5=1,x6=2,x7=1,x8=2)。
离子单位电荷毫摩尔分数(Wi)和配伍的NaCl+KCl在地层水中的离子单位电荷毫摩尔分数(WNaCl):
式中:
Wi——第i种离子(i=1、2、3、4、5、6、7、8,其中1代表Na+、2代表K+、3代表Mg2+、4代表Ca2+、5代表Cl-、6代表SO42-、7代表HCO3-、8代表CO32-)单位电荷毫摩尔分数,f;
WNaCl——Na++K+离子与Cl-离子配伍后形成的NaCl和KCl在地层水中的单位电荷毫摩尔分数(简称NaCl单位电荷分数),f。
离子单位电荷毫摩尔浓度比(R1、R2、R3):
式中:
R1、R2、R3——地层水离子单位电荷毫摩尔浓度比(简称浓度比),f;
Δ——分母安全系数(分母中其他变量为0时,Δ=0.0001;分母中其他变量不为0时,Δ=0)。
根据本发明的具体实施方案,本发明的方法中,综合成因系数、综合判断系数符合按照以下公式计算得出的数值:
综合成因系数(O、O1、O2、O3、O4):
O=W1+W2-W5 (13)
式中O、O1、O2、O3、O4——地层水综合成因系数,无量纲。
地层水综合判断系数(X1、X2、X3、X4、X5、Xmax、Y1、Y2、Y3、Y4、Y5、Ymax):
X1=min(W7+W8,W1+W2+W3+W4-W5-W6) (18)
X2=W5+W6-W1-W2-W3 (19)
X3=W3 (20)
X4=W1+W2-W5 (21)
Xmax=max(X1,X2,X3,X4) (23)
Y1=min(W4,W5+W6+W7+W8-W1-W2-W3) (24)
Y2=W1+W2+W3-W5-W6 (25)
Y3=W6 (26)
Y4=W5-W1-W2 (27)
Ymax=max(Y1,Y2,Y3,Y4) (29)
式中:
max()、min()——最大值函数、最小值函数;
X1、X2、X3、X4、X5——R1>1时地层水综合判断系数;
Xmax——R1>1时地层水综合判断系数最大值;
Y1、Y2、Y3、Y4、Y5——R1<1时地层水综合判断系数;
Ymax——R1<1时地层水综合判断系数最大值。
根据本发明的具体实施方案,本发明的方法还包括以下过程:
将水样中的Na+、K+、Mg2+、Ca2+、Cl-、SO42-、HCO3-、CO32-离子分为三组:第一组为Na++K+和Cl-、第二组为HCO3-+CO32-和SO42-、第三组为Mg2+和Ca2+,然后根据三组离子的单位电荷毫摩尔浓度比(R1、R2、R3)确定携带单位电荷量相对较多的优势离子。
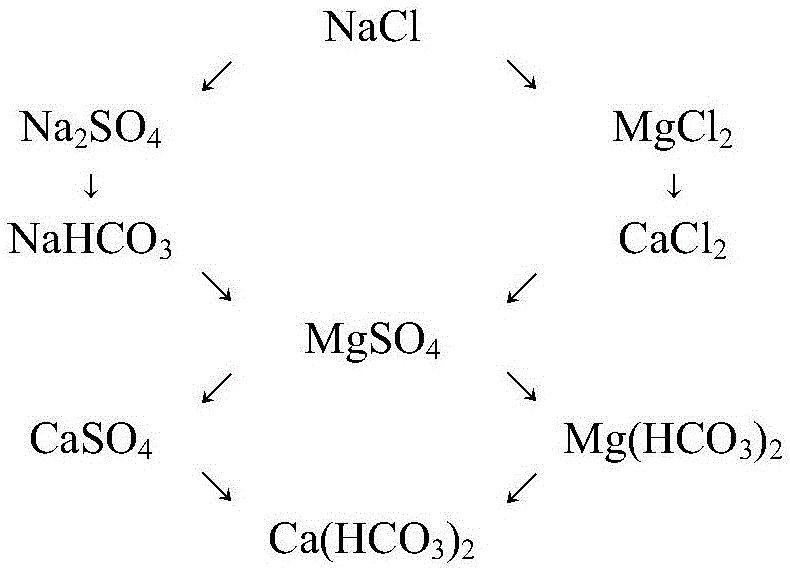
根据本发明的具体实施方案,本发明的方法中,根据所述单位电荷毫摩尔浓度结合离子亲和力大小顺序(图1),确定离子间单位电荷毫摩尔浓度化合的比例,依据在水中依次形成的九种盐类化合物(图2)将地层水和/或地表水划分为九种水型。
根据本发明的具体实施方案,本发明的方法中,根据所述综合成因系数将水中Na+、K+、Mg2+、Ca2+、Cl-、SO42-、HCO3-、CO32-离子组合分为五类(图3),再依据浓度比将地层水离子组合细分为20种类型(表2);根据五类20种地层水离子组合类型,结合NaCl单位电荷分数,将地层水和/或地表水划分为九种水型。
根据本发明的具体实施方案,本发明的方法中,所述九种水型为:NaCl水型、Na2SO4水型、MgCl2水型、NaHCO3水型、CaCl2水型、MgSO4水型、CaSO4水型、Mg(HCO3)2水型、Ca(HCO3)2水型(表3)。
根据本发明的具体实施方案,本发明的方法中,根据所述六类数据鉴定水样的水型的过程包括:
依次根据配伍的NaCl+KCl在水中的离子单位电荷毫摩尔分数、离子单位电荷毫摩尔浓度比、综合成因系数、离子单位电荷毫摩尔浓度比、综合判断系数,鉴定水样属于所述九种水型中的哪种水型。
根据本发明的具体实施方案,本发明的方法中,根据所述六类数据鉴定水样的水型的过程参照如表3所示内容进行。
表2地层水离子组合类型
表3“六步九分法”划分地层水水型一览表
本发明的有益技术效果:
本发明针对苏林地层水分类存在的问题,提出地层水综合成因系数与综合判断系数,结合离子单位电荷毫摩尔浓度比,根据水中优势离子划分地层水水型。
根据国内外不同地区125个水样分析结果,用“六步九分法”(表3)与苏林分类法对比划分地层水水型,结果表明,地表淡水以重碳酸钙【Ca(HCO3)2】水型为主,而非苏林分类法划分的Na2SO4水型。Na2SO4水型在“六步九分法”中是内陆闭塞湖泊或油气藏条件下形成的水型;Ca(HCO3)2和Mg(HCO3)2水型都不会出现在大于3000m以下的地层水中,因为含Ca(HCO3)2的地层水加热到100℃后即分解为碳酸钙沉淀和二氧化碳气体;含Mg(HCO3)2的地层水加热到100℃后即转化为碱式碳酸镁沉淀。从而系统建立了地层水水型分析方法:
(1)“六步九分法”是以离子单位电荷毫摩尔浓度比、地层水综合成因系数和地层水综合判断系数为标尺,将优势盐类的离子单位电荷毫摩尔分数与成因环境紧密结合,在离子单位电荷毫摩尔浓度相等的条件下,以亲合力更弱的离子形成优势盐类占优作为地层水分类与命名的基本原则,从而使不同环境下形成的优势盐类决定相应的地层水水型;优势离子在三组离子中产生:第一组Na++K+和Cl-、第二组HCO3-+CO32-和SO42-、第三组Mg2+和Ca2+,优势离子间可形成优势盐类,优势离子与非优势离子间也可形成优势盐类。
(2)地表水中的MgCl2水型遵循海水常量成分恒定性原理,地层水中的MgCl2水型不遵循海水常量成分恒定性原理。在地表水的Na2SO4水型中,Mg2+离子单位电荷毫摩尔浓度大于Ca2+离子单位电荷毫摩尔浓度,在地层水的Na2SO4水型中,Mg2+离子单位电荷毫摩尔浓度小于Ca2+离子单位电荷毫摩尔浓度。
附图说明
图1:地层水离子化合物顺序简图。图中,①代表相对应的阴、阳离子亲和能力最大,②代表相对应的阴、阳离子亲和能力中等,③代表相对应的阴、阳离子亲和能力最小。
图2:地层水九种盐类化合物形成顺序示意图。
图3:五类地层水离子组合示意图。
具体实施方式
下列实施例仅为例示性说明,非意图限制本发明的范围。所属领域的技术人员可藉由本发明的揭露,在不背离本发明的精神的范围内做出适度的变更和修正。
本发明中,是以水中离子单位电荷毫摩尔浓度比、地层水综合成因系数和地层水综合判断系数为标尺,将优势盐类的离子单位电荷毫摩尔分数与成因环境紧密结合,在离子单位电荷毫摩尔浓度相等的条件下,以亲合力更弱的离子形成优势盐类占优作为地层水分类与命名的基本原则,从而使不同环境下形成的优势盐类决定相应的地层水水型:NaCl、Na2SO4、MgCl2、NaHCO3、CaCl2、MgSO4、CaSO4、Mg(HCO3)2、Ca(HCO3)2。在阴、阳离子单位电荷毫摩尔浓度对等的前提下,根据地层水综合成因系数和浓度比将地层水中的离子划分为五类20种离子组合类型,这些离子组合涵盖了自然界中最常见的8种离子组合类型;优势离子在三组离子中产生:第一组Na++K+和Cl-、第二组HCO3-+CO32-和SO42-、第三组Mg2+和Ca2+,优势离子间可形成优势盐类,优势离子与非优势离子间也可形成优势盐类。具体如下:
1)利用地质勘探开发设备或地面采集设备,可以采集地层水或地面水;
2)基于采集到的地层水或地面水数据,通过水分析设备获得地层水或地面水中Na+、K+、Mg2+、Ca2+、Cl-、SO42-、HCO3-、CO32-等八种主要离子矿化度(S·Ci,单位mg/L)及离子化学结构式的量(在数值上等于离子的相对原子质量);
3)根据在步骤2)中获得的Na+、K+、Mg2+、Ca2+、Cl-、SO42-、HCO3-、CO32-离子矿化度(S·Ci)和相应离子的原子质量(Mi)来获得离子毫摩尔浓度(Ci)和配伍后的NaCl+KCl在水中的离子毫摩尔浓度(CNaCl):
CNaCl=2(C1+C2),(C1+C2≤C5) (2)
CNaCl=2C5,(C1+C2>C5) (3)
式中:
Ci——第i种离子(i=1、2、3、4、5、6、7、8,其中1代表Na+、2代表K+、3代表Mg2+、4代表Ca2+、5代表Cl-、6代表SO42-、7代表HCO3-、8代表CO32-)毫摩尔浓度,mmol/L;
CNaCl——配伍后的NaCl+KCl在水中的离子毫摩尔浓度,mmol/L;S·Ci——第i种离子矿化度,mg/L;
Mi——第i种离子或分子化学结构式的量(在数值上等于离子的相对原子质量M1=22.98977、M2=39.0983、M3=24.305、M4=40.078、M5=35.4527、M6=96.06272、M7=61.01693、M8=60.00899),g/mol。
4)根据离子的化合价(xi)和在步骤3)中获得的离子毫摩尔浓度来获得离子单位电荷毫摩尔浓度(U·Ci)和总离子单位电荷毫摩尔浓度(U·C)及配伍后的NaCl+KCl在水中的离子单位电荷毫摩尔浓度(U·CNaCl):
U·Ci=xiCi (4)
式中:
U·C——地层水中8种常见离子的总单位电荷毫摩尔浓度,mmol/L;
U·Ci——地层水中第i种离子单位电荷毫摩尔浓度,mmol/L;
U·CNaCl——配伍后的NaCl+KCl在水中的离子单位电荷毫摩尔浓度,mmol/L;
xi——第i种离子或酸根的化合价(x1=1,x2=1,x3=2,x4=2,x5=1,x6=2,x7=1,x8=2)。
5)根据在步骤4)中获得的离子单位电荷毫摩尔浓度获得离子单位电荷毫摩尔分数(Wi)和配伍的NaCl+KCl在地层水中的离子单位电荷毫摩尔分数(WNaCl):
式中:
Wi——第i种离子(i=1、2、3、4、5、6、7、8,其中1代表Na+、2代表K+、3代表Mg2+、4代表Ca2+、5代表Cl-、6代表SO42-、7代表HCO3-、8代表CO32-)单位电荷毫摩尔分数,f;
WNaCl——Na++K+离子与Cl-离子配伍后形成的NaCl和KCl在地层水中的单位电荷毫摩尔分数(简称NaCl单位电荷分数),f。
6)根据在步骤5)中获得的离子单位电荷毫摩尔分数(Wi)获得离子单位电荷毫摩尔浓度比(R1、R2、R3)、地层水综合成因系数(O、O1、O2、O3、O4)和地层水综合判断系数(X1、X2、X3、X4、X5、Xmax、Y1、Y2、Y3、Y4、Y5、Ymax):
地层水离子单位电荷毫摩尔浓度比:
式中:
R1、R2、R3——地层水离子单位电荷毫摩尔浓度比(简称浓度比),f;
Δ——分母安全系数(分母中其他变量为0时,Δ=0.0001;分母中其他变量不为0时,Δ=0)。
地层水综合成因系数:
O=W1+W2-W5 (13)
式中O、O1、O2、O3、O4——地层水综合成因系数,无量纲。
地层水综合判断系数:
X1=min(W7+W8,W1+W2+W3+W4-W5-W6) (18)
X2=W5+W6-W1-W2-W3 (19)
X3=W3 (20)
X4=W1+W2-W5 (21)
Xmax=max(X1,X2,X3,X4) (23)
Y1=min(W4,W5+W6+W7+W8-W1-W2-W3) (24)
Y2=W1+W2+W3-W5-W6 (25)
Y3=W6 (26)
Y4=W5-W1-W2 (27)
Ymax=max(Y1,Y2,Y3,Y4) (29)
式中:
max()、min()——最大值函数、最小值函数;
X1、X2、X3、X4、X5——R1>1时地层水综合判断系数;
Xmax——R1>1时地层水综合判断系数最大值;
Y1、Y2、Y3、Y4、Y5——R1<1时地层水综合判断系数;
Ymax——R1<1时地层水综合判断系数最大值。
7)将步骤2)中获得的8种主要离子分为三组:第一组为Na++K+和Cl-、第二组为HCO3-+CO32-和SO42-、第三组为Mg2+和Ca2+,然后根据步骤6)计算的三组离子单位电荷毫摩尔浓度比(R1、R2、R3)确定携带单位电荷量相对较多的三种离子,即优势离子。
8)根据步骤4)中获得的单位电荷毫摩尔浓度结合离子亲和力大小顺序(图1),确定离子间单位电荷毫摩尔浓度化合的比例,在地层水中可依次形成九种盐类化合物(图2)。
9)根据步骤6)中确定的综合成因系数将地层水中8种主要离子组合分为五类(图3),再依据浓度比将地层水离子组合细分为20种类型(表2);然后根据五类20种地层水离子组合类型,结合NaCl单位电荷分数,用六个步骤即可将地层水划分为9种水型(简称“六步九分法”):NaCl、Na2SO4、MgCl2、NaHCO3、CaCl2、MgSO4、CaSO4、Mg(HCO3)2、Ca(HCO3)2(表3)。
本发明中,还以千岛湖水分析为例,阐述了鉴定水样水型的具体步骤:
第一步,首先,计算与离子含量相关的离子毫摩尔浓度、离子单位电荷毫摩尔浓度、离子单位电荷毫摩尔分数、离子单位电荷毫摩尔浓度比、地层水综合成因系数、地层水综合判断系数六类数据。由公式(1)~(3)计算千岛湖水离子毫摩尔浓度和配伍NaCl+KCl在水中的离子毫摩尔浓度(Ci、CNaCl);由公式(4)~(7)计算离子单位电荷毫摩尔浓度和配伍的NaCl+KCl在水中的单位电荷毫摩尔浓度(U·Ci、U·CNaCl);由公式(8)和(9)计算离子单位电荷毫摩尔分数和NaCl+KCl在水中单位电荷毫摩尔分数(Wi、WNaCl);由公式(10)~(12)计算离子单位电荷毫摩尔浓度比(R1、R2、R3);由公式(13)~(17)计算地层水综合成因系数(O、O1、O2、O3、O4);由公式(18)~(29)计算地层水综合判断系数(X1、X2、X3、X4、X5、Xmax、Y1、Y2、Y3、Y4、Y5、Ymax)(表4);
然后,根据离子单位电荷毫摩尔浓度比R1先将地层水分为三组,由于千岛湖水的离子单位电荷毫摩尔浓度比R1=0.93<0.99(表4),初步确定千岛湖水不属于NaCl水型(表3);
第二步,根据配伍的NaCl+KCl在水中的离子单位电荷毫摩尔分数WNaCl=0.3274<0.80(表4),最终确定千岛湖水不属于NaCl水型(表3);
第三步,根据离子单位电荷毫摩尔浓度比R3=1.43≥1(表4),判定千岛湖水属于CaCl2、CaSO4和Ca(HCO3)2三种水型中的一种(表3);
表4千岛湖水水型确定步骤表
第四步,根据综合成因系数O3=-0.62≤0.5(表4),依然将千岛湖水锁定在CaCl2、CaSO4和Ca(HCO3)2三种水型中(表3);
第五步,根据离子单位电荷毫摩尔浓度比R2=0.95<1(表4),排除了千岛湖水不是Ca(HCO3)2水型(表3);
第六步,根据地层水综合判断系数Y5=-0.51≤1(表4),确定千岛湖水属CaSO4水型(表3)。
- 还没有人留言评论。精彩留言会获得点赞!