多囊性肾病的生物标志物及其用途的制作方法
本申请要求申请日为2015年11月18日提交的美国临时专利申请序列号62/257,089的优先权,该申请的全部内容通过提述并入本文。
技术领域
本发明涉及分子医药和分子生物学的方法。
发明背景
多囊性肾病(PKD)是一种常见的遗传病症,其特征为患者肾脏中随时间充有流体的上皮内衬的(epithelial-lined)囊肿的形成(Park等,BMB Reports 44:359-368,2011)。PKD患者中的囊肿可以在数十年内在尺寸和数量上增加,并且取代和破坏邻近的肾实质,其可以最终导致患者的终末期肾病(Chapin等,J.Cell Biol.191:701-710,2010)。除了分化和极性的丧失之外,已经显示多种机制促成了PKD,包括增加的增殖和凋亡(Belibi等,Expert.Opin.Invest.Drugs 19:315-328,2010)。许多终末期PKD患者依赖于移植或血液透析以减弱肾衰竭(Park等,2011;同上)。
存在两种类型的PKD:常染色体显性PKD(ADPKD)和常染色体隐性PKD(ARPKD)。在2006年,在美国约500,000人被诊断为具有PKD,其中约500到1000人中有1人患ADPKD,而约20,000至40,000人中有1人患ARPKD。ADPKD是肾脏最常见的遗传病症,占美国的终末期肾病患者的~5%(Pei等,Adv.Chronic Kidney Dis.17:140-152,2010)。
发明概述
本发明基于(至少部分基于)如下发现:α-1-微球蛋白/bikunin前体(AMBP)的水平在包含来自具有PKD的患者的生物流体的样品(例如尿液样品)或肾脏组织(例如肾脏活组织检查样品)中是升高的,所述水平在包括来自具有较晚期PKD的患者的生物流体(例如尿液样品)或肾脏组织(例如生长活组织检查样品)的样品中与具有较早期PKD的患者中的水平相比是增加的,且所述水平在包括来自施用了治疗上有效的PKD治疗的PKD受试者的生物流体(例如尿液样品)或肾脏组织(例如肾脏活组织检查样品)的样品中是降低的。鉴于此发现,本文提供了用于确定患者中的PKD的治疗功效、诊断患者中的PKD、对患者中的PKD进行分期、以及监测患者中的PKD的方法,该方法包括确定AMBP的水平。
本文提供了确定患者中的多囊性肾病(PKD)的治疗功效的方法,其包括(a)提供包含获取自PDK患者的生物流体的第一样品;(b)确定所述第一样品中的α-1-微球蛋白/bikunin前体(AMBP)的水平;(c)对所述患者施用PKD治疗;(d)提供包含来自步骤(c)后的患者的生物流体的第二样品,并确定所述第二样品中的AMBP的水平;和(e)如果所述第二样品中的水平低于所述第一样品中的水平,则鉴定所施用的治疗为有效。在这些方法的一些实施方案中,其中所述PKD患者具有常染色体显性PKD。在这些方法的一些实施方案中,其中所述PKD患者具有常染色体隐性PKD。在这些方法的一些实施方案中,其中所述第一和第二样品包含尿液。
在这些方法的一些实施方案中,PKD治疗包含葡糖基神经酰胺合酶(glucosyl ceramide synthase,GCS)抑制剂。在这些方法的一些实施方案中,所述GCS抑制剂选自下组:(S)-奎宁环-3-基(2-(4'-(2-甲氧基乙氧基)-[1,1'-联苯基]-4-基)丙-2-基)氨基甲酸酯;4-氟-1-(5-氟-4-(4-((2-甲氧基乙氧基)甲基)苯基)嘧啶-2-基)-N-(4-甲基-1-氮杂双环[3.2.2]壬-4-基)哌啶-4-甲酰胺;4-氟-1-(4-(4-((2-甲氧基乙氧基)甲基)苯基)嘧啶-2-基)-N-(3-甲基奎宁环-3-基)哌啶-4-甲酰胺;4-氟-1-(4-(4-((2-甲氧基乙氧基)甲基)苯基)嘧啶-2-基)-N-(4-甲基-1-氮杂双环[3.2.2]壬-4-基)哌啶-4-甲酰胺;4-氟-1-(4-(4-(甲氧基甲基)苯基)嘧啶-2-基)-N-(3-甲基奎宁环-3-基)哌啶-4-甲酰胺;4-氟-1-(4-(4-(甲氧基甲基)苯基)嘧啶-2-基)-N-(4-甲基-1-氮杂双环[3.2.2]壬-4-基)哌啶-4-甲酰胺;4-氟-1-(4-(4-(2-甲氧基乙氧基)苯基)嘧啶-2-基)-N-(3-甲基奎宁环-3-基)哌啶-4-甲酰胺;4-氟-1-(4-(4-(2-甲氧基乙氧基)苯基)嘧啶-2-基)-N-(4-甲基-1-氮杂双环[3.2.2]壬-4-基)哌啶-4-甲酰胺;4-氟-1-(4-(4-(2-氟乙氧基)苯基)嘧啶-2-基)-N-(奎宁环-3-基)哌啶-4-甲酰胺;4-氟-1-(4-(4-(2-氟乙氧基)苯基)嘧啶-2-基)-N-(4-甲基-1-氮杂双环[3.2.2]壬-4-基)哌啶-4-甲酰胺;奎宁环-3-基(2-(4’-氟-[1,1’-联苯]-3-基)丙-2-基)氨基甲酸酯;和氨基甲酸,N-[1-[2-(4-氟苯基)-4-噻唑基]-1-甲基乙基]-,(3S)-1-氮杂双环[2.2.2]辛-3-基酯。
在这些方法的一些实施方案中,其进一步包括:(f)如果所述治疗被鉴定为有效,则向所述患者施用额外剂量的GCS抑制剂。在这些方法的一些实施方案中,其中所述额外剂量的GCS抑制剂包括:(S)-奎宁环-3-基(2-(4'-(2-甲氧基乙氧基)-[1,1'-联苯基]-4-基)丙-2-基)氨基甲酸酯;4-氟-1-(5-氟-4-(4-((2-甲氧基乙氧基)甲基)苯基)嘧啶-2-基)-N-(4-甲基-1-氮杂双环[3.2.2]壬-4-基)哌啶-4-甲酰胺;4-氟-1-(4-(4-((2-甲氧基乙氧基)甲基)苯基)嘧啶-2-基)-N-(3-甲基奎宁环-3-基)哌啶-4-甲酰胺;4-氟-1-(4-(4-((2-甲氧基乙氧基)甲基)苯基)嘧啶-2-基)-N-(4-甲基-1-氮杂双环[3.2.2]壬-4-基)哌啶-4-甲酰胺;4-氟-1-(4-(4-(甲氧基甲基)苯基)嘧啶-2-基)-N-(3-甲基奎宁环-3-基)哌啶-4-甲酰胺;4-氟-1-(4-(4-(甲氧基甲基)苯基)嘧啶-2-基)-N-(4-甲基-1-氮杂双环[3.2.2]壬-4-基)哌啶-4-甲酰胺;4-氟-1-(4-(4-(2-甲氧基乙氧基)苯基)嘧啶-2-基)-N-(3-甲基奎宁环-3-基)哌啶-4-甲酰胺;4-氟-1-(4-(4-(2-甲氧基乙氧基)苯基)嘧啶-2-基)-N-(4-甲基-1-氮杂双环[3.2.2]壬-4-基)哌啶-4-甲酰胺;4-氟-1-(4-(4-(2-氟乙氧基)苯基)嘧啶-2-基)-N-(奎宁环-3-基)哌啶-4-甲酰胺;4-氟-1-(4-(4-(2-氟乙氧基)苯基)嘧啶-2-基)-N-(4-甲基-1-氮杂双环[3.2.2]壬-4-基)哌啶-4-甲酰胺;奎宁环-3-基(2-(4’-氟-[1,1’-联苯]-3-基)丙-2-基)氨基甲酸酯;或氨基甲酸,N-[1-[2-(4-氟苯基)-4-噻唑基]-1-甲基乙基]-,(3S)-1-氮杂双环[2.2.2]辛-3-基酯。
在这些方法的一些实施方案中,其中所述PKD治疗包含CDK抑制剂(例如R-roscovitine或S-CR8)。这些方法的一些实施方案进一步包括:(f)如果所述治疗被鉴定为有效,则向所述患者施用额外剂量的GCS抑制剂。在这些方法的一些实施方案中,所述额外剂量的CDK抑制剂包含R-roscovitine或S-CR8。
在这些方法的一些实施方案中,在(b)和(d)中确定AMBP的水平包括确定AMBP蛋白的水平。在这些方法的一些实施方案中,(b)和(d)包括使所述样品与特异性结合至AMBP蛋白的抗体接触。
本文还提供了确定患者中的多囊性肾病(PKD)的分期的方法,其包括:(a)提供包含来自被怀疑具有PKD或被鉴定为具有PKD的患者的生物流体的样品;(b)确定所述样品中的α-1-微球蛋白/bikunin前体(AMBP)的水平;和(c)由所述水平确定所述患者中的PKD的分期。在这些方法的一些实施方案中,所述PKD是常染色体显性PKD。在这些方法的一些实施方案中,所述PKD是常染色体隐性PKD。在这些方法的一些实施方案中,所述样品包含尿液。
这些方法的一些实施方案进一步包括(d)向被鉴定为具有I期、II期、III期、IV期或V期PKD的患者分别施用针对I期、II期、III期、IV期或V期PKD的治疗。这些方法的一些实施方案进一步包括:(d)在(c)后对所述患者中的一个或两个肾脏进行成像以确认所述患者中的PKD的分期。
在这些方法的一些实施方案中,在(b)中确定AMBP的水平包括确定AMBP蛋白的水平。在这些方法的一些实施方案中,(b)包括使所述样品与特异性结合至AMBP蛋白的抗体接触。
还提供了确定患者中的多囊性肾病(PKD)的分期的方法,其包括:(a)提供包含来自被怀疑具有PKD或被鉴定为具有PKD的患者的肾脏组织的样品;(b)确定所述样品中的α-1-微球蛋白/bikunin前体(AMBP)的水平;和(c)由所述水平确定所述患者中的PKD的分期。在这些方法的一些实施方案中,所述PKD是常染色体显性PKD。在这些方法的一些实施方案中,所述PKD是常染色体隐性PKD。
这些方法的一些实施方案进一步包括:(d)向被鉴定为具有I期、II期、III期、IV期或V期PKD的患者分别施用针对I期、II期、III期、IV期或V期PKD的治疗。这些方法的一些实施方案进一步包括:(d)在(c)后对所述患者中的一个或两个肾脏进行成像以确认所述患者中的PKD的分期。
在这些方法的一些实施方案中,在(b)中确定AMBP的水平包括确定AMBP蛋白的水平。在这些方法的一些实施方案中,(b)包括使所述样品与特异性结合至AMBP蛋白的抗体接触。
还提供了诊断患者中的多囊性肾病(PKD)的方法,其包括:(a)提供包含来自被怀疑具有PKD的患者的生物流体的样品;(b)确定所述样品中的α-1-微球蛋白/bikunin前体(AMBP)的水平;和(c)如果所述水平与对照水平相比是升高的,则鉴定所述患者为具有PKD。在这些方法的一些实施方案中,所述PKD是常染色体显性PKD。在这些方法的一些实施方案中,所述PKD是常染色体隐性PKD。在这些方法的一些实施方案中,所述样品包含尿液。
这些方法的一些实施方案进一步包括:(d)向所述患者施用PKD治疗。在这些方法的一些实施方案中,所述PKD治疗包含葡糖基神经酰胺合酶(GCS)抑制剂。在这些方法的一些实施方案中,所述GCS抑制剂选自下组:(S)-奎宁环-3-基(2-(4'-(2-甲氧基乙氧基)-[1,1'-联苯基]-4-基)丙-2-基)氨基甲酸酯;4-氟-1-(5-氟-4-(4-((2-甲氧基乙氧基)甲基)苯基)嘧啶-2-基)-N-(4-甲基-1-氮杂双环[3.2.2]壬-4-基)哌啶-4-甲酰胺;4-氟-1-(4-(4-((2-甲氧基乙氧基)甲基)苯基)嘧啶-2-基)-N-(3-甲基奎宁环-3-基)哌啶-4-甲酰胺;4-氟-1-(4-(4-((2-甲氧基乙氧基)甲基)苯基)嘧啶-2-基)-N-(4-甲基-1-氮杂双环[3.2.2]壬-4-基)哌啶-4-甲酰胺;4-氟-1-(4-(4-(甲氧基甲基)苯基)嘧啶-2-基)-N-(3-甲基奎宁环-3-基)哌啶-4-甲酰胺;4-氟-1-(4-(4-(甲氧基甲基)苯基)嘧啶-2-基)-N-(4-甲基-1-氮杂双环[3.2.2]壬-4-基)哌啶-4-甲酰胺;4-氟-1-(4-(4-(2-甲氧基乙氧基)苯基)嘧啶-2-基)-N-(3-甲基奎宁环-3-基)哌啶-4-甲酰胺;4-氟-1-(4-(4-(2-甲氧基乙氧基)苯基)嘧啶-2-基)-N-(4-甲基-1-氮杂双环[3.2.2]壬-4-基)哌啶-4-甲酰胺;4-氟-1-(4-(4-(2-氟乙氧基)苯基)嘧啶-2-基)-N-(奎宁环-3-基)哌啶-4-甲酰胺;4-氟-1-(4-(4-(2-氟乙氧基)苯基)嘧啶-2-基)-N-(4-甲基-1-氮杂双环[3.2.2]壬-4-基)哌啶-4-甲酰胺;奎宁环-3-基(2-(4’-氟-[1,1’-联苯]-3-基)丙-2-基)氨基甲酸酯;和氨基甲酸,N-[1-[2-(4-氟苯基)-4-噻唑基]-1-甲基乙基]-,(3S)-1-氮杂双环[2.2.2]辛-3-基酯。在这些方法的一些实施方案中,所述PKD治疗包含CDK抑制剂(例如R-roscovitine或S-CR8)。
这些方法的一些实施方案进一步包括:(d)对所述患者中的一个或两个肾脏进行成像。在这些方法的一些实施方案中,所述对照水平是健康受试者或健康受试者群体中的水平或阈值水平。
在这些方法的一些实施方案中,在(b)中确定AMBP的水平包括确定AMBP蛋白的水平。在这些方法的一些实施方案中,(b)包括使所述样品与特异性结合至AMBP蛋白的抗体接触。
本文还提供了诊断患者中的多囊性肾病(PKD)的方法,其包括:(a)提供包含来自被怀疑具有PKD的患者的肾脏组织的样品;(b)确定所述样品中的α-1-微球蛋白/bikunin前体(AMBP)的水平;和(c)如果所述水平与对照水平相比是升高的,则将该患者鉴定为具有PKD。在这些方法的一些实施方案中,所述PKD是常染色体显性PKD。在这些方法的一些实施方案中,所述PKD是常染色体隐性PKD。
这些方法的一些实施方案进一步包括:(d)向所述受试者施用PKD治疗。在这些方法的一些实施方案中,所述PKD治疗包含葡糖基神经酰胺合酶(GCS)抑制剂。在这些方法的一些实施方案中,所述GCS抑制剂选自下组:(S)-奎宁环-3-基(2-(4'-(2-甲氧基乙氧基)-[1,1'-联苯基]-4-基)丙-2-基)氨基甲酸酯;4-氟-1-(5-氟-4-(4-((2-甲氧基乙氧基)甲基)苯基)嘧啶-2-基)-N-(4-甲基-1-氮杂双环[3.2.2]壬-4-基)哌啶-4-甲酰胺;4-氟-1-(4-(4-((2-甲氧基乙氧基)甲基)苯基)嘧啶-2-基)-N-(3-甲基奎宁环-3-基)哌啶-4-甲酰胺;4-氟-1-(4-(4-((2-甲氧基乙氧基)甲基)苯基)嘧啶-2-基)-N-(4-甲基-1-氮杂双环[3.2.2]壬-4-基)哌啶-4-甲酰胺;4-氟-1-(4-(4-(甲氧基甲基)苯基)嘧啶-2-基)-N-(3-甲基奎宁环-3-基)哌啶-4-甲酰胺;4-氟-1-(4-(4-(甲氧基甲基)苯基)嘧啶-2-基)-N-(4-甲基-1-氮杂双环[3.2.2]壬-4-基)哌啶-4-甲酰胺;4-氟-1-(4-(4-(2-甲氧基乙氧基)苯基)嘧啶-2-基)-N-(3-甲基奎宁环-3-基)哌啶-4-甲酰胺;4-氟-1-(4-(4-(2-甲氧基乙氧基)苯基)嘧啶-2-基)-N-(4-甲基-1-氮杂双环[3.2.2]壬-4-基)哌啶-4-甲酰胺;4-氟-1-(4-(4-(2-氟乙氧基)苯基)嘧啶-2-基)-N-(奎宁环-3-基)哌啶-4-甲酰胺;4-氟-1-(4-(4-(2-氟乙氧基)苯基)嘧啶-2-基)-N-(4-甲基-1-氮杂双环[3.2.2]壬-4-基)哌啶-4-甲酰胺;奎宁环-3-基(2-(4’-氟-[1,1’-联苯]-3-基)丙-2-基)氨基甲酸酯;和氨基甲酸,N-[1-[2-(4-氟苯基)-4-噻唑基]-1-甲基乙基]-,(3S)-1-氮杂双环[2.2.2]辛-3-基酯。在这些方法的一些实施方案中,所述PKD治疗包含CDK抑制剂(例如R-roscovitine或S-CR8)。
这些方法的一些实施方案进一步包括:(d)对所述患者中的一个或两个肾脏进行成像。在这些方法的一些实施方案中,所述对照水平是健康受试者或健康受试者群体中的水平或阈值水平。
在这些方法的一些实施方案中,在(b)中确定AMBP的水平包括确定AMBP蛋白的水平。在这些方法的一些实施方案中,(b)包括使所述样品与特异性结合至AMBP蛋白的抗体接触。
本文还提供了监测多囊性肾病(PKD)患者的方法,其包括:(a)提供包含获取自PKD患者的生物流体的第一样品;(b)确定所述第一样品中的α-1-微球蛋白/bikunin前体(AMBP)的水平;(c)在步骤(b)后提供包含来自所述患者的生物流体的第二样品和确定所述第二样品中的AMBP的水平;和(d)如果所述第二样品中的所述水平不高于所述第一样品中的所述水平,则鉴定所述患者为具有改善中的或静态的PKD。在这些方法的一些实施方案中,所述PKD患者具有常染色体显性PKD。在这些方法的一些实施方案中,所述PKD患者具有常染色体隐性PKD。在这些方法的一些实施方案中,其中所述第一和第二样品包含尿液。
这些方法的一些实施方案进一步包括:(e)向被鉴定为具有改善中的或静态的PKD的患者施用同样的治疗。在这些方法的一些实施方案中,在(b)和(c)中确定AMBP的水平包括确定AMBP蛋白的水平。在这些方法的一些实施方案中,(b)和(c)包括使所述样品与特异性结合至AMBP蛋白的抗体接触。
还提供了试剂盒,其包含以下、由或基本上由以下组成:特异性结合至α-1-微球蛋白/bikunin前体(AMBP)蛋白的抗体;和特异性结合至多囊性肾病另外的蛋白标志物的抗体。
如本文所用的,名词之前的词语“一个/一种(a)”表示一个或多个(种)所述具体名词。例如,短语“标志物”表示“一个或多个标志物”。
术语“患者”意指脊椎动物,包括哺乳纲动物的任何成员,包括人、家畜或牲畜、以及动物园动物、竞技动物或宠物,如小鼠、兔、猪、绵羊、山羊、牛、马(例如赛马)、和较高级的灵长类。在优选实施方案中,所述患者是人。
术语“生物流体”意指获取自哺乳动物患者的任何流体(例如血液,血浆,血清或其他血液级分,淋巴液,尿液,脑脊液,腹水,唾液,母乳,眼泪,阴道分泌物,羊水,灌洗液,精液,腺分泌物,渗出物,以及囊肿或粪便内容物)。在优选的实施方案中,生物流体是尿液、血液、血清或血浆。
除另有定义外,本文使用的所有技术和科学术语具有与本发明所属领域的普通技术人员通常理解的相同的含义。本文描述了用于本发明的方法和材料;也可以使用本领域已知的其它合适的方法和材料。材料、方法和实施例仅是说明性的,而不意欲是限制性的。本文提及的所有出版物、专利申请、专利、序列、数据库条目和其它参考文献通过提述以其整体并入。在冲突的情况下,以本说明书(包括定义)为准。
本发明的其他特征和优点会从如下详细描述和图表及权利要求书而变得明显。
附图说明
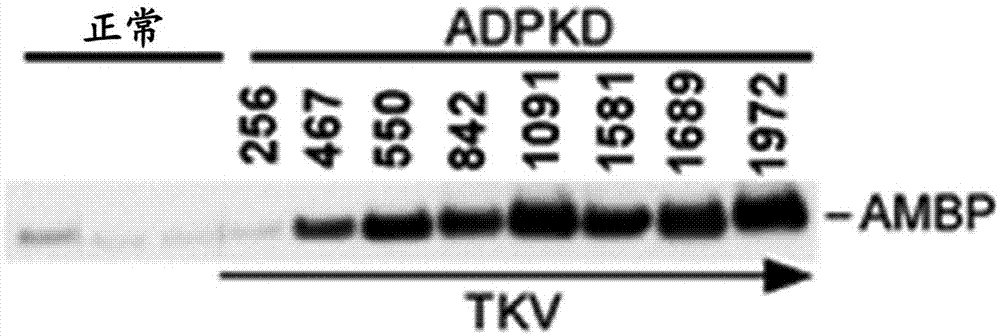
图1是显示来自两个健康患者(左边三个泳道;正常)的尿液中的AMBP的水平和来自具有范围256mL至1972mL的总肾脏容量的ADPKD患者的尿液中的AMBP蛋白的水平的免疫印迹。
图2是显示健康患者(空心圆圈;正常)和具有ADPKD的患者(黑圆圈)的尿液中AMBP蛋白的定量水平(从图1的免疫印迹定量)作为患者中的总肾脏容量的函数的图。
图3是显示来自健康患者(N;正常)和3名患有ADPKD的患者(P1、P2和P3)的肾脏裂解物中AMBP蛋白水平的免疫印迹。
图4是来自健康(正常患者)(左图)和患有ADPKD的患者(右图)的肾脏组织的免疫荧光显微照片。显示AMBP蛋白并且其定位于近端小管(PT)(由箭头指示),还显示脂蛋白脂肪酶(LTL)(一种PT的标志物)和4',6-二脒基-2-苯基吲哚(DAPI)(一种DNA染料)。
图5是显示与野生型(WT)小鼠相比,来自64日龄jck小鼠的肾脏中AMBPmRNA的折叠表达水平的图。使用RT-PCR确定来自64日龄jck小鼠和WT小鼠的肾脏中AMBP mRNA的表达。
图6是显示出生后第26、50和64天来自野生型(WT)对照小鼠和jck小鼠的肾脏裂解物中AMBP蛋白水平的免疫印迹。
图7是显示来自野生型(WT)对照小鼠和出生后第26、50和64天jck小鼠的肾裂解物中AMBP蛋白质的定量水平的图(从图6的免疫印迹定量)。
图8是野生型对照小鼠(左上图)和在出生后第26、50和64天(分别为右上、左下和右下)来自jck小鼠的肾脏组织的免疫荧光显微照片。显示了AMBP蛋白、LTL和DAPI。
图9是显示在出生后第26天、第33天、第41天、第48天和第64天从野生型小鼠和jck小鼠收集的尿液中AMBP蛋白水平的免疫印迹。
图10是显示在出生后第26天、第33天、第41天、第48天和第64天从野生型小鼠和jck小鼠收集的尿液中AMBP蛋白的定量水平的图(从图9的免疫印迹定量)。
图11是显示出生后第26天和第64天来自野生型(对照)小鼠和Pkd1cKO小鼠的肾裂解物中AMBP蛋白水平的免疫印迹。
图12是野生型(对照)小鼠(左图)、出生后26天的Pkd1cKO小鼠和出生后64天的Pkd1cKO小鼠的肾脏组织的免疫荧光显微照片。显示AMBP蛋白和LTL,“PT”表示近端管,并且“CY”表示囊肿。
图13是显示在出生后第26、33、41、48和64天从野生型(对照;C)小鼠或Pkd1cKO小鼠收集的尿液中AMBP蛋白水平的免疫印迹。
图14是显示在出生后第26、33、41、48和64天从对照(光数据)和三只Pkd1cKO小鼠收集的尿液中AMBP蛋白质的定量水平的图(从图13的免疫印迹定量)。
图15是用于测试在出生后第26天至第64天饲料中存在的0.2%roscovitine对jck小鼠中AMBP蛋白水平的影响的动物模型研究的示意图。
图16是显示在出生后第26天至第64天在饲料中接受运载体或0.2%roscovitine的64日龄jck小鼠中肾脏与体重测量值的图。
图17是显示在出生后第26天至第64天在饲料中接受运载体或0.2%roscovitine的64日龄jck小鼠的肾裂解物和尿液中AMBP蛋白质水平的图。
图18是用于测试S-CR8的不同治疗方案对jck小鼠中的囊性体积和AMBP水平的影响的动物模型研究的示意图。研究中的jck小鼠用以下S-CR8治疗方案之一(每个在出生后第26天开始)治疗:(A)每天一次腹膜内注射5周;(B)每日腹膜内注射三周,并且两周不治疗;(D)每日腹膜内注射一周,并且四周不治疗。在出生后第64天从所有小鼠收集尿液。
图19是显示在每天施用运载体五周(从出生后第26天开始)的jck小鼠和施用S-CR8治疗方案A、B和D(如图18所描述的)的jck小鼠中的囊性体积(作为体重的百分比)的图。
图20是显示出生后第64天在每天施用运载体五周(从出生后第26天开始)的jck小鼠和施用S-CR8治疗方案A、B和D(如图18所描述的)的jck小鼠中收集的尿液中AMBP蛋白水平的免疫印迹。
图21是显示出生后第64天在每天施用运载体5周(从出生后第26天开始)的小鼠和施用S-CR8治疗方案A、B和D的(如图18中所描述的)jck小鼠中收集的尿液中AMBP蛋白质的定量水平的图(从图20的免疫印迹定量)。
图22是显示在出生后第26天至第64天用GCSi长期治疗后从64日龄jck小鼠获得的尿液和肾脏裂解物中AMBP蛋白水平的免疫印迹。
发明详述
本文提供了用于确定患者中的PKD(例如ADPKD或ARPKD)的治疗功效、诊断患者中的PKD、对患者中的PKD进行分期、以及监测患者中的PKD的方法,该方法包括确定AMBP的单个或多个水平。还提供了试剂盒,其包含:特异性结合至AMBP的抗体,和特异性结合至PKD另外的蛋白标志物的抗体(例如,本文描述的或本领域已知的PKD的任何另外的蛋白标志物)。这些方法的非限制性方面描述如下。如本领域所理解的,下文描述的多种方面可以任意组合而不受限制地使用。
多囊性肾病
本文所述的方法可进一步包括鉴定或诊断患者为具有PKD的步骤。诊断患者为具有PKD的非限制性实例在本文中提供,并在下文中描述。
在其他实例中,基于对患者的如下症状的一种或多种症状的观察或评估,鉴定患者为具有PKD:高血压,背痛或侧痛,头痛,腹部尺寸增加,尿液中存在血液,尿频,肾结石,肾衰竭,尿路或肾脏感染,肾囊肿,肝囊肿,胰腺囊肿,二尖瓣脱垂,动脉瘤,恶心,呕吐,左心室肥大,疝气,憩室炎,疲乏,食欲不振,体重减轻,注意力集中困难(trouble concentrating),皮肤干燥/瘙痒,肌肉痉挛,脚和脚踝肿胀,轻度至中度抑郁和泡沫尿。还可以通过进行遗传学测试而在受试者中诊断PKD(参见例如来自多个销售商包括Athena Diagnostics(Worcester,MA)和CGC Genetics(Porto,Portugal)的PKD1遗传学诊断测试;来自多个销售商包括Centrogene AG(Germany)、PreventionGenetics(Marshfield、WI)、GCG Genetics(Portugal)和InVitae Corporation(San Francisco、CA)的PKD2遗传学诊断测试;以及可自多个销售商包括Centrogene AG(Germany)、Prevention Genetics(Marshfield、WI)、Counsyl(San Francisco、CA)和Invitae(San Francisco、CA)得到的PKHD1遗传学诊断测试)。对PKD1和/或PKD2基因的突变或缺失的检测可用来诊断ADPKD,并且对PKHD1中的突变或缺失的检测可用来诊断ARPKD。
PKD(例如ADPKD和ARPKD)可通过进行成像研究来诊断。例如超声,计算机化断层扫描成像(CT)和磁共振成像(MRI)可用来寻找肾脏上的囊肿,以及确定总肾容量(TKV)或高度调整的总肾容量(htTKV)。例如,在30岁的患者(例如具有该疾病家族史的患者)中在每个肾脏上检测到至少两个囊肿(例如至少3、4、5或6个囊肿)则可以确诊PKD。在胎儿(例如大于妊娠14周的胎儿)中检测到多囊性发育不良的肾脏可用于诊断ARPKD。此外,来自胎儿的羊水可用于检测PKHD1中的突变或缺失(例如使用本文所述或本领域已知的任何针对PKHD1的遗传学诊断测试)。
也可部分地通过确定患者的肾功能在受试者中诊断或鉴定PKD。例如,可部分地通过测量患者的肌酐水平(例如大于1.3mg/dL的肌酸酐水平指示患者具有PKD),肾小球滤过率(例如低于80mL/分钟的速率指示患者具有PKD)和血尿素氮(例如血尿素氮水平大于20mg/dL)来诊断和鉴定PKD。
本文所述的PKD患者可使用本文所述或提供的任何方法或本领域已知的任何方法来诊断或鉴定。PKD患者可为胎儿(例如胎龄大于14周、15周、17周、20周、25周、30周或35周的胎儿)、婴儿、青少年(13-18岁(例如13-15岁或15-18岁))或成人(大于18岁(例如大于20、22、24、26、28、30、32、34、36、38、40、45、50、55、60、65、70、75、80、85、90或95岁))。PKD患者可为女性(例如怀孕的女性)或可为男性。PKD患者可能已经在接受PKD治疗的。在其他实施例中,PKD患者可为未接受过PKD的治疗的。在另外的实施例中,PKD患者可接受过对PKD的先前治疗,且先前的治疗是治疗不成功的(例如导致负面不良副作用的发生,没有降低囊肿的发生和/或生长的速率,和/或不降低患者肾脏功能的损失率)。PKD患者可为临床研究的参与者。
PKD治疗
PKD的治疗的一些实例是施用一种或多种葡糖基神经酰胺合酶(GCS)抑制剂。GSC抑制剂的非限制性实例描述于Lee等(J.Biol.Chem.274:14662-14669,1999),Shayman等(Methods Enzymol.311:373-387,2000),Huang等(FASEB J.25:3661-3673,2011),Kolton等(Bioorg.Med.Chem.Lett.21:6773-6777,2011),Larsen等(J.Lipid Res.53:282-291,2012),Niino等(Biochem.Biophys.Res.Comm.433:170-174,2013),Richards等(J.Med.Chem.55:4322-4325,2012),Nietupski等(Mol.Genet.Metab.105:621-628,2012),Ashe等(PLoS One 6:e21758,2011),Shayman(Drugs Future 35:613-620,2010),Bijl等(J.Pharmacol.Exp.Ther.326:849-855,2008),Treiber等(Xenobiotica 37:298-314,2007),McEachern等(Mol.Genet.Metab.91:259-267,2007),Wennekes等(Diabetes 56:1341-1349,2007),Jimbo等(J.Biochem.127:485-291,2000),Miura等(Bioorg.Med.Chem.6:1481-1489,1998),Abe等(J.Biochem.111:191-196,1992),Inokuchi等(J.Cell Physiol.141:573-583,1989)和Inokuchi等(J.Lipid Res.28:565-571,1987)中。GCS抑制剂的其他实例描述于美国专利申请公开No.2013/0225573、2013/0137743、2013/0095089、2012/0322787、2012/0322786、2011/0184021、2011/0166134、2010/0256216和2007/0259918中(其在此通过提述并入本文)。
GCS抑制剂的其他实例描述于WO 14/043068中(其在此通过提述并入本文)。例如,GCS抑制剂可以具有如下式I所示的结构。
其中:
n是1、2或3;
m是0或1;
p是0或1;
t是0、1或2;
E是S、O、NH、NOH、NNO2、NCN、NR、NOR或NSO2R;
当m是1时X1是CR1,或当m是0时其是N;
X2是O、-NH、-CH2、SO2、NH-SO2、CH(C1-C6)烷基或–NR2;
X3是直接键、O、-NH、-CH2-、CO、-CH(C1-C6)烷基、SO2NH、-CO-NH-或NR3;
X4是直接键、CR4R5、CH2CR4R5或CH2-(C1-C6)烷基-CR4R5;
X5是直接键、O、S、SO2、CR4R5、(C1-C6)烷基、(C1-C6)烷基氧基、-O-(C1-C6)烷基、(C1-C6)烯基、(C1-C6)烯基氧基、-R7-(C3-C10)环烷基、(C3-C10)环烷基-R7-、-R7-(C6-C12)芳基、(C6-C12)芳基-R7-、-R7-(C2-C9)杂芳基、(C2-C9)杂芳基-R7-、-R7-(C2-C9)杂环烷基、和(C2-C9)杂环烷基-R7-,其中R7是直接键、O、S、SO2、CR4R5、(C1-C6)烷基、(C1-C6)烷基氧基、-O-(C1-C6)烷基、(C1-C6)烯基、(C1-C6)烯基氧基;且进一步地其中X5定义为-R7-(C3-C10)环烷基、(C3-C10)环烷基-R7-、-R7-(C6-C12)芳基、(C6-C12)芳基-R7-、-R7-(C2-C9)杂芳基、(C2-C9)杂芳基-R7-、-R7-(C2-C9)杂环烷基、和(C2-C9)杂环烷基-R7-,其中所述(C3-C10)环烷基、(C6-C12)芳基、(C2-C9)杂芳基、(C2-C9)杂环烷基基团由选自下组的一个或多个取代基任选取代:卤素、(C1-C6)烷基、(C1-C6)烯基、氨基、(C1-C6)烷基氨基、(C1-C6)二烷基氨基、(C1-C6)烷氧基、O(C3-C6环烷基)、(C3-C6)环烷氧基、硝基、CN、OH、(C1-C6)烷基氧基、(C3-C6)环烷基、(C1-C6)烷氧基羰基、(C1-C6)烷基羰基、(C1-C6)卤素烷基、(C2-C9)杂环烷基、R8R9N-CO-,其中R8和R9各自独立选自氢和(C1-C6)烷基,或R8和R9可以与其所连接的氮一起形成(C2-C9)杂环烷基或任选地由1-3个卤素基团取代的(C2-C9)杂环烷基,任选地由选自(C1-C6)烷氧基和(C3-C10)环烷基的一个或两个基团取代的(C1-C6)烷基磺酰基;
由选自下组的1-4个取代基取代的(C1-C6)烷基:卤素、羟基、氰基、(C1-C6)烷氧基、(C1-C6)烷氧基(C1-C6)烷氧基、(C2-C9)杂环烷基、由(C1-C6)烷氧基任选取代的(C2-C9)杂芳基;或由(C1-C6)烷氧基任选取代的(C3-C10)环烷氧基;和
由选自下组的1-4个取代基取代的(C1-C6)烷基氧基:卤素、羟基、氰基、(C1-C6)烷氧基、(C1-C6)烷氧基(C1-C6)烷氧基、(C2-C9)杂环烷基、由(C1-C6)烷氧任选取代的(C2-C9)杂芳基;或由(C1-C6)烷氧基任选取代的(C3-C10)环烷氧基;
R是(C6-C12)芳基、(C2-C9)杂芳基、(C1-C6)烷基、(C2-C9)杂芳基(C1-C6)烷基;
R1是H、CN、(C1-C6)烷基羰基或(C1-C6)烷基;
R2和R3各自独立地是-H、由选自下组的一个或多个取代基任选取代的(C1-C6)烷基:卤素、(C1-C6)烷基、(C6-C12)芳基、(C2-C9)杂芳基、(C1-C6)烷基(C6-C12)芳基、卤素(C6-C12)芳基、和卤素(C2-C9)杂芳基,或任选地当X2是-NR2且X3是-NR3时,R2和R3可与其连接的氮一起形成非芳香族杂环,其任选地由选自下组的一个或多个取代基取代:卤素、(C1-C6)烷基、(C6-C12)芳基、(C2-C9)杂芳基、(C1-C6)烷基(C6-C12)芳基、卤素(C6-C12)芳基、和卤素(C2-C9)杂芳基;
R4和R5独立地选自H、(C1-C6)烷基或与其连接的碳一起形成螺(C3-C10)环烷基环或螺(C3-C10)环烷氧基环;
R6是-H、卤素、-CN、(C6-C12)芳基、(C6-CI2)芳基氧基、(C1-C6)烷基氧基;由1-4个卤素或(C1-C6)烷基任选取代的(C1-C6)烷基;
A1是(C2-C6)炔基;(C3-C10)环烷基,(C6-C12)芳基,(C2-C9)杂芳基,(C2-C9)杂环烷基或苯并(C2-C9)杂环烷基,其中A1由选自下组的一个或多个取代基任选取代:卤素,由1-3个卤素任选取代的(C1-C6)烷基;(C1-C6)烯基,氨基,(C1-C6)烷基氨基,(C1-C6)二烷基氨基,(C1-C6)烷氧基,硝基,CN,-OH,由1-3个卤素任选取代的(C1-C6)烷基氧基;(C1-C6)烷氧基羰基,和(C1-C6)烷基羰基;
A2是H,(C3-C10)环烷基,(C6-C12)芳基,(C2-C9)杂芳基,(C2-C9)杂环烷基或苯并(C2-C9)杂环烷基,其中A2由选自下组的一个或多个取代基任选取代:卤素,(C1-C6)烷基,(C1-C6)烯基,氨基,(C1-C6)烷基氨基,(C1-C6)二烷基氨基,(C1-C6)烷氧基,O(C3-C6环烷基),(C3-C6)环烷氧基,硝基,CN,OH,(C1-C6)烷基氧基,(C3-C6)环烷基,(C1-C6)烷氧基羰基,(C1-C6)烷基羰基,(C1-C6)卤素烷基,(C2-C9)杂环烷基,R8R9N-CO-,其中R8和R9各自独立地选自下组:氢和(C1-C6)烷基或R8和R9可以与其连接的氮一起形成(C2-C9)杂环烷基或由1-3个卤素基团任选取代的(C2-C9)杂环烷基,由选自(C1-C6)烷氧基和(C3-C10)环烷基的1或2个基团任选取代的(C1-C6)烷基磺酰基;
由选自下组的1-4个取代基取代的(C1-C6)烷基:卤素、羟基,氰基,(C1-C6)烷氧基,(C1-C6)烷氧基(C1-C6)烷氧基,(C2-C9)杂环烷基,由(C1-C6)烷氧基任选取代的(C2-C9)杂芳基;或由(C1-C6)烷氧基任选取代的(C3-C10)环烷氧基;和
由1-4个选自下组的取代基取代的(C1-C6)烷基氧基:卤素,氰基,(C1-C6)烷氧基,(C1-C6)烷氧基(C1-C6)烷氧基,(C2-C9)杂环烷基,由(C1-C6)烷氧基任选取代的(C2-C9)杂芳基;或由(C1-C6)烷氧基任选取代的(C3-C10)环烷氧基;
条件是n+t+Y+z的总和不大于6;
条件是当p是0;X2是NH-SO2且X3是NH;
条件是当n是1;t是O;y是1;z是1;X2是NH;E是O;X3是NH;A2是H且X5是直接键;A1不是未取代的苯基,卤素苯基或异丙烯基苯基;
条件是当n是1;t是O;y是1;z是1;X2是O;E是O;X3是NH;A1是(C6-C12)芳基且X5是直接键;A2是H且R4是H,则R5不是环己基;且
条件是当X3是O,-NH,-CH2-,CO,-CH(C1-C6)烷基,SO2NH,-CO-NH-或-NR3;且X4是CR4R5,CH2CR4R5或CH2-(C1-C6)烷基-CR4R5;则A2必须是(C3-C10)环烷基,(C6-C12)芳基,(C2-C9)杂芳基,(C2-C9)杂环烷基或苯并(C2-C9)杂环烷基,其由一个或多个选自下组的取代基取代:(C2-C9)杂环烷基,R8R9N-CO-,其中R8和R9各自独立地选自氢和(C1-C6)烷基,或R8和R9可与其连接的氮一起形成(C2-C9)杂环烷基或由1-3个卤素基团任选取代的(C2-C9)杂环烷基,由选自(C1-C6)烷氧基和(C3-C10)环烷基的一个或两个基团任选取代的(C1-C6)烷基磺酰基;
由1-4个选自下组的取代基取代的(C1-C6)烷基:羟基,氰基,(C1-C6)烷氧基,(C1-C6)烷氧基(C1-C6)烷氧基,(C2-C9)杂环烷基,由(C1-C6)烷氧基任选取代的(C2-C9)杂芳基;或由(C1-C6)烷氧基任选取代的(C3-C10)环烷氧基;或
由1-4个选自下组的取代基取代的(C1-C6)烷基氧基:羟基,氰基,(C1-C6)烷氧基,(C1-C6)烷氧基(C1-C6)烷氧基,(C2-C9)杂环烷基,由(C1-C6)烷氧基任选取代的(C2-C9)杂芳基;或由(C1-C6)烷氧基任选取代的(C3-C10)环烷氧基。
其他例示性的GCS抑制剂包括:
l-氮杂双环[2.2.2]辛-3-基[2-(2,4'-二氟联苯-4-基)丙-2-基]氨基甲酸酯;
l-氮杂双环[2.2.2]辛-3-基{2-[4-(1,3-苯并噻唑-6-基)苯基]丙-2-基}氨基甲酸酯;
l-氮杂双环[3.2.2]壬-4-基{1-[5-(4-氟苯基)吡啶-2-基]环丙基}氨基甲酸酯;
l-氮杂双环[2.2.2]辛-3-基{1-[3-(4-氟苯氧基)苯基]环丙基}氨基甲酸酯;
l-氮杂双环[2.2.2]辛-3-基{1-[4-(1,3-苯并噻唑-5-基)苯基]环丙基}氨基甲酸酯;
l-氮杂双环[2.2.2]辛-3-基[1-(4'-氟-3'-甲氧基联苯基-4基)环丙基]氨基甲酸酯;
l-氮杂双环[2.2.2]辛-3-基[3-(4'-氟联苯-4-基)氧杂环丁烷-3-基]氨基甲酸酯;
l-氮杂双环[2.2.2]辛-3-基{1-[6-(4-氟苯氧基)吡啶-2-基]环丙基}氨基甲酸酯;
l-氮杂双环[2.2.2]辛-3-基[3-(4'-氟联苯-4-基)戊-3-基]氨基甲酸酯;
l-氮杂双环[2.2.2]辛-3-基{2-[2-(4-氟苯基)-2H-吲唑-6-基]丙-2-基}氨基甲酸酯;
l-氮杂双环[2.2.2]辛-3-基{2-[2-(IH-吡咯-1-基)吡啶-4-基]丙-2-基}氨基甲酸酯;
1-(3-乙基-l-氮杂双环[2.2.2]辛-3-基)-3-[1-(4'-氟联苯-4-基)环丙基]脲;
N-(I-氮杂双环[2.2.2]辛-3-基)-N'-[I-(4'-氟联苯基-4基)环丙基]乙二酰胺;
l-氮杂双环[2.2.2]辛-3-基(1-{4[(4,4二氟环己基)氧基]苯基}环丙基)氨基甲酸酯;
1-(4-甲基-l-氮杂双环[3.2.2]壬-4-基)-3-[1-(5-苯基吡啶-2-基)环丙基]脲;
1-[1-(4'-氟联苯-4-基)环丙基]-I-甲基-3-(3-甲基-l-氮杂双环[2.2.2]辛-3-基)脲;
1-[1-(4'-氟联苯-4-基)环丙基]-I-甲基-3-(3-甲基-l-氮杂双环[2.2.2]辛-3-基)脲;
1-{2-[4'-(2-甲氧基乙氧基)联苯-4-基]丙-2-基}-3-(3-甲基-l氮杂双环[2.2.2]辛-3-基)脲;
2-(l-氮杂双环[3.2.2]壬-4-基)-N-[1-(5-苯基吡啶-2-基)环丙基]乙酰胺;
3-(4'-氟联苯-4-基)-3-甲基-N-(4-甲基-l-氮杂双环[3.2.2]壬-4-5基)丁酰胺;
N-[2-(联苯-4-基)丙-2-基]-N'-(3-甲基-l-氮杂双环[2.2.2]辛-3-基)硫酸二酰胺;
N-[2-(4'-氟联苯-4-基)丙-2-基]-N'-(3-甲基-l-氮杂双环[2.2.2]辛-3-基)硫酸二酰胺;
1-(3-丁基-l-氮杂双环[2.2.2]辛-3-基)-3-{2-[1-(4-氟苯基)-IH-吡唑-4-基]丙-2-基}脲;
l-氮杂双环[2.2.2]辛-3-基[4-(4-氟苯基)-2-甲基丁-3-2-基]氨基甲酸酯;
1-(3-丁基-l-氮杂双环[2.2.2]辛-3-基)-3-[4-(4-氟苯基)-2-甲基丁-3-2-基]脲;
N-[I-(4'-氟联苯-4-基)环丙基]-1,4-二氮杂双环[3.2.2]壬烷-4-甲酰胺;
1-(2-(4'-氟-[I,1'-联苯基]-4-基)丙-2-基)-3-(3-甲基-l-氮杂双环[3.2.2]壬-3-基)脲;
1-(2-(4'-氟-[I,1'-联苯基]-4-基)丙-2-基)-3-(4-甲基-l-氮杂双环[4.2.2]癸-4-基)脲;
1-(2-(4'-氟-[I,1'-联苯基]-4-基)丙-2-基)-3-(3-甲基-l-氮杂双环[4.2.2]癸-3-基)脲;和
1-(2-(4'-氟-[1,1'-联苯基]-4-基)丙-2-基)-3-(5-甲基-l-氮杂双环[4.2.2]癸-5-基)脲。
GCS抑制剂的额外实例列举如下:
((S)-奎宁环-3-基(2-(4'-(2-甲氧基乙氧基)-[1,1'-联苯基]-4-基)丙-2-基)氨基甲酸酯)
(4-氟-1-(5-氟-4-(4-((2-甲氧基乙氧基)甲基)苯基)嘧啶-2-基)-N-(4-甲基-1-氮杂双环[3.2.2]壬-4-基)哌啶-4-甲酰胺)
(4-氟-1-(4-(4-((2-甲氧基乙氧基)甲基)苯基)嘧啶-2-基)-N-(3-甲基奎宁环-3-基)哌啶-4-甲酰胺)
(4-氟-1-(4-(4-((2-甲氧基乙氧基)甲基)苯基)嘧啶-2-基)-N-(4-甲基-1-氮杂双环[3.2.2]壬-4-基)哌啶-4-甲酰胺)
(4-氟-1-(4-(4-(甲氧基甲基)苯基)嘧啶-2-基)-N-(3-甲基奎宁环-3-基)哌啶-4-甲酰胺)
(4-氟-1-(4-(4-(甲氧基甲基)苯基)嘧啶-2-基)-N-(4-甲基-1-氮杂双环[3.2.2]壬-4-基)哌啶-4-甲酰胺)
(4-氟-1-(4-(4-(2-甲氧基乙氧基)苯基)嘧啶-2-基)-N-(3-甲基奎宁环-3-基)哌啶-4-甲酰胺)
(4-氟-1-(4-(4-(2-甲氧基乙氧基)苯基)嘧啶-2-基)-N-(4-甲基-1-氮杂双环[3.2.2]壬-4-基)哌啶-4-甲酰胺)
(4-氟-1-(4-(4-(2-氟乙氧基)苯基)嘧啶-2-基)-N-(奎宁环-3-基)哌啶-4-甲酰胺)
(4-氟-1-(4-(4-(2-氟乙氧基)苯基)嘧啶-2-基)-N-(4-甲基-1-氮杂双环[3.2.2]壬-4-基)哌啶-4-甲酰胺)
GCS抑制剂的另外的实例是:氨基甲酸,N-[1-[2-(4-氟苯基)-4-噻唑基]-1-甲基乙基]-,(3S)-1-氮杂双环[2.2.2]辛-3-基酯,如由下式II表示的:
GCS抑制剂的另外的实例是:奎宁环-3-基(2-(4’-氟-[1,1’-联苯]-3-基)丙-2-基)氨基甲酸酯,如由下式III表示的:
针对PKD的治疗的一些实例包括施用一种或多种周期蛋白依赖性激酶(CDK)抑制剂。CDK抑制剂的非限制性实例包括S-CR8、奥罗莫星(olomoucine)、LEE011、帕博西尼(palbociclib)、P1446A-05、PD-0332991、和R-ROSCOVITINE。CDK抑制剂的其他实例描述于Cicenas等(J.Cancer Res.Clin.Oncol.138:1409-1418,2011)、Blachly等(Leuk.Lymphoma 54:2133-2143,2013),Galons等(Expert Opin.Ther.Pat.20:377-404,2010)、Geyer等(Biochim.Biophys.Acta 1754:160-170,2005)中。CDK抑制剂另外的实例描述于美国专利申请公开号2006/0178371、2006/0173017、2006/0173016、2006/0135589、2006/0128725、2006/0106023、2006/0041131、2006/0040958、2006/0030555、2005/0261353、2005/0130980、2005/0004007、2004/0248905、2004/0209878、2004/0198757、2004/0116442、2004/0110775、2004/0106624、2004/0102451、2004/0097517、2004/0097516、2004/0073969、2004/0072835、2004/0063715、2004/0048849、2004/0006074、2003/0073686、2002/0065293、2002/0042412、2002/0013328、2002/0002178和2001/0025379中。
针对PKD的治疗的另一实例是血液透析或腹膜透析。针对PKD的治疗的进一步实例是肾脏的手术移植。
确定标志物的水平
本文提供的方法包括在来自患者(例如PKD患者)的至少一个样品中确定标志物(例如AMBP和/或AMBP以及PKD的至少一个另外的标志物)的水平。例如,可在包括来自患者(例如PKD患者)的生物流体(例如尿液)或肾脏组织(例如肾脏活组织检查样品)的样品中确定标志物(例如AMBP和/或AMBP以及PKD的至少一个另外的标志物)的水平。在一些实例中,该标志物是蛋白质。在其他实例中,该标志物是编码标志物蛋白的mRNA。
用于确定本文所述的标志物(例如AMBP或AMBP以及PKD的一种或多种另外的标志物)的水平的方法是本领域中充分理解的。例如,本文所述的标志物(例如AMBP或AMBP以及PKD的一种或多种另外的标志物)的蛋白水平可用基于抗体的测定(例如酶联免疫吸附测定、抗体阵列、抗体标记的珠粒或免疫印迹)来确定。可用于这些基于抗体的测定的例示性抗体描述于实施例中。可用于基于抗体的测定的其他抗体是本领域已知的。特异性结合至人AMBP的抗体的非限制性实例可商购自Santa Cruz Biotechnology(Dallas,TX)、Thermo Fisher Scientific(Waltham,MA)和Altas Antibodies(Stockholm,Sweden)。特异性结合至PCNA的抗体的非限制性实例可商购自Santa Cruz Biotechnology(Dallas,TX)、Abcam(Cambridge,MA)和Acris Antibodies(San Diego,CA)。特异性结合至周期蛋白D1的抗体的非限制性实例可商购自Santa Cruz Biotechnology(Dallas,TX)、Cell Signaling Technology(Danvers,MA)和Abcam(Cambridge,MA)。特异性结合至周期蛋白D3的抗体的非限制性实例可商购自Santa Cruz Biotechnology(Dallas,TX)、Abcam(Cambridge,MA)和Novus Biologicals(Littleton,CO)。特异性结合至MEK的抗体的非限制性实例可商购自Santa Cruz Biotechnology(Dallas,TX)、Sigma-Aldrich(St.Louis,MO)和Cell Signaling Technology(Danvers,MA)。特异性结合至S6的抗体的非限制性实例可商购自Santa Cruz Biotechnology(Dallas,TX)、Thermo Fisher Scientific(Waltham,MA)和GenWay Biotech.Inc.(San Diego,CA)。特异性结合至pS6的抗体的非限制性实例可商购自Cell Signaling Technology(Danvers,MA)、Abcam(Cambridge,MA)和Abbiotec(San Diego,CA)。特异性结合至ERK的抗体的非限制性实例可商购自Cell Signaling Technology(Danvers,MA)、Santa Cruz Biotechnology(Dallas,TX)和Thermo Fisher Scientific(Waltham,MA)。特异性结合至pERK的抗体的非限制性实例可商购自Cell Signaling Technologies(Danvers,MA)、EMD Millipore(Billerica,MA)和eBioscience(San Diego,CA)。特异性结合至AKT的抗体的非限制性实例可商购自Cell Signaling Technologies(Danvers,MA)、Abcam(Cambridge,MA)和Santa Cruz Biotechnology(Dallas,TX)。特异性结合至pAkt的抗体的非限制性实例可商购自Cell Signaling Technologies(Dallas,TX)、EMD Millipore(Billerica,MA)和Signalway Antibody(College Park,MD)。特异性结合至胱天蛋白酶-2的抗体的非限制性实例可商购自Santa Cruz Biotechnology(Dallas,TX)、Acris Antibodies(San Diego,CA)和Abcam(Cambridge,MA)。特异性结合至RBBP的抗体的非限制性实例可商购自Santa Cruz Biotechnology(Dallas,TX)。
制备特异性结合至标志物(例如AMBP或本文所述的PKD的任何另外的标志物)的抗体的方法也是本领域公知的。用于确定标志物的蛋白水平的其他方法包括质谱法、液相色谱(例如高效液相色谱)质谱法(LC-MS)和液相色谱(例如高效液相色谱)串联质谱法(LC-MS/MS)。用于确定包含生物流体的样品中标志物的蛋白水平的方法的非限制性实例描述于Pisitkun等(Proteomics Clin.Appl.6:268-278,2012)中。这些确定标志物(例如AMBP或AMBP和PKD的至少一个另外的标志物)的水平的例示性方法可用于本文提供的任何方法。
本文所述的标志物(例如AMBP或AMBP和PKD的至少一个另外的标志物)的mRNA水平可例如使用基于聚合酶链式反应(PCR)的测定(例如实时PCR和逆转录PCR)来确定。用于确定各种标志物的mRNA水平另外的方法包括使用基因芯片。用于确定含生物流体的样品中标志物的mRNA水平的方法的进一步实例描述于Chen等(Lab Chip 10:505-511,2010),Schageman等(BioMed Res.Int.,文献号253957,2013)和Alvarez等(Kidney Inter.82:1024-1032,2012)中。用于确定标志物的mRNA水平另外的方法是本领域公知的。
在一些实例中,来自受试者的样品(例如含有生物流体或肾脏组织的样品,诸如肾脏活组织检查样品)在确定样品中的至少一个标志物的水平之前可储存一段时间(例如储存至少1小时(例如至少2、4、6、8、12或24小时,或至少1、2、3、4、5、6、7、14或21天),例如储存于约10℃、约0℃、约-20℃、约-40℃、约-70℃或约-80℃的温度)。一些实例进一步包括在确定标志物(例如AMBP或AMBP和PKD的至少一个另外的标志物)的水平之前浓缩包括生物流体的样品的步骤。
AMBP的水平(和任选地PKD的至少一个另外的标志物的水平)可在本文所述的任何方法中的样品(例如含有生物流体或肾脏组织的样品(例如肾脏活组织检查样品))中确定。下文提供AMBP和示例性的另外的PKD标志物的描述。
AMBP
α-1-微球蛋白/bikunin前体(AMBP)是一种39kDa的前原蛋白,其具有352个氨基酸。人AMBP的氨基酸序列示于SEQ ID NO:1。AMBP通常在细胞内被消化以首先除去信号序列(SEQ ID NO:1的前19个氨基酸)而产生前原蛋白(本文示为SEQ ID NO:2),然后进一步通过蛋白酶切割以产生三种不同下游蛋白产物:α-1-微球蛋白(具有SEQ ID NO:3所示的氨基酸序列)、bikunin(具有SEQ ID NO:4所示的氨基酸序列)和胰蛋白酶抑制素(具有SEQ ID NO:5所示的氨基酸序列)。人AMBP(即,SEQ ID NO:1)可在SEQ ID NO:1的一个或多个以下氨基酸位置处糖基化:氨基酸位置24处的苏氨酸、氨基酸位置36处的天冬酰胺、氨基酸位置115处的天冬酰胺、氨基酸位置215处的丝氨酸和氨基酸位置250处的天冬酰胺。当测量AMBP的蛋白水平时,测量的水平可包括非糖基化的形式的AMBP和一种或多种形式的已经在一个或多个氨基酸位置被糖基化的AMBP。
PKD另外的标志物
在本文所述的任何方法中,可确定PKD的至少一个(例如2、3、4、5、6、7、8、9、10、11、12或13个)另外的标志物的一个水平或多个水平(例如,以任意组合,诸如在美国临时专利申请系列号62/033,031中所述的那些)。PKD另外的标志物的非限制性实例在下文描述。
PCNA
增殖细胞核抗原(PCNA)是一种28.8kDa的蛋白,其具有261个氨基酸。人PCNA的氨基酸序列是SEQ ID NO:6。当测量PCNA的蛋白水平时,测量的水平可包括在SEQ ID NO:6中氨基酸位置248的酪氨酸处非磷酸化的和磷酸化的PCNA形式,仅包括在SEQ ID NO:6中氨基酸位置248的酪氨酸处磷酸化的PCNA形式,或仅包括PCNA的非磷酸化形式。
周期蛋白D1
周期蛋白D1是一种33.7kDa的蛋白,其具有295个氨基酸。人周期蛋白D1的氨基酸序列是SEQ ID NO:7。当测量周期蛋白D1的蛋白水平时,测量的水平可包括在SEQ ID NO:7中氨基酸位置286的苏氨酸处非磷酸化的和磷酸化的周期蛋白D1形式,仅包括在SEQ ID NO:7中氨基酸位置286的苏氨酸处磷酸化的周期蛋白D1形式,或仅包括周期蛋白D1的非磷酸化形式。
周期蛋白D3
周期蛋白D3是一种具292个氨基酸的蛋白。人周期蛋白D3的氨基酸序列是SEQ ID NO:8。当测量周期蛋白D3的蛋白水平时,测量的水平可包括在SEQ ID NO:8中氨基酸位置279的丝氨酸处非磷酸化的和磷酸化的周期蛋白D3形式,仅包括在SEQ ID NO:8中氨基酸位置279的丝氨酸处磷酸化的周期蛋白D3形式,或仅包括周期蛋白D3的非磷酸化形式。
MEK
MAPK-ERK激酶1(MEK)是具有两个同种型的蛋白。人MEK的第一同种型具有393个氨基酸的序列(如SEQ ID NO:9所示),而人MEK的第二同种型具有367个氨基酸的序列(如SEQ ID NO:10所示)。当测量MEK的蛋白水平时,该水平可包括如下的一项或多项:MEK的第一同种型的非磷酸化形式;MEK的第二同种型的非磷酸化形式;包括在SEQ ID NO:9的氨基酸位置218的丝氨酸处的磷酸化、在SEQ ID NO:9的氨基酸位置222的丝氨酸处的磷酸化、在SEQ ID NO:9的氨基酸位置286的苏氨酸处的磷酸化、在SEQ ID NO:9的氨基酸位置292的苏氨酸处的磷酸化和在SEQ ID NO:9的氨基酸位置298的丝氨酸处的磷酸化的MEK的第一同种型的一个或多个形式;和包括在SEQ ID NO:10的氨基酸位置192的丝氨酸处的磷酸化、在SEQ ID NO:10的氨基酸位置196的丝氨酸处的磷酸化、在SEQ ID NO:10的氨基酸位置260的苏氨酸处的磷酸化、在SEQ ID NO:10的氨基酸位置266的苏氨酸处的磷酸化、和在SEQ ID NO:10的氨基酸位置272的丝氨酸处的磷酸化的MEK的第二同种型的一个或多个形式。
S6、pS6和总S6
核糖体蛋白S6(S6)是一种28.7kDa的蛋白,其具有249个氨基酸。人S6的氨基酸序列示于SEQ ID NO:11。短语“S6的水平”、“总S6”或“核糖体蛋白S6的水平”当指蛋白水平时,可包括所有可检测形式的S6的水平的总和(例如全部磷酸化形式和非磷酸化形式)。S6蛋白的磷酸化形式可包括如下的一项或多项:在SEQ ID NO:11的氨基酸位置235处的丝氨酸的磷酸化,在SEQ ID NO:11的氨基酸位置236处的丝氨酸的磷酸化,在SEQ ID NO:11的氨基酸位置240处的丝氨酸的磷酸化,在SEQ ID NO:11的氨基酸位置242处的丝氨酸的磷酸化,在SEQ ID NO:11的氨基酸位置244处的丝氨酸的磷酸化和在SEQ ID NO:11的氨基酸位置247处的丝氨酸的磷酸化。在一些实施方案中,S6的水平可通过使用结合至抗原的抗体来确定,所述抗原是S6的所有可检测形式(例如全部磷酸化形式和非磷酸化形式)的共同抗原。
短语“pS6的水平”或“核糖体蛋白pS6的水平”,当指蛋白水平时,意指具有如下的核糖体S6蛋白的磷酸化形式的一个或多个的水平(或两个或更多个的水平的总和):在SEQ ID NO:11的氨基酸位置235的丝氨酸处的磷酸化,在SEQ ID NO:11的氨基酸位置236的丝氨酸处的磷酸化,或在SEQ ID NO:11的氨基酸位置235和236的丝氨酸处的磷酸化。可例如使用特异性结合至S6中的表位的一种或多种抗体来确定pS6的水平,所述S6包括SEQ ID NO:11的氨基酸位置235的丝氨酸处的磷酸化和/或SEQ ID NO:11的氨基酸位置236的丝氨酸处的磷酸化。
ERK
短语“ERK水平”,当指蛋白水平时,可包括所有可检测形式的ERK1(例如ERK1的各个同种型的全部磷酸化形式和非磷酸化形式)和/或所有可检测形式的ERK2(例如全部磷酸化形式和非磷酸化形式)的水平的总和。人ERK1的第一同种型具有379个氨基酸的序列(如SEQ ID NO:12所示)。人ERK1的第二同种型具有335个氨基酸的序列(如SEQ ID NO:13所示)。人ERK1的第三同种型具有357个氨基酸的序列(如SEQ ID NO:14所示)。人ERK2的第一同种型具有360个氨基酸的序列(如SEQ ID NO:15所示)。人ERK2的第二同种型具有316个氨基酸的序列(如SEQ ID NO:16所示)。
ERK1的第一同种型的磷酸化形式可包括如下的一项或多项:SEQ ID NO:12的氨基酸位置170处的丝氨酸的磷酸化、SEQ ID NO:12的氨基酸位置198处的苏氨酸的磷酸化、SEQ ID NO:12的氨基酸位置202处的苏氨酸的磷酸化、SEQ ID NO:12的氨基酸位置204处的酪氨酸的磷酸化和SEQ ID NO:12的氨基酸位置207处的苏氨酸的磷酸化。ERK1的第二同种型的磷酸化形式可包括如下的一项或多项:SEQ ID NO:13的氨基酸位置170处的丝氨酸的磷酸化、SEQ ID NO:13的氨基酸位置198处的苏氨酸的磷酸化、SEQ ID NO:13的氨基酸位置202处的苏氨酸的磷酸化、SEQ ID NO:13的氨基酸位置204处的酪氨酸的磷酸化和SEQ ID NO:13的氨基酸位置207处的苏氨酸的磷酸化。ERK1的第三同种型的磷酸化形式可包括如下的一项或多项:SEQ ID NO:14的氨基酸位置170处的丝氨酸的磷酸化、SEQ ID NO:14的氨基酸位置198处的苏氨酸的磷酸化、SEQ ID NO:14的氨基酸位置202处的苏氨酸的磷酸化、SEQ ID NO:14的氨基酸位置204处的酪氨酸的磷酸化和SEQ ID NO:14的氨基酸位置207处的苏氨酸的磷酸化。ERK1的所有可检测形式可例如通过如下方式来鉴定:使用特异性结合至ERK1的第一、第二、和第三同种型的非磷酸化形式以及ERK1的第一、第二、和第三同种型的所有各种磷酸化形式的共享表位的抗体。
ERK2的第一同种型的磷酸化形式可包括如下的一项或多项:SEQ ID NO:15的氨基酸位置29位的丝氨酸处的磷酸化、SEQ ID NO:15的氨基酸位置185处的苏氨酸的磷酸化、SEQ ID NO:15的氨基酸位置187处的酪氨酸的磷酸化、SEQ ID NO:15的氨基酸位置190处的苏氨酸的磷酸化、SEQ ID NO:15的氨基酸位置246处的丝氨酸的磷酸化、SEQ ID NO:15的氨基酸位置248处的丝氨酸的磷酸化和SEQ ID NO:15的氨基酸位置284处的丝氨酸的磷酸化。ERK2的第二同种型的磷酸化形式可包括如下的一项或多项:SEQ ID NO:16的氨基酸位置29位的丝氨酸处的磷酸化、SEQ ID NO:16的氨基酸位置185处的苏氨酸的磷酸化、SEQ ID NO:16的氨基酸位置187处的酪氨酸的磷酸化和SEQ ID NO:16的氨基酸位置190处的苏氨酸的磷酸化。ERK2的所有可检测形式可例如使用特异性结合至ERK2的第一和第二同种型的非磷酸化形式以及ERK2的第一和第二同种型的所有各种磷酸化形式的共同表位的抗体来鉴定。
pERK
短语“pERK水平”,当指蛋白水平时,可包括如下一项或多项的水平(或两项或更多项所述水平的总和):具有SEQ ID NO:12的氨基酸位置202的苏氨酸处的磷酸化的ERK1的第一同种型的形式、具有SEQ ID NO:12的氨基酸位置204的酪氨酸处的磷酸化的ERK1的第一同种型的形式、具有SEQ ID NO:12的氨基酸位置202的苏氨酸和位置204的酪氨酸处的磷酸化的ERK1的第一同种型、具有SEQ ID NO:13的氨基酸位置202的苏氨酸处的磷酸化的ERK1的第二同种型的形式、具有SEQ ID NO:13的氨基酸位置204的酪氨酸处的磷酸化的ERK1的第二同种型的形式、具有SEQ ID NO:13的氨基酸位置202的苏氨酸和位置204的酪氨酸处的磷酸化的ERK1的第二同种型的形式、具有SEQ ID NO:14的氨基酸位置202的苏氨酸处的磷酸化的ERK1的第三同种型的形式、具有SEQ ID NO:14的氨基酸位置204的酪氨酸处的磷酸化的ERK1的第三同种型的形式、具有SEQ ID NO:14的氨基酸位置202的苏氨酸和位置204的酪氨酸处的磷酸化的ERK1的第三同种型的形式、具有SEQ ID NO:15的氨基酸位置185的苏氨酸处的磷酸化的ERK2的第一同种型的形式、具有SEQ ID NO:15的氨基酸位置187的酪氨酸处的磷酸化的ERK2的第一同种型的形式、具有SEQ ID NO:15的氨基酸位置185的苏氨酸和位置187的酪氨酸处的磷酸化的ERK2的第一同种型的形式、具有SEQ ID NO:16的氨基酸位置185的苏氨酸处的磷酸化的ERK2的第二同种型的形式、具有SEQ ID NO:16的氨基酸位置187的酪氨酸处的磷酸化的ERK2的第二同种型的形式和具有SEQ ID NO:16的氨基酸位置185的苏氨酸和位置187的酪氨酸处的磷酸化的ERK2的第二同种型的形式。pERK的水平可例如使用特异性结合至ERK1的第一、第二和第三同种型(分别包括SEQ ID NO:12、13或14的氨基酸位置202处的磷酸化的苏氨酸和/或SEQ ID NO:12、13或14的氨基酸位置204处的磷酸化的酪氨酸)中的表位的抗体,或特异性结合至ERK2的第一或第二同种型(分别包括SEQ ID NO:15或16中的氨基酸位置185处的磷酸化的苏氨酸和/或SEQ ID NO:15或16中的氨基酸位置187处的磷酸化的酪氨酸)上的表位的抗体来确定。
Akt
Akt是一种55.7kDa的蛋白质,其具有480个氨基酸(如SEQ ID NO:17所示)。当测量Akt的蛋白水平时,该水平可包括如下两项或更多项:Akt的非磷酸化形式,和包括SEQ ID NO:17的氨基酸位置124的丝氨酸处的磷酸化、SEQ ID NO:17的氨基酸位置126的丝氨酸处的磷酸化、SEQ ID NO:17的氨基酸位置129的丝氨酸处的磷酸化、SEQ ID NO:17的氨基酸位置176的酪氨酸处的磷酸化、SEQ ID NO:17的氨基酸位置308的苏氨酸处的磷酸化、SEQ ID NO:17的氨基酸位置450的苏氨酸处的磷酸化、SEQ ID NO:17的氨基酸位置473的丝氨酸处的磷酸化和SEQ ID NO:17的氨基酸位置474的酪氨酸处的磷酸化的Akt的一个或多个形式。
pAkt
短语“pAkt水平”,当指蛋白水平时,可包括具有SEQ ID NO:17的氨基酸位置473的丝氨酸处的磷酸化的Akt一个或多个形式的水平(或两个或更多个所述水平的总和)。pAkt的水平可通过如下方式来确定:例如使用特异性结合至Akt(包括SEQ ID NO:17的氨基酸位置473处的磷酸化的丝氨酸)中的表位的抗体。
胱天蛋白酶-2
人体中有胱天蛋白酶-2的三种不同的同种型。胱天蛋白酶-2的第一同种型的未加工形式具有总共452个氨基酸(如SEQ ID NO:18所示)。加工后,胱天蛋白酶-2的第一同种型形成3个亚基肽:SEQ ID NO:18的氨基酸170-325(胱天蛋白酶-2亚基p18)、SEQ ID NO:18的氨基酸334-452(胱天蛋白酶-2亚基p13)、和SEQ ID NO:18的氨基酸348-452(胱天蛋白酶-2亚基p12)。SEQ ID NO:18的氨基酸2-169代表胱天蛋白酶-2的未加工形式的前序列。第二同种型具有总共313个氨基酸(SEQ ID NO:19)。第三同种型具有总共91个氨基酸(SEQ ID NO:20)。胱天蛋白酶-2的第一同种型的磷酸化形式具有SEQ ID NO:18的氨基酸位置340的丝氨酸处的磷酸化。当测量胱天蛋白酶-2的蛋白水平时,该水平可包括胱天蛋白酶-2的第一同种型的一种或多种未加工形式,胱天蛋白酶-2亚基p18、胱天蛋白酶-2亚基p13、胱天蛋白酶-2亚基p12、具有SEQ ID NO:18的氨基酸位置340的丝氨酸处的磷酸化的胱天蛋白酶-2第一同种型的形式和具有胱天蛋白酶-2亚基p13中氨基酸位置7的丝氨酸处的磷酸化的胱天蛋白酶-2亚基p13的形式。
RBBP
人视网膜母细胞瘤结合蛋白(RBBP)具有425个氨基酸(如SEQ ID NO:21所示)。RBBP的磷酸化形式具有SEQ ID NO:21的氨基酸位置110的丝氨酸处的磷酸化。当测量RBBP的蛋白水平时,该水平可包括如下之一或二者:RBBP的非磷酸化形式和具有SEQ ID NO:21的氨基酸位置110的丝氨酸处的磷酸化的RBBP形式。
用于确定PKD的治疗的功效的方法
本文提供了确定PKD患者中PKD(例如ADPKD或ARPKD)的治疗的功效的方法。在一些实例中,这些方法包括:(a)提供包含获取自PDK患者的生物流体(例如尿液)或肾脏组织(例如肾脏活组织检查样品)的第一样品;(b)确定第一样品中的AMBP的水平;(c)向该PKD患者施用PKD治疗;(d)提供包含来自步骤(c)后的PKD患者的生物流体(例如尿液)或肾脏组织(例如肾脏活组织检查样品)的第二样品,并确定第二样品中的AMBP的水平;和(e)如果第二样品中的水平低于第一样品中的水平,则鉴定所施用的治疗为有效。在一些实例中,这些方法包括:(a)提供包含获取自PDK患者的生物流体(例如尿液)或肾脏组织(例如肾脏活组织检查样品)的第一样品;(b)确定第一样品中的AMBP的水平和PKD的至少一个(例如2、3、4、5、6、7、8、9、10、11、12或13个)另外的标志物(例如,PCNA、周期蛋白D1、周期蛋白D3、MEK、S6、pS6、ERK、pERK、Akt、pAkt、胱天蛋白酶-2、总S6和RBBP)的水平;(c)向该PKD患者施用PKD治疗;(d)提供包含来自步骤(c)后的PKD患者的生物流体(例如尿液)或肾脏组织(例如肾脏活组织检查样品)的第二样品,并确定第二样品中的AMBP的水平和PKD的至少一个另外的标志物的水平;和(e)如果(i)第二样品中的AMBP水平低于第一样品中的AMBP水平,且(ii)第二样品中的PKD的至少一个另外的标志物之一的水平(或2、3、4、5、6、7、8、9、10、11、12或13个的水平)低于第一样品中的PKD的至少一个另外的标志物的水平,则鉴定所施用的治疗为有效。
一些实施方案在(e)后进一步包括:(f)向PKD患者施用额外剂量的所述鉴定为有效的施用的GCS抑制剂(例如(S)-奎宁环-3-基(2-(4'-(2-甲氧基乙氧基)-[1,1'-联苯基]-4-基)丙-2-基)氨基甲酸酯;4-氟-1-(5-氟-4-(4-((2-甲氧基乙氧基)甲基)苯基)嘧啶-2-基)-N-(4-甲基-1氮杂双环[3.2.2]壬-4-基)哌啶-4-甲酰胺;4-氟-1-(4-(4-((2-甲氧基乙氧基)甲基)苯基)嘧啶-2-基)-N-(3-甲基奎宁环-3-基)哌啶-4-甲酰胺;4-氟-1-(4-(4-((2-甲氧基乙氧基)甲基)苯基)嘧啶-2-基)-N-(4-甲基-1-氮杂双环[3.2.2]壬-4-基)哌啶-4-甲酰胺;4-氟-1-(4-(4-(甲氧基甲基)苯基)嘧啶-2-基)-N-(3-甲基奎宁环-3-基)哌啶-4-甲酰胺;4-氟-1-(4-(4-(甲氧基甲基)苯基)嘧啶-2-基)-N-(4-甲基-1-氮杂双环[3.2.2]壬-4-基)哌啶-4-甲酰胺;4-氟-1-(4-(4-(2-甲氧基乙氧基)苯基)嘧啶-2-基)-N-(3-甲基奎宁环-3-基)哌啶-4-甲酰胺;4-氟-1-(4-(4-(2-甲氧基乙氧基)苯基)嘧啶-2-基)-N-(4-甲基-1-氮杂双环[3.2.2]壬-4-基)哌啶-4-甲酰胺;4-氟-1-(4-(4-(2-氟乙氧基)苯基)嘧啶-2-基)-N-(奎宁环-3-基)哌啶-4-甲酰胺;4-氟-1-(4-(4-(2-氟乙氧基)苯基)嘧啶-2-基)-N-(4-甲基-1-氮杂双环[3.2.2]壬-4-基)哌啶-4-甲酰胺);氨基甲酸,N-[1-[2-(4-氟苯基)-4-噻唑基]-1-甲基乙基]-,(3S)-1-氮杂双环[2.2.2]辛-3-基酯(如式II所示);或奎宁环-3-基(2-(4’-氟-[1,1’-联苯]-3-基)丙-2-基)氨基甲酸酯(如式III所示))。所述方法的一些实例在(e)后进一步包括:(f)向PKD患者施用额外剂量的所述鉴定为有效的施用的治疗(例如CDK抑制剂,诸如S-CR8)。
在一些实施方案中,步骤(b)和(d)包括确定选自下组的PKD的另外的标志物之一的水平(或2、3、4、5或6个的水平):PCNA、周期蛋白D1、周期蛋白D3、MEK、S6和pS6,并且如果(i)第二样品中的AMBP水平低于第一样品中的AMBP水平,且(ii)第二样品中的PKD的另外的标志物之一的水平(或2、3、4、5或6个的水平)低于第一样品中的PKD的至少一个另外的标志物的水平,则鉴定所述施用的治疗为有效。
在一些实例中,在(b)和(d)中确定AMBP的水平,和任选地确定PKD的至少一个另外的生物标志物的水平包括确定AMBP的蛋白水平,和任选地至少一个另外的标志物的蛋白水平。例如,(b)和(d)中的确定可包括使样品与特异性结合至AMBP蛋白的抗体,和任选地特异性结合至PKD的至少一个另外的生物标志物的抗体接触。在一些实施方案中,(b)和(d)包括确定周期蛋白D1和MEK之一或二者的PKD另外的生物标志物的蛋白水平。
在任何所述方法的一些实施方案中,(c)中施用的治疗是施用葡糖基神经酰胺合酶(GCS)抑制剂(例如本文所述或本领域已知的任何GCS抑制剂)。例如,GCS抑制剂选自下组:(S)-奎宁环-3-基(2-(4'-(2-甲氧基乙氧基)-[1,1'-联苯基]-4-基)丙-2-基)氨基甲酸酯;4-氟-1-(5-氟-4-(4-((2甲氧基乙氧基)甲基)苯基)嘧啶-2-基)-N-(4-甲基-1-氮杂双环[3.2.2]壬-4-基)哌啶-4-甲酰胺;4-氟-1-(4-(4-((2-甲氧基乙氧基)甲基)苯基)嘧啶-2-基)-N-(3-甲基奎宁环-3-基)哌啶-4-甲酰胺;4-氟-1-(4-(4-((2-甲氧基乙氧基)甲基)苯基)嘧啶-2-基)-N-(4-甲基-1-氮杂双环[3.2.2]壬-4-基)哌啶-4-甲酰胺;4-氟-1-(4-(4-(甲氧基甲基)苯基)嘧啶-2-基)-N-(3-甲基奎宁环-3-基)哌啶-4-甲酰胺;4-氟-1-(4-(4-(甲氧基甲基)苯基)嘧啶-2-基)-N-(4-甲基-1-氮杂双环[3.2.2]壬-4-基)哌啶-4-甲酰胺;4-氟-1-(4-(4-(2-甲氧基乙氧基)苯基)嘧啶-2-基)-N-(3-甲基奎宁环-3-基)哌啶-4-甲酰胺;4-氟-1-(4-(4-(2-甲氧基乙氧基)苯基)嘧啶-2-基)-N-(4-甲基-1-氮杂双环[3.2.2]壬-4-基)哌啶-4-甲酰胺;4-氟-1-(4-(4-(2-氟乙氧基)苯基)嘧啶-2-基)-N-(奎宁环-3-基)哌啶-4-甲酰胺;4-氟-1-(4-(4-(2-氟乙氧基)苯基)嘧啶-2-基)-N-(4-甲基-1-氮杂双环[3.2.2]壬-4-基)哌啶-4-甲酰胺;氨基甲酸,N-[1-[2-(4-氟苯基)-4-噻唑基]-1-甲基乙基]-,(3S)-1-氮杂双环[2.2.2]辛-3-基酯(如式II所示);和奎宁环-3-基(2-(4’-氟-[1,1’-联苯]-3-基)丙-2-基)氨基甲酸酯(如式III所示)。
在任何所述方法的一些实施方案中,(c)中施用的治疗是向PKD患者施用CDK抑制剂(例如任何本文所述的或本领域已知的CDK抑制剂,诸如R-roscovitine)。
任何所述方法的一些实施方案进一步包括选择具有PKD的患者或诊断具有PKD的患者(例如使用本文所述的任何例示性PKD诊断方法)的步骤。任何这些方法中的患者可为本文所述的任何患者。例如,具有PKD的患者可既往已接受过针对PKD的治疗且所述治疗是不成功的。任何所述方法的一些实施方案进一步包括从PKD患者获得第一和/或第二样品。
一些实施方案进一步包括将鉴定的施用的治疗的功效记录在患者的病历档案(例如计算机可读介质)中。一些实例进一步包括告知患者、患者的家庭、和/或患者的初级护理医师或主治医师所施用的治疗的鉴定的功效。一些实施方案进一步包括批准对所述鉴定为有效的施用的治疗进行续药(refill)。
第一样品获取自PKD患者的时间和第二样品获取自PKD受试者的时间之间的时间差异可为例如1周-40周、1周-30周、1周-20周、1周-12周、1周-8周、1周-4周、1周-2周、2周-12周、2周-8周或2周-4周。
诊断PKD的方法
还提供了诊断患者中的PKD(例如ADPKD或ARPKD)的方法,包括(a)提供包含来自怀疑具有PDK的患者的生物流体(例如尿液)或肾脏组织(例如肾脏活组织检查样品)的样品;(b)确定样品中的AMBP的水平;和(c)如果所述水平是升高的,(例如,其中AMBP水平超过对照水平(例如预定阈值水平)),则鉴定该患者为具有PKD。
在一些实例中,诊断患者中的PKD的方法包括(a)提供包含来自怀疑具有PKD的患者的生物流体(例如尿液)或肾脏组织(例如肾脏活组织检查组织)的样品;(b)确定样品中的AMP的水平,和确定PKD的至少一个(例如2、3、4、5、6、7、8、9、10、11、12或13个)另外的标志物(例如PCNA、周期蛋白D1、周期蛋白D3、MEK、S6、pS6、ERK、pERK、Akt、pAkt、胱天蛋白酶-2、总S6和RBBP)的水平;和(c)如果(i)例如与对照水平相比,AMDA的水平是升高的,且(ii)与对照水平相比,PKD的至少一个另外的生物标志物之一的水平(或2、3、4、5、6、7、8、9、10、11、12或13个的水平)是升高的,则鉴定患者具有PKD。
这些方法的一些实例在(c)后进一步包括:(d)向所述被鉴定为具有PKD的患者施用针对PKD的治疗(例如本文所述的针对PKD的任何例示性治疗)。一些实施方案在(c)后进一步包括:(d)向鉴定为具有PKD的患者施用GCS抑制剂(例如(S)-奎宁环-3-基(2-(4'-(2-甲氧基乙氧基)-[1,1'-联苯基]-4-基)丙-2-基)氨基甲酸酯;4-氟-1-(5-氟-4-(4-((2甲氧基乙氧基)甲基)苯基)嘧啶-2-基)-N-(4-甲基-1-氮杂双环[3.2.2]壬-4-基)哌啶-4-甲酰胺;4-氟-1-(4-(4-((2-甲氧基乙氧基)甲基)苯基)嘧啶-2-基)-N-(3-甲基奎宁环-3-基)哌啶-4-甲酰胺;4-氟-1-(4-(4-((2-甲氧基乙氧基)甲基)苯基)嘧啶-2-基)-N-(4-甲基-1-氮杂双环[3.2.2]壬-4-基)哌啶-4-甲酰胺;4-氟-1-(4-(4-(甲氧基甲基)苯基)嘧啶-2-基)-N-(3-甲基奎宁环-3-基)哌啶-4-甲酰胺;4-氟-1-(4-(4-(甲氧基甲基)苯基)嘧啶-2-基)-N-(4-甲基-1-氮杂双环[3.2.2]壬-4-基)哌啶-4-甲酰胺;4-氟-1-(4-(4-(2-甲氧基乙氧基)苯基)嘧啶-2-基)-N-(3-甲基奎宁环-3-基)哌啶-4-甲酰胺;4-氟-1-(4-(4-(2-甲氧基乙氧基)苯基)嘧啶-2-基)-N-(4-甲基-1-氮杂双环[3.2.2]壬-4-基)哌啶-4-甲酰胺;4-氟-1-(4-(4-(2-氟乙氧基)苯基)嘧啶-2-基)-N-(奎宁环-3-基)哌啶-4-甲酰胺;4-氟-1-(4-(4-(2-氟乙氧基)苯基)嘧啶-2-基)-N-(4-甲基-1-氮杂双环[3.2.2]壬-4-基)哌啶-4-甲酰胺;氨基甲酸,N-[1-[2-(4-氟苯基)-4-噻唑基]-1-甲基乙基]-,(3S)-1-氮杂双环[2.2.2]辛-3-基酯(如式II所示);或奎宁环-3-基(2-(4’-氟-[1,1’-联苯]-3-基)丙-2-基)氨基甲酸酯(如式III所示))。一些实施方案在(c)后进一步包括:(d)向鉴定为具有PKD的患者施用CDK抑制剂(例如roscovitine)。一些实施方案在(c)后进一步包括:(d)进行一次或多次额外的测试以确认患者中的PKD(例如在被鉴定为患有PKD的患者中对一个或两个肾脏进行成像)。
在一些实施方案中,步骤(b)包括确定选自下组的另外的PKD标志物之一的水平(或2、3、4、5、6或7个的水平):PCNA、周期蛋白D1、周期蛋白D3、MEK、S6和pS6,并且如果与对照水平相比受试者具有AMBP的水平是升高的,和与对照水平相比PKD的另外的标志物之一的水平是升高的,则鉴定该患者为具有PKD。
在一些实施方案中,(b)中确定AMBP的水平,和任选地确定PKD的至少一个另外的生物标志物的水平包括确定AMBP的蛋白水平,和任选地PKD的至少一个另外的标志物的蛋白水平。例如,(b)中的确定可包括使样品与特异性结合至AMBP蛋白的抗体,和任选地特异性结合至PKD的至少一个另外的生物标志物的抗体接触。在一些实施方案中,(b)包括确定PCNA、周期蛋白D1、周期蛋白D3、MEK、S6和pS6的至少一个的PKD另外的生物标志物的蛋白水平。
在这些方法的任何一种中,对照水平可为例如不存在一个或多个PKD症状和/或未被诊断为具有PKD的受试者中的AMBP水平(和任选地还可为至少一个另外的PKD标志物的水平),健康受试者或健康受试者群体中的至少一个标志物的水平,或阈值水平(例如,高于该水平则表明患者具有PKD或可能具有PKD的水平)。
一些实施方案进一步包括将患者中PKD的鉴定记录于患者的病历档案(例如计算机可读介质)中。一些实例进一步包括将所述患者中的PKD鉴定告知患者、患者的家属、和/或患者的初级护理医师或主治医师。一些实例进一步包括将所述患者中的PKD鉴定告知患者的保险提供者。
确定PKD的分期的方法
本文还提供确定患者中的PKD(例如ADPKD或ARPKD)的分期的方法。技术人员会轻而易举地理解确定患者中的PKD的分期可用于例如设计和实施适当的治疗方案以治疗患者,并且由此获得所希望的结果。示例性方法包括:(a)提供包含来自被怀疑具有PKD或被鉴定为具有PKD的患者的生物流体(例如尿液)或肾脏组织(例如肾脏活组织检查样品)的样品;(b)确定所述样品中的AMBP的水平;和(c)从所述水平确定患者中的PKD的分期。在一些实施方案中,确定患者中的PKD的分期的方法包括:(a)提供包含来自被怀疑具有PKD或被鉴定为具有PKD的患者的生物流体(例如尿液)或肾脏组织(例如肾脏活组织检查样品)的样品;(b)确定所述样品中的AMBP的水平和PKD的至少一个(例如2、3、4、5、6、7、8、9、10、11、12或13个)另外的生物标志物(例如PCNA、周期蛋白D1、周期蛋白D3、MEK、S6、pS6、ERK、pERK、Akt、pAkt、胱天蛋白酶-2、总S6和RBBP)的水平;和(c)从AMBP的水平和PKD的至少一个另外的生物标志物之一的水平(或2、3、4、5、6、7、8、9、10、11、12或13个的水平)确定患者中的PKD的分期。
在一些实施方案中,(b)中的确定包括将确定的AMBP的水平(和任选地PKD的至少一个另外的标志物的水平)与PKD的特定分期(例如I期、II期、III期、IV期或V期)的值的范围进行比较,如果AMBP的水平(和任选地PKD的至少一个另外的标志物之一的水平(或2、3、4、5、6、7、8、9、10、11、12或13个的水平))落在PKD特定分期的值的范围内,则鉴定受试者为具有PKD的特定分期。一些实施方案在(c)后进一步包括:(d)向被鉴定为具有I期、II期、III期、IV期或V期PKD的患者分别施用针对I期、II期、III期、IV期或V期PKD的治疗。一些实施方案在(c)后进一步包括:(d)进行一个或多个测试来确认PKD的分期(例如在步骤(c)后对患者中的一个或两个肾脏进行成像,以确认患者中PKD的分期)。一些实施方案在(c)后进一步包括:(d)使鉴定为具有IV期或V期PKD的受试者住院治疗。包含来自具有某些分期的PKD(例如I期、II期、III期、IV期或V期PKD)的受试者的生物流体(例如尿液)或肾脏组织(例如肾脏活组织检查样品)的样品中的AMBP的水平(和任选地PKD的至少一个另外的标志物的水平)的范围可使用本领域已知的方法来确定。PKD的五个分期是本领域已知的,并且该分期的描述可在多种出版物中获得。例如,五个分期在Kidney Support网页上描述(kidney-support.org):1期(出现期)、2期(生长期)、3期(增大或肿胀期)、4期(囊肿破裂期)和5期(末期)。
在一些实施方案中,步骤(b)包括确定选自下组的PKD另外的标志物的水平(或2、3、4、5、6或7个的水平):PCNA、周期蛋白D1、周期蛋白D3、MEK、S6和pS6,并从AMBP的水平和PKD另外的标志物的水平(或2、3、4、5、6或7个的水平)来确定PKD的分期。
在一些实例中,(b)中确定AMBP的水平,和任选地确定PKD的至少一个另外的生物标志物的水平包括确定AMBP的水平,和任选地PKD的至少一个另外的标志物的水平。例如,(b)中的确定可包括使所述样品与特异性结合至AMBP蛋白的抗体,和任选地特异性结合至PKD的至少一个另外的标志物的抗体接触。在一些实施方案中,(b)包括确定PCNA、周期蛋白D3、MEK和磷酸化S6中的至少一项的PKD另外的标志物的蛋白水平。
监测PKD的方法
还提供了监测PKD患者(例如ADPKD患者或ARPKD患者)的方法。监测可用于例如观察PKD患者的反应以给予治疗,并且提供给熟练的医师关于治疗是否应该继续、修改或停止的信息。示例性方法可包括:(a)提供包含获取自PKD患者的生物液体(例如尿液)或肾脏组织(例如肾脏活组织检查样品)的第一样品;(b)确定第一样品中的AMBP的水平;(c)提供包含来自步骤(b)后或第一样品获取自患者后的PKD患者的生物液体(例如尿液)或肾脏组织(例如肾脏活组织检查样品)的第二样品,并且确定第二样品中的AMBP的水平;和(d)如果第二样品中的水平不高于第一样品中的水平,则鉴定患者为具有改善中的或静态的PKD(或任选地,如果第二样品中的水平高于第一样品中的水平,则鉴定受试者为具有恶化的或进展的PKD)。
还提供了监测PKD患者的方法,其包括:(a)提供包含获取自PDK患者的生物流体(例如尿液)或肾脏组织(例如肾脏活组织检查样品)的第一样品;(b)确定所述第一样品中的AMBP的水平和PKD的至少一个(例如2、3、4、5、6、7、8、9、10、11、12或13个)另外的标志物(PCNA、周期蛋白D1、周期蛋白D3、MEK、S6、pS6、ERK、pERK、Akt、pAkt、胱天蛋白酶-2、总S6和RBBP)的水平;(c)提供包含来自步骤(b)后或第一样品获取自患者后的PKD患者的生物液体(例如尿液)或肾脏组织(例如肾脏活组织检查样品)的第二样品,并且确定第二样品中的AMBP的水平和PKD的至少一个另外的标志物的水平;及(d)如果(i)第二样品中的AMBP水平不高于第一样品中的AMBP水平,且(ii)第二样品中的PKD的至少一个另外的标志物之一的水平(例如2、3、4、5、6、7、8、9、10、11、12或13个的水平)不高于第一样品中的PKD的至少一个另外的标志物的水平,则鉴定患者为具有改善中的或静态的PKD(或任选地,如果(i)第二样品中的AMBP水平高于第一样品中的AMBP水平,且(ii)第二样品中的PKD的至少一个另外的标志物之一的水平(例如2、3、4、5、6、7、8、9、10、11、12或13个的水平)高于第一样品中的PKD的至少一个另外的标志物的水平,则鉴定受试者为具有恶化的或进展的PKD)。
在一些实施方案中,步骤(b)和(c)包括确定选自下组的PKD的另外的标志物之一的水平(或2、3、4、5或6个的水平):PCNA、周期蛋白D1、周期蛋白D3、MEK、S6和pS6,并且如果(i)第二样品中的AMBP水平不高于第一样品中的AMBP水平,且(ii)第二样品中的PKD的另外的标志物之一的水平(例如2、3、4、5或6个的水平)不高于第一样品中的PKD的至少一个另外的标志物的水平,则鉴定患者为具有改善中的或静态的PKD(或任选地,如果(i)第二样品中的AMBP水平高于第一样品中的AMBP水平,且(ii)第二样品中的PKD的另外的标志物之一的水平(例如2、3、4、5或6个的水平)高于第一样品中的PKD的至少一个另外的标志物的水平,则鉴定患者为具有恶化的或进展的PKD)。
在一些实施方案中,步骤(b)和(c)包括确定选自下组的PKD的另外的标志物之一的水平(或2、3、4、5或6个的水平):PCNA、周期蛋白D1、周期蛋白D3、MEK、S6和pS6,并且如果(i)第二样品中的AMBP水平不高于第一样品中的AMBP水平,且(ii)第二样品中的PKD另外的标志物之一的水平(例如2、3、4、5或6个的水平)不高于第一样品中的PKD的至少一个另外的标志物的水平,则鉴定患者为具有改善中的或静态的PKD(或任选地,如果(i)第二样品中的AMBP水平高于第一样品中的AMBP水平,和(ii)第二样品中的PKD另外的标志物之一的水平(例如2、3、4、5或6个的水平)高于第一样品中的PKD的至少一个另外的标志物的水平,则鉴定患者为具有恶化的或进展的PKD)。
在一些实例中,(b)和(c)中确定AMBP的水平和任选地确定PKD的至少一个另外的标志物的水平包括确定AMBP的蛋白水平和任选地PKD的至少一个另外的标志物的蛋白水平。例如,(b)和(c)中的确定可包括使样品接触特异性结合至AMBP蛋白的抗体,和任选地特异性结合PKD的至少一个另外的标志物的抗体。在一些实施方案中,(b)和(c)包括确定PCNA、周期蛋白D3、MEK和磷酸化S6的至少一项(例如2、3或4项)的PKD另外的标志物的蛋白水平。
一些实施方案在(d)后进一步包括:(e)向被鉴定为具有改善中的或静态的PKD的患者施用同样的治疗(例如本文所述的或本领域已知的任何例示性的PKD治疗)。例如,(e)中的施用可为施用GCS抑制剂(例如(S)-奎宁环-3-基(2-(4'-(2-甲氧基乙氧基)-[1,1'-联苯基]-4-基)丙-2-基)氨基甲酸酯;4-氟-1-(5-氟-4-(4-((2甲氧基乙氧基)甲基)苯基)嘧啶-2-基)-N-(4-甲基-1-氮杂双环[3.2.2]壬-4-基)哌啶-4-甲酰胺;4-氟-1-(4-(4-((2-甲氧基乙氧基)甲基)苯基)嘧啶-2-基)-N-(3-甲基奎宁环-3-基)哌啶-4-甲酰胺;4-氟-1-(4-(4-((2-甲氧基乙氧基)甲基)苯基)嘧啶-2-基)-N-(4-甲基-1-氮杂双环[3.2.2]壬-4-基)哌啶-4-甲酰胺;4-氟-1-(4-(4-(甲氧基甲基)苯基)嘧啶-2-基)-N-(3-甲基奎宁环-3-基)哌啶-4-甲酰胺;4-氟-1-(4-(4-(甲氧基甲基)苯基)嘧啶-2-基)-N-(4-甲基-1-氮杂双环[3.2.2]壬-4-基)哌啶-4-甲酰胺;4-氟-1-(4-(4-(2-甲氧基乙氧基)苯基)嘧啶-2-基)-N-(3-甲基奎宁环-3-基)哌啶-4-甲酰胺;4-氟-1-(4-(4-(2-甲氧基乙氧基)苯基)嘧啶-2-基)-N-(4-甲基-1-氮杂双环[3.2.2]壬-4-基)哌啶-4-甲酰胺;4-氟-1-(4-(4-(2-氟乙氧基)苯基)嘧啶-2-基)-N-(奎宁环-3-基)哌啶-4-甲酰胺;4-氟-1-(4-(4-(2-氟乙氧基)苯基)嘧啶-2-基)-N-(4-甲基-1-氮杂双环[3.2.2]壬-4-基)哌啶-4-甲酰胺;氨基甲酸,N-[1-[2-(4-氟苯基)-4-噻唑基]-1-甲基乙基]-,(3S)-1-氮杂双环[2.2.2]辛-3-基酯(如式II所示);或奎宁环-3-基(2-(4’-氟-[1,1’-联苯]-3-基)丙-2-基)氨基甲酸酯(如式III所示))。
所述方法的任一种的一些实施方案进一步包括选择患有PKD的患者或诊断患有PKD的患者的步骤(在步骤(a)之前)(例如用本文所述任何例示性的诊断PKD的方法)。这些方法的任一种中的患者可为本文所述的患者。所述方法的任一种的一些实施方案进一步包括从PKD患者获得第一和/或第二样品。
一些实施方案进一步包括在患者的病历档案(例如计算机可读介质)中记录患者的改善中的或静态的PKD状态(或可选的,恶化的或进展的状态)。一些实例进一步包括将患者的改善中的或静态的PKD状态(或可选的,恶化的或进展的状态)告知患者、患者的家属和/或患者的初级护理医师或主治医师。一些实施方案进一步包括当患者被鉴定为具有改善中的或静态的PKD时,批准在第一和第二样品获取自患者的时间点之间对施用于患者的治疗进行续药(或可选地,进一步包括当患者被鉴定为具有恶化的或进展的PKD时,批准在第一和第二样品获取自患者的时间点之间对施用于患者的治疗不进行续药)。一些实施方案包括基于鉴定受试者为具有改善中的或静态的PKD,而让受试者离开住院设施(例如医院)或减少住院治疗(例如透析)(或包括基于鉴定受试者为具有恶化的或进展的PKD,而让受试者继续住院治疗(例如入院)或增加住院治疗(例如透析))。
第一和第二样品获取自患者的时间之间的时间差异可为例如1周-40周、1周-30周、1周-20周、1周-12周、1周-8周、1周-4周、1周-2周、2周-12周、2周-8周或2周-4周。
试剂盒
还提供了基本由或由特异性结合AMBP蛋白的抗体和特异性结合PKD另外的蛋白标志物的至少一种(例如2、3、4、5、6、7、8、9、10、11或12种)抗体组成的试剂盒。例如,该试剂盒可基本由或由特异性结合至AMBP蛋白的抗体和选自下组的至少一种(例如2、3、4、5、6、7、8、9、10、11或12种)抗体组成:特异性结合至PCNA的抗体、特异性结合至周期蛋白D1的抗体、特异性结合至周期蛋白D3的抗体、特异性结合至MEK的抗体、特异性结合至S6的抗体、特异性结合至pS6的抗体、特异性结合至ERK的抗体、特异性结合至pERK的抗体、特异性结合至蛋白激酶Akt的抗体、特异性结合至pAkt的抗体、特异性结合至胱天蛋白酶-2的抗体和特异性结合至视网膜母细胞瘤结合蛋白(RBBP)的抗体。在一些实例中,特异性结合至AMBP蛋白的抗体和/或特异性结合至PKD另外的蛋白标志物的至少一种抗体的任何组合是带标记的(例如用放射性同位素、荧光团或淬灭剂标记)。
一些示例性试剂盒进一步包括一种或多种阳性对照重组蛋白(例如分离的重组AMBP、PCNA、周期蛋白D1、周期蛋白D3、MEK、S6、pS6、ERK、pERK、Akt、pAkt、胱天蛋白酶-2和RBBP)。在一些实例中,特异性结合至AMBP的抗体和特异性结合至PKD的至少一种另外的蛋白标志物的抗体通过Fc结构域共价地附接于固体表面(例如芯片、珠粒或膜)。
一些试剂盒进一步包含含有来自PKD患者(例如PKD严重程度已知的PKD患者)或PKD的动物模型(例如实施例中所述的任何动物模型)的生物流体的样品(例如含有生物流体、肾脏组织或肾脏细胞的样品)。这些样品可用作例如阳性对照。
本发明在以下实施例中进一步描述,所述实施例不限制权利要求中描述的本发明的范围。
实施例
实施例1.鉴定人类PKD患者和PKD的两个不同小鼠模型中的AMBP作为PKD的标志物和AMBP的水平
进行了一组实验来确定在PKD的人类和两个不同动物模型中AMBP是否是PKD的准确标志物。
材料和方法
动物和尿液收集
维持C57BL/6J jck/+小鼠以供交配。如前文所述对囊肿的jck/jck小鼠进行基因分型(Smith等,J.Am.Soc.Nephrol.17:2821-2831,2006)。如先前所述生成Pdk1条件敲除小鼠(Natoli等,Nature Med.16:788-792,2010)。通过在出生后第1天以100毫克/千克用在葵花籽油(Sigma-Aldrich,St.Louis,MO)中递送的他莫昔芬(tamoxifen)诱导Cre重组酶活性使Pdk1基因缺失。
患者样品收集
正常人患者和来自人ADPKD患者的样品购自国立疾病研究院(National Disease Research Institute,NDRI)。在多伦多大学(University of Toronto)收集来及人ADPKD患者的尿液样品。简言之,收集中段的(mid void)晨尿样品并用完全蛋白酶抑制剂混合物(Roche)将其稳定。以2000x g将尿液离心10分钟以去除细胞碎片,并储存于-80℃。在ADPKD患者中通过磁共振成像(MRI)(没有钆)对总肾容量(TKV)进行定量。
表1.代表早期和晚期ADPKD的患者概况,通过MRI测量TKV 300-2000mL。
LC-MS/MS样品制备
将基于去除试剂盒(Pierce,Rockford,IL)的Proteoseek HAS/IgG抗体用来从100μg尿液样品中消耗白蛋白和IgG的主要亚类。经过消耗的样品在冰上在10%(v/v)TCA(EMD Chemical)中沉淀2小时。沉淀以14000x g离心沉淀15分钟,并且丢弃上清液。用200μL丙酮洗涤团粒(-80℃),涡旋,并且以14000x g再离心沉淀10分钟,并且丢弃上清液。将团粒重悬,还原,烷基化,并使用ProteaseMax可降解的表面活性剂和所述的Insolution方案(Promega)进行胰蛋白酶消化。降解的表面活性剂通过以14,000x g离心样品15分钟来去除,并且上清液转移到Total Recovery Vial(Waters)用于nLC-MS/MS分析。
纳米UPLC-MS
使用在线Symmetry C18捕获柱(180μm×20mm×5μm(Waters),以15μL/分钟流速用99%缓冲液A(水中的0.1%v/v甲酸)和1%缓冲液B(乙腈中的0.1%v/v甲酸)对肽消化物脱盐3分钟。在C18BEH 100μm x 100μm,1.7μm(Waters)柱上在90分钟之内梯度洗脱肽。纳米Acuity UPLC通过TaperTip发射体(NewObjective)与Synapt G1(Waters)偶联。将连续形式的数据独立捕获方式(MSE)用来分析200-3000m/z范围内的洗脱肽。使用锁定喷雾校准物([Glu1]-纤维蛋白肽B([M+2H]2+,785.84206m/z,Genzyme,Framingham,MA)维持质量准确度。
数据分析
使用Protein Lynx Global Server v2.4(Waters)自动平滑MSE原始数据,减去背景、居中、取消目标、减少电荷状态并校正质量。针对人IPI蛋白质数据库v3.131搜索处理的数据。过滤标准设定为仅包括具有>95%置信分数的蛋白质。使用Expression Analysis(Waters)的无标记定量也用于对那些蛋白质进行排序,差异表达>对照的1.5倍以上。
蛋白质印迹(免疫印迹)分析
将肾样品在包含1mM DTT,5mM EDTA,2mM NaF,1mM Na3VO4(均由Sigma-Aldrich提供),Pefabloc SC和完全蛋白酶抑制剂混合物(两者均来自Roche Applied Sceince)的RIPA缓冲液(Boston BioProducts)中均质化。通过BCA蛋白质测定(Pierce)确定蛋白浓度。在4℃以3000RPM简单地离心尿液样品10分钟(Beckman Coulter Allegra 6A)以去除细胞碎片。在5X Laemmli缓冲液(15%SDS,0.575M蔗糖,0.325M Tris,pH 6.8,5%β-巯基乙醇和0.002%溴酚蓝)中稀释等体积的尿液。按照制造商的方案(Invitrogen)将等量蛋白质和尿液加载到4-14%NuPage Bis-Tris凝胶上。用含有0.1%Tween-20的Tris缓冲盐水(TBS)中的5%脱脂牛奶封闭膜,并在4℃下与一抗温育过夜。用辣根过氧化物酶标记的二抗(Promega)检测一抗。通过增强的化学发光(GEHealthcare)检测免疫反应蛋白。使用以下蛋白质的一抗:α-1-微球蛋白和β-肌动蛋白(Abcam)和GAPDH(US Biological)。
定量RT-PCR分析
根据制造商的说明,在5μg糖原(Invitrogen)存在下,通过在TRIzol试剂中均质化肾脏来进行RNA提取。遵循制造商的建议(Invitrogen),使用提取的RNA和SuperScript III First-Strand Synthesis SuperMix进行逆转录酶反应,用于qRT-PCR。TaqMan引物获自Applied Biosystems预先设计的对应于AMBP(Mm00431788_m1)的Taqman基因表达测定。使用TaqMan Gene Expression Master Mix进行反应,在Applied Biosystems 7500实时PCR系统上运行并标准化为啮齿动物GAPDH表达。
免疫荧光
来自正常患者和ADPKD患者的石蜡包埋的肾标本获自国家疾病研究所。将来自野生型,jck,对照和Pkd1cKO的石蜡包埋的肾切成4微米切片,并在压力锅中的抗原回收溶液(DAKO)中煮沸以揭示抗原。将肾切片用Protein Block Serum Free(DAKO)在4℃下封闭过夜1小时。莲花四倍体凝集素(Lotus tetragonolobus lectin)(LTL)(Vector Laboratories)的初级抗体以1:1000的稀释度使用。在具有20x或40x物镜(Olympus-America)的Olympus 1X70显微镜上观察染色。用Metamorph成像系列软件(Molecular Devices Corporation)捕获图像。
结果
8名ADPKD患者(7名女性和1名男性)和3名正常人类患者的尿液。表1中列出了每个人ADPKD患者的临床参数。从3名轻度疾病患者(TKV<600mL)和5名中等严重ADPKD患者(TKV>750mL)收集每位人类受试者的中间尿液。使用LC-MS/MS进行的全球尿蛋白质组分析用于比较来自正常对照与每个单独的ADPKD样品的尿液中的蛋白质表达。数据显示,ADPKD患者中α-1-微球蛋白/bikunin前体(AMBP)蛋白增加,并且AMBP蛋白水平与总肾容量(TKV)测量值相关。来自病情最轻(患者1)和病情最重(患者8)ADPKD患者的AMBP表达的比较显示AMBP表达的30倍差异,表明AMBP蛋白水平随着人中ADPKD的严重性增加而增加。
分析人ADPKD中的ADPKD表达
AMBP蛋白最初显示仅在肝脏中表达(Salier等,Biochem.J.296:85-91,1993;Salier等,Biochem.J.315:1-9,1996;Daveau等,Biochem.J.292:485-492,1993),但已显示在肾脏中表达(Grewal等,Biochem.J.387:609-616,2005)。在肾脏中,AMBP基因的表达受A1M特异性顺式元件和转录因子的调节。有在肾小管细胞中缺乏AMBP蛋白的切割的证据(Grewal等,Biochem.J.387:609-616,2005)。
进行来自人ADPKD患者的尿样中的AMBP蛋白水平的免疫印迹分析以确认LC-MS/MS数据。该分析证明AMBP在来自人ADPKD患者的尿液样品中上调,并且AMBP表达的水平与疾病进展相关(如TKV所示)(r2=0.7782)(图1-3)。来自正常和人ADPKD患者肾的切片用针对A1M的一抗和近端小管标志物LTL染色,以确定人肾脏中AMBP表达的位置。如图4所示,用近端小管标志物LTL染色的小管是ADPKD患者肾脏中AMBP蛋白质表达的位点(由箭头指示),而在正常患者肾脏中未观察到这样的表达。在单个人ADPKD患者中使用来自三种不同囊肿的囊肿液确认了ADPKD囊肿液中AMBP蛋白的表达。
这些数据表明AMDP是PKD的标志物。
PKD的jck模型中AMBP表达的评估
将PKD的jck小鼠模型(Smith等,J.Am.Soc.Nephrol.17:2821-2831,2006)用来评估AMBP的表达。jck小鼠的特征在于中度进展性肾囊性疾病的发展。来自jck小鼠模型的肾脏在出生后第26天扩大并且具有多个囊肿。到第64天,几乎没有正常组织剩余,并且囊肿的数量和大小显著增加。通过血清肌酸酐和血尿素氮测量的jck小鼠的肾脏功能随时间逐渐升高。在jck小鼠中,囊肿在疾病的早期起源于收集管,并且随着细胞发生的进展,囊肿从远端小管和Henle的环形成。在jck小鼠中未检测到源自近端小管的囊肿(Smith等,J.Am.Soc.Nephrol.17:2821-2831,2006)。
图5中的数据显示,与野生型小鼠对照相比,64日龄jck小鼠具有高60倍的AMBP基因表达水平。这些数据得到相应免疫印迹的支持,与野生型小鼠相比,也表明50和60日龄jck小鼠肾脏中的AMBP蛋白水平显著升高(图6和7)。出生后第26、50和60天来自jck小鼠和出生后第64天的野生型小鼠的肾切片的免疫荧光显微照片显示,在jck小鼠中,近端小管和肾小球中AMBP蛋白的表达随着疾病进展增加,而在64日龄野生型小鼠中几乎观察不到AMBP蛋白表达(图8)。
在下一组实验中,在来自疾病进展的不同分期的jck小鼠的尿液样品中测量AMBP蛋白水平。尿液从5只jck小鼠连续收集5周的时间段,其中在出生后64天通过肾脏体重比(最终K/BW)测量的疾病严重程度范围在6.95至8.72范围内。免疫印迹数据显示,AMBP蛋白水平的升高从出生后第33天至第41天开始出现,并在jck小鼠中逐渐增加,而更严重的疾病的特征在于尿AMBP蛋白水平的早期上调和在jck小鼠出生后第64天(图9和10)的较高AMBP蛋白水平。这些数据表明AMBP蛋白水平(例如,尿液或肾脏组织AMBP水平)可用来确定PKD的分期或严重性。
AMBP在ADPKD直系同源模型中的表达
使用Pkd1cKO(条件性敲除)小鼠(Natoli等,Nature Med.16:788-792,2010)进行实验,以研究AMBP在PKD的直系同源小鼠模型中的表达。在该模型中,出生后第1天Pkd1的失活导致显著的囊肿发生,其通过增加的肾脏体重比、囊肿百分比和血尿素氮(BUN)显而易见(Natoli等,Nature Med.16:788-792,2010)。皮质和髓质区域中的囊肿的逐渐增大分两个阶段发生,即最初的快速囊肿生长(18-26天大),然后是较慢的生长速率。
免疫印迹分析用来确定Pkd1cKO小鼠中AMBP蛋白水平随时间的变化。数据显示来自Pkd1cKO小鼠的肾脏样品中AMBP蛋白质水平随时间增加(比较出生后第64天的表达水平与出生后第26天的表达水平)(图11)。尿液从具有一定范围的疾病严重程度(如通过囊肿百分比测量的)(出生后第64天的最终囊肿%在23.3至39.6范围内)的Pkd1小鼠收集连续5周的时间段以进一步研究Pkd1cKO小鼠中的尿液的AMBP蛋白水平。图13和14中的数据显示,Pkd1小鼠中尿液中的AMBP蛋白的水平在26至33天之间增加,然后水平相对缓慢地增加直至出生后第64天(用作该研究的终止时间点)。与jck小鼠肾脏相似,Pkd1cKO肾切片的免疫荧光分析显示近端小管中AMBP的升高(图12)。
实施例2.在治疗干预后PKD临床前模型中的AMBP表达
先前已经显示,细胞周期蛋白依赖性激酶抑制剂(CDKi)和葡糖神经酰胺合成酶抑制剂(GCSi)降低PKD小鼠模型中的囊性参数(Natoli等,Nature Med.16:788-792,2010;Bukanov等,Nature 444:949-952,2006;Bukanov等,Cell Cycle 11:4040-4046,2012)。进行一组实验以确定在用CDKi Roscovitine和S-CR8以及GCSi(Genz-123346)成功治疗干预后,jck小鼠中的肾和尿AMBP表达是否会降低。
材料和方法
除了下面描述的小鼠模型处理之外,该组实验中使用的材料和方法与实施例1相同。
动物治疗
通过在0.2%的粉末状5053饮食中混合,将Roscovitine随意施用于26至64日龄jck小鼠。通过在0.225%的粉末状5053饮食中混合,将GCSi(Genz-123346)随意施用于出生后第26天至第64天的jck小鼠(Natoli等,Nature Med.16:788-792,2010)。从出生后第26天开始,每天腹膜内注射24mg/kg进行S-CR8的慢性和脉冲治疗。S-CR8治疗的时间表如图18所示。在5周的时间内(在出生后第26、33、41、48和64天)连续24小时收集尿液,其中疾病严重程度的范围通过肾脏体重比(K/BW)和囊性百分比(C%)测量。
结果
在Jck小鼠中用CDK抑制剂Roscovitine和S-CR8治疗
在jck小鼠中进行第一组实验以确定施用roscovitine是否会降低AMBP水平和肾脏容量。数据显示,与在出生后第26天至第64天之间仅施用运载体的64日龄小鼠中测量的相同参数相比较,出生后第26天至第64天口服施用0.2%roscovitine(图15)导致jck小鼠在出生后第64天肾脏容量减少(图16)且在尿液和肾脏两种样品中和AMBP蛋白水平降低(图17)。
在jck小鼠中进行第二组实验以确定第二种CDK抑制剂S-CR8会降低AMBP水平和肾脏容量。在这些实验中,从出生后第26天开始向jck动物施用以下治疗方案之一:(A)每天腹膜内注射24mg/kg S-CR8五周;(B)每天腹膜内注射24mg/kg S-CR8三周,两周不治疗;和(D)每天腹膜内注射24mg/kgS-CR8一周,四周不治疗(图18)。作为对照,在出生后第26天至第64天向jck动物施用运载体。
数据显示每天腹膜内注射24mg/kg S-CR8(在所有测试的治疗方案中)导致囊肿体积减少(图19)和尿AMBP蛋白水平的相应降低(图20和21)。这些数据显示降低的AMBP水平可以表示受试者中PKD治疗的功效。
在Jck小鼠中用GCS抑制剂治疗
进行另一组实验以测试施用GCS抑制剂Genz-123346对jck小鼠的尿液和肾脏样品中的AMBP水平的影响。数据显示,与出生后第26天至第64天之间施用运载体的64日龄对照jck小鼠的相应水平相比,在出生后第26天至第64天每天向jck小鼠施用0.225%Genz123346导致出生后第64天尿液和肾脏组织两种样品中的减少(图22)。
其他实施方案
可理解的是,虽然已对本发明结合其具体说明进行了描述,前述描述意欲说明而非限制本发明的范围,本发明的范围由所附的权利要求书的范围来限定。其他方面、优点和修饰在所附的权利要求书的范围之内。
序列表
<110> 建新公司
<120> 多囊性肾病的生物标志物及其用途
<130> 37488-0050WO1
<150> 62/257,089
<151> 2015-11-18
<160> 21
<170> PatentIn version 3.5
<210> 1
<211> 352
<212> PRT
<213> 智人
<400> 1
Met Arg Ser Leu Gly Ala Leu Leu Leu Leu Leu Ser Ala Cys Leu Ala
1 5 10 15
Val Ser Ala Gly Pro Val Pro Thr Pro Pro Asp Asn Ile Gln Val Gln
20 25 30
Glu Asn Phe Asn Ile Ser Arg Ile Tyr Gly Lys Trp Tyr Asn Leu Ala
35 40 45
Ile Gly Ser Thr Cys Pro Trp Leu Lys Lys Ile Met Asp Arg Met Thr
50 55 60
Val Ser Thr Leu Val Leu Gly Glu Gly Ala Thr Glu Ala Glu Ile Ser
65 70 75 80
Met Thr Ser Thr Arg Trp Arg Lys Gly Val Cys Glu Glu Thr Ser Gly
85 90 95
Ala Tyr Glu Lys Thr Asp Thr Asp Gly Lys Phe Leu Tyr His Lys Ser
100 105 110
Lys Trp Asn Ile Thr Met Glu Ser Tyr Val Val His Thr Asn Tyr Asp
115 120 125
Glu Tyr Ala Ile Phe Leu Thr Lys Lys Phe Ser Arg His His Gly Pro
130 135 140
Thr Ile Thr Ala Lys Leu Tyr Gly Arg Ala Pro Gln Leu Arg Glu Thr
145 150 155 160
Leu Leu Gln Asp Phe Arg Val Val Ala Gln Gly Val Gly Ile Pro Glu
165 170 175
Asp Ser Ile Phe Thr Met Ala Asp Arg Gly Glu Cys Val Pro Gly Glu
180 185 190
Gln Glu Pro Glu Pro Ile Leu Ile Pro Arg Val Arg Arg Ala Val Leu
195 200 205
Pro Gln Glu Glu Glu Gly Ser Gly Gly Gly Gln Leu Val Thr Glu Val
210 215 220
Thr Lys Lys Glu Asp Ser Cys Gln Leu Gly Tyr Ser Ala Gly Pro Cys
225 230 235 240
Met Gly Met Thr Ser Arg Tyr Phe Tyr Asn Gly Thr Ser Met Ala Cys
245 250 255
Glu Thr Phe Gln Tyr Gly Gly Cys Met Gly Asn Gly Asn Asn Phe Val
260 265 270
Thr Glu Lys Glu Cys Leu Gln Thr Cys Arg Thr Val Ala Ala Cys Asn
275 280 285
Leu Pro Ile Val Arg Gly Pro Cys Arg Ala Phe Ile Gln Leu Trp Ala
290 295 300
Phe Asp Ala Val Lys Gly Lys Cys Val Leu Phe Pro Tyr Gly Gly Cys
305 310 315 320
Gln Gly Asn Gly Asn Lys Phe Tyr Ser Glu Lys Glu Cys Arg Glu Tyr
325 330 335
Cys Gly Val Pro Gly Asp Gly Asp Glu Glu Leu Leu Arg Phe Ser Asn
340 345 350
<210> 2
<211> 333
<212> PRT
<213> 智人
<400> 2
Gly Pro Val Pro Thr Pro Pro Asp Asn Ile Gln Val Gln Glu Asn Phe
1 5 10 15
Asn Ile Ser Arg Ile Tyr Gly Lys Trp Tyr Asn Leu Ala Ile Gly Ser
20 25 30
Thr Cys Pro Trp Leu Lys Lys Ile Met Asp Arg Met Thr Val Ser Thr
35 40 45
Leu Val Leu Gly Glu Gly Ala Thr Glu Ala Glu Ile Ser Met Thr Ser
50 55 60
Thr Arg Trp Arg Lys Gly Val Cys Glu Glu Thr Ser Gly Ala Tyr Glu
65 70 75 80
Lys Thr Asp Thr Asp Gly Lys Phe Leu Tyr His Lys Ser Lys Trp Asn
85 90 95
Ile Thr Met Glu Ser Tyr Val Val His Thr Asn Tyr Asp Glu Tyr Ala
100 105 110
Ile Phe Leu Thr Lys Lys Phe Ser Arg His His Gly Pro Thr Ile Thr
115 120 125
Ala Lys Leu Tyr Gly Arg Ala Pro Gln Leu Arg Glu Thr Leu Leu Gln
130 135 140
Asp Phe Arg Val Val Ala Gln Gly Val Gly Ile Pro Glu Asp Ser Ile
145 150 155 160
Phe Thr Met Ala Asp Arg Gly Glu Cys Val Pro Gly Glu Gln Glu Pro
165 170 175
Glu Pro Ile Leu Ile Pro Arg Val Arg Arg Ala Val Leu Pro Gln Glu
180 185 190
Glu Glu Gly Ser Gly Gly Gly Gln Leu Val Thr Glu Val Thr Lys Lys
195 200 205
Glu Asp Ser Cys Gln Leu Gly Tyr Ser Ala Gly Pro Cys Met Gly Met
210 215 220
Thr Ser Arg Tyr Phe Tyr Asn Gly Thr Ser Met Ala Cys Glu Thr Phe
225 230 235 240
Gln Tyr Gly Gly Cys Met Gly Asn Gly Asn Asn Phe Val Thr Glu Lys
245 250 255
Glu Cys Leu Gln Thr Cys Arg Thr Val Ala Ala Cys Asn Leu Pro Ile
260 265 270
Val Arg Gly Pro Cys Arg Ala Phe Ile Gln Leu Trp Ala Phe Asp Ala
275 280 285
Val Lys Gly Lys Cys Val Leu Phe Pro Tyr Gly Gly Cys Gln Gly Asn
290 295 300
Gly Asn Lys Phe Tyr Ser Glu Lys Glu Cys Arg Glu Tyr Cys Gly Val
305 310 315 320
Pro Gly Asp Gly Asp Glu Glu Leu Leu Arg Phe Ser Asn
325 330
<210> 3
<211> 184
<212> PRT
<213> 智人
<400> 3
Gly Pro Val Pro Thr Pro Pro Asp Asn Ile Gln Val Gln Glu Asn Phe
1 5 10 15
Asn Ile Ser Arg Ile Tyr Gly Lys Trp Tyr Asn Leu Ala Ile Gly Ser
20 25 30
Thr Cys Pro Trp Leu Lys Lys Ile Met Asp Arg Met Thr Val Ser Thr
35 40 45
Leu Val Leu Gly Glu Gly Ala Thr Glu Ala Glu Ile Ser Met Thr Ser
50 55 60
Thr Arg Trp Arg Lys Gly Val Cys Glu Glu Thr Ser Gly Ala Tyr Glu
65 70 75 80
Lys Thr Asp Thr Asp Gly Lys Phe Leu Tyr His Lys Ser Lys Trp Asn
85 90 95
Ile Thr Met Glu Ser Tyr Val Val His Thr Asn Tyr Asp Glu Tyr Ala
100 105 110
Ile Phe Leu Thr Lys Lys Phe Ser Arg His His Gly Pro Thr Ile Thr
115 120 125
Ala Lys Leu Tyr Gly Arg Ala Pro Gln Leu Arg Glu Thr Leu Leu Gln
130 135 140
Asp Phe Arg Val Val Ala Gln Gly Val Gly Ile Pro Glu Asp Ser Ile
145 150 155 160
Phe Thr Met Ala Asp Arg Gly Glu Cys Val Pro Gly Glu Gln Glu Pro
165 170 175
Glu Pro Ile Leu Ile Pro Arg Val
180
<210> 4
<211> 147
<212> PRT
<213> 智人
<400> 4
Ala Val Leu Pro Gln Glu Glu Glu Gly Ser Gly Gly Gly Gln Leu Val
1 5 10 15
Thr Glu Val Thr Lys Lys Glu Asp Ser Cys Gln Leu Gly Tyr Ser Ala
20 25 30
Gly Pro Cys Met Gly Met Thr Ser Arg Tyr Phe Tyr Asn Gly Thr Ser
35 40 45
Met Ala Cys Glu Thr Phe Gln Tyr Gly Gly Cys Met Gly Asn Gly Asn
50 55 60
Asn Phe Val Thr Glu Lys Glu Cys Leu Gln Thr Cys Arg Thr Val Ala
65 70 75 80
Ala Cys Asn Leu Pro Ile Val Arg Gly Pro Cys Arg Ala Phe Ile Gln
85 90 95
Leu Trp Ala Phe Asp Ala Val Lys Gly Lys Cys Val Leu Phe Pro Tyr
100 105 110
Gly Gly Cys Gln Gly Asn Gly Asn Lys Phe Tyr Ser Glu Lys Glu Cys
115 120 125
Arg Glu Tyr Cys Gly Val Pro Gly Asp Gly Asp Glu Glu Leu Leu Arg
130 135 140
Phe Ser Asn
145
<210> 5
<211> 69
<212> PRT
<213> 智人
<400> 5
Val Ala Ala Cys Asn Leu Pro Ile Val Arg Gly Pro Cys Arg Ala Phe
1 5 10 15
Ile Gln Leu Trp Ala Phe Asp Ala Val Lys Gly Lys Cys Val Leu Phe
20 25 30
Pro Tyr Gly Gly Cys Gln Gly Asn Gly Asn Lys Phe Tyr Ser Glu Lys
35 40 45
Glu Cys Arg Glu Tyr Cys Gly Val Pro Gly Asp Gly Asp Glu Glu Leu
50 55 60
Leu Arg Phe Ser Asn
65
<210> 6
<211> 261
<212> PRT
<213> 智人
<400> 6
Met Phe Glu Ala Arg Leu Val Gln Gly Ser Ile Leu Lys Lys Val Leu
1 5 10 15
Glu Ala Leu Lys Asp Leu Ile Asn Glu Ala Cys Trp Asp Ile Ser Ser
20 25 30
Ser Gly Val Asn Leu Gln Ser Met Asp Ser Ser His Val Ser Leu Val
35 40 45
Gln Leu Thr Leu Arg Ser Glu Gly Phe Asp Thr Tyr Arg Cys Asp Arg
50 55 60
Asn Leu Ala Met Gly Val Asn Leu Thr Ser Met Ser Lys Ile Leu Lys
65 70 75 80
Cys Ala Gly Asn Glu Asp Ile Ile Thr Leu Arg Ala Glu Asp Asn Ala
85 90 95
Asp Thr Leu Ala Leu Val Phe Glu Ala Pro Asn Gln Glu Lys Val Ser
100 105 110
Asp Tyr Glu Met Lys Leu Met Asp Leu Asp Val Glu Gln Leu Gly Ile
115 120 125
Pro Glu Gln Glu Tyr Ser Cys Val Val Lys Met Pro Ser Gly Glu Phe
130 135 140
Ala Arg Ile Cys Arg Asp Leu Ser His Ile Gly Asp Ala Val Val Ile
145 150 155 160
Ser Cys Ala Lys Asp Gly Val Lys Phe Ser Ala Ser Gly Glu Leu Gly
165 170 175
Asn Gly Asn Ile Lys Leu Ser Gln Thr Ser Asn Val Asp Lys Glu Glu
180 185 190
Glu Ala Val Thr Ile Glu Met Asn Glu Pro Val Gln Leu Thr Phe Ala
195 200 205
Leu Arg Tyr Leu Asn Phe Phe Thr Lys Ala Thr Pro Leu Ser Ser Thr
210 215 220
Val Thr Leu Ser Met Ser Ala Asp Val Pro Leu Val Val Glu Tyr Lys
225 230 235 240
Ile Ala Asp Met Gly His Leu Lys Tyr Tyr Leu Ala Pro Lys Ile Glu
245 250 255
Asp Glu Glu Gly Ser
260
<210> 7
<211> 295
<212> PRT
<213> 智人
<400> 7
Met Glu His Gln Leu Leu Cys Cys Glu Val Glu Thr Ile Arg Arg Ala
1 5 10 15
Tyr Pro Asp Ala Asn Leu Leu Asn Asp Arg Val Leu Arg Ala Met Leu
20 25 30
Lys Ala Glu Glu Thr Cys Ala Pro Ser Val Ser Tyr Phe Lys Cys Val
35 40 45
Gln Lys Glu Val Leu Pro Ser Met Arg Lys Ile Val Ala Thr Trp Met
50 55 60
Leu Glu Val Cys Glu Glu Gln Lys Cys Glu Glu Glu Val Phe Pro Leu
65 70 75 80
Ala Met Asn Tyr Leu Asp Arg Phe Leu Ser Leu Glu Pro Val Lys Lys
85 90 95
Ser Arg Leu Gln Leu Leu Gly Ala Thr Cys Met Phe Val Ala Ser Lys
100 105 110
Met Lys Glu Thr Ile Pro Leu Thr Ala Glu Lys Leu Cys Ile Tyr Thr
115 120 125
Asp Asn Ser Ile Arg Pro Glu Glu Leu Leu Gln Met Glu Leu Leu Leu
130 135 140
Val Asn Lys Leu Lys Trp Asn Leu Ala Ala Met Thr Pro His Asp Phe
145 150 155 160
Ile Glu His Phe Leu Ser Lys Met Pro Glu Ala Glu Glu Asn Lys Gln
165 170 175
Ile Ile Arg Lys His Ala Gln Thr Phe Val Ala Leu Cys Ala Thr Asp
180 185 190
Val Lys Phe Ile Ser Asn Pro Pro Ser Met Val Ala Ala Gly Ser Val
195 200 205
Val Ala Ala Val Gln Gly Leu Asn Leu Arg Ser Pro Asn Asn Phe Leu
210 215 220
Ser Tyr Tyr Arg Leu Thr Arg Phe Leu Ser Arg Val Ile Lys Cys Asp
225 230 235 240
Pro Asp Cys Leu Arg Ala Cys Gln Glu Gln Ile Glu Ala Leu Leu Glu
245 250 255
Ser Ser Leu Arg Gln Ala Gln Gln Asn Met Asp Pro Lys Ala Ala Glu
260 265 270
Glu Glu Glu Glu Glu Glu Glu Glu Val Asp Leu Ala Cys Thr Pro Thr
275 280 285
Asp Val Arg Asp Val Asp Ile
290 295
<210> 8
<211> 292
<212> PRT
<213> 智人
<400> 8
Met Glu Leu Leu Cys Cys Glu Gly Thr Arg His Ala Pro Arg Ala Gly
1 5 10 15
Pro Asp Pro Arg Leu Leu Gly Asp Gln Arg Val Leu Gln Ser Leu Leu
20 25 30
Arg Leu Glu Glu Arg Tyr Val Pro Arg Ala Ser Tyr Phe Gln Cys Val
35 40 45
Gln Arg Glu Ile Lys Pro His Met Arg Lys Met Leu Ala Tyr Trp Met
50 55 60
Leu Glu Val Cys Glu Glu Gln Arg Cys Glu Glu Glu Val Phe Pro Leu
65 70 75 80
Ala Met Asn Tyr Leu Asp Arg Tyr Leu Ser Cys Val Pro Thr Arg Lys
85 90 95
Ala Gln Leu Gln Leu Leu Gly Ala Val Cys Met Leu Leu Ala Ser Lys
100 105 110
Leu Arg Glu Thr Thr Pro Leu Thr Ile Glu Lys Leu Cys Ile Tyr Thr
115 120 125
Asp His Ala Val Ser Pro Arg Gln Leu Arg Asp Trp Glu Val Leu Val
130 135 140
Leu Gly Lys Leu Lys Trp Asp Leu Ala Ala Val Ile Ala His Asp Phe
145 150 155 160
Leu Ala Phe Ile Leu His Arg Leu Ser Leu Pro Arg Asp Arg Gln Ala
165 170 175
Leu Val Lys Lys His Ala Gln Thr Phe Leu Ala Leu Cys Ala Thr Asp
180 185 190
Tyr Thr Phe Ala Met Tyr Pro Pro Ser Met Ile Ala Thr Gly Ser Ile
195 200 205
Gly Ala Ala Val Gln Gly Leu Gly Ala Cys Ser Met Ser Gly Asp Glu
210 215 220
Leu Thr Glu Leu Leu Ala Gly Ile Thr Gly Thr Glu Val Asp Cys Leu
225 230 235 240
Arg Ala Cys Gln Glu Gln Ile Glu Ala Ala Leu Arg Glu Ser Leu Arg
245 250 255
Glu Ala Ser Gln Thr Ser Ser Ser Pro Ala Pro Lys Ala Pro Arg Gly
260 265 270
Ser Ser Ser Gln Gly Pro Ser Gln Thr Ser Thr Pro Thr Asp Val Thr
275 280 285
Ala Ile His Leu
290
<210> 9
<211> 393
<212> PRT
<213> 智人
<400> 9
Met Pro Lys Lys Lys Pro Thr Pro Ile Gln Leu Asn Pro Ala Pro Asp
1 5 10 15
Gly Ser Ala Val Asn Gly Thr Ser Ser Ala Glu Thr Asn Leu Glu Ala
20 25 30
Leu Gln Lys Lys Leu Glu Glu Leu Glu Leu Asp Glu Gln Gln Arg Lys
35 40 45
Arg Leu Glu Ala Phe Leu Thr Gln Lys Gln Lys Val Gly Glu Leu Lys
50 55 60
Asp Asp Asp Phe Glu Lys Ile Ser Glu Leu Gly Ala Gly Asn Gly Gly
65 70 75 80
Val Val Phe Lys Val Ser His Lys Pro Ser Gly Leu Val Met Ala Arg
85 90 95
Lys Leu Ile His Leu Glu Ile Lys Pro Ala Ile Arg Asn Gln Ile Ile
100 105 110
Arg Glu Leu Gln Val Leu His Glu Cys Asn Ser Pro Tyr Ile Val Gly
115 120 125
Phe Tyr Gly Ala Phe Tyr Ser Asp Gly Glu Ile Ser Ile Cys Met Glu
130 135 140
His Met Asp Gly Gly Ser Leu Asp Gln Val Leu Lys Lys Ala Gly Arg
145 150 155 160
Ile Pro Glu Gln Ile Leu Gly Lys Val Ser Ile Ala Val Ile Lys Gly
165 170 175
Leu Thr Tyr Leu Arg Glu Lys His Lys Ile Met His Arg Asp Val Lys
180 185 190
Pro Ser Asn Ile Leu Val Asn Ser Arg Gly Glu Ile Lys Leu Cys Asp
195 200 205
Phe Gly Val Ser Gly Gln Leu Ile Asp Ser Met Ala Asn Ser Phe Val
210 215 220
Gly Thr Arg Ser Tyr Met Ser Pro Glu Arg Leu Gln Gly Thr His Tyr
225 230 235 240
Ser Val Gln Ser Asp Ile Trp Ser Met Gly Leu Ser Leu Val Glu Met
245 250 255
Ala Val Gly Arg Tyr Pro Ile Pro Pro Pro Asp Ala Lys Glu Leu Glu
260 265 270
Leu Met Phe Gly Cys Gln Val Glu Gly Asp Ala Ala Glu Thr Pro Pro
275 280 285
Arg Pro Arg Thr Pro Gly Arg Pro Leu Ser Ser Tyr Gly Met Asp Ser
290 295 300
Arg Pro Pro Met Ala Ile Phe Glu Leu Leu Asp Tyr Ile Val Asn Glu
305 310 315 320
Pro Pro Pro Lys Leu Pro Ser Gly Val Phe Ser Leu Glu Phe Gln Asp
325 330 335
Phe Val Asn Lys Cys Leu Ile Lys Asn Pro Ala Glu Arg Ala Asp Leu
340 345 350
Lys Gln Leu Met Val His Ala Phe Ile Lys Arg Ser Asp Ala Glu Glu
355 360 365
Val Asp Phe Ala Gly Trp Leu Cys Ser Thr Ile Gly Leu Asn Gln Pro
370 375 380
Ser Thr Pro Thr His Ala Ala Gly Val
385 390
<210> 10
<211> 367
<212> PRT
<213> 智人
<400> 10
Met Pro Lys Lys Lys Pro Thr Pro Ile Gln Leu Asn Pro Ala Pro Asp
1 5 10 15
Gly Ser Ala Val Asn Gly Thr Ser Ser Ala Glu Thr Asn Leu Glu Ala
20 25 30
Leu Gln Lys Lys Leu Glu Glu Leu Glu Leu Asp Glu Gln Gln Arg Lys
35 40 45
Arg Leu Glu Ala Phe Leu Thr Gln Lys Gln Lys Val Gly Glu Leu Lys
50 55 60
Asp Asp Asp Phe Glu Lys Ile Ser Glu Leu Gly Ala Gly Asn Gly Gly
65 70 75 80
Val Val Phe Lys Val Ser His Lys Pro Ser Gly Leu Val Met Ala Arg
85 90 95
Lys Leu Ile His Leu Glu Ile Lys Pro Ala Ile Arg Asn Gln Ile Ile
100 105 110
Arg Glu Leu Gln Val Leu His Glu Cys Asn Ser Pro Tyr Ile Val Gly
115 120 125
Phe Tyr Gly Ala Phe Tyr Ser Asp Gly Glu Ile Ser Ile Cys Met Glu
130 135 140
His Met Val Ile Lys Gly Leu Thr Tyr Leu Arg Glu Lys His Lys Ile
145 150 155 160
Met His Arg Asp Val Lys Pro Ser Asn Ile Leu Val Asn Ser Arg Gly
165 170 175
Glu Ile Lys Leu Cys Asp Phe Gly Val Ser Gly Gln Leu Ile Asp Ser
180 185 190
Met Ala Asn Ser Phe Val Gly Thr Arg Ser Tyr Met Ser Pro Glu Arg
195 200 205
Leu Gln Gly Thr His Tyr Ser Val Gln Ser Asp Ile Trp Ser Met Gly
210 215 220
Leu Ser Leu Val Glu Met Ala Val Gly Arg Tyr Pro Ile Pro Pro Pro
225 230 235 240
Asp Ala Lys Glu Leu Glu Leu Met Phe Gly Cys Gln Val Glu Gly Asp
245 250 255
Ala Ala Glu Thr Pro Pro Arg Pro Arg Thr Pro Gly Arg Pro Leu Ser
260 265 270
Ser Tyr Gly Met Asp Ser Arg Pro Pro Met Ala Ile Phe Glu Leu Leu
275 280 285
Asp Tyr Ile Val Asn Glu Pro Pro Pro Lys Leu Pro Ser Gly Val Phe
290 295 300
Ser Leu Glu Phe Gln Asp Phe Val Asn Lys Cys Leu Ile Lys Asn Pro
305 310 315 320
Ala Glu Arg Ala Asp Leu Lys Gln Leu Met Val His Ala Phe Ile Lys
325 330 335
Arg Ser Asp Ala Glu Glu Val Asp Phe Ala Gly Trp Leu Cys Ser Thr
340 345 350
Ile Gly Leu Asn Gln Pro Ser Thr Pro Thr His Ala Ala Gly Val
355 360 365
<210> 11
<211> 249
<212> PRT
<213> 智人
<400> 11
Met Lys Leu Asn Ile Ser Phe Pro Ala Thr Gly Cys Gln Lys Leu Ile
1 5 10 15
Glu Val Asp Asp Glu Arg Lys Leu Arg Thr Phe Tyr Glu Lys Arg Met
20 25 30
Ala Thr Glu Val Ala Ala Asp Ala Leu Gly Glu Glu Trp Lys Gly Tyr
35 40 45
Val Val Arg Ile Ser Gly Gly Asn Asp Lys Gln Gly Phe Pro Met Lys
50 55 60
Gln Gly Val Leu Thr His Gly Arg Val Arg Leu Leu Leu Ser Lys Gly
65 70 75 80
His Ser Cys Tyr Arg Pro Arg Arg Thr Gly Glu Arg Lys Arg Lys Ser
85 90 95
Val Arg Gly Cys Ile Val Asp Ala Asn Leu Ser Val Leu Asn Leu Val
100 105 110
Ile Val Lys Lys Gly Glu Lys Asp Ile Pro Gly Leu Thr Asp Thr Thr
115 120 125
Val Pro Arg Arg Leu Gly Pro Lys Arg Ala Ser Arg Ile Arg Lys Leu
130 135 140
Phe Asn Leu Ser Lys Glu Asp Asp Val Arg Gln Tyr Val Val Arg Lys
145 150 155 160
Pro Leu Asn Lys Glu Gly Lys Lys Pro Arg Thr Lys Ala Pro Lys Ile
165 170 175
Gln Arg Leu Val Thr Pro Arg Val Leu Gln His Lys Arg Arg Arg Ile
180 185 190
Ala Leu Lys Lys Gln Arg Thr Lys Lys Asn Lys Glu Glu Ala Ala Glu
195 200 205
Tyr Ala Lys Leu Leu Ala Lys Arg Met Lys Glu Ala Lys Glu Lys Arg
210 215 220
Gln Glu Gln Ile Ala Lys Arg Arg Arg Leu Ser Ser Leu Arg Ala Ser
225 230 235 240
Thr Ser Lys Ser Glu Ser Ser Gln Lys
245
<210> 12
<211> 379
<212> PRT
<213> 智人
<400> 12
Met Ala Ala Ala Ala Ala Gln Gly Gly Gly Gly Gly Glu Pro Arg Arg
1 5 10 15
Thr Glu Gly Val Gly Pro Gly Val Pro Gly Glu Val Glu Met Val Lys
20 25 30
Gly Gln Pro Phe Asp Val Gly Pro Arg Tyr Thr Gln Leu Gln Tyr Ile
35 40 45
Gly Glu Gly Ala Tyr Gly Met Val Ser Ser Ala Tyr Asp His Val Arg
50 55 60
Lys Thr Arg Val Ala Ile Lys Lys Ile Ser Pro Phe Glu His Gln Thr
65 70 75 80
Tyr Cys Gln Arg Thr Leu Arg Glu Ile Gln Ile Leu Leu Arg Phe Arg
85 90 95
His Glu Asn Val Ile Gly Ile Arg Asp Ile Leu Arg Ala Ser Thr Leu
100 105 110
Glu Ala Met Arg Asp Val Tyr Ile Val Gln Asp Leu Met Glu Thr Asp
115 120 125
Leu Tyr Lys Leu Leu Lys Ser Gln Gln Leu Ser Asn Asp His Ile Cys
130 135 140
Tyr Phe Leu Tyr Gln Ile Leu Arg Gly Leu Lys Tyr Ile His Ser Ala
145 150 155 160
Asn Val Leu His Arg Asp Leu Lys Pro Ser Asn Leu Leu Ile Asn Thr
165 170 175
Thr Cys Asp Leu Lys Ile Cys Asp Phe Gly Leu Ala Arg Ile Ala Asp
180 185 190
Pro Glu His Asp His Thr Gly Phe Leu Thr Glu Tyr Val Ala Thr Arg
195 200 205
Trp Tyr Arg Ala Pro Glu Ile Met Leu Asn Ser Lys Gly Tyr Thr Lys
210 215 220
Ser Ile Asp Ile Trp Ser Val Gly Cys Ile Leu Ala Glu Met Leu Ser
225 230 235 240
Asn Arg Pro Ile Phe Pro Gly Lys His Tyr Leu Asp Gln Leu Asn His
245 250 255
Ile Leu Gly Ile Leu Gly Ser Pro Ser Gln Glu Asp Leu Asn Cys Ile
260 265 270
Ile Asn Met Lys Ala Arg Asn Tyr Leu Gln Ser Leu Pro Ser Lys Thr
275 280 285
Lys Val Ala Trp Ala Lys Leu Phe Pro Lys Ser Asp Ser Lys Ala Leu
290 295 300
Asp Leu Leu Asp Arg Met Leu Thr Phe Asn Pro Asn Lys Arg Ile Thr
305 310 315 320
Val Glu Glu Ala Leu Ala His Pro Tyr Leu Glu Gln Tyr Tyr Asp Pro
325 330 335
Thr Asp Glu Pro Val Ala Glu Glu Pro Phe Thr Phe Ala Met Glu Leu
340 345 350
Asp Asp Leu Pro Lys Glu Arg Leu Lys Glu Leu Ile Phe Gln Glu Thr
355 360 365
Ala Arg Phe Gln Pro Gly Val Leu Glu Ala Pro
370 375
<210> 13
<211> 335
<212> PRT
<213> 智人
<400> 13
Met Ala Ala Ala Ala Ala Gln Gly Gly Gly Gly Gly Glu Pro Arg Arg
1 5 10 15
Thr Glu Gly Val Gly Pro Gly Val Pro Gly Glu Val Glu Met Val Lys
20 25 30
Gly Gln Pro Phe Asp Val Gly Pro Arg Tyr Thr Gln Leu Gln Tyr Ile
35 40 45
Gly Glu Gly Ala Tyr Gly Met Val Ser Ser Ala Tyr Asp His Val Arg
50 55 60
Lys Thr Arg Val Ala Ile Lys Lys Ile Ser Pro Phe Glu His Gln Thr
65 70 75 80
Tyr Cys Gln Arg Thr Leu Arg Glu Ile Gln Ile Leu Leu Arg Phe Arg
85 90 95
His Glu Asn Val Ile Gly Ile Arg Asp Ile Leu Arg Ala Ser Thr Leu
100 105 110
Glu Ala Met Arg Asp Val Tyr Ile Val Gln Asp Leu Met Glu Thr Asp
115 120 125
Leu Tyr Lys Leu Leu Lys Ser Gln Gln Leu Ser Asn Asp His Ile Cys
130 135 140
Tyr Phe Leu Tyr Gln Ile Leu Arg Gly Leu Lys Tyr Ile His Ser Ala
145 150 155 160
Asn Val Leu His Arg Asp Leu Lys Pro Ser Asn Leu Leu Ile Asn Thr
165 170 175
Thr Cys Asp Leu Lys Ile Cys Asp Phe Gly Leu Ala Arg Ile Ala Asp
180 185 190
Pro Glu His Asp His Thr Gly Phe Leu Thr Glu Tyr Val Ala Thr Arg
195 200 205
Trp Tyr Arg Ala Pro Glu Ile Met Leu Asn Ser Lys Gly Tyr Thr Lys
210 215 220
Ser Ile Asp Ile Trp Ser Val Gly Cys Ile Leu Ala Glu Met Leu Ser
225 230 235 240
Asn Arg Pro Ile Phe Pro Gly Lys His Tyr Leu Asp Gln Leu Asn His
245 250 255
Ile Leu Ala Leu Asp Leu Leu Asp Arg Met Leu Thr Phe Asn Pro Asn
260 265 270
Lys Arg Ile Thr Val Glu Glu Ala Leu Ala His Pro Tyr Leu Glu Gln
275 280 285
Tyr Tyr Asp Pro Thr Asp Glu Pro Val Ala Glu Glu Pro Phe Thr Phe
290 295 300
Ala Met Glu Leu Asp Asp Leu Pro Lys Glu Arg Leu Lys Glu Leu Ile
305 310 315 320
Phe Gln Glu Thr Ala Arg Phe Gln Pro Gly Val Leu Glu Ala Pro
325 330 335
<210> 14
<211> 357
<212> PRT
<213> 智人
<400> 14
Met Ala Ala Ala Ala Ala Gln Gly Gly Gly Gly Gly Glu Pro Arg Arg
1 5 10 15
Thr Glu Gly Val Gly Pro Gly Val Pro Gly Glu Val Glu Met Val Lys
20 25 30
Gly Gln Pro Phe Asp Val Gly Pro Arg Tyr Thr Gln Leu Gln Tyr Ile
35 40 45
Gly Glu Gly Ala Tyr Gly Met Val Ser Ser Ala Tyr Asp His Val Arg
50 55 60
Lys Thr Arg Val Ala Ile Lys Lys Ile Ser Pro Phe Glu His Gln Thr
65 70 75 80
Tyr Cys Gln Arg Thr Leu Arg Glu Ile Gln Ile Leu Leu Arg Phe Arg
85 90 95
His Glu Asn Val Ile Gly Ile Arg Asp Ile Leu Arg Ala Ser Thr Leu
100 105 110
Glu Ala Met Arg Asp Val Tyr Ile Val Gln Asp Leu Met Glu Thr Asp
115 120 125
Leu Tyr Lys Leu Leu Lys Ser Gln Gln Leu Ser Asn Asp His Ile Cys
130 135 140
Tyr Phe Leu Tyr Gln Ile Leu Arg Gly Leu Lys Tyr Ile His Ser Ala
145 150 155 160
Asn Val Leu His Arg Asp Leu Lys Pro Ser Asn Leu Leu Ile Asn Thr
165 170 175
Thr Cys Asp Leu Lys Ile Cys Asp Phe Gly Leu Ala Arg Ile Ala Asp
180 185 190
Pro Glu His Asp His Thr Gly Phe Leu Thr Glu Tyr Val Ala Thr Arg
195 200 205
Trp Tyr Arg Ala Pro Glu Ile Met Leu Asn Ser Lys Gly Tyr Thr Lys
210 215 220
Ser Ile Asp Ile Trp Ser Val Gly Cys Ile Leu Ala Glu Met Leu Ser
225 230 235 240
Asn Arg Pro Ile Phe Pro Gly Lys His Tyr Leu Asp Gln Leu Asn His
245 250 255
Ile Leu Gly Ile Leu Gly Ser Pro Ser Gln Glu Asp Leu Asn Cys Ile
260 265 270
Ile Asn Met Lys Ala Arg Asn Tyr Leu Gln Ser Leu Pro Ser Lys Thr
275 280 285
Lys Val Ala Trp Ala Lys Leu Phe Pro Lys Ser Asp Ser Lys Ala Leu
290 295 300
Asp Leu Leu Asp Arg Met Leu Thr Phe Asn Pro Asn Lys Arg Ile Thr
305 310 315 320
Val Glu Glu Ala Leu Ala His Pro Tyr Leu Glu Gln Tyr Tyr Asp Pro
325 330 335
Thr Asp Glu Val Gly Gln Ser Pro Ala Ala Val Gly Leu Gly Ala Gly
340 345 350
Glu Gln Gly Gly Thr
355
<210> 15
<211> 360
<212> PRT
<213> 智人
<400> 15
Met Ala Ala Ala Ala Ala Ala Gly Ala Gly Pro Glu Met Val Arg Gly
1 5 10 15
Gln Val Phe Asp Val Gly Pro Arg Tyr Thr Asn Leu Ser Tyr Ile Gly
20 25 30
Glu Gly Ala Tyr Gly Met Val Cys Ser Ala Tyr Asp Asn Val Asn Lys
35 40 45
Val Arg Val Ala Ile Lys Lys Ile Ser Pro Phe Glu His Gln Thr Tyr
50 55 60
Cys Gln Arg Thr Leu Arg Glu Ile Lys Ile Leu Leu Arg Phe Arg His
65 70 75 80
Glu Asn Ile Ile Gly Ile Asn Asp Ile Ile Arg Ala Pro Thr Ile Glu
85 90 95
Gln Met Lys Asp Val Tyr Ile Val Gln Asp Leu Met Glu Thr Asp Leu
100 105 110
Tyr Lys Leu Leu Lys Thr Gln His Leu Ser Asn Asp His Ile Cys Tyr
115 120 125
Phe Leu Tyr Gln Ile Leu Arg Gly Leu Lys Tyr Ile His Ser Ala Asn
130 135 140
Val Leu His Arg Asp Leu Lys Pro Ser Asn Leu Leu Leu Asn Thr Thr
145 150 155 160
Cys Asp Leu Lys Ile Cys Asp Phe Gly Leu Ala Arg Val Ala Asp Pro
165 170 175
Asp His Asp His Thr Gly Phe Leu Thr Glu Tyr Val Ala Thr Arg Trp
180 185 190
Tyr Arg Ala Pro Glu Ile Met Leu Asn Ser Lys Gly Tyr Thr Lys Ser
195 200 205
Ile Asp Ile Trp Ser Val Gly Cys Ile Leu Ala Glu Met Leu Ser Asn
210 215 220
Arg Pro Ile Phe Pro Gly Lys His Tyr Leu Asp Gln Leu Asn His Ile
225 230 235 240
Leu Gly Ile Leu Gly Ser Pro Ser Gln Glu Asp Leu Asn Cys Ile Ile
245 250 255
Asn Leu Lys Ala Arg Asn Tyr Leu Leu Ser Leu Pro His Lys Asn Lys
260 265 270
Val Pro Trp Asn Arg Leu Phe Pro Asn Ala Asp Ser Lys Ala Leu Asp
275 280 285
Leu Leu Asp Lys Met Leu Thr Phe Asn Pro His Lys Arg Ile Glu Val
290 295 300
Glu Gln Ala Leu Ala His Pro Tyr Leu Glu Gln Tyr Tyr Asp Pro Ser
305 310 315 320
Asp Glu Pro Ile Ala Glu Ala Pro Phe Lys Phe Asp Met Glu Leu Asp
325 330 335
Asp Leu Pro Lys Glu Lys Leu Lys Glu Leu Ile Phe Glu Glu Thr Ala
340 345 350
Arg Phe Gln Pro Gly Tyr Arg Ser
355 360
<210> 16
<211> 316
<212> PRT
<213> 智人
<400> 16
Met Ala Ala Ala Ala Ala Ala Gly Ala Gly Pro Glu Met Val Arg Gly
1 5 10 15
Gln Val Phe Asp Val Gly Pro Arg Tyr Thr Asn Leu Ser Tyr Ile Gly
20 25 30
Glu Gly Ala Tyr Gly Met Val Cys Ser Ala Tyr Asp Asn Val Asn Lys
35 40 45
Val Arg Val Ala Ile Lys Lys Ile Ser Pro Phe Glu His Gln Thr Tyr
50 55 60
Cys Gln Arg Thr Leu Arg Glu Ile Lys Ile Leu Leu Arg Phe Arg His
65 70 75 80
Glu Asn Ile Ile Gly Ile Asn Asp Ile Ile Arg Ala Pro Thr Ile Glu
85 90 95
Gln Met Lys Asp Val Tyr Ile Val Gln Asp Leu Met Glu Thr Asp Leu
100 105 110
Tyr Lys Leu Leu Lys Thr Gln His Leu Ser Asn Asp His Ile Cys Tyr
115 120 125
Phe Leu Tyr Gln Ile Leu Arg Gly Leu Lys Tyr Ile His Ser Ala Asn
130 135 140
Val Leu His Arg Asp Leu Lys Pro Ser Asn Leu Leu Leu Asn Thr Thr
145 150 155 160
Cys Asp Leu Lys Ile Cys Asp Phe Gly Leu Ala Arg Val Ala Asp Pro
165 170 175
Asp His Asp His Thr Gly Phe Leu Thr Glu Tyr Val Ala Thr Arg Trp
180 185 190
Tyr Arg Ala Pro Glu Ile Met Leu Asn Ser Lys Gly Tyr Thr Lys Ser
195 200 205
Ile Asp Ile Trp Ser Val Gly Cys Ile Leu Ala Glu Met Leu Ser Asn
210 215 220
Arg Pro Ile Phe Pro Gly Lys His Tyr Leu Asp Gln Leu Asn His Ile
225 230 235 240
Leu Ala Leu Asp Leu Leu Asp Lys Met Leu Thr Phe Asn Pro His Lys
245 250 255
Arg Ile Glu Val Glu Gln Ala Leu Ala His Pro Tyr Leu Glu Gln Tyr
260 265 270
Tyr Asp Pro Ser Asp Glu Pro Ile Ala Glu Ala Pro Phe Lys Phe Asp
275 280 285
Met Glu Leu Asp Asp Leu Pro Lys Glu Lys Leu Lys Glu Leu Ile Phe
290 295 300
Glu Glu Thr Ala Arg Phe Gln Pro Gly Tyr Arg Ser
305 310 315
<210> 17
<211> 480
<212> PRT
<213> 智人
<400> 17
Met Ser Asp Val Ala Ile Val Lys Glu Gly Trp Leu His Lys Arg Gly
1 5 10 15
Glu Tyr Ile Lys Thr Trp Arg Pro Arg Tyr Phe Leu Leu Lys Asn Asp
20 25 30
Gly Thr Phe Ile Gly Tyr Lys Glu Arg Pro Gln Asp Val Asp Gln Arg
35 40 45
Glu Ala Pro Leu Asn Asn Phe Ser Val Ala Gln Cys Gln Leu Met Lys
50 55 60
Thr Glu Arg Pro Arg Pro Asn Thr Phe Ile Ile Arg Cys Leu Gln Trp
65 70 75 80
Thr Thr Val Ile Glu Arg Thr Phe His Val Glu Thr Pro Glu Glu Arg
85 90 95
Glu Glu Trp Thr Thr Ala Ile Gln Thr Val Ala Asp Gly Leu Lys Lys
100 105 110
Gln Glu Glu Glu Glu Met Asp Phe Arg Ser Gly Ser Pro Ser Asp Asn
115 120 125
Ser Gly Ala Glu Glu Met Glu Val Ser Leu Ala Lys Pro Lys His Arg
130 135 140
Val Thr Met Asn Glu Phe Glu Tyr Leu Lys Leu Leu Gly Lys Gly Thr
145 150 155 160
Phe Gly Lys Val Ile Leu Val Lys Glu Lys Ala Thr Gly Arg Tyr Tyr
165 170 175
Ala Met Lys Ile Leu Lys Lys Glu Val Ile Val Ala Lys Asp Glu Val
180 185 190
Ala His Thr Leu Thr Glu Asn Arg Val Leu Gln Asn Ser Arg His Pro
195 200 205
Phe Leu Thr Ala Leu Lys Tyr Ser Phe Gln Thr His Asp Arg Leu Cys
210 215 220
Phe Val Met Glu Tyr Ala Asn Gly Gly Glu Leu Phe Phe His Leu Ser
225 230 235 240
Arg Glu Arg Val Phe Ser Glu Asp Arg Ala Arg Phe Tyr Gly Ala Glu
245 250 255
Ile Val Ser Ala Leu Asp Tyr Leu His Ser Glu Lys Asn Val Val Tyr
260 265 270
Arg Asp Leu Lys Leu Glu Asn Leu Met Leu Asp Lys Asp Gly His Ile
275 280 285
Lys Ile Thr Asp Phe Gly Leu Cys Lys Glu Gly Ile Lys Asp Gly Ala
290 295 300
Thr Met Lys Thr Phe Cys Gly Thr Pro Glu Tyr Leu Ala Pro Glu Val
305 310 315 320
Leu Glu Asp Asn Asp Tyr Gly Arg Ala Val Asp Trp Trp Gly Leu Gly
325 330 335
Val Val Met Tyr Glu Met Met Cys Gly Arg Leu Pro Phe Tyr Asn Gln
340 345 350
Asp His Glu Lys Leu Phe Glu Leu Ile Leu Met Glu Glu Ile Arg Phe
355 360 365
Pro Arg Thr Leu Gly Pro Glu Ala Lys Ser Leu Leu Ser Gly Leu Leu
370 375 380
Lys Lys Asp Pro Lys Gln Arg Leu Gly Gly Gly Ser Glu Asp Ala Lys
385 390 395 400
Glu Ile Met Gln His Arg Phe Phe Ala Gly Ile Val Trp Gln His Val
405 410 415
Tyr Glu Lys Lys Leu Ser Pro Pro Phe Lys Pro Gln Val Thr Ser Glu
420 425 430
Thr Asp Thr Arg Tyr Phe Asp Glu Glu Phe Thr Ala Gln Met Ile Thr
435 440 445
Ile Thr Pro Pro Asp Gln Asp Asp Ser Met Glu Cys Val Asp Ser Glu
450 455 460
Arg Arg Pro His Phe Pro Gln Phe Ser Tyr Ser Ala Ser Gly Thr Ala
465 470 475 480
<210> 18
<211> 452
<212> PRT
<213> 智人
<400> 18
Met Ala Ala Pro Ser Ala Gly Ser Trp Ser Thr Phe Gln His Lys Glu
1 5 10 15
Leu Met Ala Ala Asp Arg Gly Arg Arg Ile Leu Gly Val Cys Gly Met
20 25 30
His Pro His His Gln Glu Thr Leu Lys Lys Asn Arg Val Val Leu Ala
35 40 45
Lys Gln Leu Leu Leu Ser Glu Leu Leu Glu His Leu Leu Glu Lys Asp
50 55 60
Ile Ile Thr Leu Glu Met Arg Glu Leu Ile Gln Ala Lys Val Gly Ser
65 70 75 80
Phe Ser Gln Asn Val Glu Leu Leu Asn Leu Leu Pro Lys Arg Gly Pro
85 90 95
Gln Ala Phe Asp Ala Phe Cys Glu Ala Leu Arg Glu Thr Lys Gln Gly
100 105 110
His Leu Glu Asp Met Leu Leu Thr Thr Leu Ser Gly Leu Gln His Val
115 120 125
Leu Pro Pro Leu Ser Cys Asp Tyr Asp Leu Ser Leu Pro Phe Pro Val
130 135 140
Cys Glu Ser Cys Pro Leu Tyr Lys Lys Leu Arg Leu Ser Thr Asp Thr
145 150 155 160
Val Glu His Ser Leu Asp Asn Lys Asp Gly Pro Val Cys Leu Gln Val
165 170 175
Lys Pro Cys Thr Pro Glu Phe Tyr Gln Thr His Phe Gln Leu Ala Tyr
180 185 190
Arg Leu Gln Ser Arg Pro Arg Gly Leu Ala Leu Val Leu Ser Asn Val
195 200 205
His Phe Thr Gly Glu Lys Glu Leu Glu Phe Arg Ser Gly Gly Asp Val
210 215 220
Asp His Ser Thr Leu Val Thr Leu Phe Lys Leu Leu Gly Tyr Asp Val
225 230 235 240
His Val Leu Cys Asp Gln Thr Ala Gln Glu Met Gln Glu Lys Leu Gln
245 250 255
Asn Phe Ala Gln Leu Pro Ala His Arg Val Thr Asp Ser Cys Ile Val
260 265 270
Ala Leu Leu Ser His Gly Val Glu Gly Ala Ile Tyr Gly Val Asp Gly
275 280 285
Lys Leu Leu Gln Leu Gln Glu Val Phe Gln Leu Phe Asp Asn Ala Asn
290 295 300
Cys Pro Ser Leu Gln Asn Lys Pro Lys Met Phe Phe Ile Gln Ala Cys
305 310 315 320
Arg Gly Asp Glu Thr Asp Arg Gly Val Asp Gln Gln Asp Gly Lys Asn
325 330 335
His Ala Gly Ser Pro Gly Cys Glu Glu Ser Asp Ala Gly Lys Glu Lys
340 345 350
Leu Pro Lys Met Arg Leu Pro Thr Arg Ser Asp Met Ile Cys Gly Tyr
355 360 365
Ala Cys Leu Lys Gly Thr Ala Ala Met Arg Asn Thr Lys Arg Gly Ser
370 375 380
Trp Tyr Ile Glu Ala Leu Ala Gln Val Phe Ser Glu Arg Ala Cys Asp
385 390 395 400
Met His Val Ala Asp Met Leu Val Lys Val Asn Ala Leu Ile Lys Asp
405 410 415
Arg Glu Gly Tyr Ala Pro Gly Thr Glu Phe His Arg Cys Lys Glu Met
420 425 430
Ser Glu Tyr Cys Ser Thr Leu Cys Arg His Leu Tyr Leu Phe Pro Gly
435 440 445
His Pro Pro Thr
450
<210> 19
<211> 313
<212> PRT
<213> 智人
<400> 19
Met His Pro His His Gln Glu Thr Leu Lys Lys Asn Arg Val Val Leu
1 5 10 15
Ala Lys Gln Leu Leu Leu Ser Glu Leu Leu Glu His Leu Leu Glu Lys
20 25 30
Asp Ile Ile Thr Leu Glu Met Arg Glu Leu Ile Gln Ala Lys Val Gly
35 40 45
Ser Phe Ser Gln Asn Val Glu Leu Leu Asn Leu Leu Pro Lys Arg Gly
50 55 60
Pro Gln Ala Phe Asp Ala Phe Cys Glu Ala Leu Arg Glu Thr Lys Gln
65 70 75 80
Gly His Leu Glu Asp Met Leu Leu Thr Thr Leu Ser Gly Leu Gln His
85 90 95
Val Leu Pro Pro Leu Ser Cys Asp Tyr Asp Leu Ser Leu Pro Phe Pro
100 105 110
Val Cys Glu Ser Cys Pro Leu Tyr Lys Lys Leu Arg Leu Ser Thr Asp
115 120 125
Thr Val Glu His Ser Leu Asp Asn Lys Asp Gly Pro Val Cys Leu Gln
130 135 140
Val Lys Pro Cys Thr Pro Glu Phe Tyr Gln Thr His Phe Gln Leu Ala
145 150 155 160
Tyr Arg Leu Gln Ser Arg Pro Arg Gly Leu Ala Leu Val Leu Ser Asn
165 170 175
Val His Phe Thr Gly Glu Lys Glu Leu Glu Phe Arg Ser Gly Gly Asp
180 185 190
Val Asp His Ser Thr Leu Val Thr Leu Phe Lys Leu Leu Gly Tyr Asp
195 200 205
Val His Val Leu Cys Asp Gln Thr Ala Gln Glu Met Gln Glu Lys Leu
210 215 220
Gln Asn Phe Ala Gln Leu Pro Ala His Arg Val Thr Asp Ser Cys Ile
225 230 235 240
Val Ala Leu Leu Ser His Gly Val Glu Gly Ala Ile Tyr Gly Val Asp
245 250 255
Gly Lys Leu Leu Gln Leu Gln Glu Val Phe Gln Leu Phe Asp Asn Ala
260 265 270
Asn Cys Pro Ser Leu Gln Asn Lys Pro Lys Met Phe Phe Ile Gln Ala
275 280 285
Cys Arg Gly Gly Gly Ala Ile Gly Ser Leu Gly His Leu Leu Leu Phe
290 295 300
Thr Ala Ala Thr Ala Ser Leu Ala Leu
305 310
<210> 20
<211> 91
<212> PRT
<213> 智人
<400> 20
Met Ala Ala Asp Arg Gly Arg Arg Ile Leu Gly Val Cys Gly Met His
1 5 10 15
Pro His His Gln Glu Thr Leu Lys Lys Asn Arg Val Val Leu Ala Lys
20 25 30
Gln Leu Leu Leu Ser Glu Leu Leu Glu His Leu Leu Glu Lys Asp Ile
35 40 45
Ile Thr Leu Glu Met Arg Glu Leu Ile Gln Ala Lys Val Gly Ser Phe
50 55 60
Ser Gln Asn Val Glu Leu Leu Asn Leu Leu Pro Lys Arg Gly Pro Gln
65 70 75 80
Ala Phe Asp Ala Phe Cys Glu Ala Leu His Ser
85 90
<210> 21
<211> 425
<212> PRT
<213> 智人
<400> 21
Met Ala Asp Lys Glu Ala Ala Phe Asp Asp Ala Val Glu Glu Arg Val
1 5 10 15
Ile Asn Glu Glu Tyr Lys Ile Trp Lys Lys Asn Thr Pro Phe Leu Tyr
20 25 30
Asp Leu Val Met Thr His Ala Leu Glu Trp Pro Ser Leu Thr Ala Gln
35 40 45
Trp Leu Pro Asp Val Thr Arg Pro Glu Gly Lys Asp Phe Ser Ile His
50 55 60
Arg Leu Val Leu Gly Thr His Thr Ser Asp Glu Gln Asn His Leu Val
65 70 75 80
Ile Ala Ser Val Gln Leu Pro Asn Asp Asp Ala Gln Phe Asp Ala Ser
85 90 95
His Tyr Asp Ser Glu Lys Gly Glu Phe Gly Gly Phe Gly Ser Val Ser
100 105 110
Gly Lys Ile Glu Ile Glu Ile Lys Ile Asn His Glu Gly Glu Val Asn
115 120 125
Arg Ala Arg Tyr Met Pro Gln Asn Pro Cys Ile Ile Ala Thr Lys Thr
130 135 140
Pro Ser Ser Asp Val Leu Val Phe Asp Tyr Thr Lys His Pro Ser Lys
145 150 155 160
Pro Asp Pro Ser Gly Glu Cys Asn Pro Asp Leu Arg Leu Arg Gly His
165 170 175
Gln Lys Glu Gly Tyr Gly Leu Ser Trp Asn Pro Asn Leu Ser Gly His
180 185 190
Leu Leu Ser Ala Ser Asp Asp His Thr Ile Cys Leu Trp Asp Ile Ser
195 200 205
Ala Val Pro Lys Glu Gly Lys Val Val Asp Ala Lys Thr Ile Phe Thr
210 215 220
Gly His Thr Ala Val Val Glu Asp Val Ser Trp His Leu Leu His Glu
225 230 235 240
Ser Leu Phe Gly Ser Val Ala Asp Asp Gln Lys Leu Met Ile Trp Asp
245 250 255
Thr Arg Ser Asn Asn Thr Ser Lys Pro Ser His Ser Val Asp Ala His
260 265 270
Thr Ala Glu Val Asn Cys Leu Ser Phe Asn Pro Tyr Ser Glu Phe Ile
275 280 285
Leu Ala Thr Gly Ser Ala Asp Lys Thr Val Ala Leu Trp Asp Leu Arg
290 295 300
Asn Leu Lys Leu Lys Leu His Ser Phe Glu Ser His Lys Asp Glu Ile
305 310 315 320
Phe Gln Val Gln Trp Ser Pro His Asn Glu Thr Ile Leu Ala Ser Ser
325 330 335
Gly Thr Asp Arg Arg Leu Asn Val Trp Asp Leu Ser Lys Ile Gly Glu
340 345 350
Glu Gln Ser Pro Glu Asp Ala Glu Asp Gly Pro Pro Glu Leu Leu Phe
355 360 365
Ile His Gly Gly His Thr Ala Lys Ile Ser Asp Phe Ser Trp Asn Pro
370 375 380
Asn Glu Pro Trp Val Ile Cys Ser Val Ser Glu Asp Asn Ile Met Gln
385 390 395 400
Val Trp Gln Met Ala Glu Asn Ile Tyr Asn Asp Glu Asp Pro Glu Gly
405 410 415
Ser Val Asp Pro Glu Gly Gln Gly Ser
420 425
- 还没有人留言评论。精彩留言会获得点赞!