检测甲氰菊酯的试纸及其应用的制作方法
本发明属于快速检测
技术领域:
,具体涉及一种检测甲氰菊酯的试纸,其特别适用于茶叶样品中甲氰菊酯的检测。
背景技术:
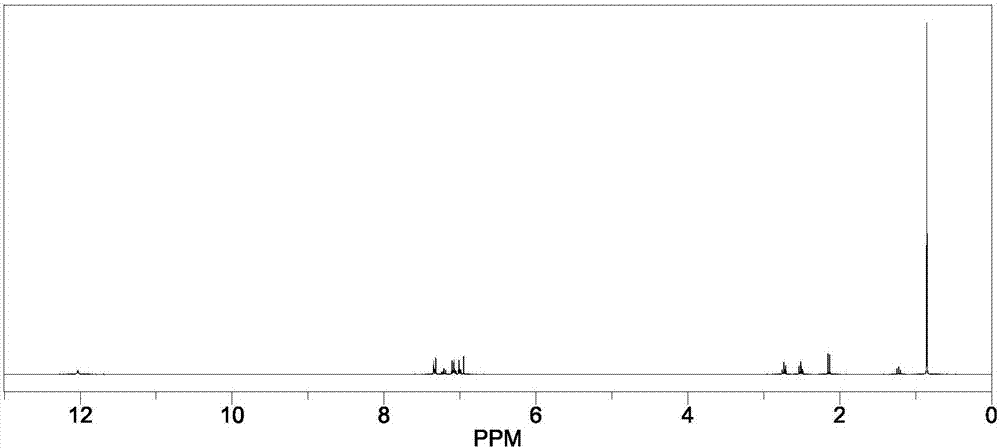
:甲氰菊酯(fenpropathrin),α-氰基-苯氧基苄基-2,2,3,3-四甲基环丙烷羧基酸酯,又名灭扫利,是一种拟除菊酯类杀虫杀螨剂。甲氰菊酯属于神经毒剂,能作用于昆虫的神经系统,使昆虫过度兴奋、麻痹而死。近年来,拟除虫菊酯类农药因具有除虫高效优点而得到普遍使用,其中的甲氰菊酯在食品中时有检出,甲氰菊酯对高等动物具有中等毒性。目前甲氰菊酯残留的检测主要为液相色谱、气相色谱和气相色谱-质谱法等,仪器方法具有检测灵敏度高、特异性强等优势,但是检测样本前处理繁琐、耗时长,并且仪器检测需要昂贵的大型仪器和设备,配备专业的检测技术人员,其推广应用受到一定限制。胶体金免疫层析法具有特异性好、灵敏度高、操作简便、检测成本低、适合于批量样品检测等优点,是理想的快速筛选手段。技术实现要素:本发明的目的在于提供一种检测灵敏度高、操作简便、成本低、检测时间短的检测甲氰菊酯的试纸及其应用。本发明所提供的检测甲氰菊酯的试纸,包括样品吸收垫1、结合物释放垫2、反应膜3、吸水垫4和底板7,所述样品吸收垫1、结合物释放垫2、反应膜3、吸水垫4依次粘贴在底板7上,所述反应膜3上具有包被有甲氰菊酯半抗原-载体蛋白偶联物的检测线5和包被有羊抗鼠抗抗体的质控线6,所述结合物释放垫2包被有甲氰菊酯单克隆抗体-胶体金标记物。所述结合物释放垫2叠放于样品吸收垫1下,并且结合物释放垫2的1/3被覆盖于样品吸收垫1下。所述甲氰菊酯半抗原-载体蛋白偶联物由甲氰菊酯半抗原与载体蛋白偶联得到,所述载体蛋白为牛血清白蛋白、卵清蛋白、血蓝蛋白或甲状腺蛋白。所述甲氰菊酯半抗原是由甲氰菊酯与间羟基苯甲醛、氰化钾、甲氰菊酰氯、对羟基苯丙酸反应合成得到,所示甲氰菊酯半抗原结构式如式(ⅰ)所示,所述甲氰菊酯单克隆抗体是以甲氰菊酯半抗原-载体蛋白偶联物作为免疫原制备获得;所述羊抗鼠抗抗体是由鼠源抗体免疫羊得到的。本发明的另一个目的是提供一种上述试纸的制备方法,其主要包括以下步骤:a)制备包被有甲氰菊酯单克隆抗体-胶体金标记物的结合物释放垫2;b)制备具有包被有甲氰菊酯半抗原-载体蛋白偶联物的检测线5和包被有羊抗鼠抗抗体的质控线6的反应膜3;c)将a)和b)制备好的结合物释放垫2、反应膜3与样品吸收垫1、吸水垫4和底板7组装成试纸。本发明检测甲氰菊酯的试纸采用高度特异性的抗体抗原反应及免疫层析分析技术,将甲氰菊酯单克隆抗体-胶体金标记物固定于结合物释放垫上,样品中的甲氰菊酯在流动过程中,先与结合物释放垫上的甲氰菊酯单克隆抗体-胶体金标记物,形成药物-抗体-胶体金标记物。样品中的药物与反应膜检测线上的甲氰菊酯半抗原-载体蛋白偶联物竞争结合甲氰菊酯单克隆抗体-胶体金标记物,根据检测线红色条带有无或颜色深浅来判断待测样品液中甲氰菊酯残留量,对茶青样品检测限为1mg/kg,对干茶样品检测限为2mg/kg。检测时,样品经处理后滴入试纸卡孔内,当甲氰菊酯在样品中的浓度低于检测限或为零时,甲氰菊酯单克隆抗体-胶体金标记物在层析过程中会与固定在反应膜上的甲氰菊酯半抗原-载体蛋白偶联物结合,在检测线(t线)和质控线(c线)内各出现一条红色条带;如果甲氰菊酯在样品中的浓度等于或高于检测限,甲氰菊酯单克隆抗体-胶体金标记物会与甲氰菊酯全部结合,从而在t线处因为竞争反应不会与甲氰菊酯半抗原-载体蛋白偶联物结合而不出现红色条带。本发明的试纸具有灵敏度高、特异性强、成本低、操作简单、检测时间短、储存简单、保质期长、适用范围广、易于推广应用等优点。附图说明图1为本发明甲氰菊酯半抗原合成路线图;图2甲氰菊酯半抗原鉴定图(氢谱图);图3甲氰菊酯半抗原鉴定图(碳谱图);图4为本发明试纸剖面结构示意图;图5为本发明试纸检测结果判定图。具体实施方式下面结合具体的实施例来进一步阐述本发明。应理解,这些实施例仅用于说明本发明,而不用来限制本发明的范围。本发明试剂如无特别说明,均为常规试剂。实施例1检测甲氰菊酯的试纸的制备该试纸的制备方法主要包括以下几个步骤:a)制备包被有甲氰菊酯单克隆抗体-胶体金标记物的结合物释放垫2;b)制备具有包被有甲氰菊酯半抗原-载体蛋白偶联物的检测线5和包被有羊抗鼠抗抗体的质控线6的反应膜3;c)将a)和b)制备好的结合物释放垫2、反应膜3与样品吸收垫1、吸水垫4和底板7组装成试纸。下面分步详细叙述:1、甲氰菊酯半抗原的制备,合成路线见图11)合成间苯氧基苯氰醇将1.22g间羟基苯甲醛溶于50ml四氢呋喃中,冰浴搅拌下缓慢加入0.65g氰化钾和0.76ml去离子水,继续搅拌30min后,缓慢滴加2.1ml2mol/l浓盐酸,继续搅拌1h,tlc法检测反应过程,反应结束后,往反应液中加50ml去离子水,用二氯甲烷提取,有机相经无水硫酸钠干燥,减压蒸馏去除溶剂,得黄色油状液体产物;2)间羟基苯甲氰醇接甲氰菊酰氯将上一步所得产物溶于50ml丙酮中,冰浴搅拌冷却,另取3.54g甲氰菊酰氯溶于50ml二氯甲烷,加入到上述产物的丙酮溶液中,再加入2.14ml嘧啶,混合物继续冰浴反应3h,反应完全后,依次用3mol/l盐酸和去离子水洗涤反应液,用无水硫酸钠干燥,减压蒸馏,得黄色油状液体;3)合成甲氰菊酯半抗原将上一步产物溶于100ml98%浓硫酸,再加入1.66g对羟基苯丙酸,100℃加热回流反应6h,tlc检测,反应完全后,将反应液倒入冰中,用固体碳酸氢钠调节ph至5.0,用乙酸乙酯提取,无水硫酸钠干燥,产品用硅胶柱层析提纯,收集目标组分,经核磁共振氢谱确证,图2中12ppm左侧附近的峰为半抗原连接臂末端羧基上的氢,7ppm附近的一簇峰为甲氰菊酯苯环上的氢和氰基α位碳上的氢,图3所示碳谱图中,110-140ppm之间的峰为甲氰菊酯上两个苯环和氰基上的碳,170-180ppm之间左边的峰为连接臂末端羧基上的碳,右边的峰为甲氰菊酯分子中酯结构上的碳,表明半抗原合成成功。2、免疫原制备-甲氰菊酯半抗原与牛血清白蛋白(bsa)偶联得到免疫原称取40mg甲氰菊酯半抗原溶解于3mldmf溶液中,加入80mgedc和80mgnhs(二者溶于3ml去离子水中)进行活化30min,将活化甲氰菊酯加入到180~400mgbsa(溶于7ml去离子水)中进行偶联制备出免疫原,用0.02mol/l磷酸盐缓冲液透析3天,每天早晚更换透析液,以除去未反应的小分子物质,即得到免疫原,分装,于-20℃保存备用。3、包被原的制备-甲氰菊酯半抗原与卵清蛋白(ova)偶联得到包被原称取20mg甲氰菊酯半抗原用1.5mldmf溶解,冷却至10℃时得到反应液ⅰ;取氯甲酸异丁酯15μl加入反应液ⅰ中,10℃条件下搅拌反应30min;取45mg卵清蛋白,用3ml50mmol/lna2co3溶解,10℃反应4h,转移4℃冰箱过夜;用0.01mol/l磷酸盐缓冲液4℃透析3天,以除去未反应的小分子物质,即得到包被原,分装,于-20℃保存备用。4、甲氰菊酯单克隆抗体的制备1)动物免疫将步骤2得到的免疫原注入balb/c小鼠体内,免疫剂量为120μg/只,使其产生抗血清。2)细胞融合和克隆化小鼠血清测定结果较高后,取其脾细胞,按8:1(数量配比)比例与sp2/0骨髓瘤细胞融合,采用间接竞争elisa测定细胞上清液,筛选阳性孔。利用有限稀释法对阳性孔进行克隆化,直到得到分泌甲氰菊酯单克隆抗体的杂交瘤细胞株。3)细胞冻存和复苏:将单克隆杂交瘤细胞株用冻存液制成1×106个/ml的细胞悬液,在液氮中长期保存。复苏时取出冻存管,立即放入37℃水浴中速融,离心去除冻存液后,移入培养瓶内培养。4)单克隆抗体的生产与纯化:将杂交瘤细胞置于细胞培养基中,在37℃条件下进行培养,用辛酸-饱和硫酸铵法将得到的培养液进行纯化,得到单克隆抗体,-20℃保存。所述细胞培养基为向rpmi1640培养基中添加小牛血清和碳酸氢钠,使小牛血清在细胞培养基中的终浓度为20%(质量百分含量),使碳酸氢钠在细胞培养基中的终浓度为0.2%(质量百分含量);所述细胞培养基的ph为7.4。5、羊抗鼠抗抗体的制备以羊作为免疫动物,以鼠源抗体为免疫原对无病原体羊进行免疫,得到羊抗鼠抗抗体。6、甲氰菊酯单克隆抗体-胶体金标记物的制备1)胶体金的制备用双蒸去离子水将1%氯金酸稀释成0.01%(质量百分含量),取100ml置于锥形瓶中,用恒温电磁搅拌器加热至沸腾,在持续高温、持续搅拌下加入2.5ml1%柠檬酸三钠,继续匀速搅拌加热至溶液呈透亮的红色时停止,冷却至室温后用去离子水恢复到原体积,4℃保存。制备好的胶体金外观纯净、透亮、无沉淀和漂浮物。2)甲氰菊酯单克隆抗体-胶体金标记物的制备在磁力搅拌下,用0.2mol/ltris-hcl溶液调胶体金的ph值至7.2,按每毫升胶体金溶液中加入40~80μg抗体的标准向胶体金溶液中加入甲氰菊酯单克隆抗体,继续搅拌混匀30min,再加入10%bsa混匀,使其在胶体金溶液中的终浓度为1%(体积百分含量),静置10min,12000r/min、4℃离心40min,弃上清液,沉淀用复溶缓冲液洗涤两次,用体积为初始胶体金体积1/10的复溶缓冲液将沉淀重悬,置4℃备用。复溶缓冲液:含牛血清白蛋白0.1%~0.3%(体积百分含量)、吐温-800.05%~0.2%(质量百分含量)、ph7.2的0.01mol/ltris-hcl缓冲液。7、结合物释放垫的制备将结合物释放垫浸泡于含有牛血清白蛋白(牛血清白蛋白在缓冲液中的浓度为0.5%)和ph7.2,0.5mol/l磷酸盐缓冲液中,均匀浸湿1h,37℃烘3h备用。用百道公司生产zx1000型喷膜仪,将制备好的甲氰菊酯单克隆抗体-胶体金标记物均匀包被在结合物释放垫上,每1cm结合物释放垫包被0.01ml甲氰菊酯单克隆抗体-胶体金标记物后,置于37℃环境中(湿度<20%)60min后取出,密封置于干燥环境(湿度<20%)中保存备用。结合物释放垫材质为硝酸纤维素膜。8、反应膜的制备将甲氰菊酯半抗原-卵清蛋白偶联物包被到反应膜上构成检测线5,将羊抗鼠抗抗体包被在反应膜上构成质控线6。反应膜为硝酸纤维素膜。包被过程:用0.1mol/lph7.4磷酸缓冲液将甲氰菊酯半抗原-卵清蛋白偶联物稀释到10mg/ml,用百道公司生产zx1000型点膜仪,将其包被于硝酸纤维素膜上的检测线(t线),包被量为1.0μg/cm2;用0.01mol/l、ph7.4的磷酸盐缓冲液将羊抗鼠抗抗体稀释到200μg/ml,用点膜仪将其包被于硝酸纤维素膜上的质控线(c线),包被量为1.0μg/cm2。将包被好的反应膜置于37℃条件下干燥2h,备用。9、样品吸收垫的制备将样品吸收垫置于含0.5%牛血清白蛋白(体积百分含量)、ph7.20.1mol/l磷酸盐缓冲液中浸泡2h,37℃烘2h备用。样品吸收垫的材质可为玻纤、无纺布、滤血膜,优选无纺布。10、试纸的组装,见图4将样品吸收垫1、结合物释放垫2、反应膜3、吸水垫4依次按顺序粘贴在底板7上;结合物释放垫2从起始端有1/3区域被样品吸收垫1覆盖,结合物释放垫2的末端与反应膜3的始端连接,反应膜3的末端与吸水垫4的始端相连,样品吸收垫1的始端与底板7的始端对齐,吸水垫4的末端与底板7的末端对齐;所述反应膜3上有检测线5和质控线6,检测线5和质控线6均为与所述试纸的长相垂直的条状带;检测线5位于靠近结合物释放垫2的末端的一侧;质控线6位于远离结合物释放垫2的末端的一侧;将试纸用机器切成3mm宽的小条,装在特制的塑料制卡中,形成带有加样孔和观察窗的试纸卡,4~30℃条件下可保存12个月。实施例2茶叶样品中甲氰菊酯残留的检测1.茶叶样品的前处理1)检测前样品应恢复至室温20~25℃;2)称取2.0±0.05g样本至聚苯乙烯离心管中;3)加入10ml样本提取液,用涡旋仪混匀;;4)茶青和干茶的稀释方法如下:茶青:100μl样品液+400μl样品稀释液;干茶:100μl样品液+900μl样品稀释液;样品稀释液为0.2mol/l磷酸盐缓冲液。2、用实施例1的试纸进行检测用吸管吸取待检茶叶样品溶液垂直滴加2~3滴于加样孔,液体流动时开始计时,反应5min,判定结果,其他时间判定无效。3、分析检测结果,见图5阴性(-):t线和c线都显色,表示茶叶样品中甲氰菊酯药物浓度低于检测限,如图5a。阳性(+):t线无显色,c线显色,表示样品中甲氰菊酯药物浓度等于或高于检测限,如图5b。无效:未出现c线,表明不正确的操作过程或试纸已变质失效,如图5c。在此情况下,应用新的试纸卡重新测试。4、检测限试验取空白干茶样品,在其中分别添加甲氰菊酯至终浓度为1、2、4mg/kg,取试纸进行检测,每个样品重复测定三次。用试纸检测茶叶样品时,当其中甲氰菊酯添加浓度为1mg/kg时,试纸上显示出肉眼可见的两条红色线条,呈阴性;当其中甲氰菊酯添加浓度为2、4mg/kg时,试纸质控线显示,但检测线不显示,呈阳性;表明本试纸干茶样品中甲氰菊酯的检测线为2mg/kg。取空白茶青样品,在其中分别添加甲氰菊酯至终浓度为0.5、1、2mg/kg,取试纸进行检测,每个样品重复测定三次。用试纸检测茶青样品时,当其中甲氰菊酯添加浓度为0.5mg/kg时,试纸上显示出肉眼可见的两条红色线条,呈阴性;当其中甲氰菊酯添加浓度为1、2mg/kg时,试纸质控线显示,但检测线不显示,呈阳性;表明本试纸茶青样品中甲氰菊酯的检测线为1mg/kg。5、假阳性率、假阴性率试验取已知甲氰菊酯含量大于1mg/kg的茶青阳性样品、含量大于2mg/kg的干茶阳性样品各20份和含量小于1mg/kg茶青阴性样品、含量小于2mg/kg干茶阴性样品各20份,用三批试纸进行检测,计算其假阳性率和假阴性率。检测结果见表1~4。表1检测阳性样品结果批次阳性茶青样品(20份)120份阳性220份阳性320份阳性表2检测阳性样品结果批次阳性干茶样品(20份)120份阳性220份阳性320份阳性表3检测阴性样品结果批次阴性茶青样品(20份)120份阴性220份阴性320份阴性表4检测阴性样品结果批次阴性干茶样品(20份)120份阴性220份阴性320份阴性用3个批次生产的试纸检测阳性样品时,结果全为阳性,可知阳性样品符合率为100%,检测20份阴性茶青样品时,全为阴性,检测20份阴性干茶样品时,只有一批次检出一份阳性。说明本发明试纸可以对茶青、干茶中甲氰菊酯进行快速检测。6、特异性试验特异性常用交叉反应率表示,是指抗体与结构不同的抗原决定簇发生结合的能力。将常检的多菌灵、三唑醇、甲菌灵药物500μg/l的样品,用本发明试纸进行检测。结果显示,用本发明试纸检测500μg/l的多菌灵、三唑醇、甲菌灵药物时,试纸质控线和检测线均显色,呈现阴性,说明本试纸对这些药物无交叉反应。当前第1页12
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1