一种基于聚集诱导荧光增强特性用于选择性识别ATP的荧光探针、合成方法及其应用与流程
本发明属于生物化学材料领域,涉及一种基于聚集诱导荧光增强特性用于选择性识别ATP的荧光探针、合成方法及应用。
背景技术:
ATP是一种腺苷三磷酸,在细胞内以辅酶的形式存在,是细胞内能量转移过程的最小分子单位。ATP在细胞内具有重要的生理功能,如在细胞信号传导、保持细胞结构、DNA或RNA的生物合成过程中都起着重要作用。通常,健康成人体内平均含有250g的ATP,ATP含量异常通常与心血管病、局部缺血、组织缺氧、低血糖及帕金森、老年痴呆症等疾病密切相关。ATP的重要生理作用激发了科学家们对其检测方法的研究,比如目前常用的检测ATP的方法有:生物发光法、色谱法、荧光法、电化学方法等。在这些检测方法中,荧光探针由于具有操作简单、灵敏度高、检测限低、可应用于细胞内或活体成像等优点得到了广泛的发展。然而,传统的ATP荧光探针所采用的荧光分子在高浓度时极易发生荧光猝灭,即聚集诱导荧光猝灭现象(Aggregation Caused Quenching,ACQ)。这种现象迫使研究人员在检测过程中只能使用稀溶液,导致检测信噪比低,限制了传统ATP荧光探针的实际应用。
2001年,唐本忠等人发现了一种在溶液状态下呈现无荧光或弱荧光,但是在聚集态呈现强荧光的特殊荧光分子,并将这种特殊的发光现象称为聚集诱导荧光(Aggregation Induced Emission,AIE)。具有AIE效应的荧光分子由于具有高荧光量子产率、强抗漂白性、无需低浓度下检测等优点,为Turn-on型的荧光探针的设计提出了新的思路,其中四苯乙烯类分子(Tetraphenylethylene,TPE)更是设计AIE类荧光探针的热门分子。本发明利用TPE分子的AIE特性,通过调节TPE分子的聚集/解聚过程,设计一种基于TPE分子的ATP荧光探针,具有选择性强、灵敏度高、抗漂白能力强等特点,能够有效避免ADP、AMP及PPi的干扰,可在水溶液中监测一种ATP水解酶的反应进程,并在活细胞中检测ATP,并且我们通过改变荧光探针的浓度可实现对ATP检测范围的调控。
技术实现要素:
本发明的内容是一种基于聚集诱导荧光增强特性用于选择性识别ATP的荧光探针、合成方法及其应用。
实现本发明目的的技术解决方案是,一种选择性识别ATP的荧光探针1,具有如下结构:
该探针具有聚集诱导荧光增强特性,即在溶液状态下具有弱荧光,聚集状态下具有强荧光。
一种选择性识别ATP的荧光探针1的合成方法,合成路线如下:
第一步:4,4-二溴二苯甲酮和锌粉加入到四氢呋喃中,搅拌下冷却到-20℃半小时,然后缓慢滴加四氯化钛,在-20℃继续搅拌半小时后,缓慢升至室温,然后加热回流过夜,冷却,过滤,浓缩后用柱层析分离纯化,得到具有聚集诱导荧光增强特性的化合物2;
第二步:将化合物2、4-吡啶硼酸、Pd(dppf)Cl2、CH2Cl2、Bu4NI和碳酸钾水溶液加入甲苯中,将混合液在氮气保护条件下回流16h,冷却,加入二氯甲烷和饱和食盐水分液、萃取,干燥、浓缩、柱层析分离后得到化合物3;
第三步:将化合物3和溴苄溶于甲苯中,80℃下反应过夜,反应液冷却后进行重结晶得到荧光探针1,荧光探针1的结构经1HNMR、13C NMR和高分辨质谱鉴定。
一种选择性识别ATP的荧光探针1的应用研究:
在荧光探针1中含有四个吡啶盐结构,赋予了该化合物一定的水溶性,因此,该探针可以用于水样检测,简单实用。在本发明中,用于检测ATP的溶剂为羟乙基哌嗪乙硫磺酸(HEPES)缓冲溶液(5mM,pH 7.4,含1%的DMSO),向溶液中加入不同浓度的ATP,测定荧光探针1的荧光强度随ATP浓度的变化情况。在1.0μM至4.0μMATP浓度范围内荧光探针1的荧光强度呈现良好的线性关系。当改变荧光探针1浓度为20.0μM时,向溶液中加入不同浓度的ATP,测定荧光探针1的荧光强度随ATP浓度的变化情况。在2.0μM至20.0μM ATP浓度范围内荧光探针1的荧光强度呈现良好的线性关系。同样的,将荧光探针1浓度继续增大为40.0μM时,向溶液中加入不同浓度的ATP,测定荧光探针1的荧光强度随ATP浓度的变化情况。在20.0μM至40.0μMATP浓度范围内荧光探针1的荧光强度呈现良好的线性关系。由此可实现对ATP浓度的检测范围调控,实现在较大浓度范围内准确定量ATP。
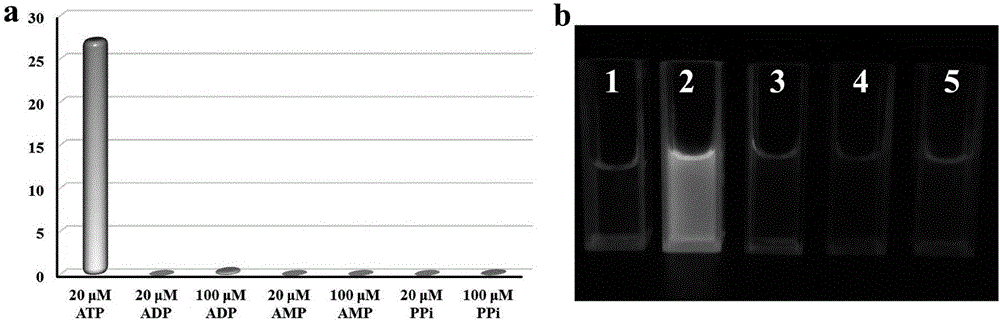
向荧光探针1的溶液中加入ATP后,带有四个正电荷的荧光探针1可以通过静电相互作用和疏水作用沿着带有四个负电荷的ATP分子链发生排列,形成聚集态,从而荧光强度大大增强。为了了解荧光探针1对ATP的选择性,本发明对ADP、AMP及焦磷酸(PPi)与荧光探针1反应前后的荧光强度也进行了测定,结果表明,除ATP外其他化合物与荧光探针1反应前后的荧光强度均没有明显增强。
溶液中一种ATP水解酶Apyrase反应过程的监测:向含有20μM荧光探针1和20μM ATP的HEPES缓冲溶液中分别加入不同浓度的ATP水解酶Apyrase(0,5,10,15,25,50mU),监测体系在500nm处荧光强度随反应时间的变化情况。ATP水解酶Apyrase可将ATP、AMP水解为ADP和无机磷(Pi)。未加入Apyrase时,体系的荧光在50min的实验时间内变化不大,当加入Apyrase后,荧光强度迅速下降,如加入50mU Apyrase后,体系荧光可在10min内被完全猝灭。当在体系中加入酶的抑制剂Na3VO4后,重复上述实验。我们发现,抑制剂的加入显著抑制了Apyrase的活性,降低了ATP的水解速率,使得体系荧光基本保持不变,这些结果都说明,荧光探针1的加入不会影响ATP水解酶Apyrase的活性,因此荧光探针1可在水溶液中监测Apyrase水解ATP的反应进程。
HeLa细胞ATP荧光成像:荧光探针1用二甲基亚砜(DMSO)溶解准确配制成1mM的母液,然后再用RPMI 1640培养基稀释成10μM的稀释液。移取200μL的稀释液加入到细胞培养皿中,于37℃、5%CO2、100%饱和湿度的培养箱中孵育12h,用RPMI 1640培养基冲洗细胞培养皿洗去多余染料分子。在405nm激发下用共聚焦荧光显微镜观察细胞的荧光成像情况,采集450-550nm的荧光信号进行荧光成像。结果表明,HeLa细胞内呈现绿色荧光。同样条件下,先将HeLa细胞与5U/mL的Apyrase于37℃、5%CO2、100%饱和湿度的培养箱中孵育6h,用新鲜培养基清洗细胞3遍,然后再用200μL 10μM的荧光探针1的培养基稀释液于37℃、5%CO2、100%饱和湿度的培养箱中孵育12h,用新鲜培养基清洗细胞3遍洗去多余染料分子。在405nm激发下用共聚焦荧光显微镜观察细胞的荧光成像情况,采集450-550nm的荧光信号进行荧光成像。结果表明,HeLa细胞内的绿色荧光较无Apyrase处理的细胞更弱,说明荧光探针1可对HeLa细胞内的ATP荧光成像。
发明人通过简单的设计与合成,将荧光探针1成功用于ATP检测。与现有技术相比,本发明合成步骤简单,较易大规模生产和应用,克服了传统染料分子易漂白、仅能在稀溶液中检测的缺点,能够有效避免ADP、AMP及PPi的干扰,可在水溶液中监测一种ATP水解酶的反应进程,并在活细胞中检测ATP,并且我们通过改变荧光探针1的浓度可实现对ATP检测范围的调控。
附图说明
图1(a)在40μM荧光探针1的HEPES缓冲溶液中加入不同浓度的ATP,荧光发射光谱的变化;(b)5μM荧光探针1在500nm处荧光强度变化比值(I0-I)/I0与ATP浓度的关系及线性拟合曲线图;(c)20μM荧光探针1在500nm处荧光强度变化比值(I0-I)/I0与ATP浓度的关系及线性拟合曲线图;(d)40μM荧光探针1在500nm处荧光强度变化比值(I0-I)/I0与ATP浓度的关系及线性拟合曲线图。
图2(a)在20μM荧光探针1的HEPES缓冲溶液中分别加入20μM或100μM的ATP、ADP、AMP或PPi,在500nm处荧光强度变化比值(I0-I)/I0柱状图。(b)在365nm紫外灯照射下,荧光探针1对100μM的ATP、ADP、AMP或PPi的响应发光情况照片。1:荧光探针1;2:荧光探针1+ATP;3:荧光探针1+ADP;4:荧光探针1+AMP;5:荧光探针1+PPi。
图3(a)在含有20μM荧光探针1和20μMATP的HEPES缓冲溶液中分别加入不同浓度的ATP水解酶Apyrase(0,5,10,15,25,50mU),在500nm处荧光强度随时间变化图;(b)含有20μM荧光探针1、20μMATP和50mUApyrase的HEPES缓冲溶液,在Na3VO4抑制剂存在或不存在条件下,500nm处荧光强度随时间变化图。
图4荧光探针1对HeLa细胞中ATP的荧光成像照片。(a)荧光探针1与HeLa细胞在37℃下孵化12h后的明场照片;(b)荧光探针1与HeLa细胞在37℃下孵化12h后的荧光照片;(c)为(a)与(b)的叠加图;(d)5U/mLApyrase与HeLa细胞在37℃下孵化6h,再与荧光探针1孵化12h后的明场照片;(e)5U/mLApyrase与HeLa细胞在37℃下孵化6h,再与荧光探针1孵化12h后的荧光照片;(f)为(d)与(e)的叠加图,荧光探针1浓度为10μM。
具体实施方式
本实施例中所用的原料均为已知化合物,可以由商业途径获得。
实施例1
荧光探针1的合成
(1)化合物2的合成:将锌粉(1.56g,24mmol)、4,4’-二溴二苯甲酮(408mg,1.2mmol)加入无水四氢呋喃中,将悬浮液在搅拌下冷却到0℃。然后用注射器缓慢滴入四氯化钛(2.276g,12mmol),0℃下继续搅拌30min后,混合液回流4h。冷却,搅拌下滴入碳酸钠溶液直至无气泡产生为止。加入二氯甲烷和饱和食盐水分液、萃取,有机相用饱和食盐水洗涤三次,有机相用无水硫酸钠干燥、浓缩、柱层析分离后得到化合物2,产率为86%。
(2)化合物3的合成:将化合物2(200mg,0.31mmol)、4-吡啶硼酸(305mg,2.48mmol)、Pd(dppf)Cl2(200mg,0.245mmol)、CH2Cl2(1mL)、Bu4NI(25mg,0.068mmol)和碳酸钾水溶液(2M,10mL)加入甲苯(20mL)中,将混合液在氮气保护条件下回流16h。冷却,加入二氯甲烷和饱和食盐水分液、萃取,有机相用饱和食盐水洗涤三次,有机相用无水硫酸钠干燥、浓缩、柱层析分离后得到化合物3,产率61%。1H NMR(400MHz,CDCl3)δ8.63(d,J=5.7Hz,8H),7.52–7.44(m,16H),7.23(d,J=8.3Hz,8H).HR-MS:440.20082,[M+H]+。
(3)荧光探针1的合成:将化合物3和溴苄溶于甲苯中,80℃下反应过夜。反应液冷却后过滤,再用氯仿洗涤得到化合物1,产率89%。1H NMR(400MHz,MeOD)δ9.00(d,J=6.8Hz,8H),8.37(d,J=6.9Hz,8H),7.89(d,J=8.4Hz,8H),7.57–7.44(m,20H),7.40(d,J=8.4Hz,8H),5.82(s,8H).13C NMR(101MHz,MeOD)δ155.83,146.37,144.40,141.81,133.31,132.75,132.39,129.58,129.31,128.70,127.86,124.73,63.47.HRMS:m/z=251.12007(M4+),304.47531([M-CH2Ph]3+)。
实施例2
ATP探针性能测试
(1)荧光探针1对ATP的荧光滴定测试:取5μL荧光探针1的DMSO溶液(1mM)于2mL HEPES缓冲溶液中,然后加入不同量的ATP水溶液(1mM)。测定加入不同浓度ATP后溶液的荧光发射光谱(Ex=344nm),在1.0μM至4.0μMATP浓度范围内混合液的荧光强度呈现良好的线性关系(如图1b所示)。当改变荧光探针1浓度为20.0μM时,体系可在2.0μM至20.0μMATP浓度范围内与荧光探针1的荧光强度呈现良好的线性关系(如图1c所示)。同样的,将荧光探针1浓度继续增大为40.0μM时,体系可在20.0μM至40.0μMATP浓度范围内与荧光探针1的荧光强度呈现良好的线性关系(如图1d所示)。由此可实现对ATP浓度的检测范围的调控,从而实现在较大的浓度范围内定量ATP。
(2)荧光探针1对ATP的选择性测试:取20μL荧光探针1的DMSO溶液(1mM)于2mL HEPES缓冲溶液中,然后加入20μL或100μL的ATP、ADP、AMP或PPi水溶液(1mM),然后测定溶液的荧光发射光谱(Ex=344nm)。结果表明,除ATP外的其他磷酸化合物与荧光探针1反应前后的荧光强度均没有明显增强(如图2所示),说明该荧光探针1可以选择性识别ATP。
实施例3
溶液中一种ATP水解酶Apyrase反应过程的监测:向含有20μM荧光探针1和20μM ATP的HEPES缓冲溶液中分别加入不同浓度的ATP水解酶Apyrase(0,5,10,15,25,50mU),监测体系在500nm处荧光强度随反应时间的变化情况,结果表明,当不存在Apyrase时,荧光探针1的荧光强度在50min的时间内变化较小(<15%),当存在Apyrase时,体系在500nm处荧光强度随反应时间延长逐渐下降,并且下降的速率随着酶浓度的增大逐渐加快。当在体系中加入酶的抑制剂Na3VO4后,重复上述实验发现,由于酶的活性被Na3VO4抑制,体系的荧光强度随反应时间的下降速率明显变慢(如图3b所示)。说明荧光探针1可用于在溶液中监测ATP水解酶Apyrase的反应过程。
实施例4
HeLa细胞激光共聚焦荧光显微成像:HeLa细胞经过复苏接种于含10%胎牛血清的RPMI1640培养基中,然后在37℃、5%CO2、100%饱和湿度的培养箱中培养。然后在18mm盖玻片上培养24h,待用。
将HeLa细胞浸入含10μM荧光探针1的培养基中,在37℃、5%CO2、100%饱和湿度的培养箱中培养12h后,倒出培养基,用新鲜培养基清洗细胞3遍。在405nm激发下用共聚焦荧光显微镜观察细胞的荧光成像情况,采集450-550nm的荧光信号进行荧光成像。结果表明,HeLa细胞内呈现绿色荧光(如图4b所示)。同样条件下,先将HeLa细胞与5U/mL的Apyrase于37℃、5%CO2、100%饱和湿度的培养箱中孵育6h,用新鲜培养基清洗细胞3遍,然后再用200μL 10μM的荧光探针1的培养基稀释液于37℃、5%CO2、100%饱和湿度的培养箱中孵育12h,用新鲜培养基清洗细胞3遍洗去多余染料分子。在405nm激发下用共聚焦荧光显微镜观察细胞的荧光成像情况,采集450-550nm的荧光信号进行荧光成像。结果表明,HeLa细胞内的绿色荧光较无Apyrase处理的细胞更弱(如图4e所示),说明荧光探针1可对HeLa细胞内的ATP荧光成像。
- 还没有人留言评论。精彩留言会获得点赞!