用于预测吉西他滨药物敏感性的生物标记物及其用途的制作方法
本发明属于分子生物学及医学领域,具体涉及用于预测吉西他滨药物敏感性的生物标记物及其用途。
背景技术:
吉西他滨是目前临床上常用的抗肿瘤化疗药物。盐酸吉西他滨适用于治疗不能手术的晚期或转移性胰腺癌及治疗局部进展性或转移性非小细胞肺癌,与紫杉醇联合,适用于治疗经辅助/新辅助化疗后复发,不能切除的、局部复发或转移性乳腺癌。即使在目前靶向药物和新型免疫治疗药物不断涌现的情况下,吉西他滨仍然具有广泛的临床应用,特别是在胰腺癌领域,吉西他滨是标准治疗药物。但是在临床治疗过程中,不同病人对吉西他滨的敏感性或有效性差别较大,存在原发性和获得性耐药问题。因此,寻找有效的吉西他滨药物敏感性的标记物来指导用药,不但可以避免由于药物选择不当延误病人治疗,而且还能在治疗过程中监控药物治疗效果,实现用药合理性和个体化治疗的目的。
目前研究认为吉西他滨耐药主要与其摄取转运过程障碍、胞浆内活化、分解酶异常及dna修复有关,研究内容包括hent1(人平衡型核苷转运蛋白1)、rrm1(核糖核苷酸还原酶m1)、rrm2(核糖核苷酸还原酶m2)、dck(脱氧胞苷激酶)等基因或蛋白。
针对这些基因或蛋白的研究也很多,但是不同研究之间的研究结果有差异。例如rolandandersson(worldjgastroenterol.2014;20:8482–8490)等研究者对10个临床研究进行了系统回顾,涉及855名患者,分为高和低的hent1组,研究结果显示高表达hent病人的总生存期显著长于低表达者。但是在一项随机iii期临床研究——conko-001临床试验(eurjcancer.2015;51:1546–1554)中接受辅助吉西他滨化疗的患者的组织样本中采用sp120兔单抗通过免疫组化检测hent1表达,结果证实hent1没有任何预测作用。而且另一项临床研究(nct01124786,jclinoncol.2013;31:4453-4461)中同样显示hent1没有预测吉西他滨敏感性的作用。fujit等人(neoplasia.2010;12:807–817)在70例切除的pdac病人中检测了hent1、dck、rrm1、rrm2的mrna,其中40例病人接受了吉西他滨为基础的辅助化疗。研究结果显示高表达dck和低rrm2病人的无疾病进展生存期更长。maréchal等人(gastroenterology.2012;143:664–674.e1-6)进行的另一项研究显示高表达hent1和dck的病人接受吉西他滨辅助治疗时可以预测有更长的生存期。这些研究结果差异较大的原因包括研究者采用的检测方法不同、病人用药情况复杂、肿瘤异质性、样本数量少等。除此之外有可能是没有找到更为精确的预测指标。
技术实现要素:
针对目前不同病人对吉西他滨的敏感性或有效性差别较大,存在原发性和获得性耐药问题以及吉西他滨敏感性预测指标的不确定性问题,本发明试图寻找到新的更精确的吉西他滨敏感性预测指标。
醛酮还原酶(aldo.ketoreductase,akr)超家族共有15个家族,其中人源akr成员共有15个。大多数akr成员均能以烟酰胺腺嘌呤二核苷磷酸nadp为辅因子催化简单的氧化还原反应。它们作用底物范围广泛,包括糖类、脂肪醛、甾体类激素、前列腺素和致癌物等。因此,akr超家族成员可能是在激素合成、药物代谢、炎症反应、致癌物解毒等生命活动中发挥重要作用的酶类。研究表明,人源akr超家族成员与多种肿瘤发生发展具有相关性,其活性高低与肿瘤的进展及治疗效果密切相关。越来越多的证据表明(国际肿瘤学.2013;40(1):43-46),akr超家族部分成员与肿瘤抗药性相关。akrlb10成为吸烟相关非小细胞肺癌,尤其肺鳞癌的早期诊断标志物,而akr1c1~3在肺癌多种化疗药物耐受过程中的作用特征使其成为预后预测的重要因子,也为提高肺癌药物敏感性提供了有效的作用靶点。但是关于akr家族与吉西他滨耐药性的关系从未有研究或报道。
本发明首次发现了醛酮还原酶(aldo.ketoreductase,akr)家族成员akr1c1、akr1c2、akr1c3家族与吉西他滨耐药性有关。本发明在29个裸鼠肿瘤移植瘤模型中研究了吉西他滨药物敏感性与akr1c1~c3表达的相关性。研究结果表明在11个akr1c1~c3高表达的模型中,9个模型结果显示吉西他滨药效差,表现不敏感性;在18个akr1c1~c3低表达的模型中,17个模型结果显示吉西他滨药效好,表现敏感性。
因此,本发明的目的在于提供用于预测吉西他滨或其药学上可接受的盐治疗癌症时的药物敏感性的生物标记物akr1c1、akr1c2、akr1c3及其用途。
具体的,本发明提供了akr1c1、akr1c2或akr1c3作为预测吉西他滨或其药学上可接受的盐治疗癌症时的药物敏感性的生物标记物的应用。
进一步的,所述的癌症为结肠癌、肺癌、胃癌、胰腺癌、卵巢癌、黑色素瘤、肝癌、乳腺癌、宫颈癌。
本发明的有益效果:利用醛酮还原酶(aldo.ketoreductase,akr)家族成员akr1c1、akr1c2或akr1c3作为预测吉西他滨治疗癌症时的药物敏感性的生物标记物来指导临床用药,不但可以避免药物选择的盲目性,避免由于药物选择不当而延误病人病情,而且还能在治疗过程中监控药物治疗效果,实现用药的合理性和个体化治疗的目的。
附图说明
图1akr1c1~c3在不同细胞中的表达量分析。gapdh或β-tubulin作为内参。条带灰度值越高表示对应蛋白的表达量越高。
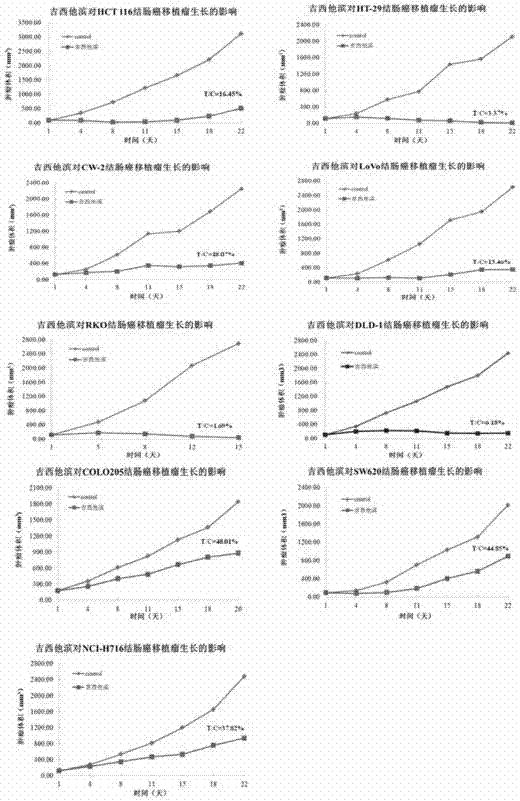
图2吉西他滨在不同结肠癌裸鼠移植瘤模型中的抗肿瘤作用
图3吉西他滨在不同肺癌裸鼠移植瘤模型中的抗肿瘤作用
图4吉西他滨在不同胃癌裸鼠移植瘤模型中的抗肿瘤作用
图5吉西他滨在不同胰腺癌裸鼠移植瘤模型中的抗肿瘤作用
图6吉西他滨在不同卵巢癌裸鼠移植瘤模型中的抗肿瘤作用
图7吉西他滨在mda-mb-435黑色素瘤裸鼠移植瘤模型中的抗肿瘤作用
具体实施方式
以下内容将进一步说明本发明,但不应被理解为限制本发明的主旨和保护范围。
实验一:蛋白质免疫印迹(westernblot,wb)
实验原理:
经过聚丙烯酰胺凝胶电泳(polyacryamidegelelectrophoresis,page)分离的蛋白质样品,转移并结合到固相载体上(如硝酸纤维素膜,二氟化树脂膜等),以固相载体上的蛋白质或多肽作为抗原,其对应的抗体能识别并与之结合,再与酶或同位素标记的第二抗体起反应,经过底物显色或放射自显影以检测目的蛋白的表达量。
实验目的:
检测akr1c1~c3蛋白在不同细胞中的表达。
实验材料:
细胞:人结肠癌细胞cw-2,lovo,hct116,sw620,colo205,ht-29,rko,dld-1,nci-h716,sw1116,sw948;人肺癌细胞nci-h292,a549,nci-h460,nci-h1650,hcc827,nci-h1299,nci-h1975,sk-mes-1,nci-h1437,nci-h1944;人胃癌细胞bgc-823,hgc-27,sgc-7901,katoiii,nci-n87,snu-1;人胰腺癌细胞aspc-1,bxpc-3,panc-1,capan-2,cfpac-1,miapaca-2,hpaf-ii;人乳腺癌细胞bt-474,sk-br-3,mcf-7,t-47d,mda-mb-231,mda-mb-468;人卵巢癌细胞sk-ov-3,nih:ovcar-3,a2780;人肝癌细胞bel-7402,hepg2;人宫颈癌细胞hela;人黑色素瘤细胞mda-mb-435均购买自中国科学院典型培养物保藏委员会细胞库,并按该网站提供的细胞培养条件进行培养。
一抗:akr1c1鼠单克隆抗体(mab6529)购买自r&dsystems,akr1c2兔多克隆抗体(13035)购买自cellsignalingtechnology,akr1c3鼠单克隆抗体(mab7678)购买自r&d,gapdh兔单克隆抗体(2118)购买自cellsignalingtechnology,hrp-β-tubulin鼠单克隆抗体(ab012)购买自联科生物。
二抗:hrp标记的山羊抗兔igg和hrp标记的马抗鼠igg均购买自cellsignalingtechnology。
实验方法:
细胞于25cm2培养瓶中进行培养,待80~90%覆盖率时收集细胞,根据细胞数量加入200-300μlripa裂解液(50mmtris·hcl,150mmnacl,1%np-40,1%sds,1×蛋白酶抑制剂cocktail),涡旋混匀后置于冰上裂解30min。14000rpm,4℃离心10min后取上清,用bsa蛋白定量检测试剂盒进行定量。并加入5×loadingbuffer,煮沸。
每个样品30μg总蛋白经10%sds-page电泳分离后,250ma电转至pvdf膜上,用tbst配制的5%脱脂奶粉室温封闭1h,然后在4℃用一抗孵育过夜,akr1c1抗体用5%脱脂奶粉稀释1000倍,akr1c2抗体稀释500倍,akr1c3抗体稀释2000倍,gapdh或β-tubulin抗体稀释10000倍。用tbst彻底洗涤后经二抗(5%bsa稀释5000倍)室温孵育1h,再次用tbst彻底洗涤后加入ecl化学发光底物显色,曝光。检测β-tubulin的膜经一抗孵育后,不经二抗孵育,洗涤后直接加入ecl化学发光底物进行曝光。实验以gapdh或β-tubulin作为内参。
实验结果:
akr1c1~c3三个蛋白在不同细胞中的表达量具体如图1所示,从图1可知:
人结肠癌细胞中,colo205细胞中akr1c1~c3均高表达;nci-h716细胞中akr1c1和akr1c2为中等到高表达,akr1c3为高表达;hct116、rko、dld-1细胞中三个蛋白均低表达;cw-2、lovo、sw620、ht-29、sw1116和sw948细胞中akr1c1和akr1c2低表达,akr1c3中等或高表达。
人肺癌细胞中,a549、nci-h460、sk-mes-1、nci-h1437、nci-h1944细胞中akr1c1~c3均高表达;nci-h292、nci-h1650、nci-h1299和nci-h1975细胞中akr1c1~c3均低表达;hcc827细胞中,akr1c1和akr1c2低表达,akr1c3低表达。
人胃癌细胞中,sgc-7901细胞中akr1c1~c3高表达;hgc-27和snu-1中akr1c1~c3均低表达;bgc-823细胞中akr1c1中等表达,akr1c2为低到中等,akr1c3高表达;katoiii和nci-n87细胞中,akr1c1和akr1c2蛋白低表达,akr1c3中等表达。
人胰腺癌细胞中,aspc-1和bxpc-3细胞中akr1c1~c3均高表达;panc-1和capan-2中akr1c1~c3均低表达;cfpac-1细胞中,akr1c1和akr1c2低到中等表达,akr1c3高表达;miapaca-2细胞中,akr1c1中到高等表达,akr1c2和akr1c3低表达;hpaf-ii细胞中,akr1c1低表达,akr1c2低到中等表达,akr1c3高表达。
人乳腺癌细胞中,bt-474、mcf-7、t-47d、mda-mb-231和mcf7细胞中akr1c1~c3均低表达;sk-br-3细胞中akr1c1和akr1c2为低表达,akr1c3为中等表达;mda-mb-468细胞中akr1c1和akr1c2高表达,akr1c3中等表达。
人卵巢癌细胞中,nih:ovcar-3和a2780细胞中akr1c1~c3均低表达;sk-ov-3细胞中akr1c1~c3均高表达。
人肝癌细胞中,bel-7402细胞中akr1c1~c3均低表达;hepg2细胞中akr1c1和akr1c2低表达,akr1c3高表达。
人宫颈癌细胞hela中,akr1c1和akr1c2均低表达,akr1c3高表达。
人黑色素瘤细胞mda-mb-435中,akr1c1~c3均低表达。
实验二:裸鼠体内移植瘤药效试验
实验目的:研究吉西他滨对不同肿瘤裸鼠移植瘤的药效。
实验材料:
盐酸吉西他滨购买自美仑生物,matrigel购买自美国corning公司(货号:354262),balb/c裸小鼠购买自上海西普尔-必凯实验动物有限公司。
实验方法:
将结肠癌细胞cw-2、lovo、hct116、sw620、colo205、ht-29、rko、dld-1、nci-h716;人肺癌细胞a549、nci-h460、nci-h1650、nci-h1299、nci-h1975、nci-h1944、nci-h1437;人胃癌细胞bgc-823、hgc-27、sgc-7901、nci-n87、snu-1;人胰腺癌细胞aspc-1、bxpc-3、panc-1、capan-2、cpfac-1;人卵巢癌细胞sk-ov-3、a2780;人黑色素瘤细胞mda-mb-435在体外培养后,收集指数生长期的细胞悬液至适合浓度并与matrigel1:1混合后用于balb/c裸小鼠皮下肿瘤接种,建立各种移植瘤模型,待肿瘤生长至100~200mm3后分为2组,即control组和吉西他滨给药组,每组6只动物。盐酸吉西他滨给药剂量为120mg/kg,腹腔注射给药,每周第1天和第4天给药。每周2次测量肿瘤长径a(mm)、短径b(mm),根据以下公式计算肿瘤体积(tumorvolume,v):v=1/2×a×b2(mm3);根据肿瘤体积结果计算出相对肿瘤体积(relativetumorvolume,rtv),计算公式为:rtv=vt/v0。其中v0为分笼给药时(即d0)测量所得肿瘤体积,vt为每一次测量时的肿瘤体积。抗肿瘤活性的评价指标为相对肿瘤增殖率t/c(%),计算公式如下:t/c%=trtv/crtv*100%;其中trtv:治疗组平均rtv;crtv:溶媒对照组平均rtv。采用excel表统计,t.test检验。
实验结果:
吉西他滨在不同移植瘤模型中其药效表现出差异性。
在相同给药剂量和给药方案下,吉西他滨在不同裸鼠移植瘤模型中的抗肿瘤作用表现差异较大。在9个结肠癌移植瘤模型中(见图2),吉西他滨对hct-116、ht-29、cw-2、lovo、rko、dld-1移植瘤生长具有显著抑制作用,t/c%<20%;但在colo205、sw620移植瘤模型中,吉西他滨的抑制作用较差,t/c%>40%;在nci-h716模型中,吉西他滨的抑制作用介于中间,t/c%约为38%。
同样地,在肺癌移植瘤模型中(见图3),吉西他滨对nci-h1650、nci-h1975和nci-h1299裸鼠移植瘤具有显著抑制作用,t/c<20%;而对a549、nci-h460、nci-h1437和nci-h1944移植瘤抑制效果差(见图3),t/c>40%。
在胃癌模型中(见图4),吉西他滨对nci-n87、hgc-27和snu-1移植瘤生长具有显著抑制作用,t/c<20%;但是对bgc-823和sgc-7901移植瘤抑制作用差,t/c>50%。
在胰腺癌模型中(见图5),吉西他滨对capan-2、panc-1、cfpac-1移植瘤具有显著抑制作用,t/c<20%;对bxpc-3和aspc-1移植瘤抑制作用差,t/c>40%。
在卵巢癌模型中也观察到类似的现象(见图6),吉西他滨对a2780和sk-ov-3移植瘤抑制作用差异较大,对a2780抑制作用明显,而对sk-ov-3模型作用较差。
吉西他滨在mda-mb-435黑色素瘤模型中也表现出较强的抗肿瘤活性(见图7),t/c<20%。
实验一和实验二的研究结果表明:在吉西他滨敏感性与akr1c1~c3表达之间存在强相关性,具体而言,在akr1c1~c3高表达的模型中,吉西他滨药效差,表现不敏感性;akr1c1~c3低表达的模型中,吉西他滨药效好,表现敏感性。因此,akr1c1~c3可以作为生物标记物用于预测吉西他滨或其药学上可接受的盐治疗癌症时的药物敏感性。
- 还没有人留言评论。精彩留言会获得点赞!