校正质谱检测核酸样品的准确率的方法及产品与流程
本发明涉及一种通过改善生物样本结晶及校正方式来提高maldi-tof质谱检测正确率的方法,能质谱检测核酸分子,属于质谱检测技术领域。
背景技术:
基质辅助激光解析电离飞行时间质谱(maldi-tofms)技术已成为目前蛋白质组学研究中的经典技术。在该技术的成功应用过程中,合适的样品前处理方法起着首要和关键的作用。只有将合适的样品前处理方法与合适的有机基质结合起来,才能成功实现对核酸和蛋白质等生物大分子的准确鉴定。对于基质、溶剂、盐(金属离子)和样品制备方法的选择是maldi分析高聚物成败的关键因素。最优化的条件是使样品分子和基质均匀地形成共结晶。maldi方法分析大分子,重要的关键之一是选择合适的基质。结果表明,效果较佳的基质只有几种。水溶性合成高分子如聚乙二醇(peg)、聚丙二醇经常出现于早期的maldi研究中,这是因为分析多肽的基质也可以应用于它们,对于另外一些高分子,可以从高分子和基质的溶解性中找到一些选择基质的思路。一般来说,选择基质时应使基质与高分子的极性比较一致,彼此之间具有兼容性。
微阵列芯片以高密度阵列为特征。微阵列技术就是利用分子杂交原理,使同时被比较的标本与微阵列杂交,通过检测杂交信号强度及数据处理,把他们转化成不同标本中特异基因的丰度,从而全面比较不同标本的基因表达水平的差异。微阵列芯片因其高度均一性,结构稳定性,样品用量少及高通量而成为芯片领域中发展最迅速的一部分。微阵列不仅仅在生物遗传领域有着广泛的用途,在其他定量和相对定量分析方面也有着潜在的用途。
微阵列芯片因其微孔尺寸相同,微孔与周围亲疏水性质的差别,较好的限制了样品所处的范围,使得所分析的区域保持一致,使定量分析成为可能。质谱成图因为其无需标记,无需分离,通过对图像的分析来进行混合物中组成物质的定量分析,使多组分的同时检测成为可能,因此利用微阵列芯片中质谱成图进行多组分的同时定量分析,是一种具有广泛应用前景的定量分析技术。微阵列芯片中质谱成图在定量分析中的应用很大程度上取决于样本结晶的均一性,由于质谱数据采集中的质量歧视,质谱图的峰高或峰面积无法作为样品的定量分析的依据,因此如何获得可靠的,稳定的定量数据就显得尤为重要。
在应用maldi-tofms时,通常将生物样本与一种饱和的低分子量无机化合物溶液(称为基质)进行混合加在靶板上,待干后样本与基质共结晶后形成了以基质包裹构架的样本固体沉淀。样本基质结晶体经激光辐射,基质从激光中吸收能量,能量蓄积并迅速产热,从而使基质晶体升华,使样品吸附,基质与样品之间发生电荷转移使得样品分子电离,离子在加速电场下获得相同的动能,经高压加速、聚焦后进入飞行时间检测器。根据离子飞行时间的不同进行分析得出离子质荷比(m/z)和离子峰值,形成质量图谱,检测准确性高。通过软件分析比较,筛选并确定出特异性指纹图谱,从而实现对目标微生物种或菌株的区分和鉴定。maldi-tofms可用于分析多种类型的样本,包括有机分子溶液、核酸、蛋白质以及整个微生物,其中基因、蛋白质和微生物是目前在临床质谱检测实验室应用最广的项目。
基质辅助激光解吸电离质谱(maldi-tofms)离子源可电离相对分子质量为100~1000000的生物分子,通过高压电与短激光脉冲作用,让基质晶体升化,使基质与样本分子气化进入质谱仪的气相,其最突出的特点是准分子离子化很强、对样本中杂质的耐受量大,直接分析核酸、蛋白质经电离产生的混合物,能为临床检验中标准物质的研究提供有效的技术保障,是临床检验的参考方法的首选。因此芯片上的样本结晶形态和质量好坏直接影响质谱的检定结果。
在提高芯片的样本结晶形态和质量的研究中,现有的研究重点在于如何改进芯片的质量。例如,中国授权专利201410090967.3、“制备亲疏水相间的微阵列芯片及其用于质谱成像定量分析的方法”提供了一种通过在芯片上设置疏水和亲水区域来制备检测芯片,其中采用丝网印刷技术将疏水性聚合物(聚二甲基硅氧烷或聚甲基丙烯酸甲酯)按照设计好的模板刷在导电玻璃上,其中涂布区为疏水区,空白区作为预留的亲水区。然后,用亲水材料(如样品体系的水溶液)涂布空白区,形成均一间隔的亲水区和疏水区。该方法通过利用丝网印刷技术来设计模板形状,预先在亲水区留出空白区(又称“留白处理”),因此需要特殊的印刷设备和操作软件,同时在涂布疏水区时靶板要绝对静置。同时,丝网印刷技术的精度低,亲疏水区域的分界不能达到微米精度。并且,需要将待测混合物体系水溶液均匀地铺在亲水区,芯片烘干固化,置于烘箱中60摄氏度固化2h,增加了生产时间和成本。
中国授权专利201110401165.6、“对生物样品进行富集和除盐净化处理的方法”公开了一种利用疏水和亲水材料制备具有封闭图案化表面的检测靶板的方法,包括通过在基底上构筑具有较大直径的聚合物涂层(如聚甲基丙烯酸甲酯、聚苯乙烯或光刻胶)作为挡层圆区,然后以含氟单分子层或蒸镀金属层作为疏水层贴在整个基底上。由于该疏水层不能粘附在上述挡层圆区,因此将靶板浸入有机溶剂中进行超声处理,可以除去挡层圆区。最后,再将所述聚合物涂层在所述圆区内部突变较小直径的同心圆,从而获得疏水外圈(含氟单分子层或蒸镀金属层)-亲水中圈-疏水内圈(聚合物涂层)的同心圆图案的质谱靶板,因此该方法又称“挡层涂布”。然而,该方法在基底上构筑疏水-亲水-疏水区域的封闭图案化表面,需要进行两步疏水处理,即采用含氟的试剂在100~250℃下加热生长1~5个小时,工艺复杂,过程耗时。由于该方法需要精确控制两次聚合物涂层的间距,间距过小导致外圈和内圈相连,同时由于使用两种不同的疏水材料来分别突变不同的基底表面,所获得的疏水区液滴的接触角过小,导致疏水效果差,影响了普通实验室的应用。
中国专利申请200610023671.5、公开了“一种低丰度蛋白靶上一步除盐与富集的方法”,其中通过疏水聚合物(聚甲基丙烯酸甲酯、聚乙烯、聚苯乙烯、聚氟乙烯等)预先在靶板的样品池中央部分进行涂布,然后进行蛋白点样,使得蛋白样品富集在疏水聚合物层上。然后,将基质溶液加入点样区,使得蛋白样品中的污染物和无机盐扩散出去,最后得到样品和基质均匀细致的结晶。由于该方法是直接将蛋白样品加到疏水层,通过加入过量的基质溶液来进行纯化,虽然客观上有一定纯化效果,但造成了蛋白样品的浪费。同时,如果手动操作将0.2μl疏水性聚合物溶液点在每个kapton膜的小孔内,耗时,且0.2μl溶液的精度难以控制,影响小孔表面疏水均一性;如果自动操作,需要配置相应点样设备,增加成本,制备复杂,并不适合不易制备的微量蛋白样品的检测和应用。
由于上述靶板的在先研究中,或是靶板表面没有亲水疏水差异,(如中国专利200610023671.5),导致结晶形态差,或是形成亲水疏水差异的涂层,但亲疏水分界不能达到微米精度或液滴接触角过小,但制备过程过于复杂,不能节约时间和成本(如中国专利201410090967.3、专利201110401165.6),或是需要额外的装置和检测软件,或是需要过多的珍贵蛋白样本进行检测,这些都导致质谱检测样本峰的准确度低,信噪比低,基线高。
在最接近的现有技术中,发明人在先前提交的中国专利(cn201710539756、用于飞行时间质谱检测蛋白和核酸的通用芯片的制备方法;cn201710539893、用于飞行时间质谱检测蛋白和核酸的通用芯片)中,提出了通过制备新的质谱芯片来提高样本结晶形态和质量,该芯片主要包括主体表面具有微整列排列的亲水性点样孔和疏水性孔外区,亲水性点样孔覆盖150-800nm的亲水性薄膜,疏水性孔外区覆盖150nm-2μm疏水性薄膜,其表面水滴接触角>120°,其中所述亲水性薄膜为特殊的二氧化硅氧化物薄膜、氧化锌薄膜、氧化铝薄膜等,疏水性孔外区通过硅烷偶联剂进行处理形成疏水性薄膜。该发明在一定程度上能够提高样本的结晶质量。然而,该发明的研究重点主要在于提供一种两用型的质谱芯片,联合特殊设计的芯片适配器,通过适配器上不同的卡槽设计,可放置多张芯片,能实现核酸与蛋白不同样品同时进样检测,节省质谱开门关门时间。由于该发明的研究重点并未集中在针对单一样本的质谱检测中,如何提高单一样本的结晶质量,因此本发明人仍然需要以此为基础进行研究。
鉴于maldi-tofms可用于分析多种类型的样本,包括有机分子溶液、核酸、蛋白质以及整个微生物,其中基因、蛋白质和微生物是目前在临床质谱检测实验室应用最广的项目,因此在现有的芯片基础上,需要一种通过改善样本结晶条件以提高maldi-tof质谱检测核酸靶分子准确率的方法。
技术实现要素:
本发明原理之一在于,通过改善样本结晶条件以提高maldi-tof质谱检测生物靶分子准确率的方法,该方法不针对如何改进现有的质谱芯片,而是通过摸索和优化质谱芯片的结晶条件,来提高对生物靶分子在芯片上的结晶水平,从而能够充分利用现有的质谱芯片,以减少检测成本。
本发明原理之二在于,针对核酸靶分子在芯片上结晶性质,提供一种生物靶分子的通用结晶方法。
本发明原理之三在于,在改善样本结晶条件的基础上,进一步提供一种样本质谱检测的校正方法,从而为提高maldi-tof质谱检测生物靶分子准确率确定前提条件。
因此,本发明第一个目的是提供一种改善核酸样本结晶的方法,步骤包括:
(1)采用去离子水与高效液相色谱级的乙腈按照1:1-0.5:1的体积比混合,得到混合溶液;
(2)加入3-羟基-2-吡啶甲酸充分溶解,其中3-羟基-2-吡啶甲酸:混合溶液=1-10:100(mg/ml);
(3)取3-羟基-2-吡啶甲酸溶液和柠檬酸二胺溶液,按照1-3:1体积比混合均匀,过滤即得基质溶液。
(4)选取0.5-1μl基质溶液和0.5-1μl样本,在芯片上进行点样结晶。
在一个实施方案中,其中步骤2中加入0.01-0.2mg的3-羟基-2-吡啶甲酸,并且通过2000-3000rpm震荡3-10min,8000-12000rpm离心3-10min,得到3-羟基-2-吡啶甲酸溶液;在一个具体实施方案中,加入0.05mg的3-羟基-2-吡啶甲酸。
在另一实施方案中,其中步骤3中的柠檬酸二胺溶液的配制如下:称量柠檬酸二胺置于离心管中,再加入去离子水进行溶解,其中柠檬酸二胺的重量mg与去离子水体积ml比为1-5:100,在2000-3000rpm震荡3-10min,8000-12000rpm离心3-10min,得到柠檬酸二胺溶液。在一个具体实施方案中,过滤是选用0.22um针式滤器过滤。
在其他的实施方案中,其中步骤4中选取0.75μl基质溶液和0.5μl样本进行结晶。
在上述任一实施方案中,上述操作选自操作间十万级洁净度,环境温度20-25℃,环境湿度20-30%条件下进行。
本发明第二个目的是提供一种能够提高质谱检测生物靶分子的准确率的质谱芯片,该芯片包括:由硅材料或玻璃或钛合金组成的芯片主体,其表面具有多个竖直交叉排列的亲水区域定位孔、疏水孔外区域、中心校正孔、验证校正孔、备用校正孔;
其中,定位孔具有亲水特性,用于滴定基质溶液或样本;疏水孔外区域,表面具有疏水特性;定位孔和孔外区域形成的微阵列芯片表面亲疏水间隔的结构,可以辅助液体样本收缩凝聚在亲水区域内,使样本结晶集中,且呈现标准圆形,提高离子化效率;
中心校正孔和验证校正孔,用于校正核酸标准样本的滴定位置验证校正孔,用来验证校正效果;
备用校正孔,作为备用,中心校正孔或验证校正孔如果出现异常,可用备用校正孔。
在一个实施方案中,定位孔在芯片上为(4-8)×(4-8)的竖直交叉方向排列,中心校正孔、验证校正孔以及备用校正孔在芯片中间位置竖向排列,数量均为1或2个。在一个具体实施方案中,中心校正孔、验证校正孔以及备用校正孔的数量为1个。
在另一实施方案中,所述芯片亲水性定位孔覆盖150-800nm的亲水性薄膜,疏水性孔外区覆盖150nm-2μm疏水性薄膜,其表面水滴接触角>120°在一个具体实施方案中,所述亲水性薄膜为二氧化硅氧化物薄膜、氧化锌薄膜、氧化铝薄膜等,疏水性孔外区通过硅烷偶联剂进行处理形成疏水性薄膜。在另一具体实施方案中,所述硅烷偶联剂选自乙烯基硅烷、氨基硅烷或二甲基二氯硅烷。
本发明第三个目的是提供一种可提高质谱检测核酸靶分子的准确率的质谱校正方法,步骤包括:
(1)如上所述,配制基质溶液,并配置核酸靶分子样本以及校正样本uep的溶液;
(2)分别在亲水区域定位孔、中心校正孔以及验证校正孔,点0.5-1μl基质溶液,自然挥干后形成一次结晶;
(3)在亲水区域定位孔,在一次结晶表面,点0.5-1μl生物靶分子样本,自然挥干后形成二次结晶;
(4)分别在中心校正孔、验证校正孔,在一次结晶表面,点0.5-1μl校正样本uep,自然挥干后形成二次结晶;
(5)通过激光飞行时间质谱分别轰击中心校正孔位、验证校正孔的校正样本uep,获得多个uep峰分子量的谱图;
(6)当至少90%的uep峰分子量偏差小于200ppm,即为校正有效;
(7)校正成功后,即可对亲水区域定位孔的待测生物靶分子样本进行质谱检测。
在一个实施方案中,选取0.75μl基质溶液和0.5μl样本进行结晶。
在一个具体实施方案中,所述生物靶分子是核酸,所述校正样本uep是用于扩增靶核酸的引物,即耳聋uep,对耳聋uep谱图20根uep峰分子量进行验证,其中18根uep峰分子量偏差小于200ppm,即为校正有效。
在上述任一实施方案中,所述质谱,参数设置如下:
turingmode:linear;
massrange:3000-9000;
maxlaserreprate:10.0;
power:105;
profiles:40;
shots:10。
在一个优选实施方案中,所述质谱是clin-tof-ii飞行时间质谱。
本发明第四个目的是保护上述方法中所用的能够提高质谱检测生物靶分子的准确率的质谱芯片。
附图说明
图1为生物样本一次结晶图;
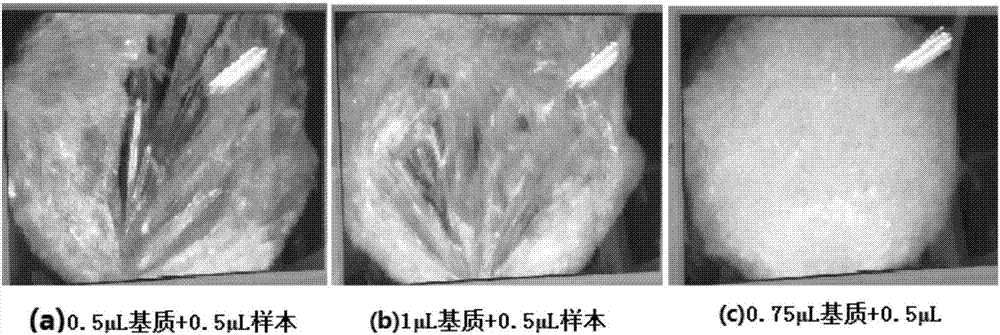
图2为基质溶液与样本二次结晶对比图,其中(a)0.5μl基质溶液+0.5μl样本,(b)1μl基质溶液+0.5μl样本,(c)0.75μl基质溶液+0.5μl。
图3为改进的微阵列质谱检测芯片表面结构示意图,包括:(1)亲水区域定位孔;(2)疏水孔外区域;(3)中心校正孔;(4)验证校正孔;(5)备用校正孔;
图4为耳聋uep验证校正品谱图;
图5为耳聋样本5例质谱图;
技术效果
1、本发明的核酸质谱检测是基于微阵列核酸检测芯片,其微阵列芯片表面结构增加校正孔,提高质谱峰质量精度,从而提高核酸质谱检测的正确率;
2、本发明提出一种优选的基质溶液配方,及洁净度环境温湿度条件,使生物样本一次结晶形态较佳;
3、本发明提出一种优选的基质溶液与样本体积配比,使基质溶液与样品在芯片表面共结晶更均匀,检测结果更佳。
4、本发明提出的通过改善结晶形态及校正方法,选取20例耳聋样本,鉴定正确率达到100%;
具体实施方案
以下结合附图及实施例对本发明做进一步说明。
实施例一、基质溶液的配制
所述基质溶液主要成分为3-羟基-2-吡啶甲酸,加入一定比例的乙腈,加速基质一次结晶的挥发,快速形成均一完好一次结晶。
基质溶液的配制步骤如下:
a、采用去离子水与高效液相色谱级的乙腈按照v去离子水:v乙腈=1:1-0.5:1的体积比混合,得到混合溶液ⅰ;
b、称量3-羟基-2-吡啶甲酸置于离心管中,再加入混合溶液ⅰ进行溶解,其中3-羟基-2-吡啶甲酸的重量mg与混合溶液体积ml比为1-10:100;
c、2000-3000rpm震荡3-10min,8000-12000rpm离心3-10min,得到3-羟基-2-吡啶甲酸溶液;
d、称量柠檬酸二胺置于离心管中,再加入去离子水进行溶解,其中柠檬酸二胺的重量mg与去离子水体积ml比为1-5:100,在2000-3000rpm震荡3-10min,8000-12000rpm离心3-10min,得到柠檬酸二胺溶液;
e、取3-羟基-2-吡啶甲酸溶液和柠檬酸二胺溶液,按照v3-羟基-2-吡啶甲酸:v柠檬酸二胺=1-3:1体积比混合;
f、在2000-3000rpm震荡3-10min,8000-12000rpm离心3-10min,得到混合溶液ⅱ,过滤,得到基质溶液。
上述3-羟基-2-吡啶甲酸规格要在含量99%以上,可以选购sigma品牌。
上述3-羟基-2-吡啶甲酸粉末0.01-0.2mg用精度大于0.001g的电子天平进行称量,优选地,本实施例称量3-羟基-2-吡啶甲酸0.05mg。
上述柠檬酸二胺粉末0.010-0.020mg用精度大于0.001g的电子天平进行称量,可以选购国药集团品牌,分析纯(ar),浓度>99%。
上述去离子水可以选购thermofisher品牌、规格100ml的去离子水;乙腈可以选购赛默飞世尔品牌、高效液相色谱级(hplc)。
步骤(f)所述过滤是选用0.22um针式滤器过滤,可以选购millipore品牌。
实施例二、生物样本一次结晶形态
在(1)亲水区域定位孔,点0.5-1μl基质溶液,自然挥干后形成一次结晶;
(2)中心校正孔,点0.5-1μl基质溶液,自然挥干后形成一次结晶;
(3)验证校正孔,点0.5-1μl基质溶液,自然挥干后形成一次结晶;
如图1显示,左图为亲水区域定位孔的结晶图,右图为中心校正孔的结晶图。二个结晶外形均呈现规整的圆形,表面圆润如玉石,质地规则均一,晶体各向生长细致,为理想的蛋白结晶形态。
应当指出的是,实施例一和二应当在操作间十万级洁净度,环境温度20-25℃,环境湿度20-30%条件下进行。
实施例三、通过二次结晶,确定基质与样本溶液的最佳比例
准备好表面洁净的质谱芯片,及按照实施例一配置的基质溶液,分别在芯片表面的3个孔中点0.5、0.75、1μl三种体积的基质溶液,自然挥干后形成一次结晶;
然后在三种一次结晶表面,均点0.5μl标准样本uep,自然挥干后形成二次结晶;
二次结晶的对比如图2所示。其中,0.5μl基质+0.5μl样本和1μl基质+0.5μl样本两种配比形成的结晶不规则,厚度不均匀,中间空,周围厚。因此当激光轰击样品时,样本峰准确度差,噪声高,基线高。
而0.75μl基质+0.5μl样本的配比形成的结晶规则,厚度均匀,晶向生长细致,质地密集,当激光轰击样品时,样本峰准确度高,噪声低,基线低。
由此确定选用0.75μl基质溶液和0.5μl样本进行结晶,为最佳方案。
实施例四、耳聋基因uep校正
(一)选取耳聋基因
20个与遗传性耳聋相关的基因多态位点分别是:gjb2基因35delg、gjb2基因167delt、gjb2基因176_191del16、gjb2基因235delc、gjb2基因299_300delat、gjb3基因c538t、gjb3基因g547a、slc26a4基因c281t、slc26a4基因g589a、slc26a4基因ivs7-2、slc26a4基因a1174t、slc26a4基因g1226a、slc26a4基因c1229t、slc26a4基因ivs15_5、slc26a4基因g1975a、slc26a4基因t2027a、slc26a4基因c2162t、slc26a4基因a2168g,12srrna基因c1494t、12srrna基因a1555g,对所述耳聋基因设计引物。
表1是引物信息表,各位点引物序列分别是seqidno:1-20:
表1
(二)预处理
在微阵列质谱检测芯片的中心校正孔及验证校正孔,点0.75μl基质溶液,自然风干后,再点0.5μl耳聋uep标准品,自然挥干后,将微阵列质谱检测芯片载入芯片适配器,进样,放入clin-tof-ii飞行时间质谱样品室。
设置clin-tof-ii飞行时间质谱参数:
turingmode:linear;
massrange:3000-9000;
maxlaserreprate:10.0;
power:105;
profiles:40;
shots:10。
(d)真空阈值:
当真空度<5e-6,开始检测;
(三)uep校正
第一、激光轰击中心校正孔位的耳聋uep
对耳聋uep谱图20根uep峰分子量进行校正,其中18根uep峰分子量偏差小于200ppm,即可。
第二、激光轰击验证校正孔位的耳聋uep
对耳聋uep谱图20根uep峰分子量进行验证,其中18根uep峰分子量偏差小于200ppm,即为校正有效。
验证校正孔位的质谱检测部分谱图见附图4。
在3000-9000da质量范围内,20根uep峰,分辨率400-600,基线低,信噪比高。
验证校正孔位的20个uep峰位置偏差见下表:
表2验证校正孔uep峰偏差:
耳聋uep标准品20根uep峰,去除6782.4da,6789.4da两根,剩余18根uep峰,最大偏差为147.3ppm<200ppm。
校正成功后,即可检测耳聋基因样本。
实施例五、耳聋基因样本检测
(一)准备工作:
配制好的基质溶液,前处理完成的耳聋质粒样本20例,清洗干净的微阵列质谱检测芯片。
(二)点样:
在微阵列质谱检测芯片表面选取20个亲水区域定位孔及中心校正孔、验证校正孔,点0.75μl基质溶液,自然挥干后,中心校正孔及验证校正孔点0.5μl耳聋uep标准品,20个亲水区域定位孔点0.5μl临床耳聋样本,自然挥干后,将微阵列质谱检测芯片载入芯片适配器,进样,放入clin-tof-ii飞行时间质谱样品室。
(三)设置clin-tof-ii飞行时间质谱参数:
turingmode:linear;
massrange:3000-9000;
maxlaserreprate:10.0;
power:105;
profiles:40;
shots:10。
真空阈值:
当真空度<5e-6,开始检测;
(四)uep校正
1、激光轰击中心校正孔位的耳聋uep
对耳聋uep谱图20根uep峰分子量进行校正,其中18根uep峰分子量偏差小于200ppm,即可。
2、激光轰击验证校正孔位的耳聋uep
对耳聋uep谱图20根uep峰分子量进行验证,其中18根uep峰分子量偏差小于200ppm,即为校正有效。
校正成功后,即可检测耳聋样本。
(五)样本采集
激光轰击亲水区域定位孔的耳聋质粒样本,采集20张耳聋样本质谱图;详见附图5。
(六)谱图分析
选用北京毅新博创生物科技有限公司的besnp软件进行耳聋样本分析,20个位点的分析结果详见报告。
由besnp软件分析鉴定报告,得出,20例耳聋质粒样本,共20*20=400个位点,鉴定结果全部正确,即耳聋样本鉴定结果正确率100%。
besnp软件分析鉴定报告如下:
表3
以上报告得出,耳聋样本20例,每例20重质谱峰,检测范围3000-9000da,共400个位点,经北京毅新博创生物科技有限公司be-snp软件分析,每个位点均能正确分型,鉴定结果正确率100%。
综上所述,本发明提供的基质溶液配方以及基质与样本配比,能够获得形态较佳的一次结晶和二次结晶,得到的有益效果是质谱检测谱图的基线低,信噪比高;按照本发明提供的校正方法,得到的有益效果是提高质谱检测质量精度,提高鉴定准确率,本实施例耳聋样本检测,鉴定结果正确率100%。
综上可知,本发明改进基质溶液配方,能够获得结晶形态较佳的一次结晶和二次结晶效果,并且其校正方法能够有助于获得更加稳定和准确的质谱检测结果。
- 还没有人留言评论。精彩留言会获得点赞!