靶分析物的亚细胞定位的制作方法
本申请要求提交于2016年3月18日的美国临时申请no.62/310,595的优先权,该临时申请的内容全文以引用方式并入本文。
本发明涉及用于细胞样品中靶分析物的亚细胞检测和分析的方法、制品和组合物。
背景技术
通过流式细胞术对细胞内标记物的分析依赖于每个细胞内存在的每种染色或荧光标记物所发射的绝对信号的测量。这些数据不赋予此类信号的亚细胞定位,并且使用户通过染色或靶分子(如果有的话)的现有知识来推断定位。例如,当分析可活化蛋白质(诸如转录因子)的活化时,传统流式细胞术唯一存在的方法是分析其磷酸化或其他修饰的水平,并且假设该信息与最终的核定位相关。
分析这些分子中的任一个时的重要因素是它们是否实际存在或转位到细胞核中。在一些情况下,诸如对于信号转导子及转录活化子(stat)家族的成员,该信息可能是相当准确的,因为stat一旦磷酸化便立即转位到细胞核中。然而,情况并非总是如此,因为细胞信号传导通常非常复杂,并且大多数蛋白质在转位到细胞核中之前需要一组迂回事件。还可能需要附加活化步骤以在细胞核内启动一次转录修饰。
另外,任何仅依赖于修饰状态而没有关于亚细胞定位的信息的方法受到各种问题的阻碍,包括:1)对此类修饰有用的抗体的必要性;2)事实上,对于每一种蛋白质/分子存在许多不同类型的修饰,所述修饰都需要它们自身可能不存在的抗体(例如,磷酸化、氨基甲酰化、甲基化,乙酰化、磺化、亚硝基化、遍在蛋白化等);3)事实上,对于大多数蛋白质/分子实际上并未识别大多数修饰;4)修饰状态的短暂性质,这不一定直接与蛋白质随时间推移的亚细胞定位或与蛋白质表达水平本身相关(即,不再被修饰的蛋白质仍可存在并且在靶区室内起作用);5)用于评估此类修饰的透化试剂盒的兼容性;6)以及要求被分析的分子表面上存在修饰或此类修饰的生物化学暴露,以便使抗体能够接近染色的修饰。实际上,虽然磷酸化与stat家族的核转位的诱导完全相关,但后者的问题使得除了市场上最苛刻的固定/透化试剂盒之外的所有试剂盒都无法评估stat磷酸化,这通常由于其苛刻性而对检测其他蛋白质有问题。
通过使用细胞通过细胞仪时的低至中等分辨率显微镜图像,成像流式细胞术已被用于视觉评估蛋白质的亚细胞定位。作为另外一种选择,细胞已被纯化,然后通过传统显微镜检查、生物化学细胞亚分级分离后蛋白质溶解物的蛋白质印迹、或其他分子生物化学方法进行分析。
这些现有技术方法都有缺点。成像流式细胞术需要昂贵的仪器。它也主要是定性的,并且因为它拍摄三维细胞的二维图像,所以可能无法有效区分位于图像中的细胞核前面或后面的区室内的核周蛋白质或蛋白质的细胞质与核定位。类似地,传统显微镜工作良好,但主要是定性的并且难以解析核周蛋白质的三维定位。更先进的显微技术(诸如共焦显微镜)主要通过拍摄细胞的许多图像切片来解决该问题,然后允许将它们重建成三维图像;然而,这些显微镜比图像细胞仪昂贵得多,并且它们与粘附到显微镜载片的细胞一起工作效果最佳。此外,即使用最先进的显微镜,仍然难以辨别核周膜结合蛋白质是位于核膜内部还是外部。
分子生物化学技术的主要缺点是处理和制备蛋白质提取物以供分析所需的时间和精力,对于大多数技术(包括蛋白质印迹)这可能花费数天。此外,显微镜和分子生物化学技术在用于分析复杂样品(诸如全血)时共同的主要缺点是必须首先纯化靶细胞群,然后在进一步的实验和分析之前休息、培养并且可能扩增细胞持续数天至数周。
本发明解决了用于检测靶分析物(诸如可活化蛋白质)的亚细胞定位的现有技术方法的这些和其他缺点。
技术实现要素:
本发明提供了用于定量细胞样品中的分析物的方法。该方法包括用第一透化试剂处理细胞的第一等分试样,该第一透化试剂使细胞质膜透化但不使核膜透化;用第二透化试剂处理细胞的第二等分试样,该第二透化试剂使细胞质膜和核膜透化;用洗涤缓冲液(诸如含有或不含bsa或fbs的pbs)洗涤第一等分试样和第二等分试样;用能够特异性结合到分析物的标记试剂染色第一等分试样和第二等分试样;测量来自第一等分试样的细胞中的标记试剂的第一信号和来自第二等分试样的细胞中的标记试剂的第二信号;以及比较第一信号与第二信号以确定分析物的分布。分析物可以是可活化蛋白质或在患病或异常细胞中差异表达或活化的蛋白质,包括但不限于转录因子或调节因子,诸如nf-κb、rel、stat、traf、foxp、foxo、连环蛋白、creb、atf、类固醇受体、hox、tfii、组蛋白乙酰转移酶、组蛋白脱乙酰酶、sp-1、活化蛋白质、c/ebp、e4bp、nfil、p53、热休克因子、jun、fos、myc、oct、nf-i、或nfat家族的成员;激酶,诸如erk、akt、gsk、mapk、map2k、map3k、map4k、map5k、map6k、map7k、map8k、pi3k、cam、pka、pkc、pkg、cdk、clk、tk、tkl、ck1、ck2、atm、atr、gpcr、或受体酪氨酸激酶家族的成员;磷酸酶,诸如mkp、shp、钙调磷酸酶、pp1、pp2、ppm、ptp、cdc、cdc14、cdkn3、pten、ssh、dusp、蛋白丝氨酸/苏氨酸磷酸酶、ppp1-6、碱性磷酸酶、ctdp1、ctdsp1、ctdsp2、ctdspl、dullard、epm2a、ilkap、mdsp、pgam5、phlpp1-2、ppef1-2、pptc7、ptpmt1、ssu72、ublcp1、肌管素蛋白、受体酪氨酸磷酸酶、非受体型ptp、vh-1样或dsp、prl、或非典型dsp家族的成员;dna和/或rna结合和修饰蛋白,诸如组蛋白、单链dna结合蛋白、双链dna结合蛋白、锌指蛋白、bzip蛋白、hmg盒子蛋白质、亮氨酸拉链蛋白、核酸酶、聚合酶、连接酶、解旋酶、转录因子、共活化因子、共抑制因子、支架蛋白、核酸内切酶、核酸外切酶、重组酶、端粒酶、多聚腺苷酸酶、rna剪接酶、以及核糖体家族的成员;核输入和输出受体;细胞凋亡或存活的调节因子,包括bcl2家族的成员和各种检查点蛋白;以及泛素和泛素样蛋白家族的连接酶和它们各自的解偶联酶,诸如脱嵌蛋白酶、desumoylase、deisgylase、usp、以及半胱氨酸蛋白酶家族的成员。分析物也可以是通常组成性地存在于一个区室或另一个区室中的蛋白质,包括但不限于结构微丝、微管、和中间丝状体蛋白、细胞器特异性标记物、蛋白酶体、跨膜蛋白、表面受体、核孔蛋白、蛋白质/肽转位酶、蛋白质折叠伴侣蛋白、信号传导支架、以及离子通道。分析物也可以是dna、染色体、寡核苷酸、多核苷酸、rna、mrna、trna、rrna、微rna、肽、多肽、蛋白质、脂质、离子、糖(诸如单糖、寡糖或多糖)、脂蛋白、糖蛋白、糖脂,或它们的片段。
该方法可包括逐个细胞地测量信号,诸如通过流式细胞术,成像流式细胞术或质量细胞术。还可使用其他细胞计数方法(诸如显微镜法)来分析样品。
该方法还可包括用第三透化试剂处理细胞的第三等分试样,该第三透化试剂在使细胞核透化或不使细胞核透化的情况下使细胞质以及一种或多种细胞器膜透化。
第一透化剂可包括0.001%和0.25%之间的洋地黄皂苷。例如,第一试剂可包括约0.01%-0.15%的洋地黄皂苷,ph为4.5-6.5的约1-100mm的mes,0-274mm的nacl以及0-5.2mm的kcl。
第二透化试剂可包括>0.01%的洋地黄皂苷或>0.0125%的tx-100中的一种。在一些实施方案中,第二试剂可包括约0.025%-0.5%的洋地黄皂苷或约0.0125%-0.25%的tritonx-100中的一种。第二试剂还可包括ph为4.5-6.5的约1-100mm的mes,0-274mm的nacl以及0-5.2mm的kcl。
在一些实施方案中,该方法包括用固定剂(诸如1-10%的多聚甲醛)固定细胞的步骤。
靶细胞可由多形核细胞(例如,粒细胞)组成,其中第一透化试剂可包括约0.01%-0.15%的洋地黄皂苷和约0.0125%-0.25%的tx-100的混合物中的一种以使细胞质膜透化,并且第二试剂可包括约0.01%-0.15%的洋地黄皂苷和>0.0125%的tween20的混合物以使细胞质+核膜透化,或包括>0.05%的tween20以使细胞质+线粒体膜透化。
该方法可包括用能够特异性结合到细胞的表面标记物的标记试剂染色第一等分试样和第二等分试样的步骤。
本发明还提供了用于实施本发明方法的试剂盒。试剂盒可包括第一透化试剂,该第一透化试剂使细胞的细胞质膜透化,但不使核膜透化;以及第二透化试剂该第二透化试剂使细胞的细胞质和核膜透化。第一透化试剂可包括约0.01%-0.15%的洋地黄皂苷,或约0.01%-0.15%的洋地黄皂苷和约0.0125%-0.25%的tx-100的混合物中的一种。第二透化试剂可包括约0.025%-0.5%的洋地黄皂苷、0.0125%-0.25%的tx-100、0.01%-0.15%的洋地黄皂苷和>0.0125%的tween20、或>0.05%的tween20中的一种。试剂盒还可包括固定剂。
附图说明
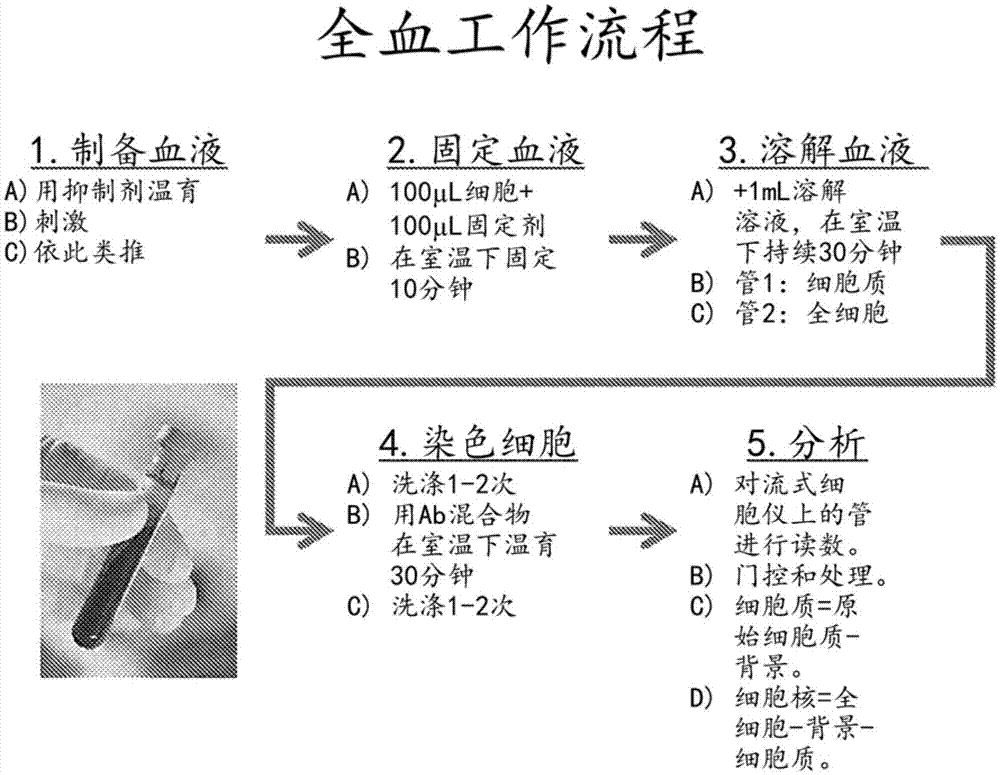
图1是使用本发明的方法来溶解全血的工作流程。
图2a和图2b用以测定细胞质与核膜透化的最佳浓度的洋地黄皂苷和tx-100滴定。a)全血中的细胞质膜由约0.031%的洋地黄皂苷完全透化,而细胞核也由约0.5%的洋地黄皂苷或0.125%的tx-100透化。b)pbmc中的细胞质膜由约0.0016%的洋地黄皂苷完全透化,而细胞核也由约0.05%的洋地黄皂苷或0.025%的tx-100透化。在该图中,钙黄绿素信号的减少表示质膜透化,而峰值hdac1染色指示完全核透化。在完全溶解之前用hdac1形成的凸缘是由于内质网的溶解,该内质网也含有hdac1。
图3用以测定使mcf-7细胞的细胞质与细胞核透化的最佳浓度的洋地黄皂苷和tx-100的滴定。a)0.031%的洋地黄皂苷使细胞质透化,并且0.25%的洋地黄皂苷使细胞核透化。b)0.0156%的tx-100使细胞质透化,并且0.125%的tx-100使细胞核透化。在该图中,细胞质膜的透化由hsp60染色指示,而核膜的透化由hdac1染色指示。
图4用mcf-7细胞评估质膜透化的修改方案。细胞预先加载cytocalceinviolet,并且细胞质膜透化由该信号的丢失指示。在该实验中,0.025%的洋地黄皂苷或tx-100仅透化细胞质,而0.25%的任一者完全透化细胞质和核膜。
图5a和图5b使用最佳缓冲液组合物在全血样品中的细胞质与核膜透化。a)溶解后样品的cd45与ss以及fs与ss分布。b)t细胞中线粒体与核膜透化的程度。c)单核细胞中线粒体与核膜透化的程度。该实验中使用的所有洗涤剂浓度使质膜完全透化,而hsp60和核纤层蛋白a/c分别指示线粒体内膜和核膜透化的程度。
图6滴定洗涤剂以便识别粒细胞的细胞质与核膜透化的最佳浓度。用0.0625%的洋地黄皂苷+0.5%的tween20可以看到细胞质+细胞核的最佳透化。与全细胞缓冲液相比,单独的细胞质的最佳透化是使用0.0625%的d洋地黄皂苷+0.25%的tx-100。单独的>0.5%的tween20将使细胞质+线粒体完全透化。在这些图中,tween20浓度是其他洗涤剂所指示数字的2倍:其被滴定在0.0625%和1%之间。如在图5中,hsp60和核纤层蛋白a/c分别用于指示线粒体内膜和核膜透化的程度。
图7a和图7b用1μg/mllps刺激单核细胞。a)缓冲液1和缓冲液2溶解之间的散射分布的比较,以及门控工作流程。b)全血单核细胞中的细胞质与核信号传导。c)t细胞中的细胞质与核信号传导。如所预期的,lps刺激单核细胞中的nf-κb和akt信号传导,但不刺激t细胞。
图8由1μg/mllps与100ng/mlgm-csf诱导的单核细胞中的差异信号传导。a)lps和gm-csf均诱导s133处的creb磷酸化,在细胞核中最多累积10分钟。b)lps刺激在细胞质和细胞核中诱导rela磷酸化最多10分钟,但是主要在细胞核中。c)lps和gm-csf均主要在细胞质中刺激erk磷酸化,对于gm-csf最多为5分钟,并且对于lps最多为10分钟。
图9通过cd3/cd28刺激t细胞中的细胞内信号传导。cd3/cd28诱导crebs133磷酸化最多2.5分钟,并且诱导relas536磷酸化最多5分钟,两者主要在细胞核中累积。hdac1对照也显示为主要在细胞核中。
图10il2刺激后treg中stat5核转位的分析。a)cd4和cd8t细胞群中不同cd25亚组的门控。b)分析部分a中门控的不同t细胞亚组中foxp3的表达。在该图表中,可以看出foxp3主要在cd4+cd25高群的细胞核中,这是预期的,因为这是treg群。c)在不同cd4t细胞群中进行il2刺激后stat5的核转位。il2刺激在treg群中最快速地诱导最大stat5转位,2.5分钟达到峰值。剩余的cd4t细胞10分钟达到峰值,其中cd25+群比cd25低群体被更强烈地刺激。d)在不同cd8t细胞群中stat5的核转位。stat5转位在cd8+cd25+群中10分钟达到峰值,但在cd8+cd25低群中未被诱导。所有这些结果都是预期的。在该实验中用于stat5染色的抗体针对整个stat5蛋白质,而不针对磷酸化位点。
具体实施方式
概述
本发明在各种上下文中使用标准标记技术(诸如流式细胞术)来实现细胞内蛋白质的亚细胞定位的定量测定。本发明利用某些洗涤剂使不同亚细胞器的膜透化的不同能力,每种亚细胞器由不同的脂质组合物组成。
例如,本发明可在数小时内直接用于全血,节省时间和资源,从而提高产量并降低成本。本发明对于分析血液中的稀有细胞群同样非常有用,所述稀有细胞群可不以足够大的量存在以有效地用首先需要其纯化的传统技术来实现研究。因为不需要纯化同源细胞群,所以,本发明能够以与传统技术相比所需小得多的样品量分析处于其内源状态的细胞。因此,本发明以小样品体积实现研究,并且可用于研究稀有且珍贵样品(例如,来自儿科患者的血液)中的细胞信号传导,其中样品的总体积通常太低而不能进行传统的研究。
细胞样品
本发明方法中的细胞样品可以是例如血液、骨髓、脾细胞、淋巴细胞、骨髓抽吸物(或从骨髓获得的任何细胞)、尿液(灌洗液)、唾液、脑脊髓液、尿液、羊水、间质液、粪便、粘液、组织(例如,肿瘤样品、分解的组织、分解的实体瘤)、或细胞系。在某些实施方案中,样品是血液样品。在一些实施方案中,血液样品是全血。可使用标准临床程序从受试者获得全血。在一些实施方案中,样品是来自全血(例如,红细胞、白细胞、淋巴细胞(例如,t细胞、b细胞或nk细胞)、吞噬细胞、单核细胞、巨噬细胞、粒细胞、嗜碱性粒细胞、嗜中性粒细胞、嗜酸性粒细胞、血小板、或者具有一种或多种可检测标记物的任何其他细胞、囊泡或外来体)的一种或多种细胞、或细胞衍生的微囊泡或外来体的亚组。在一些实施方案中,细胞或细胞衍生的微囊泡或外来体可来自细胞培养物。
受试者可以是人(例如,患有癌症的患者)、或商业上重要的哺乳动物,包括例如猴、牛或马。样品也可得自家庭宠物,包括例如狗或猫。在一些实施方案中,受试者为用作疾病动物模型或用于药物筛选的实验室动物,例如小鼠、大鼠、兔或豚鼠。样品可以是源自这样的生物体的初生或次生组织或细胞。
靶分析物和信号转导途径活化
本发明的靶分析物通常是“信号转导途径蛋白质”或“可活化蛋白质”。这些术语用于指具有至少一种同种型的蛋白质,该同种型对应于具有特定生物学、生物化学或物理性质(例如,酶活性、修饰(例如,翻译后修饰,诸如磷酸化)、或构象)的特定形式的蛋白质。在典型的实施方案中,蛋白质通过磷酸化活化。作为活化的结果,蛋白质转位至不同的细胞区室(例如,从细胞质到细胞核)。
在本发明方法中靶向的特定可活化蛋白质对本发明并不重要。示例包括stat家族的成员,诸如stat1、stat2、stat3、stat4、stat5(stat5a和stat5b)、以及stat6。细胞因子的细胞外结合诱导受体相关联的janus激酶的活化,这使stat蛋白质内的特定酪氨酸残基磷酸化。然后将活化蛋白质转运到细胞核。
其他可活化蛋白质的示例包括但不限于组蛋白脱乙酰酶1(hdac1)、rela(p65)、camp反应元件结合蛋白(creb)、forkheadboxp3(foxp3)、erk、s6、akt、以及p38。
另一个信号转导途径的示例包括促分裂原活化蛋白激酶(mapk)途径,该途径是影响基因调节的信号转导途径,并且响应于细胞外信号来控制细胞增殖和分化。该途径包括可活化蛋白质,诸如erk1/2。该途径可被脂多糖(lps)、细胞因子诸如白细胞介素-1(il-l)和肿瘤坏死因子α(tnfα)、cd40配体、佛波醇12-肉豆蔻酸酯13-乙酸酯(pma)活化,并且被蛋白质诸如mos、raf、ras、tpl2和v12haras组成性地活化。
另一个信号转导途径是磷脂酰肌醇-3-激酶(pi3k)途径。pi3k途径介导并调节细胞凋亡。pi3k途径还介导细胞过程,包括增殖、生长、分化、迁移、新血管形成、有丝分裂发生、转化、活力和衰老。介导pi3k途径的细胞因子包括pi3k、akt和bad。
因此,在一些实施方案中,本发明的方法可包括活化步骤,该活化步骤包括向细胞样品中加入活化剂试剂。活化试剂适于触发/活化细胞内的至少一个信号转导途径。合适的活化剂试剂包括例如lps、cd40l、pma或细胞因子(例如,il-l、tnf或gm-csf)。活化剂试剂还可以是组成性地活化信号转导途径的活化剂试剂。示例包括蛋白质,诸如mos、raf、ras、tpl2和v12haras。
固定和透化
本发明的方法可包括固定(或保存)步骤,该步骤可包括使样品与固定剂接触,固定剂的量足以交联蛋白质、脂质和核酸分子。用于将细胞固定在样品中的试剂是本领域技术人员熟知的。示例包括醛基固定剂,诸如甲醛、多聚甲醛和戊二醛。其他固定剂包括乙醇、甲醇、四氧化锇、重铬酸钾、铬酸、以及高锰酸钾。在一些实施方案中,固定剂可以是加热剂、冷冻剂、干燥剂、交联剂或氧化剂。
如上所述,本发明的方法包括至少两个透化步骤。该方法利用洗涤剂使不同亚细胞器的膜透化的不同能力,每种亚细胞器由不同的脂质组合物组成。在典型的实施方案中,将来自细胞样品的细胞的一个等分试样与第一透化试剂接触,该第一透化试剂破坏或溶解细胞质膜(以及可能的其他膜,诸如线粒体和er膜),但不破坏或溶解核膜。将细胞的第二等分试样与第二透化试剂接触,该第二透化试剂破坏或溶解细胞质膜(以及由第一透化试剂溶解的其他膜)加上核膜。在一些实施方案中,第三透化试剂可用于在使核膜透化或不使核膜透化的情况下溶解细胞质膜和附加细胞器膜。
在典型的实施方案中,每个后续透化试剂将具有比之前的透化试剂更高浓度的洗涤剂。作为另外一种选择,透化试剂可由多种不同浓度的洗涤剂组成。在一些实施方案中,透化步骤可在相同样品上按顺序进行。
用于使细胞透化的透化试剂(例如,洗涤剂)可基于多种因素来选择,并且可以是例如离子或非离子洗涤剂。合适的洗涤剂是使细胞透化并保持被检测蛋白质的表面表位完整性的那些洗涤剂。洗涤剂通常是非离子洗涤剂。示例性非离子洗涤剂包括洋地黄皂苷和乙氧基化辛基苯酚
结合剂
本发明的“结合剂”可以是能够特异性地结合到靶分析物(例如,可活化蛋白质)的任何分子或分子复合物。本发明的结合剂包括任何分子,例如蛋白质、小有机分子、碳水化合物(包括多糖)、寡核苷酸、多核苷酸、脂质等。在一些实施方案中,结合剂是抗体或其片段。在本发明的上下文中的特异性结合是指结合反应,该结合反应在异质群的蛋白质以及其他生物分子存在的情况下决定靶蛋白的存在。因此,在指定的测定条件下,规定的结合剂优先结合到特定蛋白质或特定蛋白质的同种型,并且不会以显著量结合到样品中存在的其他蛋白质或其他同种型。
当结合剂是抗体时,它们可以是单克隆或多克隆抗体。如本文所用的术语抗体是指免疫球蛋白分子和免疫球蛋白(ig)分子的免疫活性部分。此类抗体包括但不限于多克隆、单克隆、单特异性多克隆抗体、抗体模拟物、嵌合、单链、fab、fab'和f(ab')2片段、fv和fab表达文库。
可以标记本发明的结合剂,然后将其称为“标记结合剂”。标记是可以直接(即,主要标记)或间接(即,次要标记)检测到的分子。标记可被可视化和/或测量或以其他方式识别,使得可通过可检测信号来检测其存在或不存在。示例包括荧光分子、酶(例如,辣根过氧化物酶)、颗粒(例如,磁性颗粒)、金属标签、发色团、磷光体、化学发光剂、特异性结合分子(例如,生物素和链霉抗生物素蛋白、地高辛和抗地高辛)等。
在典型的实施方案中,标记是荧光标记,该荧光标记是可经由其固有的荧光特性检测到的任何分子。合适的荧光标记包括但不限于荧光素、罗丹明、四甲基罗丹明、曙红、赤藓红、香豆素、甲基香豆素、芘、malacite绿、二苯乙烯、荧光黄、cascadebluetm、texas红、iaedans、edans、bodipyfl、lcred640、cy5、cy5.5、lcred705、oregon绿、绿色荧光蛋白(gfp)、蓝色荧光蛋白(bfp)、增强型黄色荧光蛋白(eyfp)和荧光素酶。用于本发明的附加标记包括:alexa-fluor染料(诸如:alexafluor350、alexafluor430、alexafluor488、alexafluor546、alexafluor568、alexafluor594、alexafluor633、alexafluor660、和alexafluor680)、共轭聚合物基染料、树枝状聚合物基染料、量子点、聚合物点和藻红蛋白(pe)。
在某些实施方案中,多个荧光标记与本发明的捕获分子一起采用。在一些实施方案中,可以使用至少两种荧光标记,它们是荧光共振能量转移(fret)对的成员。可用于本发明的fret对(供体/受体)包括但不限于pe-cy5、pe-cy5.5、pe-cy7、apc-cy5、apc-cy7、apc-af700、apc-af750、edans/荧光素、iaedans/荧光素、荧光素/四甲基罗丹明、荧光素/lcred640、荧光素/cy5、荧光素/cy5.5和荧光素/lcred705。
可使用本领域熟知的标准程序进行标记与捕获分子的缀合。例如,常规方法可用于将标记部分共价结合到蛋白质或多肽。偶联剂(诸如二醛、碳二亚胺、二马来酰亚胺、双亚氨酸酯、双重氮化联苯胺等)可用于标记具有上述荧光、化学发光和酶标记的抗体。
尽管本发明的方法不要求结合剂对可活化蛋白质的活化(例如,磷酸化)形式具有特异性,但此类结合剂可用于受权利要求保护的方法中。已经产生了其中许多都可商购获得的抗体,所述抗体特异性地结合到蛋白质的磷酸化同种型但不特异性地结合到蛋白质的非磷酸化同种型。用于p-erk的示例性抗体包括phospho-p44/42mapk(erkl/2)克隆e10或d13.14.4e,其可从cellsignalingtechnology公司商购获得。
标记结合剂的其他示例包括但不限于以下抗体:小鼠抗stat5(py694)-pe(加利福尼亚州圣何塞的bdbiosciencespharmingen公司(bdbiosciencespharmingensanjosecalif.))、小鼠phospho-p44/42mapk(erkl/2)(thr202/tyr204)(e10)alexafluor647、phospho-p38mapk(t180/y182)alexafluor488、phospho-stat1(tyr701)(58d6)alexafluor488、phospho-stat3(tyr705)(3e2)alexafluor488(马萨诸塞州丹弗斯的cellsignalingtechnology公司(cellsignalingtechnologyinc.,danvers,mass.))、phospho-akt(ser473)(a88915)、phospho-p44/42mapk(erkl/2)(thr202/tyr204)(a88921)、phospho-stat3(tyr705)(a88925)、phospho-p38mapk(thr180/tyr182)(a88933)、phospho-s6核糖体蛋白(ser235/236)(a88936)、phospho-stat1(tyr701)(a88941)、以及phospho-sapk/jnk(thr183/tyr185)(a88944,加利福尼亚州布雷亚的贝克曼库尔特公司(beckmancoulterinc.(bci),brea,calif.))。
在一些实施方案中,可使用特异性地结合细胞表面抗原或表面标记物的结合剂。表面标记物的示例包括跨膜蛋白(例如,受体)、膜相关蛋白(例如,受体)、膜组分、细胞壁组分,以及细胞的可由至少部分在细胞外部的试剂接近的其他组分。在一些实施方案中,表面标记物是细胞类型或亚型(例如,淋巴细胞或单核细胞的类型)的标记物或标识符。在一些实施方案中,表面标记物选自:cd1、cd2、cd3、cd4、cd5、cd6、cd8、cd10、cd11a、cd14、cd15、cd16、cd19、cd20、cd24、cd25、cd26、cd27、cd28、cd29、cd30、cd31、cd32、cd33、cd34、cd38、cd40、cd45、cd45ra、cd45ro、cd49a-f、cd53、cd54、cd56、cd61、cd62l、cd64、cd69、cd70、cd80、cd86、cd91、cd95、cd114、cd117、cd120a、cd120b、cd127、cd134、cd138、cd152、cd153、cd154、cd161、cd181、cd182、cd183、cd184、cd185、cd186、cd191、cd192、cd193、cd194、cd195、cd196、cd197、cd198、cd199、cd252、cd257、cd268、cd273、cd274、cd275、cd278、cd279、cd281、cd282、cd283、cd284、cd286、cd288、cd289、cd290、cd326、以及cd357。
测量系统
使用结合剂和标记来定量细胞中结合分子的测量系统是众所周知的。此类系统的示例包括流式细胞仪、扫描细胞仪、成像细胞仪、成像流式细胞仪、荧光显微镜、共焦荧光显微镜和质量细胞仪。
在一些实施方案中,流式细胞术可用于检测荧光。适用于该用途的许多设备是可用的并且是本领域技术人员已知的。示例包括beckmancoulternavios、gallios、aquios和cytoflex流式细胞仪。在一些实施方案中,如果使用金属标记的抗体,则可使用质量细胞术来分析细胞。
试剂盒
可用于本发明的方法的试剂也能够以试剂盒的形式生产。此类试剂盒是包装的组合,其包括例如以下基本元素:(a)第一透化试剂,该第一透化试剂使细胞的细胞质膜透化,但不使细胞的核膜透化;以及(b)第二透化试剂,该第二透化试剂使细胞的细胞质膜和核膜透化。试剂盒还可包括(c)标记结合剂,该标记结合剂特异性地结合对照(例如,细胞器特异性或细胞骨架蛋白)或可活化蛋白质(例如,磷酸化形式、非磷酸化形式或两者),(d)固定剂,以及(e)关于如何使用这些试剂进行该方法的说明。在一些实施方案中,洗涤缓冲液也可包括在内。
示例性试剂盒由用于全血单核细胞(即,淋巴细胞+单核细胞)的两个单独缓冲液组成:1)第一缓冲液用于使细胞质透化,包括er、内体系统和外线粒体膜,而2)第二缓冲液用于使由第一缓冲液透化的所有物质,加上细胞核(以及在一些实施方案中,内线粒体基质)透化。缓冲液1(细胞质)可由以下各项组成:ph为4.5-6.5的1-100mm的mes、0-274mm的nacl、0-5.4mm的kcl,以及0.01%-0.15%的洋地黄皂苷。缓冲液1的最佳洗涤剂浓度介于0.001%和0.25%的洋地黄皂苷之间,其中细胞质被溶解,但细胞核未被溶解。缓冲液2(全细胞)可由以下各项组成:ph为4.5-6.5的1-100mm的mes、0-274mm的nacl、0-5.4mm的kcl,以及>0.01%的洋地黄皂苷或>0.0125%的tritonx-100。缓冲液2的最佳洗涤剂浓度取决于样品类型,其中上限受表面标记物丢失和细胞崩解的限制,两者的发生率在2%左右。
对于缓冲液1和缓冲液2,盐浓度可以是生理盐水(即,0-274mmnacl+0-5.2mmkcl)中给定1倍浓度的0和4倍之间的任何值。对于一些洗涤剂,盐浓度的差异可影响特异性细胞膜的靶向效率。固定剂可例如由以下各项组成:1倍pbs(ph为7.4的10-20mm的nah2po4、137mm的nacl和2.7mm的kcl)中的8-10%多聚甲醛,从而提供4%-5%的最终固定剂浓度。缓冲液1和2还将在1%和10%之间任何值的最终固定剂浓度下起作用,但在较低浓度下具有细胞信号传导的蛋白质修饰将较少保留,并且在浓度>4%时rbc的溶解更有效。固定剂中的盐浓度将在给定1倍浓度的0和2倍之间起作用,但在较低浓度下wbc的光散射分布可受到一点影响,并且洗涤剂的有效性随着浓度接近2倍而降低。
实施例
提供以下实施例以说明但不限制受权利要求保护的发明。
本发明的目的是通过流式细胞术以及其他细胞计数技术实现细胞内蛋白质的亚细胞定位的定量测定。该系统通过利用某些洗涤剂使不同亚细胞器的膜透化的不同能力来起作用,每种亚细胞器由不同的脂质组合物组成。
用于处理全血样品的方案如下(工作流程参见图1):1)首先将样品与固定剂1:1混合,涡旋,然后温育10分钟。每种缓冲液包括额外的对照管,该对照管用除了正在测试的特异性信号传导或靶抗体以外的所有抗体染色,以便减去背景信号。背景对照也可用同种型对照抗体标记,以更精确地确定非特异性结合,尤其是在具有特征性高的非特异性结合的细胞中,诸如嗜中性粒细胞。对于间接抗体标记,省略初级抗体但仍然使用次级抗体是用于确定可归因于次级抗体的非特异性背景信号程度的常用方法,该次级抗体通常高于靶抗体的直接缀合物。2)在固定周期期间,将样品分成2个独立的部分,一个用于细胞质溶解,而另一个用于全细胞溶解。作为另外一种选择,可为每个样品预先设置2个单独的管,假设它们均被同样地处理。3)在固定之后,将每个管中的样品分别与缓冲液1或缓冲液2以1:5混合(例如,200μl样品(包括固定剂)+1ml溶解缓冲液);背景对照也用每种缓冲液溶解,但是如果两种缓冲液均由相同的洗涤剂组成(即使在不同的浓度下),可能只需要用两种缓冲液中的一种溶解该背景对照。然后将管涡旋并在室温下温育15-30分钟。4)在溶解之后,将样品用pbs或标准洗涤缓冲液(例如pbs+1%bsa)洗涤2次,然后用所需的抗体混合物染色30分钟。5)如果使用未缀合的初级抗体,则可洗涤样品并用含有/不含免疫表型分型抗体的次级抗体染色。免疫表型分型抗体可需要另外洗涤,然后需要封闭步骤以防止与靶向其宿主物种的任何次级抗体的非特异性结合。6)一旦染色,便将样品再次用pbs或洗涤缓冲液洗涤2次,重悬于pbs+0.5%pfa中,并在流式细胞仪上读数。
数据采集后,对样品进行门控,补偿,并作为标准流式细胞术样品进行分析。为了确定细胞质与核定位,所得数据进一步如下处理:1)对于细胞质:从原始细胞质数据中减去来自缓冲液1的背景对照的靶信号。2)对于细胞核:首先从全细胞数据中减去来自缓冲液2的背景对照的靶信号,然后从该结果中进一步减去经处理的细胞质数据。例如,如果对于foxp3的亚细胞分布染色,其中细胞质和全细胞的背景mfi为1.5,并且细胞质和全细胞的原始foxp3信号分别为3.5和31.5,则细胞质mfi将被计算为2(即,3.5(原始)-1.5(背景)=2),并且核mfi将被计算为28(即,31.5(原始)-1.5(背景)-2(细胞质)=28)。如果在缓冲液1和2中使用相同洗涤剂,则可以通过从全细胞中减去原始细胞质数据以获得核数据来简化数据处理,而无需间歇地减去背景。这也在先前的实施例中得到证实(即,核mfi将简单地计算为:31.5(原始)-3.5(原始细胞质)=28)。一些选择的蛋白质中有一小部分可存在于内线粒体基质中,但预期这对此类蛋白质的核定位数据的影响非常小(如果有的话)(信号的很小一部分),并且不会预期改变大多数蛋白质(包括转录因子)的活化依赖性转位信号,因为需要蛋白质变性以穿过外线粒体膜和内线粒体膜,需要在内线粒体基质内重新折叠以便执行功能,并且事实上线粒体只是不使用大多数细胞蛋白质的不同系统:它是残留的细菌。
对于外周血单核细胞(pbmc),细胞系和其他纯化细胞、缓冲液1和缓冲液2具有与全血不同的组成;然而,方案在其他方面是相同的。大多数细胞系的表现与pbmc相似。此外,全血粒细胞可能需要不同的缓冲液组合以使它们的细胞质与核区室适当地透化。具体地讲,由0.0625%的洋地黄皂苷+0.25%的tx-100组成的缓冲液1将溶解质膜而不溶解线粒体或细胞核,而由0.0625%的洋地黄皂苷+>0.125%的tween20组成的缓冲液2将溶解质膜(与缓冲液1相当)并且还将完全溶解细胞核;>0.5%的tween20本身将溶解质膜并且完全溶解线粒体而不溶解细胞核,而低浓度的tx-100或单独的洋地黄皂苷将分别溶解线粒体或细胞核,但浓度不高。
实施例1
图2是不同浓度的洋地黄皂苷或tx-100对t细胞和单核细胞的细胞质与核透化效率的比较。图2a是对全血进行的滴定,而图2b是对pbmc进行的滴定。在两种情况下,首先将样品用1μmcytocalceinviolet(aatbioquest公司(aatbioquest,inc))在co2调节的37℃温育箱中预加载1小时。在1小时后,将样品用4%pfa固定10分钟,然后在室温下温育30分钟,其中不同浓度的洗涤剂用dih2o稀释,与样品混合物的比例为1:5。然后洗涤样品并用抗hdac1-fitc(abcam公司(abcam,plc))染色,再次洗涤,并且最后在gallios流式细胞仪(bci公司(bci))上读数。在该图中,细胞质溶解由cytocalceinviolet信号的丢失指示,因为一旦质膜被透化,它就会从细胞中释放,而当核膜被透化时,核溶解由增加的hdac1信号指示。就洋地黄皂苷溶解而言,一旦质膜被溶解并且在完全核溶解之前,便存在hdac1染色的凸缘;这表示内质网的溶解,内质网也含有hdac1的储存库。在全血中,洋地黄皂苷的工作范围在大约0.015%和0.125%之间,其中质膜被溶解,但细胞核未被溶解。对于pbmc,该范围大约在0.001%和0.0125%之间。tx-100不提供这种工作范围,并且在达到质膜透化的足够浓度后几乎立即开始溶解细胞核。全血的细胞的完全溶解在0.25%的洋地黄皂苷或0.125%的tx-100中的任一者的浓度下实现,并且pbmc的细胞的完全溶解在0.025%的洋地黄皂苷或0.025%的tx-100中的任一者的浓度下实现。
实施例2
图3示出用mcf-7细胞(乳腺癌细胞系)对洋地黄皂苷或tx-100的滴定。图3a是对洋地黄皂苷的滴定,而图3b是对tx-100的滴定。在两种情况下,将细胞培养24小时,然后在8孔玻璃显微镜载片(nunc)中进行实验。在实验当天,首先用4%pfa将细胞固定10分钟,然后在室温下温育30分钟,其中不同浓度的洗涤剂用1倍pbs稀释。然后洗涤样品并且在室温下用小鼠抗人hsp60和兔抗人hdac1抗体(圣克鲁兹生物技术公司(santacruzbiotechnologies))标记1小时。在1小时后,再次洗涤样品并且在室温下用鸡抗小鼠af488和鸡抗兔af647抗体(分子探针公司(molecularprobes))标记30分钟。最后,洗涤样品,用含有dapi(vector实验室(vectorlaboratories))的vectashield封固剂盖上盖玻片,并且使用zeissaxioskop2plus荧光显微镜连同63倍油浸透镜捕获图像。在图3a中,如细胞质和线粒体中的hsp60染色所指示,可以看到使细胞质透化开始于约0.031%的洋地黄皂苷;而约0.25%的洋地黄皂苷开始使细胞核完全透化,如细胞核内的hdac1染色增加所指示。在图3b中,可以看到使细胞质透化开始于约0.016%的tx-100,然后使细胞核透化开始于约0.125%的tx-100。
实施例3
图4是用于染色mcf-7细胞的方案的修改,以便更清楚地示出质膜的透化,并消除较低水平的表观hsp60染色可能是由于次级抗体的非特异性结合的可能性。在该实验中,在将细胞铺板24小时后,用1μmcytocalceinviolet预加载1小时,然后如图3所指示进行处理。当样品准备好盖上盖玻片时,使用不含dapi的封固剂。在zeissaxioskop2plus显微镜连同63倍油浸透镜上捕获图像。在该图中,可以看到未透化的mcf-7细胞被加载有cytocalceinviolet,并且一旦质膜被透化,这种染色便会丢失。仔细检查cytocalceinviolet的亚细胞定位指示其被加载在内体系统内,正如在加载细胞时所用的时间帧所预期的那样。反过来,在细胞质透化下cytocalceinviolet染色的丢失指示内体系统也被透化,这是预期的,因为内体膜从质膜夹断。在该实验中,可以看到0.025%的洋地黄皂苷和tx-100使质膜透化,而可以看到0.25%的两者使全细胞透化。该修改的方案用于随后通过流式细胞术用全血和pbmc测试不同洗涤剂的性能,包括图2中的结果。
实施例4
图5指示全血的最佳溶解参数,包括改进的缓冲液条件以改善rbc溶解。虽然发现洗涤剂在用dih2o稀释时使细胞膜差异透化表现良好,但发现dih2o在非常低的洗涤剂浓度下溶解rbc的有效性不一致,特别是如果固定时间延长超过方案超过几分钟。为了改善rbc溶解,最终用介于4.5-6.5之间(诸如ph为5.5)的ph的mes来缓冲溶液,这也使盐浓度增加至生理水平。这进一步改善了wbc的散射分布,将完全溶解所需的时间减少到大约15分钟,并且如果固定时间延长到超过方案(>20分钟),则将rbc溶解效率提高到缓冲液仍良好地工作的程度。同时,由于性能改善,固定剂浓度增加至5%。在图5a中,可以看到最佳溶解参数的散射分布,其中0.0625%的洋地黄皂苷对于细胞质膜透化是最佳的,并且0.5%的洋地黄皂苷或0.25%的tx-100对于全细胞膜透化是最佳的。在cd45与ss图中,可以看到rbc完全溶解,而fs与ss图显示了在不同浓度下保留的wbc散射分布。图5b显示了t细胞中线粒体(hsp60)和核(核纤层蛋白a/c)膜透化的有效性,而图5c显示了单核细胞中的该有效性。在两种情况下,可以看到透化分布与限定的最佳洗涤剂浓度一致。
实施例5
图6显示了用于粒细胞的差异透化的最佳洗涤剂组合。在一些情况下,使用亚细胞定位试剂盒的限定缓冲液可能无法有效且可重复地使粒细胞透化,因为它们是单核细胞,并且可用不同的洗涤剂组合更好地靶向。如图6中可见,粒细胞的细胞质+核膜被0.0625%的洋地黄皂苷+0.5%的tween20最佳地透化(曲线图中的tween20浓度是对于其他洗涤剂所指示浓度的2倍),而单独的细胞质膜被0.0625%的洋地黄皂苷+0.25%的tx-100最同等地透化。可以看到浓度>0.5%的tween20使细胞质+线粒体膜透化而不使核膜透化,而单独的较低浓度的洋地黄皂苷和tx-100将分别使核膜或线粒体膜透化。最终,粒细胞的差异透化可比单核细胞更复杂,这取决于靶细胞器。
实施例6
图7显示了lps刺激的单核细胞中细胞信号传导的分析。用1μg/mllps刺激全血持续指定的时间。然后用5%pfa固定样品,并用亚细胞定位试剂盒的缓冲液组合物处理,将0.0625%的洋地黄皂苷用于缓冲液1并且将0.5%的洋地黄皂苷用于缓冲液2。在图7a中,可以看到缓冲液1与缓冲液2溶解的散射分布,连同不同wbc群的门控工作流程。在图7b中,可以看出iκbα在细胞质和细胞核中均被降解,而akt在s473处在细胞质和细胞核中均被磷酸化,并且在s529处磷酸化的rela在细胞核内积累,最多10分钟。相反,图7c示出缺乏在t细胞中诱导的任何信号传导。这些结果是预期的,因为lps使用cd14作为共受体来刺激单核细胞上的tlr4受体,所述受体不存在于t细胞上。
实施例7
图8显示了用1μg/mllps或100ng/mlgm-csf对单核细胞的另一次刺激。在该实验中,用4%pfa固定细胞,并且对于缓冲液1用0.05%的洋地黄皂苷以及对于缓冲液2用0.5%的洋地黄皂苷处理,两种缓冲液均在dih2o中稀释。在图8a中,显示了在s133处creb磷酸化的诱导,对于两个刺激在细胞核中在10分钟时积累到最大值。在图8b中,可以看到在s536处rela磷酸化的诱导在lps刺激后在细胞核中约10分钟达到峰值,并且还在细胞质中累积到较低程度。gm-csf不刺激s536处的rela磷酸化。在图8c中,可以看出在s202/t204处的erk磷酸化被lps和gm-csf主要在细胞质中诱导,并且在细胞核中较小程度地诱导。对于gm-csf,该磷酸化5分钟达到峰值,并且对于lps,该磷酸化10分钟达到峰值。
实施例8
图9示出用0.25μg/mlcd3(okt3)+2.5μg/mlcd28(cd28.2)(bd生物科学公司(bdbiosciences))+10μg/ml山羊抗小鼠交联剂(jackson免疫研究(jacksonimmunoresearch))对t细胞的刺激。在该实验中,用4%pfa固定样品,并且对于缓冲液1用0.05%的洋地黄皂苷以及对于缓冲液2用0.5%的洋地黄皂苷处理,两种缓冲液均在dih2o中稀释。在cd3/cd28刺激后,pcrebs133在细胞核内最多积累2.5分钟,而prelas536在细胞核内积累,并在细胞质中较小程度地积累5分钟。如所预期的,hdac1染色也被示为主要位于细胞核内。
实施例9
图10示出用50iu/ml的il2刺激后treg中stat5核转位的优先活化。在该实验中,用4%pfa固定样品,并且对于缓冲液1用0.05%的洋地黄皂苷以及对于缓冲液2用0.5%的洋地黄皂苷处理,两种缓冲液均在dih2o中稀释。图10a示出cd4和cd8t细胞的cd25高、cd25+和cd25低群的门控。图10b示出用抗foxp3-af647(bci公司(bci))染色的foxp3+的细胞质与核定位。在该曲线图中,可以看到foxp3主要位于cd4+cd25高细胞的细胞核内,这是预期的,因为这是treg群,由细胞核中的foxp3表达定义。图10c示出使用抗stat5-fitc(abcam公司(abcam))检测的整个stat5蛋白质的核转位。在该图中,可以看到stat5最快速地转位到treg群的细胞核中,在接近2.5分钟时达到峰值,而其转位在cd4+cd25+细胞中诱导得更慢,在10分钟时达到峰值。在cd8+cd25+细胞中也最多诱导stat5转位10分钟,但程度较小。在不需要检测stat5磷酸化的情况下检测整个stat5蛋白质的核转位的能力证明了该技术能够解决现有技术的局限性,所述现有技术只能检测蛋白质修饰的差异:如果未暴露完整蛋白质的抗体的表位,则总有另一种抗体可用于不同的表位;对于特异性蛋白质修饰位点,情况并非如此。
替代方法:
本发明的方法依赖于不同的洗涤剂或洗涤剂浓度,以便在一个管中温和地溶解细胞质加上尽可能多的细胞质组分,并且整个细胞包括另一个管中的细胞核。出于该原因,各种洗涤剂将工作以完成该任务。一些洗涤剂如下,参考他们的全血表现:
细胞质:
皂苷(quillajabark):>0.03%将使淋巴细胞和单核细胞的细胞质膜透化而不使任何表观亚细胞器透化。对于粒细胞,它还可以在较低浓度下使核膜透化。这可以是用于细胞质膜透化的洋地黄皂苷(皂苷家族的另一成员)的可行替代物,但较高浓度将不会使核膜透化。如果需要,较高浓度的皂苷也可用于缓冲液1以匹配2种缓冲液的同渗容摩。然而,皂苷产生比洋地黄皂苷更高的背景信号。
tween20:在大约0.0625%和0.25%之间的范围内,其中质膜将完全透化并且淋巴细胞和单核细胞的细胞核不受影响。随着浓度增加,细胞质+线粒体膜将在粒细胞中完全透化,这在上文中指出。tween20也极大地改变了溶液的表面张力,并且将涂覆试管,从而使它们非常光滑。这提供的一个益处在于它有助于在洗涤之间倾析时用很少的努力完全去除缓冲液管,但是它产生很大的缺点,因为用小体积的抗体混合物进行染色很难正确地重悬样品。
tx-100:紧密范围恰好在0.0313%,并且可能高达0.0625%,其中细胞质膜将被透化而不影响淋巴细胞和单核细胞的细胞核。然而,这可能太窄而不能与不同的供体保持一致的表现。
np-40(igepalca-630)与tx-100等效地表现。
滴定低水平的离子洗涤剂,诸如十二烷基硫酸钠、脱氧胆酸钠或n-月桂酰肌氨酸,连同低水平的非离子洗涤剂以使细胞质膜透化,将使细胞质+线粒体膜完全透化,但将以较低浓度抑制核膜透化。在大于大约0.125%-0.25%的浓度下,离子洗涤剂将在达到足够高以使细胞核透化的浓度之前开始使蛋白质变性。一旦达到将使细胞核透化的浓度,散射分布开始降低,并且通常再1个滴定步骤将完全分解样品。这对于用较低浓度的缓冲液1区分线粒体可能是有用的,但缓冲液1和2之间蛋白质变性水平的差异最终将会使测定的可靠性复杂化。此外,不同的蛋白质在不同浓度的离子洗涤剂下变性,因此可能无法预定义整个蛋白质组的预期性能。
全细胞:
0.0625%的洋地黄皂苷+0.125%-0.25%的tx-100将比单独的洋地黄皂苷或tx-100更好地使细胞完全透化。然而,与使用单独的任一种洗涤剂相比,它更加降低了样品散射分布,并且样品质量的降低程度并不总是一致的。
使用0.0625%的洋地黄皂苷使细胞质膜透化将允许与较低水平的其他洗涤剂(诸如chaps和脱氧胆酸钠)组合以同样使细胞核透化。然而,chaps的性能在较低的ph下降低,并且无论浓度如何,脱氧胆酸钠在低于约7.0的ph下立即从溶液中沉淀出来。因此,这些可用于pbmc或细胞系,其中不需要降低ph,但不能用于全血。
皂苷可与洋地黄皂苷互换,以用于与其他洗涤剂组合以实现全细胞透化。然而,如前所述,背景将通常略高于其他洗涤剂的背景。
对于全细胞透化,np-40可与tx-100互换。
当单独以较高浓度使用时,离子洗涤剂诸如十二烷基硫酸钠和n-月桂酰肌氨酸将使细胞完全透化。然而,它们也使蛋白质变性,这可使得实现缓冲液1和2之间的等效性变得困难,如前所述。
缓冲液的ph影响其对rbc和血小板溶解的表现。缓冲液的最佳ph范围在4.5和6.5之间。低于4.5的ph开始大大损害散射分布并增加血小板粒度,而高于6.5的ph将导致固定10-15分钟后rbc溶解效率降低。最佳ph在5和6之间。该ph范围可以使用除mes以外的各种缓冲液来完成,包括柠檬酸盐、磷酸盐和其他具有至少部分与ph4.5-6.5范围重叠的有用范围的缓冲液。
还可以如下修改方案以减少所需的洗涤剂的量:1)首先,用单独的mes缓冲盐水(即,ph为4.5-6.5的1-100mm的mes、0-274mm的nacl、和0-5.4mm的kcl)固定样品并溶解rbc,而无需任何添加的洗涤剂。2)然后,洗涤样品,通过离心浓缩wbc,并倾析缓冲液和碎片。3)最终,使富集的wbc在较小体积的洗涤剂中透化,诸如分别在mes缓冲盐水或者甚至是用于细胞质或全细胞的pbs中的50-200ul的0.01-0.15%的洋地黄皂苷。对于较小的体积,染色抗体可与透化缓冲液一起包括在内,从而导致大致相等的处理时间。单独通过mes缓冲盐水的rbc溶解的速率实际上可通过增加mes或其他缓冲液的浓度,转换缓冲液(例如,柠檬酸盐在相同浓度下比mes更快),改变盐浓度,或可能用低浓度的皂苷或洋地黄皂苷补充缓冲液来增加,只要这些修改不影响步骤3中细胞质与全细胞透化的特异性。如果在rbc溶解步骤期间诸如用皂苷使细胞质膜透化,则可以修改第二透化步骤以靶向特异性亚细胞器,而不需要细胞质管所需的任何附加洗涤剂,并且如果洗涤剂必须首先克服质膜,则可能用通常比可能更低浓度的洗涤剂靶向特异性膜。然而,无论洗涤剂组合如何,使用多种洗涤剂和/或多个洗涤剂溶解步骤趋于极大地降低样品质量、表位和散射分布。
该方案也可按顺序执行,使得可以在各个细胞内看到并比较信号。该方法可如下进行:1)固定样品并用0.0625%的洋地黄皂苷使细胞质膜+rbc透化。2)洗涤样品。3)用第一抗体或其他标记物染色细胞质分析物。4)再次洗涤样品,并且优选地在进行之前交联来自步骤3的抗体或其他标记物。5)使用或不使用剩余的抗体或标记物使细胞核渗透以染色剩余的分析物。6)任选:如果未与核透化一起染色,则在该步骤中染色剩余的分析物。7)洗涤并重悬于pbs/0.5%pfa中。8)用流式细胞仪或显微镜分析样品。如果使用1ml体积溶解,则第二透化步骤可要求与第一步骤相同的0.0625%的洋地黄皂苷浓度,或者如果使用较小的50-200μl体积,则需要>0.0625%的洋地黄皂苷,如上所指出。在这种情况下,为了区分细胞质与核信号,2种抗体将需要不同的标记,因此2个区室的信号不能直接定量比较(即,它们在区室之间将是定性的)。然而,区室内的差异将是定量的。该方案的主要缺点是进行连续透化、染色和洗涤步骤所需的时间大约是标准方案的两倍。
应当理解,本文所述的实施例和实施方案仅用于说明目的,并且将建议本领域技术人员鉴于其进行各种修改或改变,并且这些修改或改变将包括在本申请的实质和范围以及所附权利要求的范围内。出于所有目的,本文引用的所有出版物、专利和专利申请据此全文以引用方式并入本文。
- 还没有人留言评论。精彩留言会获得点赞!