用于测定体液样品中的靶分析物的浓度的方法与流程
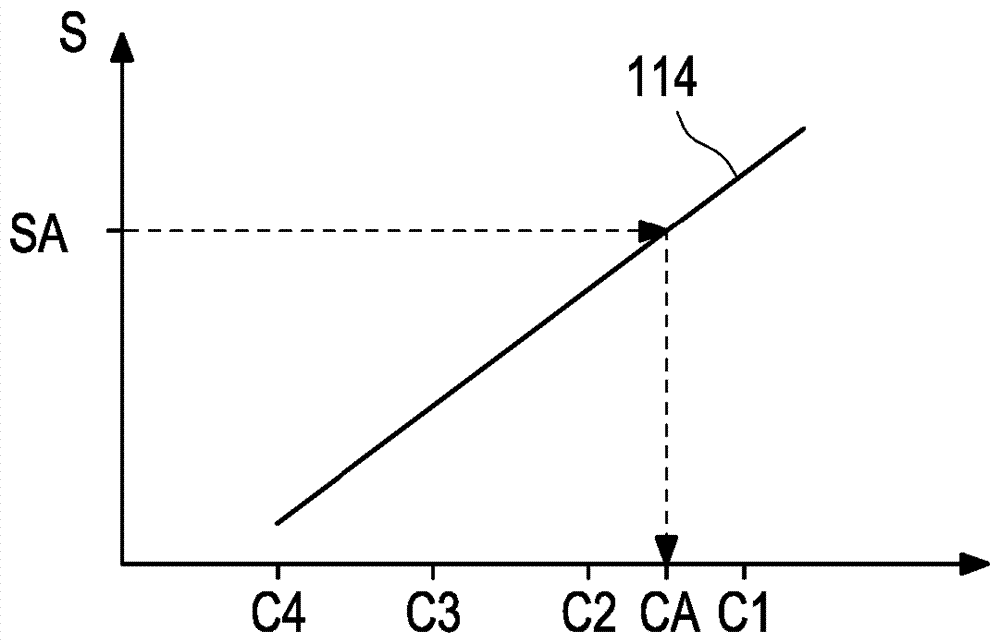
本公开的方法涉及用于测定体液样品中的靶分析物的浓度的方法。相关领域在许多生物医学和健康护理应用中,快速确定体液(诸如血液、血浆、血清、尿液、脑脊髓液(csf)或组织提取物)中的分析物浓度是至关重要的。传统上,此类测量已经由基于免疫测定的技术诸如酶联免疫吸附测定(elisa)完成。此类技术依赖于抗体与样品内的靶分析物的选择性结合。在大多数测定中,与基于比色、荧光测定或放射性的检测系统连接的第二抗体用于检测分析物-抗体复合物。已经开发了许多能够在生物流体上运行免疫测定的全自动装置,并且通常用于医院和研究设置中。尽管这些系统具有自动化和容量的优点,但它们也具有显著的缺点。例如,每种测定的特异性和选择性仅与所使用的抗体一样好。最近,在临床和研究设置中传统上通过免疫吸附测定法分析的许多定量测定法正在通过基于质谱的技术进行分析。基于与质谱偶联的液相或气相色谱(lc-ms或gc-ms)的方法经常被认为是绝对分析物定量测量的金标准,因为其具有固有的特异性、非常好的精确度和高灵敏度。然而,绝对定量的质量严重依赖用于将测量的信号转换成分析物浓度的校准过程的质量。lc-ms定量的现有技术方法依赖于稳定同位素稀释的概念和从参考标准产生的外部校准曲线。稳定同位素稀释是这样的过程,其中在样品制备过程中尽可能快地将同位素标记的分析物结构(几乎全部是氘化的,13c标记的,15n标记的)添加至样品中。因此,样品用同位素标记物稀释。在样品制备期间和测量过程期间,假定或验证同位素标记物具有与样品中的靶分析物相同的特性。因此,该过程中的任何随机或系统误差将等同地影响靶分析物和同位素标记的分析物,使得它们的浓度比将保持相同。同位素标记的分析物的一个额外特征是其具有不同的质量(或更精确地质荷比),其允许其与靶分析物分开检测。因此,该过程产生两种独立的信号,一种来自靶分析物(sa),而另一种来自同位素标记的分析物(sistd)。然后,通过同位素标记的信号对分析物信号进行归一化,以产生信号比,其通常是峰面积比,以调整可能扰乱过程的任何系统或随机误差。这种归一化过程改善了整体精度。外部校准过程依赖于含有已知浓度的靶分析物的外部校准物,其允许质谱检测器响应以校准曲线的形式描述。就像所有待测试的样品一样,校准物也用相同量的同位素标记的分析物掺入。这允许绘制信号比响应相对分析物浓度的图线,即校准曲线。测量掺入同位素标记的分析物的未知样品以测定信号比(分析物信号/同位素标记分析物的信号)。然后使用外部生成的校准曲线将该归一化的信号响应转换为浓度。依赖于同位素稀释的原理的外部校准曲线仅在以下情况下有效:1)同位素标记的分析物的量在校准物和待定量的所有未知样品中完全相同,2)在校准物的基质和待测量的未知样品的基质之间的仪器响应没有差异和3)在外部校准的时间点的ms响应与在该时间点的ms响应相同。因此,显然,外部校准曲线具有适合于定量未知样品的确定寿命。该寿命取决于如何好地控制上述三个方面。目前通过增加校准频率使风险最小化,以致于在许多实验室开发的lc-ms测试中,每天几次生成新的校准曲线。一些方法需要每20个未知样品的频率进行新的全7点外部校准,以确保外部校准曲线适合于定量。增加校准频率的策略改进了数据质量和置信度,同时牺牲测量时间。尽管该模型在临床环境中广泛适用于批量模式测定,但它不太适合处理能够在随机访问中运行许多不同测定的动态、多重系统。在这种情况下的校准需求将太高,以致于无法在这种日常频率下进行定期重新校准。一种降低校准频率的方法是转向内部校准的概念,其中在每个样品内描述仪器响应。这将有望完全减少对外部校准物和昂贵的外部校准时间的需求。在这种情况下,稳定同位素稀释程序是相同的,除了同位素标记的分析物指定作为校准物的额外作用。这依赖于为同位素标记的分析物指定浓度值,以便将分析物信号转换为分析物比率。经常包括分析物和同位素标记的分析物之间仪器响应的差异。在这种情况下显著不同的是,仪器响应由替代分析物(同位素标记的分析物)定义,并且该过程的有效性要求分析物和同位素标记的分析物之间的相对仪器响应随时间是相同的。如果同位素标记的分析物的ms响应会相对于分析物的信号响应的ms响应而变化,则内部校准响应不再有效。因此,还已描述了监测和校正改变的同位素标记的分析物响应的策略,其依赖于并入响应因子。wo2015/106169a1描述了使用单一同位素标记的分析物作为单一内部校准点的内部校准方法。尽管内部校准方法提供优势,但单点内部校准的概念具有以下缺点:1)未知样品的准确度取决于单次校准测量的可靠性,2)仪器响应可能并非总是在整个测量范围内正确描述,3)没有解决如何定义正确的y轴截距(空白值)的问题,4)如果无法确定内部校准物信号或者其是否为异常值,则定量是不可能的,和5)精度取决于分析物和单一同位素标记的分析物在整个过程中如何接近地追踪彼此。概述所有这些限制都可以通过在构建内部校准中使用更多同位素标记的分析物来解决。实际上,由于不同同位素标记的分析物的可用性有限,该技术方案具有其实际限制。然而,在至少各一个实例中,描述了两种独立的同位素标记的分析物用于内部校准的用途。除此之外,据我们所知,没有基于不同同位素标记的分析物的多点内部校准的进一步公开描述。几种不同同位素标记的分析物的合成将极端昂贵且耗时,例如2h6和13c3标记的分析物。如本文所用的术语“校准”是指确定仪器响应和分析物浓度之间的关系以确保样品的有效定量的过程。本文公开了用于测定体液样品中的靶分析物的浓度的方法。公开的用于测定体液样品中的靶分析物的浓度的方法的实施方案具有独立权利要求的特征。在从属权利要求中公开了可以分离的方式或任何任意组合实现的具体实施方案。如下文所用,术语“具有”、“包含”或“包括”或其任意语法变体以非排他性的方式使用。因此,这些术语可以既指其中除通过这些术语引入的特征外无其它特征存在于该上下文中所述的实体的情况,也指其中存在一种或多种其它特征的情况。作为实例,表述“a具有b”、“a包含b”和“a包括b”可以既指其中除b外a中不存在其它要素的情况(即其中a仅仅且排他地由b组成的情况),也指其中除b外实体a中存在一种或多种其它要素(诸如要素c、要素c和d或甚至另外的要素)的情况。进一步,应当注意,指示特征或要素可以存在一次或多于一次的术语“至少一个/种”、“一个/种或多个/种”或类似表述在介绍相应特征或要素时通常仅使用一次。在下文中,在大多数情况下,当提及相应的特征或要素时,表述“至少一个/种”或“一个/种或多个/种”将不再重复,即便事实上相应的特征或要素可以存在一次或多于一次。此外,如下文所用,术语“具体地”、“更具体地”、“特定地”、“更特定地”或相似的术语与具体或替代实施方案的特征结合使用,而不限制替代可能性。如技术人员将认识到的,公开的方法/系统可通过使用替代特征进行。类似地,由“公开的方法/系统的一个实施方案中”或类似表述引入的特征意欲为额外和/或替代的特征,而并非是对替代实施方案的任何限制,并非是关于公开的方法/系统的范围的任何限制且并非是关于组合以这种方式引入的特征与公开的方法/系统的其它任选或非任选的特征的可能性的任何限制。根据公开的方法,公开了用于测定体液样品中的靶分析物的浓度的方法。该方法包括以下步骤:-提供包括靶分析物的体液样品,-提供内部标准溶液,其包括包含靶分析物的多种同位素的组分的混合物,其中每种同位素的浓度是未知的,-将所述内部标准溶液添加至所述样品中,-借助质谱仪分析包括内部标准溶液的样品,-基于信号强度产生样品函数曲线,其中信号强度定义任意单位,-借助样品函数曲线,将分析物信号转化为相应的任意分析物单位,和-借助代表取决于任意单位的浓度曲线的标准化函数,将任意分析物单位转化为靶分析物的浓度。如本文所用的术语“靶分析物”是指其浓度待测定的任何目标分析物。如本文所用的术语“内部标准溶液”是指具有与靶分析物不同的分子量的组分的混合物。内部标准溶液的同位素的浓度是未知的,但调整为给出最小信号和最大信号之间的组分的信号强度。内部标准溶液对于复杂基质(诸如体液)中的有效lc-ms定量至关重要。这是理想地与靶分析物相同且仅分子量不同的物质。对于常规的质谱法,内部标准通常用于基于分析物信号与内部标准信号的比率(即所谓的峰面积比)产生归一化的仪器响应。用公开的方法,内部标准溶液用作内部校准物,以能够在每个样品中实现内部校准。这需要假设相对响应因子是恒定的,或者通过参考外部标准来校正相对响应因子。如本文所用的术语“校准”是指确定仪器响应和分析物浓度之间的关系以确保样品的有效定量的过程。如本文所用的术语“组分”是指要素的混合物,其要素可以是来自一种化学物质的天然同位素分布的混合物和/或具有单独同位素分布的两种或更多种化学物质的混合物。如本文使用的术语“任意单位”是指适合于表示测量的信号强度与彼此的关系的任何单位。如本文使用的术语“标准化函数”是指为每批内部标准溶液产生批次特定函数且描述浓度对任意单位的依赖性的函数。浓度是样品中的分析物浓度,单位为si,诸如mmol/l或mg/l。用公开的方法,避免了制备内部标准溶液的组分的精确浓度的需要,这节省了成本和时间。相反,用于将由信号强度产生的任意单位转化为靶分析物的浓度的关键由预先外部提供且对于每种类型的靶分析物是特异性的标准化函数提供。可以借助分析患者样品来产生标准化函数,其中每个患者样品包含已知浓度的靶分析物。因此,确保标准化函数从与靶样品相同的生物基质产生。因此,防止靶样品内同位素分布和用于产生标准化函数的样品基础的任何变化。可以将患者样品与内部标准溶液混合。因此,患者样品包含与靶样品相同的同位素分布。体液样品可以以预定体积提供。可以将内部标准溶液以预定体积添加至具有体液样品中。因此,即使同位素的浓度未知,也提供内部标准溶液和样品的精确比率。由此,便于从任意单位至靶分析物的各个浓度的精确计算。可以根据信号强度对组分进行排列。因此,即使各组分的浓度未知,也可根据它们相对于彼此的量,对其进行分选。例如,组分从高强度至低强度进行排列。不用说,所述组分可以替代地从低强度至高强度进行排列。可以基于根据任意单位绘制信号强度来产生样品函数曲线。因此,提供信号强度和任意单位之间的相关性,其允许从样品函数曲线获取代表由任意单位表示的任意浓度的另外值。例如,借助从绘制的信号强度计算来产生样品函数曲线。标准化函数可以是多项式函数、指数函数或部分线性函数,诸如分段线性函数。这些函数是众所周知的,且因此可以容易地整合至公开的方法中。可以根据参考方法测量患者样品。因此,确保标准化函数基于增加再现性的标准化方法。标准化函数可以取决于靶分析物的类型。因此,标准化函数适合于相应的靶分析物,其确保取决于相应的靶分析物的可靠的内部校准。同位素可以是稳定的同位素。因此,提供了稳定的测量结果。可以借助质谱仪在单次测量中分析体液样品和添加的内部标准溶液。因此,内部校准方法没有延迟任何分析,而是在分析的同时进行。进一步,公开了用于测定体液样品中的靶分析物的浓度的设备。所述设备包括质谱仪和被配置为执行公开的方法的控制单元。公开的方法进一步公开并提出了计算机程序,其包括计算机可执行指令,所述计算机可执行指令用于当在计算机或计算机网络上执行程序时,执行根据在本文包括的一个或多个实施方案中公开的方法的方法。具体地,所述计算机程序可以存储在计算机可读数据载体上。因此,具体地,可以通过使用计算机或计算机网络,优选地通过使用计算机程序来执行一个、多于一个或甚至所有如上所述的方法步骤。公开的方法进一步公开并提出了计算机程序产品,其具有程序代码装置以便当在计算机或计算机网络上执行程序时,执行根据在本文包括的一个或多个实施方案中公开的方法/系统的方法。具体地,所述程序代码装置可以存储在计算机可读数据载体上。此外,本发明公开并提出了数据载体,其上存储有数据结构,所述数据结构在加载至计算机或计算机网络之后,诸如加载至计算机或计算机网络的工作存储器或主存储器中之后,可以执行根据本文公开的一个或多个实施方案的方法。本发明进一步提出并公开了计算机程序产品,其具有存储在机器可读载体上的程序代码装置,以便当在计算机或计算机网络上执行程序时,执行根据本文公开的一个或多个实施方案的方法。如本文所用,计算机程序产品将程序称为可交易产品。所述产品通常可以以任意格式存在,诸如以纸质格式存在,或者在计算机可读数据载体上存在。具体地,所述计算机程序产品可以分布在数据网络上。最后,本发明提出并公开了调制的数据信号,其含有计算机系统或计算机网络可读的指令,用于执行根据本文公开的一个或多个实施方案的方法。优选地,参考本发明的计算机执行的方面,可以通过使用计算机或计算机网络来执行根据本文公开的一个或多个实施方案的方法的一个或多个方法步骤或甚至所有方法步骤。因此,通常,可以通过使用计算机或计算机网络来执行包括提供和/或操纵数据的任何方法步骤。通常,这些方法步骤可以包括任何方法步骤,通常除了需要手动工作的方法步骤,诸如提供样品和/或用于执行实际测量的某些方面。具体地,公开的方法进一步公开了:-包含至少一个处理器的计算机或计算机网络,其中所述处理器适于执行根据本说明书中描述的实施方案之一的方法,-计算机可加载数据结构,其适于在所述数据结构在计算机上执行的同时,执行根据本说明书中描述的实施方案之一的方法,-计算机程序,其中所述计算机程序适于在所述程序在计算机上执行的同时,执行根据本说明书中描述的实施方案之一的方法,-包含程序装置的计算机程序,所述程序装置用于在所述计算机程序在计算机或计算机网络上执行的同时,执行根据本说明书中描述的实施方案之一的方法,-根据前述实施方案的包含程序装置的计算机程序,其中所述程序装置存储在计算机可读的存储介质上,-存储介质,其中数据结构存储在存储介质上,且其中所述数据结构适于在已经加载至计算机或计算机网络的主要和/或工作存储器中之后,执行根据本说明书中描述的实施方案之一的方法,和-具有程序代码装置的计算机程序产品,其中所述程序代码装置可以存储或存储在存储介质上,如果所述程序代码装置在计算机或计算机网络上执行,其用于执行根据本说明书中描述的实施方案之一的方法。概述公开的方法和设备的发现,公开了以下实施方案:实施方案1:用于测定体液样品中的靶分析物的浓度的方法,其包括:-提供包括靶分析物的体液样品,-提供内部标准溶液,其包括包含靶分析物的多种同位素的组分的混合物,其中每种同位素的浓度是未知的,-将所述内部标准溶液添加至样品中,-借助质谱仪分析包括内部标准溶液的样品,-基于信号强度产生样品函数曲线,其中信号强度定义任意单位,-借助样品函数曲线,将分析物信号转化为相应的任意分析物单位,和-借助代表取决于任意单位的浓度曲线的标准化函数,将任意分析物单位转化为靶分析物的浓度。实施方案2:根据实施方案1所述的方法,其中借助分析患者样品来产生标准化函数,其中每个患者样品包含已知浓度的靶分析物。实施方案3:根据实施方案2所述的方法,其中将所述患者样品与所述内部标准溶液混合。实施方案4:根据实施方案1至3中任一项所述的方法,其中所述体液样品以预定体积提供,其中将所述内部标准溶液以预定体积添加至体液样品中。实施方案5:根据实施方案1至4中任一项所述的方法,其中根据信号强度对所述组分进行排列。实施方案6:根据实施方案5所述的方法,其中所述组分从高强度至低强度进行排列。实施方案7:根据实施方案1至6中任一项所述的方法,其中基于根据任意单位绘制信号强度来产生样品函数曲线。实施方案8:根据实施方案7所述的方法,其中借助从绘制的信号强度计算来产生样品函数曲线。实施方案9:根据实施方案1至8中任一项所述的方法,其中所述标准化函数是多项式函数、指数函数或部分线性函数。实施方案10:根据实施方案1至9中任一项所述的方法,其中根据参考方法测量患者样品。实施方案11:根据实施方案1至10中任一项所述的方法,其中所述标准化函数取决于靶分析物的类型。实施方案12:根据实施方案1至11中任一项所述的方法,其中所述同位素是稳定的同位素。实施方案13:根据实施方案1至12中任一项所述的方法,其中借助质谱仪在单次测量中分析所述体液样品和添加的内部标准溶液。实施方案14:用于测定体液样品中的靶分析物的浓度的设备,其包括质谱仪和被配置为执行根据实施方案1至13中任一项的方法的控制单元。附图简要说明将在后续的实施方案的描述中,优选结合从属权利要求来更详细地公开本发明的另外的特征和实施方案。其中,相应的特征可以以分离的方式以及任何任意可行的组合来实现,如技术人员将认识到的。在附图中示意性地描绘实施方案。其中,这些附图中相同的参考编号是指相同的要素或功能相同的要素。在附图中:图1显示用于测定体液样品中的靶分析物的浓度的设备;图2显示取决于分子量的信号强度的图;图3显示取决于任意单位的信号强度的图;图4显示取决于任意单位的浓度的图;图5取决于浓度的信号强度的图。实施方案的详述图1示意性显示用于测定体液样品102中的靶分析物a的浓度ca的设备100。靶分析物a可以是睾酮。体液可以是血液。设备100包含质谱仪104和控制单元106。控制单元106被配置为执行用于测定体液样品102中的靶分析物a的浓度ca的方法。为此目的,控制单元104与质谱仪102协作。执行该方法,如下面将进一步详细解释。基本上,提供体液样品102。例如,提供来自患者的血液。进一步,提供内部标准溶液108。内部标准溶液108包括包含靶分析物的多种同位素的组分n1至nn的混合物。同位素的分子量不同。具体地,所述同位素是稳定的同位素。每种同位素的浓度是未知的。将内部标准溶液108添加至样品102。体液样品102以预定体积(诸如25ml)提供,且将内部标准溶液108以预定体积(诸如5ml)添加至体液样品102中。随后,借助质谱仪104分析包括内部标准溶液108的样品102。具体地,可以借助质谱仪104在单次测量中分析体液样品102和添加的内部标准溶液108。然后,产生基于信号强度的样品函数曲线110,如下文将进一步详细解释。图2显示取决于分子量的信号强度的图。根据信号强度对组分进行排列。组分从高强度至低强度进行排列。例如,内部标准溶液108包含图2中的4种组分n1、n2、n3、n4。组分n1包含分子量mw1,组分n2包含分子量mw2,组分n3包含分子量mw3,且组分n4包含分子量mw4。分析的组分n1、n2、n3、n4产生信号强度s1、s2、s3、s4。图3显示取决于任意单位的信号强度的图。信号强度s1、s2、s3、s4定义任意单位u1、u2、u3、u4。基于根据任意单位u1、u2、u3、u4绘制信号强度s1、s2、s3、s4来产生样品函数曲线110。具体地,借助从绘制的信号强度s1、s2、s3、s4计算来产生样品函数曲线110。例如,借助任意单位u1、u2、u3、u4的内插来产生样品函数曲线110。靶分析物a也产生信号sa。借助样品函数曲线110,将分析物信号sa转化为相应的任意分析物单位ua。换句话说,将信号sa绘制在y轴上。从该起点绘制平行于x轴的假想线,产生与样品函数曲线110的截取点。从该截取点绘制平行于y轴的假想线,并且x轴上的相关值产生任意分析物单位ua。在图3中显示的实例中,任意分析物单位ua对应于1.6任意单位u,即1.6u。图4显示取决于任意单位的浓度的图。该图是标准化函数112,其代表取决于任意单位u的浓度ca1至can的曲线。借助分析患者样品来产生标准化函数112,其中每个患者样品包含已知浓度ca1至can的靶分析物a。应当注意,患者样品与内部标准溶液108混合。标准化函数112取决于靶分析物a的类型。因此,标准化函数112是多项式函数、指数函数或部分线性函数。为了生成标准化函数112,根据参考方法测量患者样品。在图4中显示的实例中,患者样品包含四种已知浓度ca1、ca2、ca3、ca4的靶分析物a,其中每种浓度ca1、ca2、ca3、ca4与任意单位u1、u2、u3、u4的对应量相关联。图5显示取决于浓度的信号强度的图。借助标准化函数112,可以将包括标准溶液108的分析样品102的信号强度s转化为浓度c1至cn,产生图线114。然后,借助标准化函数112,将任意分析物单位ua转化为靶分析物a的浓度ca。换句话说,将信号sa绘制在y轴上。从该起点绘制平行于x轴的假想线,产生与图线114的截取点。从该截取点绘制平行于y轴的假想线,并且x轴上的相关值产生靶分析物a的浓度ca。将基于以下实施例进一步详细描述本发明的方法。借助与质谱联用的液相色谱来制备实施例。作为用于液相色谱的装置,利用agilent1290infinity高效液相色谱(高效液相色谱-hplc)系统,在借助质谱检测前从血清组分分离分析物。流动相a是2mm乙酸铵与0.1%甲酸/水,且流动相b是2mm乙酸铵与0.1%甲酸/95%乙腈和5%水。对于柱,使用phenomenexkinetex2.6uf5100a,150x2.1mm(00f-4723-an)。应用以下线性逐步梯度程序:在1.5分钟内97%a/3%b至95%a/5%b,在0.3分钟内至50%a/50%b,在3.0分钟内至0%a/100%b,等度1.5分钟,在0.1分钟内返回至97%a/3%b且平衡1.1分钟。总运行时间为7.4分钟。将柱温箱调节为40℃,并将样品在自动进样器中在8℃下冷却。注射体积为5μl,且针头在冲洗口中用80%甲醇和20%水洗涤5秒。质谱仪是具有selexionfaims模块的absciexqtrap6500系统(bl27421409)。离子源是涡轮喷雾esi(esi-电喷雾电离),其对于正极性和负极性具有相等的源参数:温度300℃,帘式气体30psi,离子喷雾电压±4300v,离子源气体160psi,离子源气体230psi和碰撞气体介质。selexion在以下条件下操作:温度低,无改性剂,分离电压3500v,且分辨率增强开放。表1中给出实施例的分析物。对每种分析物调整最佳质谱电压设置,即去簇电位、碰撞能量、入口电位、出口室电位和补偿电压。获取以下多反应监测转换并将其分配给不同的内部标准函数。对应于内部标准(is)的同位素或多反应监测转换用作外部校准方法的内部标准。包括内部标准的所有其它同位素用于内部校准方法。表1分析物is-3is-2is-1isis+1is+2is+3is+4睾酮289.2/109.2292.2/112.0293.2/112.0294.2/112.0咪达唑仑326.2/291.2332.2/297.2333.2/297.2334.2/297.2335.2/297.2甲基苯丙胺150.1/91.0155.1/96.0156.1/97.0157.1/977.0去甲地西泮271.2/208.1276.2/213.1277.2/214.1278.2/215.1279.2/214.1280.2/215.1加巴喷丁172.1/67.0175.1/68.0176.1/68.0177.1/68.0庆大霉素1478.3/322.2481.3/324.2482.3/324.2483.3/324.2484.3/324.2485.3/324.2利眠宁300.2/227.1304.2/231.1305.2/232.1306.2/233.1307.2/234.1308.2/235.15-氟尿嘧啶129.1/129.1132.1/132.1133.1/133.1134.1/134.1丙戊酸143.1/143.1146.1/146.1147.1/147.1148.1/148.1在合适溶剂(甲醇、异丙醇或水)中制备较高浓度的储备分析物溶液。然后,通过在维生素d耗尽的人血清中稀释储备溶液以获得最高浓缩样品(其定义为100%)来制备掺料样品。使用维生素d耗尽的人血清作为稀释剂(如表2中给出),从该工作溶液制备7种校准标准(cal1至cal7)和20种质量控制样品(m01至m20),其范围为2%-100%的工作溶液。其中,工作溶液以%给出,且样品浓度以ng/ml给出。表2。以比表2中显示的100%样品cal7高10倍的浓度制备内部标准混合物。通过将100μl每种样品添加至1.5mleppendorf杯中,随后添加10μl同位素标记的内部标准来处理样品。将样品在37℃下混合10分钟。然后,添加150μl乙腈以沉淀血清蛋白。然后将样品在25℃下涡旋10分钟,随后在4℃-8℃下孵育1小时。分离大约150μl上清液,并在以14,000rpm离心样品30分钟后转移至hplc小瓶中。通过添加150μl水来进一步稀释样品。然后,注射5μl样品用于lc-ms分析。将每种样品分析4次以确定中间精度。遵循外部校准的原理定量质量控制样品m01至m20。构建完整的7点校准,并使用1/x加权与线性曲线拟合。该数据评估被认为是将与根据本公开的内部多点校准进行比较的现有技术方法。根据基于如上所述的内部标准的同位素簇的内部校准的原理,定量质量控制样品m01至m20。基于分析物,内部校准点的数量在3至5之间变化。首先使用单一分析物校准标准,将同位素的浓度标准化。为此,选择校准标准cal5,因为其代表靶测量范围的中间。使用线性1/x加权函数,将各个同位素的信号强度针对其浓度进行拟合。由此制备的上述分析物的内部标准的所得同位素分布显示于表3至10中。表3:睾酮13c3。表4:利眠宁2h5。表5:去甲地西泮13c6。表6;5-氟尿嘧啶13c、15n2。表7:丙戊酸13c4。表8:加巴喷丁13c3。表9:甲基苯丙胺13c6。表10:庆大霉素c1-氘代的。在表3至10中,左起第一列给出表示为离子的各自的同位素。左起第二列给出同位素的分子量。左起第三列给出参考材料的同位素的相对含量,其表示为参考材料丰度。左起第四列给出如上所述制备的标记材料的同位素的相对含量,并且表示为标记材料丰度。分别如表3至10中所示的参考材料和内部标准,其商品名和各自的供应来源在表11中给出。表11。如从表3至10可见,可以可行地实现一系列同位素标记的分析物并用于基于lc-ms分析进行内部校准。显而易见的是,由于天然同位素分布或合成改变,同位素标记的内部标准实际上分别是许多不同同位素结构和同位素簇的分布。如表3至10中所示的这种分布在每个单一小分子中是明显的,并且当合成标记小分子时仍然还存在。还显而易见的是,个别同位素都具有独特的丰度或浓度。基于外部校准,以及基于包括内部多点校准的公开方法的分析物的样品m01至m20的测量结果在表12至20中给出。表12。表13。表14。表15。表16。表17。表18。表19。表20。在表12至20中,左起第一列给出分析物。左起第二列给出样品。左起第三列给出根据外部校准以ng/ml计的测量的浓度。左起第四列给出根据外部校准以百分比变异系数计的精度。第五列给出根据包括内部多点校准的公开方法的以ng/ml计的测量的浓度。左起第六列给出根据包括内部多点校准的公开方法的以百分比变异系数计的精度。左起第七列给出根据包括相对于外部校准,包括内部多点校准的公开方法的准确度。如从表12至20可见,分析物的同位素可以用作内部校准物,以进行并入公开方法中的多点内部校准。数据显示,内部校准以与现有技术的7点外部校准等效的精度和准确度产生结果。显示的9种不同分析物的实例揭示,根据外部校准和公开方法的分析性能是等效的。公开方法中包括的内部校准减少了对校准标准及其测量的需要,因为足够的标准化仅需要单一校准标准。应当注意,可以通过混合两种不同的合成内部标准来分别调节同位素浓度和丰度。例如,两种不同的内部标准标记物(其中一种是氘代的,且另一种是13c),可以在不同的组合物中混合在一起以定制个别同位素的分布。因此,可以通过将两种不同的标记物质在不同组合物中混合在一起来定制同位素分布。因此,可以将内部校准的校准点针对所需浓度进行定制。参考编号的列表100设备102样品104质谱仪106控制单元108标准溶液110样品函数曲线112标准化函数114图线。当前第1页12
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1