肝细胞癌的诊断测试的制作方法
本发明涉及生物标志物和用于检测生物标志物的测定领域,以及涉及用于此类测定的抗体。特别地,本发明涉及用于检测指示原发性肝癌(肝细胞癌(hepatocellularcarcinoma),hcc)的生物标志物的测定。
背景技术
原发性肝癌(肝细胞癌,hcc)是最常见的人癌症之一,也是第三致命的癌症。大多数hcc病例是在肝硬化的背景下发展的,并且发展为硬化和hcc的主要病因是慢性乙型肝炎病毒(hbv)或丙型肝炎病毒(hcv)感染。hbv和hcv感染与全世界所有hcc病例的>80%相关1-3。发展hcc的非病毒背景包括由酒精性疾病、糖尿病和代谢和自身免疫疾病引起的肝硬化。
如果在早期阶段检测到hcc肿瘤,可以提供使用手术切除、移植或射频消融的治愈性治疗。然而,在早期阶段仅检测到30%的hcc肿瘤,其适合进行潜在的治愈性治疗。
用于诊断和测量hcc进展的最常用的血清生物标志物是甲胎蛋白(afp)。然而,afp检测hcc的诊断能力有限。肝硬化和肝炎都可导致afp水平升高,并且几乎一半被诊断为hcc的患者未显示afp水平升高。在一些临床研究中,另一种生物标志物脱-γ-羧基凝血酶原(dcp)已经显示出比afp更好的诊断灵敏度4。然而,afp和dcp都显示出作为筛选标志物的不足的诊断灵敏度和特异性,并且在国际指南中不推荐将其用作监测中的诊断标志物5。超声具有更好的诊断灵敏度和特异性(60-80%),但是缺陷是高成本和在早期阶段不能检测肿瘤6。
已显示血清糖蛋白中的糖基化变化与肝疾病和hcc的发展和进展相关。最充分研究的实例是afp、afp-l3的核心-岩藻糖基化形式的提升,其显示出比使用单独的afp更高的hcc特异性7。
血浆蛋白岩藻糖基化的提高是与hcc相关的常见发现,并且质谱研究已经揭示了肝硬化和hcc患者之间岩藻糖基化模式的特异性差异8-13。然而,使用凝集素(例如来自对岩藻糖具有广泛的特异性的橙黄网孢盘菌(aleuriaaurantia)的岩藻糖结合凝集素(lectinfromaleuriaaurantia,aal))的研究通常显示出在区分hcc患者和肝硬化患者中存在问题14,15。
岩藻糖结合凝集素aal已被广泛用于研究与疾病相关的血浆蛋白的岩藻糖基化变化。aal由两个相同的亚基构成,其中每个亚基含有五个岩藻糖的结合位点16。aal显示出对岩藻糖基化寡糖的广泛特异性,并与岩藻糖连接的α1-6、α1-2、α1-3和α1-4(包括唾液酸化和岩藻糖基化结构,例如slex和slea)寡糖结合。五种不同的结合位点在结合特异性和亲和力方面不同。
从wo2009/136859已知源于aal的单价岩藻糖结合肽。已经产生仅包含结合位点2、s2的重组形式的aal17。与aal相比,该重组形式显示出对岩藻糖基化寡糖的更受限制的结合,其对唾液酸化/岩藻糖基化寡糖的结合降低。其还显示出对岩藻糖基化结构的一般较低亲和力,对多岩藻糖基化寡糖和含有α1-6连接的岩藻糖的寡糖具有最高亲和力。
技术实现要素:
本发明涉及用于测定具有对原发性肝癌(肝细胞癌,hcc)特异性的糖基化模式的α1-酸性糖蛋白(agp)的测定。
在第一方面,本发明涉及用于检测样品中岩藻糖基化α1-酸性糖蛋白(agp)的方法,其包括以下步骤:
-提供固定于固相的,与具有根据seqidno:1的氨基酸的肽具有至少80%同一性(例如85%、90%、95%、99%或100%同一性)的单价岩藻糖结合肽;
-使样品与固定的岩藻糖结合肽接触;以及
-检测与所述岩藻糖结合肽结合的任何岩藻糖基化agp。
在另一方面,本发明涉及用于评估人个体患有肝细胞癌(hcc)的风险的方法,其包括以下步骤:使用根据上述方面的方法检测来自所述个体的样品中的岩藻糖基化agp,其中与来自未患hcc的人个体的参考浓度相比,岩藻糖基化agp浓度提高指示个体患有hcc的风险提高。
在另一方面,本发明涉及成套试剂盒(kitofparts),其包含固定于固相的与具有根据seqidno:1的氨基酸的肽具有至少80%同一性(例如85%、90%、95%、99%或100%同一性)的单价岩藻糖结合肽,和至少第一检测抗体,所述第一检测抗体能够特异性结合与所述岩藻糖结合肽结合的岩藻糖基化agp。
本发明还涉及根据本发明的成套试剂盒在根据上述方面的方法中的用途。
在其他一些方面,本发明涉及分离的肽及其在产生抗体中的用途,所述分离的肽由与根据seqidno:3的氨基酸序列具有至少83%(例如88%、94%或100%)同一性的氨基酸序列组成。此类抗体可用于根据上述方面的方法中。
本发明还涉及能够特异性与人agp的第183-189位氨基酸残基至少部分重叠的表位结合的抗体,以及能够特异性与人agp的第183-201位氨基酸残基至少部分重叠的表位结合的igg抗体。
附图说明
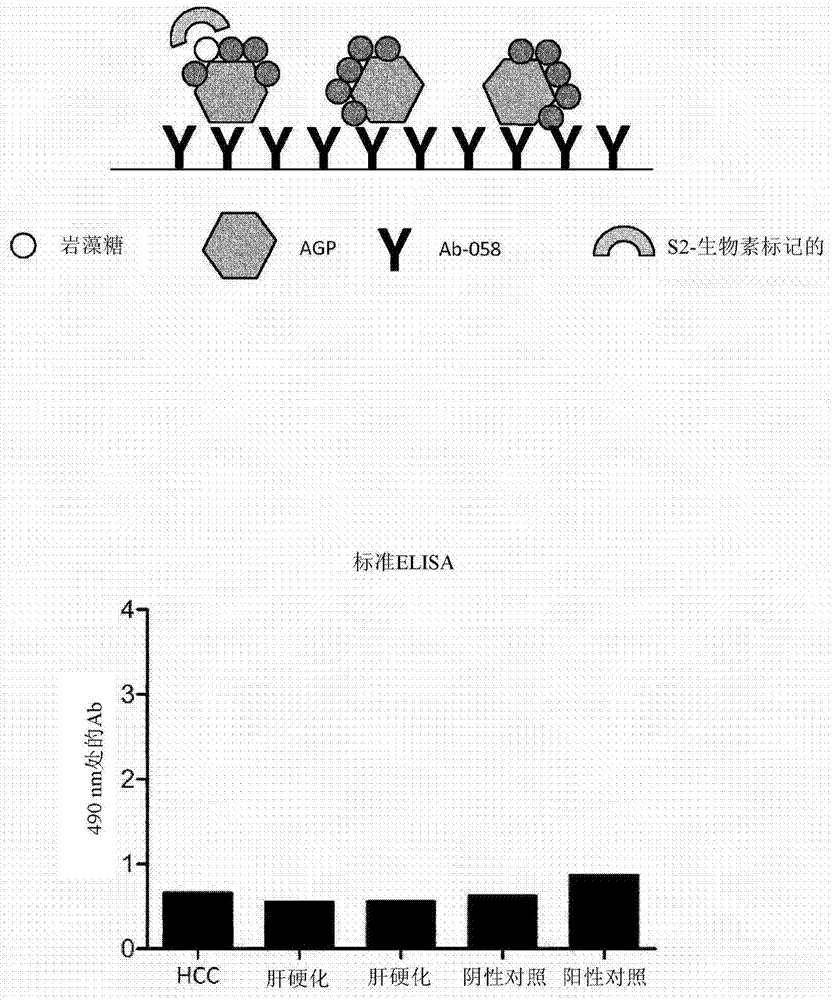
图1.a.上图:固定在固体支持物上的抗体#058的标准elisa的图示。下图:从患有肝细胞癌(hcc)、肝硬化的患者和阴性和阳性对照获得的样品的测量吸光度值。
b.上图:固定在固体支持物上的s2的反向elisa的图示。下图:从患有肝细胞癌(hcc)、肝硬化的患者和阴性和阳性对照获得的样品的测量吸光度值。
图2.在反向s2-elisa中比较兔多克隆抗体#058和可商业获得的抗agp抗体。对从患有肝细胞癌(hcc)的患者、患有肝硬化的患者、患有肝炎的患者和正常对照获得的样品进行分析。
图3.来自患者血浆样品的富含aal和富含s2的α1-酸性糖蛋白(agp)的western印迹分析。泳道1-4代表肝硬化样品,泳道5-8代表hcc样品,泳道9代表肝炎样品和泳道10代表正常血浆样品。使用抗人agp抗体058检测agp。
图4.a.在反向s2-elisa测定中,来自患者样品的不同浓度的纯化agp的结合。在反向s2-elisa中分析来自hcc(黑色三角形)、肝硬化(黑色方块)和正常样品(黑色圆圈)的agp的结合。
b.反向s2-elisa中基质效应的分析。来自在含有1%bsa(圆圈)和正常血浆(黑色方块)的pbs中稀释的hcc患者样品的不同浓度的纯化agp的结合。
c.在反向s2-elisa测定中不同浓度的dsagp的结合。
图5.患有肝炎、肝硬化和hcc患者中s2结合的agp(a)、agp(b)和afp(c)水平的散点图。
图6.agp和s2结合agp水平的相关图。r平方值为0.11。
定义
本说明书中使用的所有术语和词语通常应被解释为具有本领域技术人员通常给出的含义。为了清楚起见,下面明确定义了一些术语。
本文关于抗体使用的“特异性”是指与相似但不相同的表位相比,抗体以显著更高的亲和力结合特定表位的性质。
如本文所用,“亲和力”是指物质或颗粒之间的吸引力,其导致它们进入并保持在化学组合中。亲和力表示两种物质形成强或弱化学键,形成分子或复合物,或抗原-抗体复合物的热力学键强度的趋势。通过复合物的解离常数测量复合物中两种物质之间非共价结合的强度。在免疫学中,亲和力是单个抗原结合位点和单个抗原决定簇之间相互作用强度的热力学表达,因此是它们之间的立体化学相容性的热力学表达。
本文所用的“agp”是指α1-酸性糖蛋白(也称为血清类黏蛋白)。agp是41-43kda糖蛋白,pi为2.8-3.8。对于成熟的人agp,肽部分是具有两个二硫桥的183个氨基酸的单链。碳水化合物含量表示以五至六个高度唾液酸化的复合型n-连接聚糖形式连接的分子量的45%。人agp的序列如seqidno:2所示,其中残基1-18是不存在于成熟蛋白中的信号肽。使用根据seqidno:2的序列提及本公开中agp中的特定氨基酸位置。
如本文所用的“hcc”意指肝细胞癌。hcc是肝的原发性恶性肿瘤,并且主要发生在潜在的慢性肝病和/或肝硬化患者中。原发性恶性肿瘤是指hcc应与其中癌症起源于另一个器官,随后通过转移扩散到肝的转移性肝癌区别开来。hcc占据大多数肝癌。
如本文所用,“同一性”是指两个氨基酸序列在比对中相同位置具有相同残基的程度。同一性以百分比表示。比对是匹配两个或更多个氨基酸序列的氨基酸残基以实现最大水平的同一性和保守性的过程或结果。氨基酸序列的比对可以通过许多可用的工具进行,例如欧洲生物信息学研究所网站上提供的clustalomega,http://www.ebi.ac.uk/tools/msa/clustalo/。
与具有根据seqidno:1的氨基酸的肽具有至少80%同一性(例如85%、90%、95%、99%或100%同一性)的肽在本公开中统称为“s2”或“s2-肽”。
序列
seqidno:1是仅包含结合位点2的重组形式的橙黄网孢盘菌凝集素(aal)的氨基酸序列。
seqidno:2示出了人α1-酸性糖蛋白(agp)的序列。
seqidno:3示出了人α1-酸性糖蛋白(agp)的第183-201位氨基酸残基。
发明详述
本发明人已经鉴定出具有根据seqidno:1的氨基酸序列的单价岩藻糖结合肽,下文表示为s2-肽,显示出可用于测定具有指示肝细胞癌的糖基化模式的α1-酸性糖蛋白(agp)存在的结合特征。
凝集素琼脂糖珠沉淀用于分析来自肝炎、肝硬化和hcc患者的血浆中aal结合agp的量中是否存在差异。与正常相比,肝硬化和hcc患者样品中aal结合agp提高,这与岩藻糖基化的提高一致。然而,当使用s2-肽进行免疫沉淀时,与肝硬化患者和肝炎患者二者相比,出现hcc-患者在其血浆中具有提高的凝集素结合agp水平的趋势。
因此,在第一方面,本发明涉及用于检测样品中岩藻糖基化α1-酸性糖蛋白(agp)的方法,其包括以下步骤:
-提供固定于固相的,与具有根据seqidno:1的氨基酸的肽具有至少80%同一性(例如85%、90%、95%、99%或100%同一性)的单价岩藻糖结合肽(s2-肽);
-使样品与固定的岩藻糖结合肽接触;
-检测与所述岩藻糖结合肽结合的任何岩藻糖基化agp。
固相可以是在生物测定中有用的任何类型。目前优选的实施方案包括聚苯乙烯微量滴定板和具有共价连接的链霉亲和素的琼脂糖珠。其他类型的固体支持物包括凝胶基质、纤维素和硝化纤维素基质、凝胶珠、磁珠、塑料(例如聚苯乙烯)珠和平坦物质(载玻片)。可以使用标准技术将s2-肽固定于固相。
当使用由聚苯乙烯组成的固相时,可以通过本领域已知的和实施例中描述的被动吸附来固定s2-肽。s2-肽也可以可逆地固定于固相,例如通过生物素化s2-肽,也如实施例中所述,并使用具有共价连接的链霉亲和素部分的固相。
在实施例1中公开的条件下,当单价岩藻糖结合肽与具有根据seqidno:1的氨基酸的肽不为100%同一性时,优选如具有根据seqidno:1的氨基酸序列的肽对具有指示肝细胞癌的糖基化模式的岩藻糖基化agp显示出基本相同或更高的亲和力。
该方法中使用的样品优选为血浆、血清或血液样品。样品优选来自怀疑患有hcc的人个体。在适于允许样品中任选存在的岩藻糖基化agp结合s2-肽的条件下,使样品与固定在固体支持物上的s2-肽接触。在实施例中提供了示例性条件。
在一个实施方案中,对任何结合的岩藻糖基化agp的检测通过使任何结合的岩藻糖基化agp与第一检测抗体接触来进行,所述第一检测抗体能够特异性结合与所述岩藻糖结合肽结合的岩藻糖基化agp。
在一个实施方案中,通过使用显示对第一检测抗体特异性的第二检测抗体检测第一检测抗体。例如,如本领域常用的,如果第一检测抗体是在某种物种中产生的多克隆igg抗体,则第二检测抗体可以是针对来自该物种的igg抗体产生的抗体。在该实施方案中,第二检测抗体与可检测标记物缀合。
在上述实施方案中使用的可检测标记物可以是适合于所选择的测定形式的任何可检测标记物,并且包括但不限于酶和荧光团,所述酶包括辣根过氧化物酶、碱性磷酸酶和葡糖氧化酶。
在一个实施方案中,s2-肽可逆地固定于固相。然后可以通过从固相释放s2-肽并洗脱s2-肽以及与s2-肽结合的任何岩藻糖基化agp或从s2-肽释放岩藻糖基化agp来进行对任何结合的岩藻糖基化agp的检测。然后可以检测岩藻糖基化agp并任选地在洗脱液中量化。
在另一方面,本发明涉及用于评估人个体患有肝细胞癌(hcc)的风险的方法,其包括以下步骤:使用如上述的方法检测来自所述个体的样品中的岩藻糖基化agp,其中与来自未患hcc的人个体的参考浓度相比,岩藻糖基化agp浓度提高表明个体患有hcc的风险提高。
对于前述方面,样品优选是血液、血清或血浆样品。
在该方面的一个实施方案中,本发明还包括测量样品中总agp浓度和总甲胎蛋白(afp)浓度中的一种或两种。总agp和总afp的测定可从许多供应商商购获得,例如,fujirebiodiagnostics,inc.、r&dsystems,inc.、和lifespanbiosciences,inc.。与仅测量与s2-肽结合的岩藻糖基化agp相比,使用这些一种或两种另外的生物标志物的组合使得能够更好地区分一方的hcc和另一方的肝硬化和肝炎。
在另一方面,本发明涉及用于实施根据本发明的方法的成套试剂盒。这种成套试剂盒优选包含固定于固相的,与具有根据seqidno:1的氨基酸的肽具有至少80%同一性(例如85%、90%、95%、99%或100%同一性)的单价岩藻糖结合肽,和至少第一检测抗体,所述第一检测抗体能够特异性结合与所述岩藻糖结合肽结合的岩藻糖基化agp。
第一检测抗体可以与可检测标记物缀合,或者试剂盒可包含能够特异性结合第一检测抗体的第二检测抗体,并且其中第二检测抗体与可检测标记物缀合。可检测标记物如上所述。
在一个实施方案中,用于检测样品中的岩藻糖基化α1-酸性糖蛋白(agp)的方法实施在反向elisa中。
elisa(酶联免疫吸附测定)是用于从分析混合物(例如血清)中检测和定量组分的公知方法,并且首次描述于1971年。从那时起,该方法得到了进一步发展并得到了广泛的应用。除直接elisa外,常用的有三种变形;间接elisa、夹层elisa和竞争性elisa。有关elisa分析和标准方案的大量公开,可以访问网站elisaencyclopedia(http://www.elisa-antibody.com/)。
通常,elisa分析包括以下步骤。在整个elisa程序期间的所有洗涤步骤都用缓冲溶液完成。缓冲溶液优选是包含吐温的磷酸盐缓冲盐溶液(pbst)。
固体支持物制备:通过将抗原或捕获抗体被动吸附到固体支持物上来涂覆固体支持物。固体的材料通常是聚苯乙烯,并且通常使用聚苯乙烯的管或微量滴定板。优选使用96孔微量滴定板(微孔板)。
通过被动吸附到聚苯乙烯表面将抗原或抗体固定到固体支持物上。这通常在延长的时间段内进行,例如在4℃下过夜。碱性条件对于固定步骤是优选的,但是在某些应用中ph7的涂层可能是可接受的。在固定步骤之后,洗涤固体支持物并且通常用蛋白质封闭以抑制可影响分析的任何其他未知分子固定到固体支持物上。通常通过在磷酸盐缓冲盐(pbs)溶液中使用牛血清白蛋白(bsa)来进行封闭。封闭后,洗涤固体支持物。
测定程序:将待测试的液体形式的样品添加至固体支持物,然后孵育。对固定在固体支持物上的抗原或捕获抗体具有亲和力或特异性的任何抗体或抗原都将与其结合。除去液体样品,洗涤固体支持物以除去任何未结合的分子。
此后,加入至少一种检测抗体,其可以是多克隆的或单克隆的。其可以是与来自测试样品的抗原结合的第一检测抗体,随后是针对第一检测抗体的第二检测酶缀合的抗体。如果来自测试样品的抗体与固体支持物上的抗原结合,则可以直接添加酶缀合的第二检测抗体用于检测。
作为第二检测抗体,通常使用igg免疫球蛋白,其对来自样品的抗体或对第一检测抗体具有特异性。例如,如果第一检测抗体来自兔,则第二检测抗体是抗兔。该第二检测抗体具有与其缀合的酶。为此目的已经使用了许多酶,包括碱性磷酸酶(ap)、辣根过氧化物酶(hrp)、葡糖氧化酶和对硝基苯磷酸酶。使用戊二醛偶联方法用过氧化物酶制备可商业获得的缀合物。然而,代替抗体,第二试剂可以涉及可以特异性结合抗原并且与酶缀合的任何其他分子,只要其适合用于elisa分析即可。这可以例如是荧光团。
在添加抗体后,在添加第一和第二检测抗体之间,再次洗涤固体支持物。
然后加入底物溶液,使固体载体孵育一段时间。底物将使酶产生有色反应产物。所需时间取决于为检测选择的酶和底物组合。
可用于使上述酶产生有色反应产物的底物根据所用的酶而不同。4-硝基苯磷酸盐是ap常用的底物。通常使用的用于hrp的底物是5-氨基水杨酸、3,3′-二氨基联苯胺、2,2′-氮杂双[3-乙基苯并噻唑啉-6-磺酸二铵盐、邻苯二胺二盐酸盐、3,3′.5.5′-三甲基联苯胺。与对硝基苯磷酸酶一起使用的底物通常是对硝基苯磷酸二钠。
经过所需的一段时间后,加入终止溶液以停止反应。此后,立即通过分光光度法测量来自产物的透射光强度或光密度来检测有色反应产物的测量。读数优选用酶标仪完成。取决于所用的酶和底物,反应产物的检测可以是发色的、化学荧光的或化学荧光的。
底物是可商业获得的,并且本领域技术人员可以根据与检测抗体缀合的酶容易地制备底物溶液。微孔板读取器也可容易地商业获得。
结果的计算:使用包括在分析中的平均零标准吸光度,计算每个孔或管的平均吸光度。将平均吸光度绘制在针对浓度的标准曲线中。
本发明人已经构建了标准elisa,其中第一检测抗体已固定在微板上,作为抗原检测剂(参见图1a)。使用的第一检测抗体是针对人血浆来源的α1-酸性糖蛋白(agp)的抗体。此后,将固体支持物与患者血浆样品一起孵育。然后将患者血浆样品中存在的任何α1-酸性糖蛋白与第一检测抗体结合。此后,加入与生物素缀合的单价岩藻糖结合肽。使用与碱性磷酸酶偶联的链霉亲和素作为酶和tris缓冲液中的pnpp底物用于检测,生物素缀合的岩藻糖结合肽将结合并检测任何岩藻糖基化agp(参见图1a)。
然而,该标准elisa未提供令人满意的信号与背景比。
因此,发明人开发了根据本发明的方法,其中一个优选实施例在图1b的上图中示意性地公开,其中信噪比得到显著改善。这可以通过分别比较图1a和图1b的下图中提供的结果看出。不是将针对人血浆来源的agp的抗体固定在固体支持物上,而是将s2-肽固定在固体支持物上。通过这样做,当所述支持物与患者血浆样品一起孵育时,仅岩藻糖基化蛋白会与固体支持物结合。此后,添加针对人血浆来源的agp的第一检测抗体,使得第一检测抗体结合与吸附在固体支持物上的s2-肽结合的任何agp。最后,为了能够检测与s2-肽结合的agp,添加针对第一检测抗体的hrp-缀合的第二检测抗体。此后,进行检测,作为elisa分析的标准程序。该模型称为s2反向elisa。
在一个方面,本发明涉及产生抗体的方法,其特征在于由与seqidno:3的氨基酸序列具有至少83%(例如88%、94%或100%)同一性的氨基酸序列组成的肽用作免疫原。此类抗体显示对位于人agp的c末端部分中的表位的特异性,并且可用作根据本发明的方法和成套试剂盒中的第一检测抗体。
在一个方面,本发明还涉及由与根据seqidno:3的氨基酸序列具有至少83%(例如88%、94%或100%)同一性的氨基酸序列组成的肽,并涉及其在产生抗体中作为免疫抗原的用途。
在本申请的方法中产生和使用的抗体可以是单克隆抗体或多克隆抗体。
单克隆抗体代表识别抗原内单个表位的抗体群。其通常由免疫哺乳动物的单个b细胞产生,从而产生抗体克隆群,彼此相同并且都识别特定抗原的相同表位。
用目的抗原免疫哺乳动物,使哺乳动物产生针对所述抗原的抗体。然后进行二次和三次注射以增强免疫应答并产生针对特定免疫抗原的更高滴度的抗体。哺乳动物可以是例如兔子、小鼠、大鼠、豚鼠、仓鼠、绵羊、山羊或马。注射后,从脾中收集血液,分离产生抗体的b细胞。尽管b细胞可用于收获抗体,但缺点是这些细胞具有有限的寿命并最终将停止产生抗体。
通过将产生特异性抗体的b细胞与骨髓瘤细胞融合,形成杂交瘤细胞,从而可以克服b细胞的有限寿命。b细胞和骨髓瘤细胞的融合可以通过使用聚乙二醇、病毒或通过包含两种细胞类型的细胞培养物的电穿孔来完成。融合后,必须进行选择杂交瘤。这是通过使用hgprt(次黄嘌呤-鸟嘌呤磷酸核糖基转移酶),一种参与次黄嘌呤核苷酸合成的酶来完成的。骨髓瘤细胞是hgprt-,b细胞是hgprt+。培养物在hat(次黄嘌呤-氨蝶呤-胸腺嘧啶)培养基中生长,其仅能维持hgprt+细胞。与另一个骨髓瘤细胞融合或者不融合的骨髓瘤细胞在hat培养基中全部死亡,因为其是hgprt-。与另一个b细胞融合或不融合的b细胞全部死亡,因为其没有无限分裂的能力。只有b细胞和骨髓瘤细胞之间的杂交瘤存活,既是hgprt+又是癌性的。
来自所用哺乳动物的b细胞的初始收集物是异源的,即其不都产生相同的抗体。因此,杂交瘤群体不产生单一抗体。因此,每种杂交瘤用本领域熟知的方法培养和筛选,并且是本领域技术人员熟悉的。一旦检测到产生正确抗体的特定杂交瘤,永生化b细胞-骨髓瘤杂交瘤可以提供恒定供应的高度特异性单克隆抗体。由于单克隆抗体仅识别一个表位,因此其通常与非特异性抗原具有低交叉反应性。
多克隆抗体代表从复数个已被一个单一免疫动物的免疫应答活化的b细胞克隆收集的抗体群。传统上,向哺乳动物(例如山羊、绵羊、小鼠或兔)注射特异性目标抗原,其引发初次免疫应答。然后进行二次和三次注射,产生针对特定免疫抗原的更高滴度的抗体。从哺乳动物收集含有抗体的血清,并且通常进行亲和纯化,以富集针对所述抗原产生的抗体。该方法导致产生针对目标抗原的所有表位的高滴度、高亲和力多克隆抗体。例如,marliesleenaars及其同事19已经描述了多克隆抗体的产生。
实施例
包括以下实施例以进一步举例说明本发明,其不应解释为限制本发明的范围,本发明的范围是所附权利要求的范围。
实施例1,标准elisa和反向elisa的比较
患者样品
来自一名hcc患者和两名肝硬化患者的血浆样品获自huddinge,sweden的karolinska大学医院。正常对照是来自健康血液供体的血浆库。阳性对照是dsagp,浓度为2μg/ml。
抗体产生
通过agrisera抗体(
标准凝集素elisa
将微量滴定板(maxisorp,nunc)用在0.05m碳酸盐-碳酸氢盐缓冲液(ph9.6)(medicago)中的10μg/ml的抗体058涂覆,在4℃过夜。用pbs(medicago)中的3%bsa封闭孔1小时。将板用pbs+0.05%吐温20(pbst)洗涤3次,然后加入在含有1%bsa的pbs中1∶50稀释的患者血浆样品,并以200rpm振荡孵育1小时。如上所述洗涤孔后,添加在含有1%bsa的pbs中的0.25μg/ml的生物素化s2-肽,并在室温(rt)下温和振荡孵育1小时。使用碱性磷酸酶缀合的extravidine和pnpp底物(sigma-aldrich)检测结合的s2-肽。30分钟后使用versamax酶标仪(moleculardevicescorporation)在490nm下测量结合的s2-肽的量。
反向s2-elisa
将微量滴定板(maxisorp,nunc)用在0.05m碳酸盐-碳酸氢盐缓冲液(ph9.6)(medicago)中的10μg/ml的抗体058涂覆,在4℃过夜。用pbs(medicago)中的3%bsa封闭孔1小时。将板用pbs+0.05%吐温20(pbst)洗涤3次,然后加入在含有1%bsa的pbs中1∶50稀释的患者血浆样品,并以200rpm振荡孵育1小时。如上所述洗涤孔后,加入在含有1%bsa的pbs中的1μg/ml的兔抗人α1-酸性糖蛋白058,并在室温(rt)下温和摇动孵育1小时。使用辣根过氧化物酶缀合的山羊抗兔igg(jacksonimmunoresearchlaboratories,westgrove,pa)和o-苯二胺二盐酸盐底物(sigma-aldrich)检测结合的抗人α1-酸性糖蛋白。30分钟后加入25μl/孔的1mh2so4终止反应,并使用versamax酶标仪(moleculardevicescorporation)在490nm处测量结合的抗agp的量。
结果
标准elisa的结果显示在图1a中,而反向elisa显示在图1b中。与标准elisa相比,反向elisa显示更高的信号强度。标准elisa中hcc样品和阳性对照样品的信号与背景比分别为1.05和1.38,而相同hcc样品和相同阳性对照的信噪比分别提高到5.1和5.2(图1)。
实施例2,检测抗体的比较
患者样品
对来自一名患有hcc的患者、一名患有肝硬化的患者、一名患有肝炎的患者和来自健康血液供体的血浆库(正常)的血浆样品进行分析。
测定
反向s2-elisa(如上所示)用于比较商业抗agp抗体与ab-058。根据以下列表将058抗体(图2中的样品12)与多种商业多克隆或单克隆抗agp抗体进行比较。
检测抗体
使用以下抗体进行检测。
1.人α1-酸性糖蛋白抗体(r&dsystems,产品号af3694)
·来源:多克隆山羊igg
·免疫原:人血浆来源的α1-酸性糖蛋白
2.人α1-酸性糖蛋白抗体(agp-1/2,santacruzbiotechnology,产品号sc-51018)
·来源:多克隆山羊igg
·免疫原:人源agp-1内部区域内的肽图谱
3.orm1多克隆抗体、人和小鼠规格(proteintech,产品号16439-1-ap)
·来源:多克隆兔igg
·免疫原:ag9758,血清类黏蛋白1
4.orm2多克隆抗体、人规格(proteintech,产品号11199-1-ap)
·来源:多克隆兔igg
·免疫原:ag1667,血清类黏蛋白2
5.anti-orm1/血清类黏蛋白抗体(lsbio,产品号ls-c292722)
·来源:多克隆兔igg
·免疫原:大肠杆菌(e.coli)中产生的重组人α1-agp(aa19-201)
6.人α1-酸性糖蛋白抗体(agp-1(29a1),产品号sc-69753)
·来源:单克隆鼠igg
·免疫原:人源的纯化的α1-agp
7.单克隆抗-orm1抗体,克隆2f9-1f10(sigma,产品号wh0005004m1-100μg)
·来源:单克隆鼠igg
·免疫原:orm1(aah26238,18a.a.-202a.a.)全长重组蛋白与gst标签
8.orm1单克隆抗体、人规格(proteintech,产品号66097-1-ig)
·来源:单克隆鼠igg
·免疫原:ag19248,血清类黏蛋白1α
9.人α1-酸性糖蛋白抗体(thermoscientific,产品号pa1-9530)
·来源:多克隆鸡igy
·免疫原:对应于人α1-酸性糖蛋白的残基149-160和190-201的合成肽的混合物
10.人α1-酸性糖蛋白抗体(sigma,产品号a-0534)
·来源:多克隆兔igg
免疫原:纯化的人α1-酸性糖蛋白
11.人α1-酸性糖蛋白抗体(dako,产品号q0326)
·来源:多克隆兔igg
·免疫原:纯化的人α1-酸性糖蛋白
12.人α1-酸性糖蛋白,亲和力纯化的#058(agrisera)
·来源:多克隆兔igg
·免疫原:对应于aa183-201的合成肽cep19
结果
结果显示在图2中。这些结果表明,不同的检测抗体在区分hcc与非hcc样品中的信号与背景比和性能方面不同。只有058抗体(第12号)和来自r&dsystems的多克隆igg抗体(第1号),以及在较小程度上来自thermoscientific的多克隆igy抗体(第9号),显示出区分hcc样品与非hcc样品的选择性,而其他抗体没有显示出这种选择性。然而,与来自r&dsystems的多克隆igg抗体相比,058抗体显示出稍微更好的信号背景比。
据推测,测定中第1、9和12号的主要检测抗体针对位于agp的未糖基化c-末端部分的表位具有亲和力。当具有指示肝细胞癌的糖基化模式的agp与s2-肽结合时,该表位可用于结合,但当agp具有源自肝硬化、肝炎或源于来自未受hcc、肝硬化或肝炎影响的个体的正常糖基化模式的糖基化模式时,该表位不达到相同可用程度。此外,与058相比,几种测试抗体显示高背景染色,表明抗体直接与包被的s2非特异性结合,这限制了其在反向s2-elisa中的用途。
实施例3,使用纯化的agp样品验证反向s2-elisa。
agp的纯化
根据asao等20,使用两步离子交换色谱法从血浆样品中分离agp。将1ml血浆样品应用于用ph4的20mm柠檬酸盐-磷酸盐缓冲液平衡的hitrap脱盐柱(gehealthcare,uppsala,sweden)。将脱盐峰应用于用ph4的20mm柠檬酸盐-磷酸盐缓冲液平衡的hitrapdeae柱(gehealthcare)。含有agp的级分用含有200mmnacl的ph7的20mm柠檬酸盐-磷酸盐缓冲液洗脱,合并并施加到用ph4的20mm柠檬酸盐-磷酸盐缓冲液平衡的两个连接的hitrap脱盐柱上。将脱盐峰应用于用ph4的20mm柠檬酸盐-磷酸盐缓冲液平衡的hitrapsp柱(gehealthcare),并用ph4.8的20mm柠檬酸盐-磷酸盐缓冲液洗脱agp。将洗脱的级分对水透析并冻干。
产生多克隆抗人α1-酸性糖蛋白058
如实施例1中所述,通过agrisera抗体(
产生脱唾液酸化agp(dsagp)
将agp(1.7mg,sigma)溶于0.3ml50mm乙酸钠缓冲液(ph5.5)中。加入神经氨酸酶(60mu,产气荚膜梭菌(clostridiumperfringens),v型,sigma),将样品在37℃下孵育4小时。使用5ml柱(nhs活化的hightrap,amershambiosciences)上的亲和层析,用5mg固定的抗agp抗体(dako,a0011)纯化脱唾液酸化agp。在aktaprime设备(gehealthcare)上进行色谱。用ph7.4的pbs(medicago,uppsala,sweden)将样品稀释至1.3ml并注射到柱上。用pbs洗涤20分钟(流速5ml/分钟)后,用ph2.5的0.1m甘氨酸-hcl缓冲液洗脱dsagp。通过260nm处的uv吸光度监测洗脱。合并阳性级分并对2lmilli-q水的三次变化透析。然后将透析的dsagp冻干。
从血浆样品中富集s2结合糖蛋白和aal结合糖蛋白
根据制造商的方案,使用ez-linksulfonh-lc生物素化试剂盒(pierce,ockford,il,usa)将s2-肽和重组aal进行生物素化。每个蛋白质样品使用5摩尔倍过量的生物素试剂进行生物素化。使用haba/抗生物素蛋白测定法确定并以每个s2分子1个生物素部分和每个aal分子2个生物素部分计算生物素/蛋白质比。ezviewredstreptavidinaffinitygel(sigma-aldrich,saintlouis,mo,usa)用于根据制造商的方案从血浆样品中富集s2结合糖蛋白和aal结合糖蛋白。简言之,将用ph7.4的磷酸盐缓冲盐水(pbs)(medicago,uppsala,sweden)平衡的20μlezviewredstreptavidin亲和凝胶与10μgs2或aal混合,并在室温下孵育1小时。将凝集素凝胶用pbs洗涤一次,用pbs中的3%牛血清白蛋白(bsa)(sigma-aldrich)洗涤一次,用pbs洗涤三次,然后加入1μl血浆样品。孵育1小时后,洗涤凝集素-凝胶并与laemmli样品缓冲液(bio-rad,hercules,ca,usa)混合。在变性条件下,在梯度(4-20%)mini-proteantgx凝胶(bio-rad)上分离富集的糖蛋白,并转移至pvdf膜用于western印迹分析。将膜用pbs中的3%bsa封闭1小时,并与pbs中3%bsa中1μg/ml的兔抗人酸性糖蛋白058孵育,然后在pbs中的1%bsa中以1∶20000稀释山羊抗兔igghrp缀合的抗体。ecl底物(gehealthcare,buckinghamshire,uk)用于检测富集的agp。
反向s2-elisa
将微量滴定板(maxisorp,nunc)用在0.05m碳酸盐-碳酸氢盐缓冲液(ph9.6)(medicago)中的5μg/ml的s2-肽涂覆,在4℃过夜。用pbs(medicago)中的3%bsa封闭孔1小时。将板用pbs+0.05%吐温20(pbst)洗涤3次,然后加入在含有1%bsa的pbs中稀释的纯化的agp样品,并以200rpm振荡孵育1小时。如上所述洗涤孔后,加入在pbs中的1%bsa的1μg/ml的兔抗人α1-酸性糖蛋白058,并在室温(rt)下温和振荡孵育1小时。使用辣根过氧化物酶缀合的山羊抗兔igg(jacksonimmunoresearchlaboratories,westgrove,pa)和o-苯二胺二盐酸盐底物(sigma-aldrich)检测结合的抗人α1-酸性糖蛋白。30分钟后加入25μl/孔的1mh2so4终止反应,并使用versamax酶标仪(moleculardevicescorporation)在490nm处测量结合的抗agp的量。
结果
如上所述,重组全长橙黄网孢盘菌凝集素(aal)与琼脂糖珠结合并用于捕获来自4名hcc患者、4名肝硬化患者、2名慢性肝炎患者和来自正常血浆库的血浆样品中的岩藻糖基化糖型。使用抗体058通过蛋白质印迹分析捕获的糖蛋白。
在所有患者样品和正常对照中检测agp。然而,与肝炎样品和正常对照相比,在来自hcc患者和肝硬化样品的样品中检测到更多aal结合的agp。肝硬化和hcc样品之间aal结合agp的量之间没有明显差异。(图3,上图)。
当s2-肽用于富集来自相同样品的血浆糖蛋白时,在正常样品和肝炎样品中几乎没有或没有可见的agp染色。此外,与天然aal形成对比,与肝硬化样品相比,s2在hcc样品中结合更多的agp。肝硬化样品显示s2结合的agp没有染色或中度染色,而来自hcc患者的所有样品显示s2结合的agp染色,表明s2可能对hcc糖基化更具特异性(图3,下图)。
如上所述从一名hcc患者、一名肝硬化患者和从正常库中纯化agp,并使用反向s2-elisa测量agp的结合。将s2-肽涂覆到微量滴定孔中,并使用如上所述的058抗体测量纯化的agp样品的提高浓度。
来自所有三个样品的信号呈剂量依赖性提高。然而,从正常库中分离的agp在反向s2-elisa中显示出非常低的吸光度值,与凝集素沉淀数据一致。来自肝硬化患者的样品显示中等吸光度值,而从hcc患者(hcc-agp)纯化的agp显示高吸光度值。因此,分析表明反向s2-elisa可以特异性地检测不同样品之间的糖基化差异(图4a)。
使用添加纯化的hcc-agp的正常血浆样品进一步验证反向s2-elisa以评估基质效应。使用1∶50的正常血浆样品的血浆稀释液,背景信号与对照样品相同,其中从测定中忽略血浆(od=0.2)。这表明基本上没有来自正常血浆样品的agp与s2-肽结合。以提高的浓度向正常血浆样品中添加hcc-agp显示吸光度的剂量依赖性提高,其与没有添加血浆的样品中观察到的吸光度的提高相关。这表明在血浆样品中可以精确测量s2结合agp的提高(图4b)。
为了在反向凝集素测定中优化s2的涂层浓度和第一和第二检测抗体的稀释,使用不同的涂层和抗体浓度测量hcc-血浆样品和正常样品(背景)的吸光度值。发现涂层浓度为5μg/mls2,第一检测抗体浓度为1∶200,第二检测抗体浓度为1∶40000,使得得到超过10的最佳信号与背景比(数据未显示)。
使用脱唾液酸化形式的agp(dsagp)构建标准曲线。与正常唾液酸化形式的agp相反,s2会对dsagp上暴露的末端lex结构具有亲和力。尽管dsagp不能反映患者样本中s2结合形式的agp,但其可用于关联在反向凝集素测定中获得的吸光度值(图4c)。
通过在同一平板(96孔)上重复分析dsagp样品来确定测定的测定内精确度。测定内变异的变异系数(cv)为1.2%(未显示)。
通过分析在三个不同平板上具有中等和高吸光度值的两种hcc样品来确定测定间变异性。hcc(中等)和hcc(高)的cv分别为2.8%和5.0%(未显示)。
实施例4,使用患者样品验证反向s2-elisa。
患者样品
来自32名肝硬化患者、28名hcc患者和来自32名慢性肝炎患者的血浆样品的血浆样品被包括在该研究中。在治疗前收集所有包括的hcc样品(索拉非尼治疗<1个月)。5例hcc样本来自复发性hcc患者。肝硬化患者在取样后6个月均未出现任何hcc迹象。肝炎患者确定为非肝硬化。将来自没有肝病迹象的血液供体的血清池组成的正常样品用作对照。
所有患者均获得书面同意,该研究得到了林雪平大学和卡罗琳斯卡医学院伦理委员会的批准。
反向s2-elisa
如上所述使用在含有1%bsa的pbs中1∶50稀释的血浆样品进行反向s2-elisa。
总afp和agp分析
总afp浓度在林雪平大学医院的临床常规实验室中使用cobase602分析仪(rochediagnostics,rotkreuz.switzerland)和总agp浓度在卡尔马县医院的临床常规实验室中使用balprospec系统(siemens,erlangen,germany)测定。
统计分析
所有统计分析均使用ibmspss23进行。使用anova中的tukey多重比较检验确定组间的统计学差异。二项逻辑回归用于评估多个标志物的组合。p值<0.05被定义为具有统计学意义。用graphpadprism5(lajolla,ca)产生接收器操作特性(roc)曲线和柱散点图。
结果
反向s2-elisa用于测定来自肝炎患者、肝硬化患者和hcc患者的患者血清中的s2结合agp。与来自肝炎患者(p=0.001)和肝硬化患者(p=0.005)的血浆相比,来自hcc患者的血浆中s2结合的agp显著提高。当比较肝硬化患者与肝炎患者时,s2结合的agp水平没有显著提高(图5a)。
在反向s2-elisa设置中,患者样品中agp浓度的变化可能潜在地影响检测到的糖基化变化。因此,在所有样品中测量agp的浓度。agp浓度显示从0.3mg/ml至3.9mg/ml的变化。hcc和肝炎样品(p=0.008)之间以及hcc和肝硬化样品(p=0.02)之间agp浓度显著提高,但肝硬化和肝炎患者之间agp浓度无显著差异(图5b)。然而,s2结合的agp信号和agp浓度之间没有相关性(图6),表明agp中的浓度差异不影响反向s2-elisa的诊断性能。
为了比较,还在样品中测量afp水平。hcc患者的afp平均值为5581ng/ml,与之相比,肝硬化和肝炎患者的平均值分别为4ng/ml和6ng/ml。然而,未发现这些差异是显著的(p=0.1,图5c)。
进行了接收者操作特性(roc)分析以确定每个标志物的总体性能以区分不同的患者群体。当将hcc与肝炎区分开时,s2-结合的agp的曲线下面积(auc)为0.94。hcc与肝硬化的分化给出0.77的auc(表1)。afp具有与s2结合的agp相似的表现,hcc和肝硬化的分化的auc为0.77,hcc和肝炎的分化的auc为0.82(表1)。agp浓度的roc分析显示,agp浓度本身在区分hcc与肝炎(auc0.66)和hcc与肝硬化(auc0.65)方面表现不佳。
由于在比较hcc患者与肝硬化患者时,s2结合的agp、总afp和总agp的平均值提高,使用逻辑回归分析使用任意两个或所有三个标志物的组合进一步分析这些标志物的表现。所有三种标志物的组合显示hcc和肝硬化之间(auc为0.86),以及hcc和肝炎之间(auc为0.95)的最佳分化(表1)。s2-结合的agp与afp的组合以及s2-结合的agp与agp的组合也提供比单独使用的任何标志物更好的性能(表1)。
表1.roc-分析(hcc与肝炎以及肝硬化)
参考文献
1.marreroja.hepatocellularcarcinoma.curropingastroenterol.2006;22:248-253.
2.perzjf,armstronggl,farringtonla,hutinyj,bellbp.thecontributionsofhepatitisbvirusandhepatitiscvirusinfectionstocirrhosisandprimarylivercancerworldwide.jhepatol.2006;45:529-538.
3.sarbahsa,gramlicht,younoszaia,etal.riskfactorsforhepatocellularcarcinomainpatientswithcirrhosis.digdissci.2004;49:850-853.
4.ertlejm,heiderd,wichertm,etal.acombinationofalpha-fetoproteinanddes-gamma-carboxyprothrombinissuperiorindetectionofhepatocellularcarcinoma.digestion.2013;87:121-131.
5.bruixj,shermanm,americanassociationforthestudyofliverd.managementofhepatocellularcarcinoma:anupdate.hepatology.2011;53:1020-1022.
6.singala,volkml,waljeea,etal.meta-analysis:surveillancewithultrasoundforearly-stagehepatocellularcarcinomainpatientswithcirrhosis.alimentpharmacolther.2009;30:37-47.
7.nakagawat,miyoshie,yakushijint,etal.glycomicanalysisofalpha-fetoproteinl3inhepatomacelllinesandhepatocellularcarcinomapatients.jproteomeres.2008;7:2222-2233.
8.ahnyh,shinpm,kimys,etal.quantitativeanalysisofaberrantproteinglycosylationinlivercancerplasmabyaal-enrichmentandmrmmassspectrometry.analyst.2013;138:6454-6462.
9.comunalema,rodemich-beteshl,hafnerj,etal.linkagespecificfucosylationofalpha-1-antitrypsininlivercirrhosisandcancerpatients:implicationsforabiomarkerofhepatocellularcarcinoma.plosone.2010;5:e12419.
10.comunalema,wangm,hafnerj,etal.identificationanddevelopmentoffucosylatedglycoproteinsasbiomarkersofprimaryhepatocellularcarcinoma.jproteomeres.2009;8:595-602.
11.naitoha,aoyagiy,asakurah.highlyenhancedfucosylationofserumglycoproteinsinpatientswithhepatocellularcarcinoma.jgastroenterolhepatol.1999;14:436-445.
12.tanabek,deguchia,higashim,etal.outerarmfucosylationofn-glycansincreasesinseraofhepatocrllularcarcinomapatients.biochembiophysrescommun.2008;374:219-225.
13.wangm,longre,comunalema,etal.novelfucosylatedbiomarkersfortheearlydetectionofhepatocellularcarcinoma.cancerepidemiolbiomarkersprev.2009;18:1914-1921.
14.asazawah,kamaday,takeday,etal.serumfucosylatedhaptoglobininchronicliverdiseasesasapotentialbiomarkerofhepatocellularcarcinomadevelopment.clinchemlabmed.2015;53:95-102.
15.comunalema,wangm,anbarasann,etal,totalserumglycananalysisissuperiortolectin-flisafortheearlydetectionofhepatocellularcarcinoma.proteomicsclinappl.2013;7:690-700.
16.wimmerovam,mitchelle,sanchezjf,gautierc,lmbertya.crystalstructureoffungallectin:six-bladedbeta-propellerfoldandnovelfucoserecognitionmodeforaleuriaaurantialectin.jbiolchem.2003;278:27059-27067.
17.olaussonj,astrome,jonssonbh,tibellla,pahlssonp.productionandcharacterizationofamonomericformandasingle-siteformofaleuriaaurantialectin.glycobiology.2011;21:34-44.
18.
19.p.p.a.marliesleenaars,etal.,“theproductionofpolyclonalantibodiesinlaboratoryanimals:thereportandrecommendationsofecvamworkshop35”,atla27,79-102,1999.
20.asaot,yazawas,nishimurat,etal.developmentofanovelsystemformassspectrometricanalysisofcancer-associatedfucosylationinplasmaalphal-acidglycoprotein.biomedresint.2013;2013:834790.
序列表
<110>glycobondab
<120>新结合测定
<130>p41600692pct00
<150>se1650619-8
<151>2016-05-09
<160>3
<170>patentin版本3.5
<210>1
<211>114
<212>prt
<213>人工序列
<220>
<223>来自橙黄网孢盘菌(a.aurantia)凝集素的凝集素结合位点2
<400>1
serhismetserglnasnvalileglyglualalysleupheserpro
151015
leualaalavalthrtrplysseralaglnglyileglnileargval
202530
tyrcysvalasnlysaspasnileleusergluphevaltyraspgly
354045
serlystrpilethrglyglnleuglyservalglyvallysvalgly
505560
serasnserlysleualaalaleuglntrpglyglysergluserala
65707580
proproasnileargvaltyrtyrglnlysserasnglyserglyser
859095
serilehisglutyrvaltrpserglylystrpthralaglyalaser
100105110
phegly
<210>2
<211>201
<212>prt
<213>智人(homosapiens)
<220>
<221>信号
<222>(1)..(19)
<400>2
metalaleusertrpvalleuthrvalleuserleuleuproleuleu
151015
glualaglnileproleucysalaasnleuvalprovalproilethr
202530
asnalathrleuaspglnilethrglylystrpphetyrilealaser
354045
alapheargasngluglutyrasnlysservalglngluileglnala
505560
thrphephetyrphethrproasnlysthrgluaspthrilepheleu
65707580
argglutyrglnthrargglnaspglncysiletyrasnthrthrtyr
859095
leuasnvalglnarggluasnglythrileserargtyrvalglygly
100105110
glngluhisphealahisleuleuileleuargaspthrlysthrtyr
115120125
metleualapheaspvalasnaspglulysasntrpglyleuserval
130135140
tyralaasplysprogluthrthrlysgluglnleuglygluphetyr
145150155160
glualaleuaspcysleuargileprolysseraspvalvaltyrthr
165170175
asptrplyslysasplyscysgluproleuglulysglnhisglulys
180185190
gluarglysglnglugluglygluser
195200
<210>3
<211>19
<212>prt
<213>人工序列
<220>
<223>agp的第183至201位氨基酸
<400>3
cysgluproleuglulysglnhisglulysgluarglysglngluglu
151015
glygluser
- 还没有人留言评论。精彩留言会获得点赞!