一种管花肉苁蓉中苯乙醇苷类化合物萃取分离的评价方法与流程
本发明涉及一种管花肉苁蓉中苯乙醇苷类化合物萃取分离的新评价方法。
背景技术
管花肉苁蓉cistanchetubulosa(schenk)r.wight为列当科植物,是中亚地区及新疆特有药用植物,新疆主要分布于南疆的塔克拉玛干沙漠边缘地区。作为药用已有千年历史,记载于《神农本草经》,收载于《中华人民共和国药典》。用于补肾阳、益精血、润肠通便、增强体力和免疫力、延缓衰老等。近年来研究发现管花肉苁蓉中的主要物质苯乙醇苷类(phenylethanoidglycosides,phgs)化合物在神经保护和延缓神经退行性疾病方面有良好的开发前景,成为研究的热点。其中松果菊苷和毛蕊花糖苷作为主要的化合物,得到了广泛的研究,但因得到高含量的化合物,成本较高,开发受到了限制。项目组前期通过柱色谱技术制备得到高纯度的化合物,但对设备和操作技术要求高,难以实现工业化。
液-液萃取技术是一种最常规的分离方法,根据物质对水的亲疏性不同,通过适当的处理将物质从水相中萃取到有机相,最终达到分离的目的。液-液萃取常用于样品中被测物质与基质的分离,在两种不相容液体或相之间通过分配对样品进行分离而达到被测物质纯化和消除干扰物质的目的。在大部分情况下,一种液相是水溶剂,另一种液相是有机溶剂。可通过选择两种不相容的液体控制萃取过程的选择性和分离效率。在水和有机相中,亲水化合物的亲水性越强,憎水性化合物将进入有机相中的程度就越大。溶剂萃取技术是一种比较节能和简单的方法。操作条件比较宽松,该技术与其他分离技术相比较,可以减少耗能、设备操作简单、收率比较高、处理能力比较强,分离结果比较令人满意。萃取的实质就是发生在两相之间的传质过程,它与两液相间的平衡关系有着紧密的联系
为了简单、高效地获得管花肉苁蓉中苯乙醇苷类化合物松果菊苷和毛蕊花糖苷,本发明利用松果菊苷和毛蕊花糖苷在不同溶剂中的溶解性不同,采用溶剂萃取法,以三元体系结合指纹图谱评价萃取效果,来优化工艺参数。目前,尚未见有该方面的报道。
液-液相平衡数据是进行萃取流程设计和设备计算的重要参数,是评估萃取工艺可行性的基础数据。本文分别建立三元体系正丁醇-苯乙醇苷类化合物-水的指纹图谱,考察不同萃取条件下,计算了正丁醇-毛蕊花糖苷-水的选择性系数和分配系数,并采用三角形相图表示相平衡关系,考察各体系指纹图谱色谱峰的相对峰面积对已知化合物松果菊苷和毛蕊花糖苷的影响和分配系数的影响,评估萃取工艺的可行性;并测定其液液平衡数据,从而获得萃取分离松果菊苷和毛蕊花糖苷所需的基本数据。
技术实现要素:
本发明目的在于,提供一种管花肉苁蓉中苯乙醇苷类化合物萃取分离的评价方法,该方法以毛蕊花糖苷、松果菊苷为参照,分别建立正丁醇-苯乙醇苷类化合物-水三元体系的指纹图谱,考察不同萃取条件下,有机相和水相指纹图谱色谱峰峰数和相对峰面积对已知化合物毛蕊花糖苷的影响和分配系数,从而获得萃取分离毛蕊花糖苷的基本参数,评估萃取工艺的可行性。
本发明所述的一种管花肉苁蓉中毛蕊花糖苷萃取分离的评价方法,该评价方法以毛蕊花糖苷、松果菊苷为参照,利用正丁醇-毛蕊花糖苷-水三元体系,采用高效液相色谱法分别建立水相和有机相的指纹图谱,具体操作按下列步骤进行:
a、供试品制备:取管花肉苁蓉浸膏细粉1g,精密称定,置于100ml容量瓶中,加30ml温水溶解,放冷,加水定容至刻度,摇匀,过滤,稀释定容,0.45μm微孔滤膜过滤,取续滤液作为供试品溶液;
b、萃取溶液制备:取管花肉苁蓉浸膏粉5g,精密称定,置于已称重的50ml容量瓶中,精密称定,加入30ml温水溶解,放冷,加水定容至刻度,称重,摇匀后倒入温度50℃恒温夹套烧杯中,精密量取50ml正丁醇于已称重的容量瓶中,精密称定,100r/min磁力搅拌30min,静置2h,分离正丁醇层和水层,分别取正丁醇层和水层各1ml,置于已称重的容量瓶中,精密称定,甲醇稀释定容,0.45μm微孔滤膜过滤,取续滤液;
c、对照品溶液的制备:分别取毛蕊花糖苷、松果菊苷对照品各10mg,精密称定,分别加体积浓度为50%甲醇制成每1ml含毛蕊花糖苷、松果菊苷各0.2mg的溶液,0.45μm微孔滤膜过滤,取续滤液作为对照品溶液;
d、测定:分别精密吸取步骤c对照品溶液与步骤a供试品溶液各10μl,注入高效液相色谱仪,色谱条件为:以十八烷基硅烷键合硅胶为填充剂,以甲醇为流动相a,以含0.2%甲酸溶液为流动相b,梯度洗脱,流动相a、b的比例变化为:0-10min,a相20%,b相80%;10-40min,a相35%,b相65%;40-60min,a相44%,b相56%;流速1.0ml·min-1,柱温35℃,采用二极管阵列检测器,理论塔板数按毛蕊花糖苷峰计算应不低于5000,记录60分钟内的色谱图,用指纹图谱软件对图谱进行处理,分别测定水相和有机相的指纹图谱,计算共有峰。
利用正丁醇-毛蕊花糖苷-水三元体系,采用高效液相色谱法分别建立水相和有机相的指纹图谱,建立了不同萃取物浓度、有机相与水相体积比、搅拌速率、搅拌时间、静置时间、萃取次数、萃取温度等萃取条件的有机相和水相的指纹图谱,记录指纹图谱共有峰个数以及相对峰面积的变化,考察其对已知化合物松果菊苷和毛蕊花糖苷分配系数的影响,从而获得萃取分离目标物质毛蕊花糖苷的基本工艺参数,评估萃取工艺的可行性。
附图说明
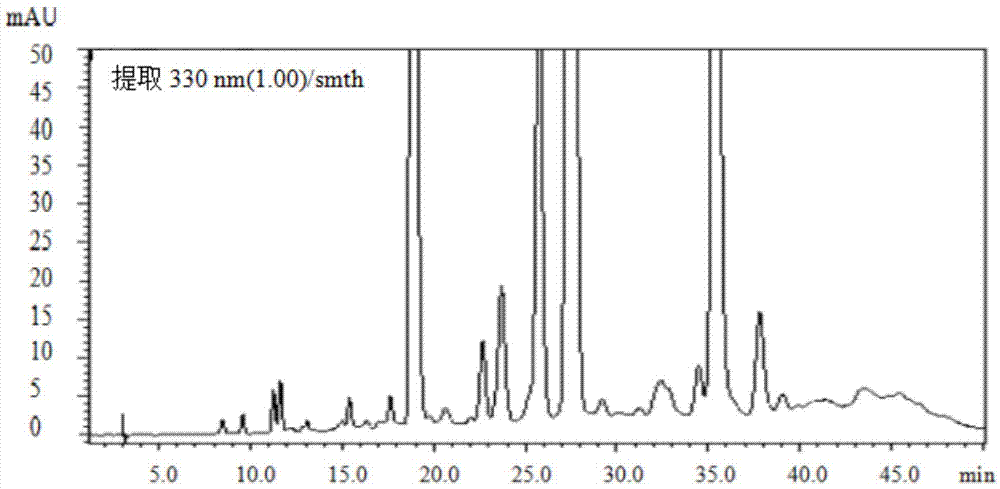
图1为本发明有机相色谱图;
图2为本发明水相色谱图;
图3为本发明毛蕊花糖苷对照色谱图。
具体实施方式
实施例
一、试验材料:常规材料;
二、试验方法:
1、供试品溶液的制备:
1.1浸膏粉含量测定供试品制备:取管花肉苁蓉浸膏细粉1g,精密称定,置于100ml容量瓶中,加适量温水溶解,放冷,加水定容至刻度,摇匀,过滤,稀释定容(稀释定容具体体积预试后确定),0.45μm微孔滤膜过滤,平行三份,待测;
1.2萃取溶液制备:取管花肉苁蓉浸膏粉5g,精密称定,置于已称重的50ml容量瓶中,精密称定,加入30ml温水溶解,放冷,加水定容至刻度,称重。摇匀后倒入50℃恒温夹套烧杯中,精密量取50ml正丁醇于已称重的容量瓶中,精密称定。100r/min磁力搅拌30min,静置2h(时间待定),分离正丁醇层和水层,分别取二者各1ml,置于已称重的容量瓶中,精密称定,甲醇稀释定容,0.45μm微孔滤膜过滤,取续滤液作为供试品溶液;
1.3对照品溶液的制备:分别取毛蕊花糖苷、松果菊苷对照品10mg,精密称定,加50%甲醇分别制成每1ml含毛蕊花糖苷、松果菊苷0.2mg的溶液,0.45μm微孔滤膜过滤,取续滤液作为对照品溶液;
2、指纹图谱测定方法建立:
2.1色谱条件:色谱条件为:色谱柱:inertsil-ods-3v(4.6×250mm,5μm);检测波长:330nm,柱温:30℃,进样量:10μl;a相:甲醇;b相:0.2%甲酸水梯度洗脱,梯度洗脱条件如下:表1
三、实验结果:
1液液平衡单因素实验:
1.1萃取物的浓度:分别按6、8、10、12倍加入浸膏粉,精密称定,置于50ml容量瓶中,30ml温水溶解,加水定容至刻度,称重,将水相混合物倒入恒温夹套烧杯中,加入50ml水饱和的正丁醇,200r/min磁力搅拌30min,温度55℃,水浴中静置分层(记录时间)后再静置2h,分别取有机相、水相1ml,于称量瓶(m1)中称重,记为m2流动相溶解,定容,摇匀后进样分析(有机相稀释25倍,水相稀释10倍),根据萃取率选择最适萃取物浓度;
表2有机相、水相色谱峰峰数比较
表3有机相中共有峰相对峰面积
共有峰数最多的条件为6倍体积水相浓度,6倍体积有机相、水相相比较,其中共有峰24个,有机相的相对质量分数总和为17.2857,水相的相对质量分数总和为35.9417,有机相特有峰有1个,相对质量分数为0.0017。水相特有峰共13个,相对质量分数总和为0.604。12倍体积水相浓度的毛蕊花糖苷萃取率最大为71.98%,毛蕊花糖苷分配系数为2.4568,松果菊苷萃取率为33.18%,分配系数为0.3967,以毛蕊花糖苷与松果菊苷两种组分的萃取分离为指标,计算萃取分离因数为6.1931;
由表3可知,1、10号峰随水相中毛蕊花糖苷浓度增高相对峰面积逐渐减低,5、6、7号峰随水相中毛蕊花糖苷浓度增高相对峰面积逐渐升高,2、9号峰随水相中毛蕊花糖苷浓度增高而增高,在10倍水相中毛蕊花糖苷浓度时相对峰面积达到最大后逐渐降低,3、4、8号峰升高至10倍后保持平衡状态,11、12、14号峰未见明显变化,可见萃取物的浓度越大,萃取效果不佳,故选择萃取物的浓度为溶剂与溶质之比约为12倍时,效果较佳;
1.2有机相与水相体积比:取4.2g浸膏粉(溶剂与溶质之比约相当于12倍),精密称定,置于50ml容量瓶中,30ml温水溶解,加水定容至刻度,称重,将水相混合物倒入恒温夹套烧杯中,按有机相/水相分别为:0.5/1、1/1、1.5/1、2/1的比例加入水饱和的正丁醇,200r/min磁力搅拌30min,温度55℃静置至所有样品分层(记录时间)后再静置2h,分别取有机相、水相1ml,于称量瓶(m1)中称重,记为m2流动相溶解,定容,摇匀后进样分析有机相稀释25倍、水相稀释10倍,根据萃取率选择最适有机相与水相体积比;
表4有机相、水相色谱峰数比较
表5有机相共有峰相对峰面积
共有峰数最多的条件为有机相水相体积比0.5倍,有机相与水相比较,共有峰24个,有机相的相对质量分数总和为14.2743,水相的相对质量分数总和为30.1468,有机相特有峰有1个,相对质量分数总和为0.0079,水相特有峰共11个,相对质量分数总和为0.1915。有机相/水相体积比为2倍的毛蕊花糖苷萃取率最大为83.85%,毛蕊花糖苷分配系数为2.5946,松果菊苷萃取率为44.91%,分配系数为0.4077,以毛蕊花糖苷与松果菊苷两种成分的分离为指标,计算萃取分离因数为6.3647,故选择有机相/水相体积比为2倍;
1.3搅拌速度:取4.2g浸膏粉(溶剂与溶质之比约相当于12倍),精密称定,置于50ml容量瓶中,30ml温水溶解,加水定容至刻度,称重,将水相混合物倒入恒温夹套烧杯中,精密量取正丁醇100ml,分别200、300、400、500r/min磁力搅拌30min,温度55℃静置至所有样品分层(记录时间)后再静置2h,分别取有机相、水相1ml,于称量瓶(m1)中称重,记为m2流动相溶解,定容,摇匀后进样分析(有机相、水相均稀释10倍),根据萃取率选择最适搅拌速度。
表6搅拌速度峰数变化
表7有机相共有峰相对峰面积
共有峰数最多的条件为500r/min,500r/min有机相和水相比较,其中共有峰27个,有机相的相对质量分数总和为24.9552,水相的相对质量分数总和为19.5061,有机相特有峰有2个,相对质量分数总和为0.0581,水相特有峰共10个,相对质量分数总和为0.22425。搅拌速度在200-500r/min范围内对毛蕊花糖苷萃取率影响不大,200r/min毛蕊花糖苷萃取率为84.80%,毛蕊花糖苷分配系数为2.7900,松果菊苷萃取率为47.09%,分配系数为0.4450,以毛蕊花糖苷与松果菊苷两种组分的萃取分离为指标,计算萃取分离因数为6.2703。故搅拌速率选择200r/min;
1.4搅拌时间:取4.2g浸膏粉(溶剂与溶质之比约相当于12倍),精密称定,置于50ml容量瓶中,30ml温水溶解,加水定容至刻度,称重,将水相混合物倒入恒温夹套烧杯中,精密量取正丁醇100ml,以200r/min搅拌15、30、60、90min,静置至所有样品分层(记录时间)后再静置2h,分别取有机相和水相1ml,于称量瓶(m1)中称重,记为m2流动相溶解,定容,摇匀后进样分析(有机相、水相均稀释10倍),根据萃取率选择最适搅拌时间;
表8搅拌时间峰数变化
表9有机相共有峰相对峰面积
共有峰数最多的条件为90min,90min有机相和水相相比较,其中共有峰25个,有机相的相对质量分数总和为24.5567,水相的相对质量分数总和为19.6208,有机相特有峰有1个,相对质量分数总和为0.0446,水相特有峰共10个,相对质量分数总和为3.021。搅拌时间为15min毛蕊花糖苷萃取率为84.53%,毛蕊花糖苷分配系数为2.7331,松果菊苷萃取率为44.49%,分配系数为0.4007,以毛蕊花糖苷与松果菊苷两种组分的萃取分离为指标,计算萃取分离因数为6.8203,效果较佳,故选择搅拌时间为15min;
1.5静置时间:取4.2g浸膏粉(溶剂与溶质之比约相当于12倍),精密称定,置于50ml容量瓶中,30ml温水溶解,加水定容至刻度,称重,将水相混合物倒入恒温夹套烧杯中,精密量取正丁醇100ml,以200r/min搅拌15min,静置至所有样品分层(记录时间),再分别静置0、2、4、8、24h,分别取有机相和水相1ml,于称量瓶(m1)中称重,记为m2流动相溶解,定容,摇匀后进样分析。根据萃取率选择最佳静置时间;
表10有机相、水相峰数比较
表11有机相共有峰相对峰面积
峰数最多的条件为静置24h,24h有机相、水相比较,其中共有峰24个,有机相的相对质量分数总和为24.5518,水相相对质量分数总和为18.9651,有机相特有峰有3个,相对质量分数总和为0.0728,水相特有峰共11个,相对质量分数总和为0.13629。静置时间为24h时毛蕊花糖苷萃取率最大为85.18%,毛蕊花糖苷分配系数为2.7533,松果菊苷萃取率为47.63%,分配系数为0.4359,以毛蕊花糖苷与松果菊苷两种组分的萃取分离为指标,计算萃取分离因数为6.3170,故最终选择24h静置时间;
1.6萃取温度:取4.2g浸膏粉(溶剂与溶质之比约相当于12倍),精密称定,置于50ml容量瓶中,30ml温水溶解,加水定容至刻度,称重,将水相混合物倒入恒温夹套烧杯中,精密量取正丁醇100ml,以200r/min搅拌15min,分别于温度50℃、55℃、60℃、65℃静置至所有样品分层(记录时间),再静置24h,分别取有机相、水相1ml,于称量瓶(m1)中称重,记为m2流动相溶解,定容,摇匀后进样分析,根据萃取率选择最适萃取温度;
表12温度有机相、水相峰数
表12有机相共有峰相对峰面积
峰数最多的条件为静置60℃,60℃有机相、水相相比较,其中共有峰19个,有机相的相对质量分数总和为19.3016,水相相对质量分数总和为20.3062,有机相特有峰有3个,相对质量分数总和为0.0862,水相特有峰共15个,相对质量分数总和为0.238,温度为55℃时毛蕊花糖苷萃取率最大为83.42%,毛蕊花糖苷分配系数为2.5168,松果菊苷萃取率为36.43%,分配系数为0.2865,以毛蕊花糖苷与松果菊苷两种组分分离开来为指标,计算萃取分离因数为8.7836。2号峰随温度增高相对峰面积逐渐升高,3-6、9、11、12号峰随温度增高相对峰面积逐渐升高至55℃后保持平衡状态,7号峰随温度增高相对峰面积逐渐升高至60℃后保持平衡状态,8、10、14号峰未见明显变化趋势,1号峰保持平衡状态,综合考虑,选择萃取温度为55℃;
1.7萃取次数:取4.2g浸膏粉(溶剂与溶质之比约相当于12倍),精密称定,置于50ml容量瓶中,30ml温水溶解,加水定容至刻度,称重,将水相混合物倒入恒温夹套烧杯中,精密量取正丁醇100ml,以200r/min搅拌15min,于55℃静置至所有样品分层(记录时间),再静置24h,萃取1次、2次、3次、4次后,分别取有机相、水相1ml,于称量瓶(m1)中称重,记为m2流动相溶解,定容,摇匀后进样分析,根据萃取率选择最适萃取次数;
表11有机相中毛蕊花糖苷、松果菊苷的质量及百分比
表13有机相共有峰相对峰面积
1、3号峰随水相中毛蕊花糖苷浓度增高相对峰面积逐渐减低至2次后逐渐升高,10号峰随水相中毛蕊花糖苷浓度增高相对峰面积逐渐减低至3次后逐渐升高,2、5、8、9号峰随水相中毛蕊花糖苷浓度增高相对峰面积逐渐升高,4、6号峰随水相中毛蕊花糖苷浓度增高相对峰面积逐渐升高至3次后逐渐降低,11、14号峰随水相中毛蕊花糖苷浓度增高相对峰面积逐渐升高至2次后逐渐降低,12号峰未见明显变化趋势;
优化条件共有峰共14个,保留时间分别为3.018、8.810、9.901、11.566、11.920、15.409、15.802、18.093、19.415、22.754、23.422、26.723、28.291、35.442,分别将其命名为1-14号峰,其中9号峰为松果菊苷,在330nm水相对峰面积最大,通过极差分析可得对相对峰面积影响因素大小关系为:提取次数>有机相与水相体积比>温度>水相中毛蕊花糖苷浓度>搅拌时间>搅拌速度>静置时间,其中提取次数越多,有机相与水相体积比越大,搅拌时间、静置时间越长松果菊苷相对峰面积越大,在温度55℃时,松果菊苷相对峰面积最大,水相中毛蕊花糖苷浓度为10倍时,松果菊苷相对峰面积最大,毛蕊花糖苷在330nm时相对峰面积第二;
12号峰第三,通过极差分析可得对相对峰面积影响因素大小关系为:提取次数>温度>静置时间>有机相与水相比例>搅拌速度>搅拌时间>水相中毛蕊花糖苷浓度,其中提取次数对12号峰相对峰面积变化未见明显变化趋势,在55℃时,12号峰相对峰面积最大,在0-24h内,静置时间与12号峰相对峰面积呈负相关,有机相与水相比例在0.5-2范围内,对12号峰相对峰面积呈正相关。12号峰相对峰面积在200-400r/min范围内随搅拌速度增加而增加,在400r/min时达到最大后降低。12号峰相对峰面积在15-60min范围内随搅拌时间增加而增加,在60min达到最大后降低;
11号峰第四,通过极差分析可得对相对峰面积影响因素大小关系为:提取次数>有机相与水相比例>温度>静置时间>搅拌时间>水相中毛蕊花糖苷浓度>搅拌速度,各因素均对11号峰相对峰面积变化未见明显变化趋势;
14号峰第五,通过极差分析可得对相对峰面积影响因素大小关系为:提取次数>有机相与水相比例>静置时间>温度>搅拌时间>水相中毛蕊花糖苷浓度>搅拌速度,提取二次时14号峰相对峰面积最大,随后逐渐降低,有机相与水相比例、温度、水相中毛蕊花糖苷浓度对14号峰相对峰面积未见明显变化趋势,,随静置时间增加,14号峰相对峰面积逐渐增加,温度对14号峰相对峰面积未见明显变化趋势,搅拌时间、搅拌速度对14号峰相对峰面积影响不大;
1号峰第六,通过极差分析可得对相对峰面积影响因素大小关系为:提取次数>有机相与水相比例>水相中毛蕊花糖苷浓度>搅拌速度=静置时间>温度>搅拌时间,提取次数、搅拌速度对1号峰相对峰面积未见明显变化趋势,1号峰相对峰面积对有机相与水相比例呈正相关,1号峰对水相中毛蕊花糖苷浓度、静置时间呈负相关,温度、搅拌时间对1号峰相对峰面积影响不大;
5号峰第七,通过极差分析可得对相对峰面积影响因素大小关系为:提取次数>温度>静置时间>水相中毛蕊花糖苷浓度>搅拌速度>搅拌时间>有机相与水相比例,提取次数与5号峰相对峰面积呈正相关,温度55℃时5号相对峰面积最大后逐渐降低,5号峰相对峰面积对静置时间、水相中毛蕊花糖苷浓度、搅拌时间、有机相与水相比例呈正相关,400r/min时5号峰相对峰面积最大;
4号峰第八,通过极差分析可得对相对峰面积影响因素大小关系为:提取次数>有机相与水相比例>温度>静置时间>搅拌时间>搅拌速度>水相中毛蕊花糖苷浓度,提取次数、有机相与水相比例、静置时间、搅拌时间与4号峰相对峰面积呈正相关,水相中毛蕊花糖苷浓度、温度对4号峰相对峰面积未见明显变化趋势,400r/min时4号峰相对峰面积最大;
7号峰第九,通过极差分析可得对相对峰面积影响因素大小关系为:提取次数>搅拌时间>有机相与水相比例>温度>静置时间>水相中毛蕊花糖苷浓度>搅拌速度,有机相与水相比例、水相中毛蕊花糖苷浓度对7号峰相对峰面积呈正相关,温度、静置时间、提取次数、搅拌时间、搅拌速度对7号峰相对峰面积未见明显变化趋势;
3号峰第十,通过极差分析可得对相对峰面积影响因素大小关系为:提取次数>搅拌时间>温度>静置时间>温度=搅拌速度>有机相与水相比例,提取次数、搅拌时间、有机相与水相比例、温度对3号峰相对峰面积呈正相关,随水相中毛蕊花糖苷浓度增高,3号峰相对峰面积逐渐升高后保持平衡状态,搅拌速度保持平衡状态;
2号峰第十一,通过极差分析可得对相对峰面积影响因素大小关系为:提取次数>有机相与水相比例>搅拌时间>静置时间=温度>水相中毛蕊花糖苷浓度=搅拌速度,提取次数、有机相与水相比例、搅拌时间、静置时间、温度对1号峰相对峰面积呈正相关,在10倍水相中毛蕊花糖苷浓度时,2号峰相对峰面积最大;
10号峰第十二,通过极差分析可得对相对峰面积影响因素大小关系为:提取次数>有机相与水相比例>温度>静置时间>搅拌时间>水相中毛蕊花糖苷浓度>搅拌速度,各影响因素对10号峰相对峰面积未见明显变化趋势;
8号峰第十三,通过极差分析可得对相对峰面积影响因素大小关系为:提取次数>温度=静置时间>搅拌速度>搅拌时间>有机相与水相比例>水相中毛蕊花糖苷浓度,提取次数、搅拌速度、搅拌时间对8号峰相对峰面积呈正相关,温度、静置时间、有机相与水相比例、水相中毛蕊花糖苷浓度对8号峰相对峰面积未见明显变化趋势;
6号峰第十四,通过极差分析可得对相对峰面积影响因素大小关系为:提取次数>搅拌速度>温度>静置时间>有机相与水相比例>水相中毛蕊花糖苷浓度>搅拌时间,提取次数、有机相与水相比例、水相中毛蕊花糖苷浓度对6号峰相对峰面积呈正相关,搅拌速度、温度、静置时间、搅拌时间对6号峰相对峰面积未见明显变化趋势;
综上所述,对各峰相对峰面积影响最大的因素为提取次数,且提取次数对其相对峰面积呈正相关,即提取次数越多,各杂质峰相对峰面积越大,为使各杂质峰相对峰面积最小,因此选择萃取一次,各峰相对峰面积对有机相与水相比例大多呈正相关,与萃取规律相同,为使毛蕊花糖苷萃取率达到最大,且考虑到经济合理的原则,选择有机相与水相比例为2:1作为萃取比例,温度对各峰相对峰面积的影响不同,因此选择相对峰面积最大的松果菊苷进行分析,松果菊苷与毛蕊花糖苷结构相似,均在温度55℃时萃取最高,因松果菊苷与毛蕊花糖苷极性相差较大,可在后续工艺中将其去除,因此选择温度55℃为最佳萃取温度,因溶剂性质、用量,萃取剂性质、用量等原因,限制了萃取效率,一次提取加入的溶质的量不能超过萃取溶剂能力,为使萃取率达到最大,且考虑经济合理的原则,水相中溶质的量按12倍;搅拌时间与搅拌速度对各峰相对峰面积影响不大,为避免搅拌时间过长、搅拌速度过快造成乳化现象,选择搅拌时间为15min,搅拌速度为200r/min,静置时间与各峰相对峰面积呈正相关,但各峰所占比例较小,为毛蕊花糖苷萃取率最高,因此选择静置24h;
最终优化条件有机相峰数为22个,水相峰数为34个,毛蕊花糖苷萃取率最为83.42%,松果菊苷萃取率为36.43%,以毛蕊花糖苷与松果菊苷两种成分分离为指标,计算萃取分离因数为8.7836,初步使毛蕊花糖苷纯度得到了提高,为进一步纯化工艺研究提供了合格的原料。
- 还没有人留言评论。精彩留言会获得点赞!