一种用有机溶剂提取样品快速检测农药残留的方法与流程
本发明属于食品检测领域,具体涉及一种农药残留快速检测中的样品前处理和酶抑制反应检测方法。
背景技术:
基于酶活性抑制的农药残留快速检测技术在农产品质量安全筛查与检测中应用广泛。该反应的原理是,酶可以催化探针底物反应,产生可检测的光化学或电化学信号,但农药残留物会抑制酶活性,导致底物反应信号减小甚至消失,由此快速筛查出农产品中是否含有农药残留。
但是,生物酶一般都在水性溶剂中活力较高,有机溶剂的存在会显著影响酶的活性和稳定性,因而基于酶活性抑制反应的农残快速检测过程基本都在水相溶液中进行,从样品的提取到样品的检测,都是用水或pbs缓冲溶液等水相溶剂来作为反应溶剂。这存在一个严重问题,即大部分有机磷、氨基甲酸酯类杀虫剂农药为有机化合物,分子极性较弱,在水中的溶解性较差,用水性溶剂来提取,会存在提取效率低的问题,无法完全提取到样品中的农药残留,回收率较差。很有可能样品中原本含有的微量农药,由于水提取效率的原因导致检测结果不准确。但如果改用有机溶剂进行提取,在进行后续酶反应检测时,有机溶剂又会影响酶的活性,导致检测结果不准确。因此,现有以酶反应为基础的农药残留速测方法中,前处理提取与酶反应检测这两步骤对溶剂种类(有机溶剂还是水溶液)的要求处于相互矛盾的状态,成为制约方法灵敏度等关键性能的主要原因。现有技术在报道酶反应快速检测农药的各类方法时,都局限在水性溶剂上,无论是标样的制作,还是样品的提取,溶剂大多为水或水相缓冲液。因此,可以发现文献中鲜有回收率数据,正是因为水提取的回收率较差,大多都回避了这一问题。
微流控纸芯片具有敞开式的微通道系统,且芯片基底纤维的超大比表面积特性显著增大了微通道中液体与空气的接触面积,加快了液体挥发。因此,用有机溶剂提取农残样品,然后在纸芯片上利用酶反应实现农残速测成为可能。
技术实现要素:
本发明的目的在于提供一种用有机溶剂提取样品快速检测农药残留的方法,该方法借助微流控纸芯片技术得以实现。
本发明采用乙酰胆碱酯酶-信号探针反应体系,改变现有快检技术中千篇一律地预先对酶进行固定化的方案,在芯片上先加样,待样品溶剂挥发后再引入酶溶液和酶反应,消除前处理所用溶剂对后续酶反应检测过程的影响,实现有机溶剂前处理和酶反应检测的有机结合,达到提高检测性能的目的。
本发明采用的技术方案是:
一种用有机溶剂提取样品快速检测农药残留的方法,所述方法包括以下步骤:
(1)有机溶剂提取样品:取固体样品或液体样品,加入有机溶剂进行提取,涡旋混匀,静置后离心,取上清液作为待测样品溶液;
固体样品或液体样品取一定重量或一定体积,称取的重量或体积记录准确,便于后续计算。
一般可在离心管中进行提取。
涡旋时间一般为1~10min,优选3min。
涡旋混匀使得样品与溶剂充分接触。
静置时间一般为1~10min,优选2min。
对固体样品,根据样品本身形态,预先进行剪碎、切碎等操作,以便于样品放入提取的容器;
提取固体样品的有机溶剂可以为乙腈、正己烷、丙酮、乙酸乙酯或乙腈和水的混合溶剂,优选乙腈或乙腈和水的混合溶剂。
进一步,按固体样品的形态优选为:对于湿样,提取的有机溶剂的优选乙腈;对于干样,提取的有机溶剂优选为乙腈和水的混合溶剂,其中乙腈、水的体积比优选为2:1。
对液体样品,若不需进行浓缩则可不进行溶剂提取直接进样,若需浓缩,则选取与样品本身不能互溶的有机溶剂进行提取;进一步,提取液体样品的有机溶剂可以为乙酸乙酯、石油醚、二氯甲烷或氯仿,优选乙酸乙酯作为有机溶剂进行提取。
有机溶剂的体积用量以固体样品的质量计为0.2~10ml/g,优选1~2ml/g;有机溶剂与液体样品的体积比优选为1:1~50,优选1:5~20。
(2)样品加样:
用有机溶剂配制目标农药的标准溶液,浓度范围为0.0001~50.0mg/l;
在纸芯片的各个检测区分别滴加等体积的待测样品溶液、空白对照和/或不同浓度的标准溶液,自然晾干后,再向检测区分别滴加等体积的胆碱酯酶溶液,并在空气中静置5~20min,使得样品和酶充分接触、反应;得到加样后的纸芯片;
所述纸芯片是在纸基底上设置有多个亲水性的反应检测区的微流控芯片,各检测区可以为阵列排布或用亲水性的通道连接成网络,反应检测区上还可以根据检测手段需求固定各类功能器件,如固定纳米颗粒、荧光量子点或设置电极,或通过多层组合的方式,将纸芯片与电极、荧光量子点等功能层组合使用。纸芯片可按照相关公知技术制作。
所述纸芯片上,各个检测区的大小形状相同,优选为等直径的圆形。
检测区的直径优选1~10mm。
所述纸芯片上的检测区为2个以上,优选3~50个,更优选8~20个。
所述纸基底的材料可选用纤维比表面积很大,有利于溶剂挥发的基底材料均可,一般可选用滤纸片、层析纸、滤膜、离子交换纸中的一种,优选滤纸片。
所述胆碱酯酶为乙酰胆碱酯酶或者丁酰胆碱酯酶,优选乙酰胆碱酯酶;
所述胆碱酯酶溶液的浓度为10~500u/ml之间,优选100u/ml;胆碱酯酶溶液的配制溶剂为ph7.4的pbs缓冲液;
本发明检测的反应机理是酶活性抑制反应,即有机磷和氨基甲酸酯类农药残留会抑制胆碱酯酶活性,本发明中,将样品溶液和空白对照和/或标准溶液最先加样,然后晾干后加入胆碱酯酶溶液,如果样品中含有农药残留,则会抑制酶活性,在纸芯片上发生酶活性抑制反应,然后后续通过检测酶活性的抑制情况可以检测农药残留情况。
用于配制标准溶液的有机溶剂可以为乙腈、正己烷、丙酮、乙酸乙酯、石油醚、二氯甲烷或氯仿。
所述目标农药的标准溶液的溶剂以与步骤(1)提取样品时所用的有机溶剂可以相同也可以不同,以相同为佳,当无法保证与提取时使用的有机溶剂相同时,可采用与提取步骤所用溶剂挥发性相似的溶剂,以保证各检测区溶剂挥发速度相似,节省反应时间;进一步,即使标准溶液的溶剂和提取步骤所用的溶剂的挥发性也不一致,也可通过延长进样步骤(即酶溶液加入前)的晾干时间或采用额外辅助手段加速进样步骤检测区的干燥。
所述空白对照、标准溶液、待测样品溶液的加入量为0.5μl~3μl,但每次检测时,不同检测区中的空白对照、标准溶液、待测样品溶液的加入量相等。
所述酶溶液的加入量为0.5μl~3μl,但每次检测时,不同检测区中的酶溶液的加入量相等。
空白对照、标准溶液、样品溶液和酶溶液加入的体积与纸芯片的检测区域面积有关,当单个检测区直径为0.5mm时,优选体积均为1μl。
加入酶溶液后芯片在空气中静置时间优选为10min。
在此步骤中,本发明采用在芯片上先进样、后加酶试剂的操作顺序,是本发明方法的关键步骤,也是基于有机溶剂的样品提取方法与酶抑制检测方法能够兼容的关键因素,此顺序不可改变。
此步骤的关键点在于,通过改变样品和酶试剂的引入顺序,先进样、后加酶试剂,样品引入后在敞开的反应平台上实现溶剂挥发,则检测区上没有残留溶剂,消除溶剂对后加酶试剂的酶活性的影响,从而可以实现将有机溶剂提取样品用于酶反应检测的方法。除纸芯片外,其他类似敞开体系的基质载体,通过在敞开体系中溶剂挥发的途径来消除有机溶剂对后续酶反应影响的方法,应属本发明的技术变形。
(3)酶活性指标检测:检测加样后的纸芯片上胆碱酯酶残余活性,以酶活性指标来反应酶活性变化情况,得到样品溶液、空白对照和/或标准溶液的酶活性指标数据,然后通过肉眼观察进行半定量化判定或制作酶活性指标工作曲线并计算待测样品中农药含量水平。
步骤(3)酶活性指标检测是本领域公知的技术,酶活性指标检测的反应原理为,加入探针底物,然后胆碱酯酶催化底物进行催化水解反应,通过检测水解产物产生的信号作为酶活性指标,来检测酶活性变化情况。胆碱酯酶活性相关指标信号的检测手段有很多种,可以通过多种检测技术来实现,任何现有的测定胆碱酯酶活性指标的检测技术均可用于本发明。根据酶活性指标检测反应原理来选择合适的检测技术是本领域技术人员可以实现的。
因此,所述步骤(3)中,可加入探针底物检测纸芯片上胆碱酯酶残余活性,根据所使用探针底物的不同,可采用普通酶显色反应、化学发光检测、荧光检测或电化学检测方法等公知技术来检测胆碱酯酶催化水解反应的产物所产生的信号,作为酶活性指标,得到样品溶液、空白对照和/或标准溶液的酶活性指标数据,然后通过肉眼观察进行半定量化判定或制作酶活性指标工作曲线并计算待测样品中农药含量水平。
本发明中,由于有机磷和氨基甲酸酯类农药残留会抑制酶活性,标准溶液中的农药成分会抑制胆碱酯酶活性,在纸芯片上发生酶活性抑制反应,然后检测胆碱酯酶活性指标,得到样品溶液、空白对照以及不同浓度下的标准溶液的酶活性指标数据,一般来说,如果进行阳性判定,以样品溶液、空白对照的酶活性指标数据即可进行判定;根据样品溶液、空白对照以及不同浓度下的标准溶液的酶活性指标数据,可通过肉眼观察进行半定量化判定,判定样品溶液的农药残留大致的浓度范围;进一步,可进行定量检测,以标准溶液中农药的浓度(可取对数)为横坐标、相应检测区酶活性指标数据为纵坐标,绘制酶活性指标的工作曲线,将样品溶液的酶活性指标数据与工作曲线对比,即可计算待测样品中农药含量水平。
进一步,本发明实施例中采用的是酶显色反应来检测胆碱酯酶残余活性,酶显色反应是利用酶与显色剂反应直接呈现颜色变化,酶活性受到抑制则显色程度变浅或不显色,因此以显色的颜色强度作为酶活性指标数据。酶显色反应中,显色剂可以为靛酚乙酸酯、吲哚乙酸酯、乙酰胆碱+溴百里酚蓝、乙酸-β-萘酯+固蓝b盐等显色试剂或显色试剂与生物酶、荧光量子点或纳米颗粒等新材料结合的复合显色剂体系,优选为靛酚乙酸酯。
进一步,酶显色反应检测方法中,加样后的纸芯片上的酶活性指标数据测定可以按以下步骤操作:以ph8的pbs缓冲液配置浓度为1~5mm的靛酚乙酸酯溶液,优选浓度为3mm;然后向加样后的纸芯片上的各个检测区加入等量的靛酚乙酸酯溶液(0.5μl~3μl,优选1~1.2μl),然后将芯片整体放入密闭盒中孵育,3~20min(优选5min)后取出,肉眼观察、对比各样品与空白对照、标准溶液检测区的颜色深浅,对各样品进行可视化半定量判定;或对芯片进行整体图像采集,并通过图像处理软件分析获得各检测区的颜色强度数据,利用标准溶液检测区的颜色强度数据绘制酶活性指标工作曲线,由工作曲线和待测样品的颜色强度数据,计算待测样品中农药含量水平。
可利用扫描仪、照相机、智能手机等设备对芯片进行整体图像采集。
进一步,所述纸芯片可采用微流控纸芯片的各类构型,只需要要求检测区大小相同即可。
优选的,可采用该领域中最常见的放射形芯片构型。具体来说,芯片由疏水区和亲水通道网络组成,所述疏水区完全包围所述亲水通道网络,所述亲水通道网络包括中心区、环绕中心区的多条亲水通道,每条亲水通道的一端与中心区连通,远离中心区的一端设置为反应检测区,形成放射形。
所述亲水通道为4条以上,优选8~12条。
本发明实施例中采用8通道米字型芯片,具体构型如图1中芯片示意图。
备注说明:对于8通道芯片,即在同一个芯片上共有8个检测区的芯片,使用时,其中4~5个检测区用作不同浓度的标准溶液的检测,用于半定量检测中作为颜色强度判定标准或在定量检测中以其灰度数据绘制工作曲线;剩余3~4个检测区用于待测样品的检测,可最多同时测定3~4个不同未知样品或对相同样品进行最多3~4次平行测定。当芯片通道数增加时,同一片芯片上的待测样品检测区增多。
在放射形构型的纸芯片上,酶显色反应的操作中,所述向纸芯片上的各个检测区加入等量的靛酚乙酸酯溶液,可以按以下步骤操作:向芯片的中心区加入10~50μl(优选25μl)的靛酚乙酸酯溶液,待其浸润所有检测区后,即可认为检测区中加入了等量的靛酚乙酸酯溶液,然后进行孵育显色等操作。
即步骤(3)采用酶显色反应来检测加样后的纸芯片上的酶活性指标数据时,优选按以下步骤操作:
向放射形构型的纸芯片的中心区加入10~50μl的显色剂溶液,待其浸润所有检测区后,将芯片整体放入密闭盒中孵育,3~20min(优选5min)后取出,肉眼观察、对比各样品与空白对照、标准溶液检测区的颜色深浅,对各样品进行可视化半定量判定;或对芯片进行整体图像采集,并通过图像处理软件分析获得各检测区的颜色强度数据,利用标准溶液检测区的颜色强度数据绘制酶活性抑制工作曲线,由工作曲线和待测样品的颜色强度数据,计算待测样品中农药含量水平。
本发明还可以使用其他本领域公知的检测技术来检测芯片上酶活性指标,如化学发光检测、荧光检测或电化学检测等,任何现有的公知的测定胆碱酯酶活性指标的检测技术均可用于本发明。
进一步,可预先选择检测手段,然后设计纸芯片和加入不同的探针底物,然后在步骤(3)分别采用相应的化学发光检测、荧光检测或电化学检测等现有技术公知的方法来检测酶活性指标。
本发明可用于检测各类农产品的农药残留,包括各类蔬菜、水果、牛奶及其相关副产品如蔬菜汁、果汁、果泥、各类乳制品如酸奶、奶酪、奶油、奶粉等等。
本发明方法中,反应机理为待测物对胆碱酯酶活性有抑制作用,因此可检测对胆碱酯酶活性有抑制作用的农药残留,主要可检测的农药残留为有机磷、氨基甲酸酯类农药的残留,包括农药母体、衍生物、代谢物、降解物等等。
其他对胆碱酯酶活性有抑制作用的目标物也可作为本申请发明的检测目标,如重金属和某些神经毒素(比如沙林毒气)等。
本发明还提供一种利用酶活性抑制反应快速检测农药残留的样品提取和加样方法,所述利用酶活性抑制反应快速检测农药残留的方法是先进行样品提取,样品加样得到加样后的纸芯片,检测加样后的纸芯片上的胆碱酯酶残余活性,以酶活性指标来反应酶活性变化情况,肉眼观察进行半定量化判定或制作酶活性指标工作曲线,计算得到农药残留含量,其特征在于所述样品提取和加样方法包括以下步骤:
(1)有机溶剂提取样品:取固体样品或液体样品,加入有机溶剂进行提取,涡旋混匀,静置后离心,取上清液作为待测样品溶液;
(2)样品加样:
用有机溶剂配制目标农药的标准溶液,浓度范围为0.0001~50.0mg/l;
在纸芯片的各个检测区分别滴加等体积的待测样品溶液、空白对照和/或不同浓度的标准溶液,自然晾干后,再向检测区分别滴加等体积的胆碱酯酶溶液,并在空气中静置5~20min,使得样品和酶充分接触、反应,得到加样后的纸芯片;
所述纸芯片是在纸基底上设置有多个亲水性的反应检测区的微流控芯片;纸芯片上各个检测区的大小形状相同。
与市面上现有的农药残留快速检测方法相比,本发明最显著的区别及技术优势如下:
(1)改变样品与酶试剂的加入顺序:现有绝大多数常规农药残留速测都采用在芯片/试纸上预先固定酶试剂的模式,本发明克服了技术偏见,摒弃固定酶模式,而是使用未经任何酶试剂处理过的空白纸芯片进行检测,在检测区先加入样品,待其中的溶剂挥发殆尽以后再引入酶试剂。这一方面避免了固定化酶操作及后续储存过程造成酶活性损失的可能性,更重要的是,完全避免了样品溶液中的有机溶剂与酶的接触,消除了前处理提取时所用溶剂对后续酶反应检测过程的影响,改变了现有以酶反应为基础的农药残留快速检测方法中前处理与酶反应两部分对溶剂种类要求处于相互矛盾的状态,使得有机溶剂前处理在农药残留速测中的应用成为可能。
(2)本发明采用有机溶剂提取样品,然后利用酶反应进行农药残留快速检测,在快速检测的基础上,有机溶剂提取农药残留可以大幅提高提取效率,回收率比起水溶剂提取大幅提高,从而提高了检测的准确性和灵敏度。
本发明结合了快速检测和常规检测的优点,摒弃了其缺点。目前快速检测农残大多在芯片/试纸上进行,利用酶反应进行快速检测,如上所述,现有技术基于酶反应特性,只能采用水性溶剂提取样品,而水提取的提取效率低,回收率低,在提取都不完全的前提下,检测方法的可靠性和应用前景明显受到限制。
而常规检测一般利用色谱技术和仪器检测微量农残,此时提取样品一般采用有机溶剂提取法,提取完全,结果更为准确。但色谱方法对前处理操作要求高,设备贵重,耗时长,不适合现场快速筛查。
本申请结合了快速检测和常规检测的优点,利用酶反应可以现场快速筛查,不需大型设备,而且有机溶剂提取农残提取效率高,回收率高,对痕量的有机农药也可以准确检出,提高了检测的准确性和灵敏度。
(3)与市面上现有的芯片或试纸条方法相比较,本发明方法不需要预先固定酶试剂,酶试剂用量大幅度减少,显著降低了检测成本。
(4)本发明方法采用多通道集成化的微流控芯片技术,增大了反应通量,提高了检测效率,且具有向集成化、自动化、便携化的小型检测仪器发展的潜力。
本发明以有机溶剂在纸芯片上的自主挥发特性为切入点,在空白芯片上先进样,待样品中溶剂完全挥发后再引入酶试剂;纸芯片作为酶检测平台的同时,又作为一道虚拟屏障,在时间和空间上将样品前处理与后续检测两部分操作和功能完全分开,实现了有机相样品溶液中溶质与溶剂的简便、快速分离,解决了现有农药残留(主要包括有机磷和氨基甲酸酯类农药)速测方法中对前处理提取溶剂使用的限制,及由此导致的检测灵敏度低下的问题,提高了实际样品农药残留速测的灵敏度和准确性。同时,微流控芯片技术的引入,增大了反应通量,提高了检测效率。
附图说明
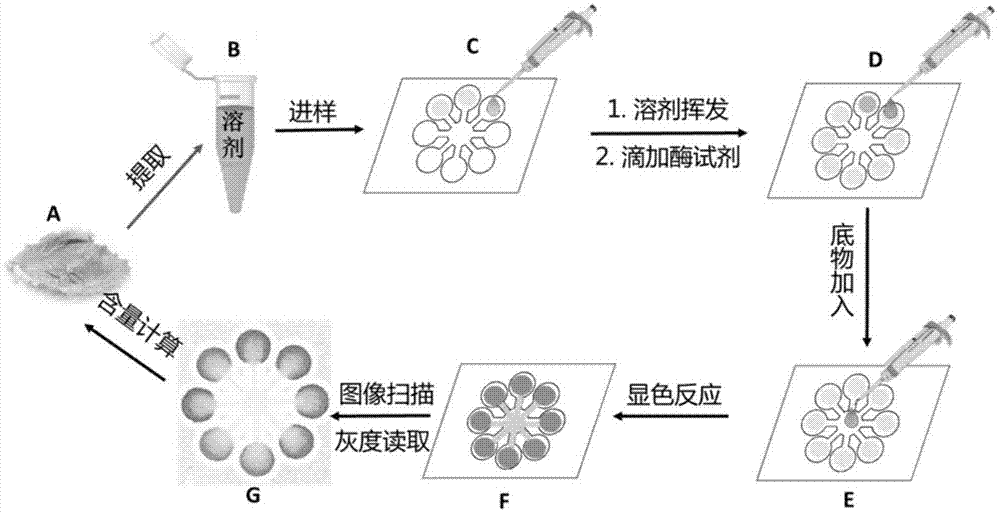
图1利用微流控纸芯片用有机溶剂提取样品快速检测农药残留的方法过程流程图。
图2是利用本发明方法测得的克百威、甲萘威、辛硫磷、甲胺磷四种农药乙腈作为溶剂的标准溶液的工作曲线。
图3是利用本发明方法对含有0.02mg/l甲萘威的苹果汁进行可视化快速筛查检测结果图。
具体实施方式
下面结合实施例对本发明的技术方案做进一步说明,但本发明的保护范围不限于此。
实施例1
图1是利用微流控纸芯片用有机溶剂提取样品快速检测农药残留的方法过程流程图,纸芯片可采用微流控纸芯片的各类构型,只需要要求检测区大小相同即可。本发明实施例中采用最常见的放射形米字型芯片构型。
图1中,纸芯片上设有米字型亲水通道网络,包括中心区和均匀地环绕中心区的8条亲水通道;每条亲水通道的一端与中心区连通,远离中心区的一端设置为反应检测区
中心区呈圆形,直径为5mm。每个通道的长度为4mm,宽度为1.5mm;
反应检测区是直径为5mm的圆。
8条亲水通道环绕中心区,以中心区为对称点形成点对称。
纸芯片上的亲水通道网络由疏水性的线条限定而成。
图1中,(a):待检测的实际样品,图中以蔬菜为典型代表,实际待测样品可以为各种固体或液体样品;
(b):样品粉碎后加入含有有机溶剂的离心管进行提取,常用溶剂为乙腈等;
(c):农药的标准溶液或经b提取所得的样品溶液逐样加入到微流控纸芯片的相应检测区内;
(d):检测区内,标准溶液或样品溶液的溶剂完全挥发以后,在各检测区内加入等量的乙酰胆碱酯酶溶液,自然晾干;
(e):从芯片中心加入适当体积的显色底物溶液,溶液在毛细管作用力驱动下沿着通道向各检测区流动;
(f):显色后的纸芯片,可通过肉眼判断进行半定量化判定;
(g):经过扫描和photoshop软件进行灰度信号转换后的纸芯片图像,可进行定量检测。
为了检验本发明检测方法的可靠性及其检测结果与样品溶液所含有机溶剂种类的无关性特点,发明人在发明过程中对使用乙腈、正己烷、丙酮、乙酸乙酯等溶剂配制的克百威、甲萘威、辛硫磷、甲胺磷等农药的标准溶液进行检测,绘制农药的浓度-信号强度(灰度)曲线,具体实验如下:
(1-1)以乙腈分别配制克百威、甲萘威、辛硫磷、甲胺磷的不同浓度的单组分标准溶液,配制浓度范围为0.001~20mg/l;用ph7.4的pbs缓冲液配制乙酰胆碱酯酶溶液,酶溶液浓度为100u/ml;以ph8的pbs缓冲液配置浓度为3mm的靛酚乙酸酯溶液;
(1-2)在如图1所示构型芯片的1个检测区内,滴入1.0μl的乙腈作为空白对照区,剩余检测区分别滴入1.0μl不同浓度的克百威标准溶液;自然晾干后,在各个检测区分别滴加1.0μl酶溶液,并在空气中静置10min,使得样品和酶充分接触、反应;之后,从芯片的中心区加入25μl的靛酚乙酸酯溶液,待其浸润所有检测区后,将芯片整体放入密闭盒中孵育,5min后从盒内取出并吹干芯片表面,以扫描仪对整个芯片进行图像扫描,记录各检测区的颜色数据。
(1-3)利用photoshop图像处理软件,读取上述芯片各检测区的灰度值数据,以克百威标准溶液的浓度为横坐标(取对数),以标准溶液检测区的灰度值数据为纵坐标,在origin8.0软件中进行hill1公式的数据拟合,得到克百威农药的有机溶剂溶液在芯片上对乙酰胆碱酯酶抑制反应的工作曲线。
(1-4)分别以甲萘威、辛硫磷或甲胺磷的标准溶液替代步骤(1-2)中的克百威标准溶液,重复以上(1-2)和(1-3)步骤操作,分别得到甲萘威、辛硫磷和甲胺磷的工作曲线。具体结果汇总见图2。
(1-5)用正己烷、丙酮、乙酸乙酯分别代替乙腈溶剂,按照步骤(1-1)~(1-4)分别配制克百威、甲萘威、辛硫磷和甲胺磷的标准溶液并进行检测,绘制工作曲线,结果发现对于同一农药来说,不同溶剂得到的工作曲线基本一致。也就是说,即使提取溶剂和标准溶液的溶剂不同,工作曲线也是可以参考的。
本实例所得不同农药的ic50等参数与文献报道的水相反应相当或优于水相反应,显示微流控纸芯片方法确实可以有效消除有机溶剂对酶反应的影响,在常规有机溶剂所提取的实际样品的速测上具有很好的应用潜力。
实施例2
为了对比本发明方法(以有机溶剂进行前处理提取)与常规酶抑制检测法(以水进行样品提取)的检测效果,并检验本发明检测方法在实际样品检测中的可靠性,发明人以结球生菜为模型,分别用水和乙腈作为提取溶剂,对辛硫磷、甲萘威、克百威、甲胺磷等四种不同极性的代表性农药进行单一加标水平的回收率测定。具体操作如下:
(2-1)称取四份打碎后的结球生菜样品,每份10g,计为a,b,c,d样品,依次放入4只离心管中,按表1所示相应浓度加入对应农药标准品溶液并涡旋混匀,得到4份生菜的加标样品,其中a样品中含有0.8mg/kg辛硫磷,b样品中含有0.4mg/kg甲萘威,c样品中含有0.01mg/kg克百威,d样品中含有2.0mg/kg甲胺磷农药。
表1加标回收实验不同农药的加标浓度及标准溶液浓度范围
(2-2)从a管中准确称取两份3.0g加标样,分别放入2只离心管中,依次计为a-1和a-2。在a-1中加入3.0ml去离子水,a-2中加入3.0ml乙腈溶剂。将2只离心管分别涡旋3min后再静置2min。两离心管同时离心后,分别取上清液作为待测溶液。
(2-3)按2-2所述操作,分别对b,c,d加标样进行前处理,得到b-1,b-2,c-1,c-2,d-1,d-2待测液。
(2-4)分别以ph7.4、ph8.0的pbs缓冲溶液配制100u/ml的乙酰胆碱酯酶溶液和3mm靛酚乙酸酯溶液;依据实例1所测得各农药工作曲线情况,分别在水和乙腈溶剂中配制四种农药的标准溶液(共八种不同系列溶液)。所述每种条件下的农药标准溶液设置至少为4个以上不同浓度,具体浓度范围如表1所示:
(2-5)在如图1所示构型芯片的1个检测区内,滴入1.0μl的水作为空白对照区,剩余检测区分别滴入1.0μl不同浓度的辛硫磷(水)标准溶液及a-1待测液;自然晾干后,在各个检测区分别滴加1.0μl酶溶液,并在空气中静置10min,使得样品和酶充分接触、反应;之后,从芯片的中心区加入25μl的靛酚乙酸酯溶液,待其浸润所有检测区后,将芯片整体放入密闭盒中孵育,5min后从盒内取出并吹干芯片表面后,以扫描仪对整个芯片进行图像扫描,记录各检测区的颜色数据。
(2-6)利用photoshop图像处理软件,读取上述芯片的扫描图像中各检测区的灰度值数据。在origin8.0软件中,对标准溶液浓度及其对应灰度数据进行hill1拟合,得到辛硫磷(水)在芯片上酶抑制反应的工作曲线。进一步依据此工作曲线及a-1检测区灰度值数据,计算a-1待测样品中辛硫磷浓度和回收率。
(2-7)以辛硫磷(乙腈)替代辛硫磷(水)标准溶液、a-2替代a-1待测液,重复上述(2-5)及(2-6)步骤,计算得到a-2待测样品辛硫磷浓度和回收率水平。(2-8)分别以甲萘威、克百威、甲胺磷替代辛硫磷,重复上述(2-5)~(2-7)步骤,测得b-1,b-2,c-1,c-2,d-1,d-2相应农药的浓度和回收率水平。具体检测结果如表2所示:
表2生菜中不同农药加标回收率结果
a.生菜样品中的加标浓度;具体加标浓度水平由实施例1实验结果及农药残留限量确定。
对比表2中的四种不同农药分别在水和乙腈两种前处理提取条件下的回收率情况,可以明显看出,乙腈提取可以显著提高检测的回收率水平,且不同农药的回收率水平相对稳定,四种农药回收率均在75.2%~111.7%之间;相比之下,水的提取效果明显较差,不仅回收率水平整体低于乙腈提取组,且不同的农药回收率水平差异巨大,四种农药回收率最低值为18.6%(辛硫磷),最高值为73.2%(甲胺磷),不同农药间回收率水平的差异显然会影响检测结果的可靠性。由此可见,本发明方法对实际样品的加标回收率情况显著优于目前市场上普遍使用的方法,应用有机溶剂前处理在农药残留快速检测中意义重大,本发明方法实现了有机溶剂前处理和酶反应检测的有机结合,有重要应用价值。
实施例3
本发明所建立的方法不仅可用于检测固体样品,对于各类水体及饮料中的农药残留也可以实现快速测定。
国家限量标准中对环境及生活用水、果汁等样品中有机磷及氨基甲酸酯类农药残留水平的限量在0.05mg/kg以下,远低于现有快检方法的检测限,应用目前市面上的常规检测方法较难进行简便的现场快速筛查检测。而在本发明方法中,由于酶抑制检测可以与有机溶剂兼容,可通过采用与水不互溶的有机溶剂提取、缩小溶剂/样品比来实现对目标农药的提取与浓缩,从而整体上提高检测灵敏度。这在水溶性较差的氨基甲酸酯类农药的快速检测中效果尤其明显。
应用本发明所提供的检测方法,申请者在苹果汁中加入低至0.02mg/l的甲萘威农药,然后用乙酸乙酯进行提取,乙酸乙酯与苹果汁的体积比为1:20,摇匀静置后取上层有机溶剂进行检测,设置三个直径为5mm的圆形的亲水检测区,分别加入不含农药的苹果汁(空白对照)、含甲萘威苹果汁未经浓缩直接加样、含甲萘威苹果汁经乙酸乙酯浓缩提取再加样,加样量均为1.0μl,自然晾干后,在各个检测区分别滴加1.0μl酶溶液,并在空气中静置10min,之后,向各个检测区分别滴加1.2μl的靛酚乙酸酯溶液,待其浸润所有检测区后,将芯片整体放入密闭盒中孵育,5min后从盒内取出并吹干芯片表面后,所得检测区图像如图3所示,图3中的a、b、c分别为不含农药的苹果汁(空白对照)、含甲萘威苹果汁未经浓缩的样品、含甲萘威苹果汁经乙酸乙酯浓缩提取的样品。三者颜色通过肉眼对比,b和a颜色相近,判定为阴性(即不含农药),与样品实际情况不符,为假阴性;c明显比a颜色浅,判定为阳性(即含有农药),与样品实际情况相符。结果表明,本发明方法可以检测出低至0.02mg/l的微量农药,检测限显著降低,检测的准确度和灵敏度提高。
- 还没有人留言评论。精彩留言会获得点赞!