一种二氢硫辛酸琥珀酰转移酶抑制剂的筛选方法与流程
本发明涉及的是生物化学领域,涉及一种二氢硫辛酸琥珀酰转移酶抑制剂的筛选方法,具体地说,涉及一种二氢硫辛酸琥珀酰转移酶抑制剂的离体及活体筛选方法。
背景技术:
二氢硫辛酸琥珀酰转移酶(dlst)作为α-酮戊二酸脱氢酶复合体(α-ketoglutaratedehydrogenasecomplex)的核心组成部分,在催化α-酮戊二酸转换成琥珀酰辅酶a过程中发挥着关键作用,是三羧酸循环(tca)的重要组成部分[1-3]。研究表明dlst蛋白与多种疾病的发生密切相关,如阿尔茨海默病[4-6]、白血病[7]、心血管疾病[8]等,因此dlst蛋白是一种重要的疾病治疗靶标,dlst抑制剂成为疾病治疗相关的潜在药物。当前,高效、高选择性的dlst抑制剂几乎没有,因而导致对dlst的功能研究面临极大的挑战。
近年来,cpi613作为一种α-酮戊二酸脱氢酶复合体抑制剂,目前已被用于治疗白血病和非小细胞肺癌的临床实验[9-10]。cpi613是一种硫辛酸类似物,通过与硫辛酸竞争性结合dlst从而抑制dlst活性,但同时cpi613也能抑制丙酮酸脱氢酶复合体的活性,其选择性欠缺,因而亟需开发高效、专一的dlst抑制剂。然而由于缺乏有效的dlst抑制剂筛选平台,目前对dlst抑制剂的研发仍然十分艰难,因此构建一种高效的dlst抑制剂筛选方法对于dlst抑制剂的开发及其功能研究具有十分重要的意义。
本申请所引用背景技术文献如下所示:
[1]yang,l.;shi,q.;ho,d.j.;starkov,a.a.;wille,e.j.;xu,h.;chen,h.l.;zhang,s.;stack,c.m.;calingasan,n.y.;gibson,g.e.;beal,m.f.micedeficientindihydrolipoylsuccinyltransferaseshowincreasedvulnerabilitytomitochondrialtoxins.neurobiol.dis.,2009,36,320-330.
[2]starkov,a.a.anupdateontheroleofmitochondrialα-ketoglutaratedehydrogenaseinoxidativestress.mol.cell.neurosci.,2013,55,13-16.
[3]guo,h.;madzak,c.;du,g.;zhou,j.mutagenesisofconservedactivesiteresiduesofdihydrolipoamidesuccinyltransferaseenhancestheaccumulationofα-ketoglutarateinyarrowialipolytica.appl.microbiol.biotechnol.,2016,100,649-659.
[4]gibson,g.e.;blass,j.p.;beal,m.f.;bunik,v.theα-ketoglutarate-dehydrogenasecomplex.mol.neurobiol.,2005,31,43-63.
[5]dumont,m.;ho,d.j.;calingasan,n.y.;xu,h.;gibson,g.;beal,m.f.mitochondrialdihydrolipoylsuccinyltransferasedeficiencyacceleratesamyloidpathologyandmemorydeficitinatransgenicmousemodelofamyloiddeposition.freeradic.biol.med.,2009,47,1019-1027.
[6]gibson,g.e.;starkov,a.;blass,j.p.;ratan,r.r.;beal,m.f.causeandconsequence:mitochondrialdysfunctioninitiatesandpropagatesneuronaldysfunction,neuronaldeathandbehavioralabnormalitiesinage-associatedneurodegenerativediseases.biochim.biophys.acta,2010,1802,122-134.
[7]anderson,n.m.;li,d.;peng,h.l.;laroche,f.j.f.;mansour,m.r.;gjini,e.;aioub,m.;helman,d.j.;roderick,j.e.;cheng,t.;harrold,i.;samaha,y.;meng,l.;amsterdam,a.;neuberg,d.s.;denton,t.t.;sanda,t.;kelliher,m.a.;singh,a.;look,a.t.;feng,h.thetcacycletransferasedlstisimportantformyc-mediatedleukemogenesis.leukemia,2016,30,1365-1374.
[8]heggermont,w.a.;papageorgiou,a.p.;quaegebeur,a.;deckx,s.;carai,p.;verhesen,w.;eelen,g.;schoors,s.;vanleeuwen,r.;alekseev,s.;elzenaar,i.;vinckier,s.;pokreisz,p.;walravens,a.s.;gijsbers,r.;haute,c.v.d.;nickel,a.;schroen,b.;vanbilsen,m.;janssens,s.;maack,c.;pinto,y.;carmeliet,p.;heymans,s.inhibitionofmicrorna-146aandoverexpressionofitstargetdihydrolipoylsuccinyltransferaseprotectagainstpressureoverload-inducedcardiachypertrophyanddysfunction.circulation,2017,136,747–761.
[9]lycan,t.w.;pardee,t.s.;petty,w.j.;bonomi,m.;alistar,a.;lamar,z.s.;isom,s.;chan,m.d.;miller,a.a.;ruiz,j.aphaseiiclinicaltrialofcpi-613inpatientswithrelapsedorrefractorysmallcelllungcarcinoma.plosone,2016,11:e0164244.
[10]pardee,t.s.;lee,k.;luddy,j.;maturo,c.;rodriguez,r.;isom,s.;miller,l.d.;stadelman,k.m.;levitan,d.;hurd,d.;ellis,l.r.;harrelson,r.;manuel,m.;dralle,s.;lyerly,s.;powell,b.l.aphaseistudyofthefirst-in-classantimitochondrialmetabolismagent,cpi-613,inpatientswithadvancedhematologicmalignancies.clin.cancerres.2014,20,5255–5264.
技术实现要素:
本发明的目的之一在于提供一种dlst抑制剂。
本发明的另一目的在于提供一种含有上述dlst抑制剂的组合物。
本发明还有一目的在于提供所述dlst抑制剂的用途。
本发明还有一目的在于提供一种dlst抑制剂的筛选方法。
本发明提供的方法不仅适用于离体条件下dlst抑制剂的筛选,同时适用于活细胞中dlst抑制剂的筛选。
为实现上述发明目的,本发明采用的技术方案如下:
一种二氢硫辛酸琥珀酰转移酶抑制剂的筛选方法,包括:用抑制剂预处理离体或活体介质得到预处理反应体系的步骤;所述离体或活体介质选自细胞裂解物、二氢硫辛酸琥珀酰转移酶或病菌;优选地,所述离体或活体介质选自水稻白叶枯病菌细胞裂解物、柑橘溃疡病菌细胞裂解物、重组水稻白叶枯病菌二氢硫辛酸琥珀酰转移酶、水稻白叶枯病菌、柑橘溃疡病菌。
优选地,还包括使用探针处理所述预处理反应体系。
优选地,所述抑制剂为
优选地,所述探针为下述式i化合物所示:
其中r1选自任意取代的亚烷基、亚氨基、任意取代的亚烯基、任意取代的亚炔基、任意取代的亚环烷基、任意取代的亚芳基或任意取代的亚杂芳基;优选地,选自任意取代的c1-6亚烷基、任意取代的c1-6亚芳基;更优选地,选自亚甲基、亚乙基、亚丙基、亚异丙基、亚丁基、亚仲丁基、亚戊基、亚邻苯基、亚间苯基、亚对苯基、亚邻噻吩基、亚间噻吩基、亚邻呋喃基、亚间呋喃基、亚邻吡啶基、亚间吡啶基、亚对吡啶基、亚萘基、亚蒽基、亚卤代苯基;最优选地,选自
r2选自氢、烷基、烯基、炔基、环烷基、芳基、杂芳基;优选地,选自c1-6烷基或c1-6芳基;更优选地,选自甲基、乙基、丙基、异丙基、丁基、仲丁基、戊基或苯基。
最优选地,所述探针化合物选自下述化合物:
探针1:2-(甲磺酰基)-5-(4-氟-3-(丙炔基氧基)甲基)苯基-1,3,4-噁二唑;
探针2:2-(乙磺酰基)-5-(4-氟-3-(丙炔基氧基)甲基)苯基-1,3,4-噁二唑;
探针3:2-(甲磺酰基)-5-(3-(丙炔基氧基)甲基)苯基-1,3,4-噁二唑;
探针4:2-(乙磺酰基)-5-(3-(丙炔基氧基)甲基)苯基-1,3,4-噁二唑;
探针5:2-(甲磺酰基)-5-(2,4-二氯-3-(丙炔基氧基)甲基)苯基-1,3,4-噁二唑;
探针6:2-(乙磺酰基)-5-(2,4-二氯-3-(丙炔基氧基)甲基)苯基-1,3,4-噁二唑。
优选地,还包括经探针处理后的体系在biotin-n3存在下进行化学反应。
优选地,还包括进行成像反应分析的步骤。
更优选地,所述的筛选方法,具体包含以下步骤:
(1)通过超声破碎法提取植物病原细菌总蛋白;
(2)将待筛选的二氢硫辛酸琥珀酰转移酶抑制剂与病原菌总蛋白在25℃下孵育2h,空白组用dmso处理,然后用能标记二氢硫辛酸琥珀酰转移酶的探针分别处理总蛋白2h;
(3)分别向上述体系中加入biotin-n3、抗坏血酸钠以及bttaa/cuso4混合溶液,在37℃下进行点击化学反应;
(4)将样品分别进行sds-page后在冰浴条件下转膜50min,经5%脱脂奶粉封闭2h后在4℃下孵育hrp-conjugatedstreptavidin,加入化学发光底物后进行成像分析;
或,
(1)将二氢硫辛酸琥珀酰转移酶进行体外重组表达;
(2)将待筛选的二氢硫辛酸琥珀酰转移酶抑制剂与重组表达的二氢硫辛酸琥珀酰转移酶在25℃下孵育2h,空白组用dmso处理,然后分别向上述重组二氢硫辛酸琥珀酰转移酶体系中加入能标记二氢硫辛酸琥珀酰转移酶的探针进行标记;
(3)分别向上述体系中加入biotin-n3、抗坏血酸钠以及bttaa/cuso4混合溶液,在37℃下进行点击化学反应;
(4)将样品分别进行sds-page后在冰浴条件下转膜50min,经5%脱脂奶粉封闭2h后在4℃下孵育hrp-conjugatedstreptavidin,加入化学发光底物后进行成像分析;
或,
(1)将待筛选的二氢硫辛酸琥珀酰转移酶抑制剂与植物病原细菌在25℃下孵育2h,空白组用dmso处理。再分别加入能标记二氢硫辛酸琥珀酰转移酶的探针处理细胞2h;
(2)分别将细胞离心后进行超声破碎,然后分别向上清中分别加入biotin-n3、抗坏血酸钠以及bttaa/cuso4混合溶液,在37℃下进行点击化学反应;
(3)将样品分别进行sds-page后在冰浴条件下转膜50min,经5%脱脂奶粉封闭2h后在4℃下孵育hrp-conjugatedstreptavidin,加入化学发光底物后进行成像分析。
一种组合物,其含有
化合物
进一步地,本发明还公开了:
一种直接在复杂的蛋白质组中筛选dlst抑制剂的方法,具体包含以下步骤:
(1)通过超声破碎法提取植物病原细菌总蛋白;
(2)将待筛选的dlst抑制剂与病原菌总蛋白在25℃下孵育2h,空白组用dmso处理,然后用能标记dlst的探针1或2分别处理总蛋白2h;
(3)分别向上述体系中加入biotin-n3、抗坏血酸钠以及bttaa/cuso4混合溶液,在37℃下进行点击化学反应;
(4)将样品分别进行sds-page后在冰浴条件下转膜50min,经5%脱脂奶粉封闭2h后在4℃下孵育hrp-conjugatedstreptavidin,加入化学发光底物后进行成像分析。通过比较空白组与实验组中探针1或2对dlst标记强度的差异来筛选抑制剂。若实验组中探针1或2对dlst的标记强度明显弱于空白组,则表明所用抑制剂对dlst具有显著抑制活性。若标记强度无明显差异,则说明抑制剂对dlst无显著抑制活性。
一种通过重组表达的dlst在体外筛选dlst抑制剂的方法,具体包含以下步骤:
(1)将dlst在大肠杆菌进行体外重组表达;
(2)将待筛选的dlst抑制剂与重组表达的dlst在25℃下孵育2h,空白组用dmso处理,然后分别向上述体系中加入能标记dlst的探针1或2进行标记;
(3)分别向上述体系中加入biotin-n3、抗坏血酸钠以及bttaa/cuso4混合溶液,在37℃下进行点击化学反应;
(4)将样品分别进行sds-page后在冰浴条件下转膜50min,经5%脱脂奶粉封闭2h后在4℃下孵育hrp-conjugatedstreptavidin,加入化学发光底物后进行成像分析。通过比较空白组与实验组中探针1或2对dlst标记强度的差异来筛选抑制剂。若实验组中探针1或2对dlst的标记强度明显弱于空白组,则表明所用抑制剂对dlst具有显著抑制活性。若标记强度无明显差异,则说明抑制剂对dlst无显著抑制活性。
一种直接在活细胞中筛选dlst抑制剂的方法,具体包含以下步骤:
(1)将待筛选的dlst抑制剂与植物病原细菌在25℃下孵育2h,空白组用dmso处理。再分别加入能标记dlst的探针1或2处理细胞2h;
(2)分别将细胞离心后进行超声破碎,然后分别向上清中分别加入biotin-n3、抗坏血酸钠以及bttaa/cuso4混合溶液,在37℃下进行点击化学反应;
(3)将样品分别进行sds-page后在冰浴条件下转膜50min,经5%脱脂奶粉封闭2h后在4℃下孵育hrp-conjugatedstreptavidin,加入化学发光底物后进行成像分析。通过比较空白组与实验组中探针1或2对dlst标记强度的差异来筛选抑制剂。若实验组中探针1或2对dlst的标记强度明显弱于空白组,则表明所用抑制剂对dlst具有显著抑制活性。若标记强度无明显差异,则说明抑制剂对dlst无显著抑制活性。
本发明的有益效果:
本发明首次报道了一种dlst抑制剂的筛选方法,能同时实现在离体及活体条件下对dlst抑制剂的筛选,并且通过本发明提供的方法发现甲磺酰菌唑是一种有效的dlst抑制剂。
附图说明
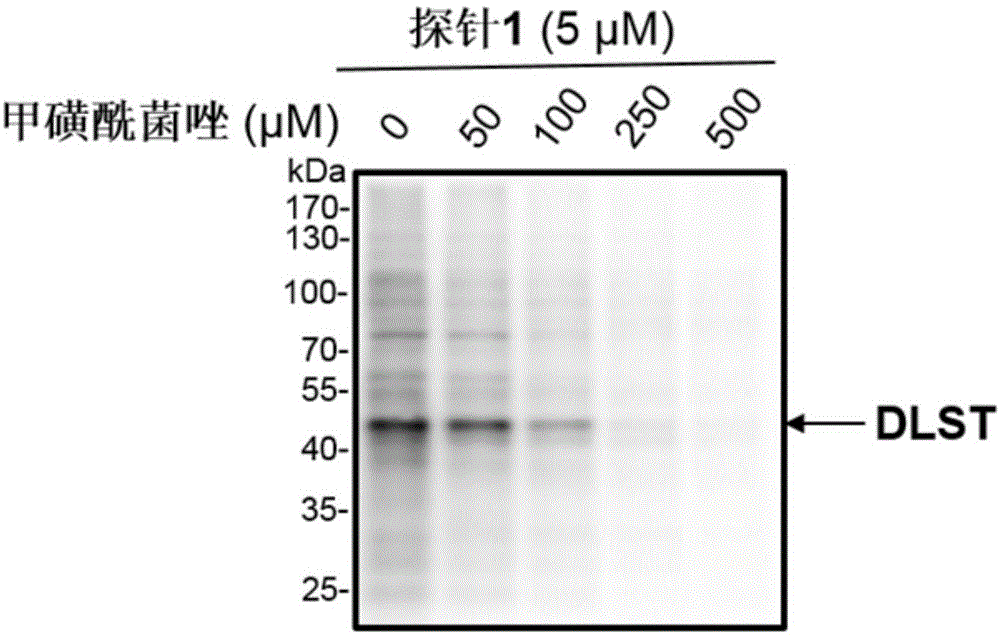
图1;甲磺酰菌唑对水稻白叶枯病菌(xoo)总蛋白的离体筛选结果;
图2;甲磺酰菌唑对柑橘溃疡病菌(xac)总蛋白的离体筛选结果;
图3;甲磺酰菌唑对重组表达dlst的离体筛选结果;
图4;甲磺酰菌唑对水稻白叶枯病菌(xoo)的活体筛选结果;
图5;甲磺酰菌唑对柑橘溃疡病菌(xac)的活体筛选结果;
图6:本发明筛选方法流程图。
实施例
下面通过实施例对本发明作进一步说明。应该理解的是,本发明实施例所述方法仅仅是用于说明本发明,而不是对本发明的限制,在本发明的构思前提下对本发明制备方法的简单改进都属于本发明要求保护的范围。实施例中用到的所有原料和溶剂均为市售相应纯度产品。
甲磺酰菌唑,其化学名称为2-(4-氟苯基)-5-甲磺酰基-1,3,4-噁二唑,是贵州大学自主研发的新型杀菌剂,专利号为zl2011103142462,对多种植物病原菌均具有广谱、高效的抑菌活性,具有良好的开发前景。其结构式为:
实施例1:甲磺酰菌唑对水稻白叶枯病菌(xoo)总蛋白的离体筛选结果
取100mlod600=0.6的xoo菌液,7500rpm下离心10min,弃上清,然后用pbs洗涤3次。取10mlpbs(ph=7.2)重悬细胞,将离心管置于冰上进行超声破碎,通过bradford法测蛋白浓度,然后稀释至1mg/ml。取43μl总蛋白,向其中加入1μl不同浓度的甲磺酰菌唑,使其终浓度分别为50、100、250、500μm,空白组加入等体积dmso,分别在25℃下孵育2h。然后分别加入5μm探针1,继续孵育2h。分别向上述体系中加入biotin-n3、抗坏血酸钠及bttaa/cuso4混合溶液进行click反应。2h后再分别向体系中加入2×loadingbuffer,在95℃下煮沸10min。分别取10μg样品进行sds-page,然后在200ma恒流下转膜50min,pbst洗膜后用5%脱脂奶粉封闭2h。将膜用pbst清洗后加入hrp标记的链霉亲和素(hrp-streptavidin)孵育2h,然后加入hrp标记的链霉亲和素(hrp-streptavidin)孵育2h,经pbst洗膜后加入化学发光试剂,最后通过化学发光成像系统进行成像分析(如图1)。从图1中可以看出,与空白对照组相比,实验组随着甲磺酰菌唑浓度的增加,探针1对dlst的标记强度逐渐减弱,说明甲磺酰菌唑在离体条件下能有效抑制dlst活性。
实施例2:甲磺酰菌唑对柑橘溃疡病菌(xac)总蛋白的离体筛选结果
取100mlod600=0.6的xac菌液,7500rpm下离心10min,弃上清,然后用pbs洗涤3次。取10mlpbs(ph=7.2)重悬细胞,将离心管置于冰上进行超声破碎,通过bradford法测蛋白浓度,然后稀释至1mg/ml。取43μl总蛋白,向其中加入1μl不同浓度的甲磺酰菌唑,使其终浓度分别为10、25、50、100、250μm,空白组加入等体积dmso,分别在25℃下孵育2h。然后分别加入50μm探针2,继续孵育2h。分别向上述体系中加入biotin-n3、抗坏血酸钠及bttaa/cuso4混合溶液进行点击化学反应。2h后再分别向体系中加入2×loadingbuffer,在95℃下煮沸10min。分别取10μg样品进行sds-page,然后在200ma下转膜50min,pbst洗膜后用5%脱脂奶粉封闭2h。将膜用pbst清洗后加入hrp标记的链霉亲和素(hrp-streptavidin)孵育2h,然后加入hrp标记的链霉亲和素(hrp-streptavidin)孵育2h,经pbst洗膜后加入化学发光试剂,最后通过化学发光成像系统进行成像分析(如图2)。从图2中可以看出,与空白对照组相比,实验组随着甲磺酰菌唑浓度的增加,探针2对dlst的标记强度逐渐减弱,说明甲磺酰菌唑在离体条件下能有效抑制xac中dlst活性。
实施例3:甲磺酰菌唑对重组表达dlst的离体筛选结果
以pet28a为载体构建重组质粒,将其导入bl21菌株中后扩大培养,经ni柱亲和纯化后再通过thrombin酶切,最后通过分子筛纯化得到重组dlst。取25ng重组dlst,加入biotin-n3、抗坏血酸钠及bttaa/cuso4混合溶液进行点击化学反应。再分别向体系中加入2×loadingbuffer后在95℃下煮沸10min。分别取12.5ng重组dlst进行sds-page,然后在200ma下转膜50min,pbst洗膜后用5%脱脂奶粉封闭2h。将膜用pbst清洗后加入hrp标记的链霉亲和素(hrp-streptavidin)孵育2h,然后加入hrp标记的链霉亲和素(hrp-streptavidin)孵育2h,经pbst洗膜后加入化学发光试剂,最后通过化学发光成像系统进行成像分析(如图3)。从图3中可以看出,与空白对照组相比,实验组随着甲磺酰菌唑浓度的增加,探针2对重组dlst的标记强度逐渐减弱,说明甲磺酰菌唑能有效抑制重组dlst活性。
实施例4:甲磺酰菌唑对水稻白叶枯病菌(xoo)的活体筛选结果
分别取2mlod600=0.6的xoo菌液,离心后弃上清,用pbs(ph=7.2)重悬细胞,再分别向体系中加入25、50、100、250、500μm甲磺酰菌唑处理2h,空白组用dmso处理。然后分别加入5μm探针1,继续孵育2h。离心后弃上清,经pbs洗涤3次后再分别加入100μlpbs重悬细胞,将细胞分别进行超声破碎,在12000rpm下离心30min,上清经bradford法测蛋白浓度后将蛋白稀释至1μg/μl。分别取45μl上清,分别加入biotin-n3、抗坏血酸钠及bttaa/cuso4混合溶液进行点击化学反应,再分别向样品中加入等体积2×loadingbuffer,95℃下煮沸10min。分别取10μg样品进行sds-page,然后在200ma下转膜50min,pbst洗膜后用5%脱脂奶粉封闭2h。将膜用pbst清洗后加入hrp标记的链霉亲和素(hrp-streptavidin)孵育2h,然后加入hrp标记的链霉亲和素(hrp-streptavidin)孵育2h,经pbst洗膜后加入化学发光试剂,最后通过化学发光成像系统进行成像分析(如图4)。从图4中可以看出,与空白对照组相比,实验组随着甲磺酰菌唑浓度的增加,探针1对dlst的标记强度逐渐减弱,说明甲磺酰菌唑在xoo细胞中能有效抑制dlst活性。
实施例5:甲磺酰菌唑对柑橘溃疡病菌(xac)的活体筛选结果
分别取2mlod600=0.6的xac菌液,离心后弃上清,用0.98mlpbs(ph=7.2)重悬细胞,再分别向体系中加入10、25、50、100、250μm甲磺酰菌唑处理2h,空白组用dmso处理。然后分别加入5μm探针2,继续孵育2h。离心后弃上清,经pbs洗涤3次后再分别加入100μlpbs重悬细胞,将细胞分别进行超声破碎,在12000rpm下离心30min,上清经bradford法测蛋白浓度后将蛋白稀释至1μg/μl。分别取45μl上清,分别加入biotin-n3、抗坏血酸钠及bttaa/cuso4混合溶液进行点击化学反应,再分别向样品中加入等体积2×loadingbuffer,95℃下煮沸10min。分别取10μg样品进行sds-page,然后在200ma下转膜50min,pbst洗膜后用5%脱脂奶粉封闭2h。然后加入hrp标记的链霉亲和素(hrp-streptavidin)孵育2h,经pbst洗膜后加入化学发光试剂,最后通过化学发光成像系统进行成像分析(如图5)。从图5中可以看出,与空白对照组相比,实验组随着甲磺酰菌唑浓度的增加,探针2对dlst的标记强度逐渐减弱,说明甲磺酰菌唑在xac细胞中能有效抑制dlst活性。
实施例6:探针1-6的制备
(1)取0.20mol不同取代的苯甲酸于250ml圆底烧瓶中,向其中加入20倍当量的甲醇和4ml98%浓硫酸,然后回流反应4-6h。减压蒸馏除掉甲醇后用硅胶拌样,通过柱层析提纯得到化合物1,收率96-99%。
(2)取0.15mol化合物1于100ml圆底烧瓶中,向其中加入2.5倍当量的80%水合肼,回流反应2h。待体系冷却后,有白色固体析出,水洗后烘干得到化合物2,收率77-91%。
(3)取0.15mol化合物2于250ml圆底烧瓶中,向其中加入2倍当量的koh和100ml乙醇,搅拌溶解后滴加2倍当量cs2,常温搅拌8h后回流反应24-36h。减压蒸馏除掉乙醇后在冰浴下用5%稀盐酸调节ph至4-5,抽滤后得到粗产物3。
(4)取0.10mol粗产物3于100ml圆底烧瓶,向其中加入含0.20molkoh的50ml水溶液,缓慢滴加2倍当量硫酸二甲(乙)酯,室温搅拌2h。将体系抽滤后得到黄色固体,取少量乙酸乙酯溶解后硅胶拌样,柱层析提纯后得到化合物4,两步收率36-53%。
(5)取0.03mol化合物4于100ml圆底烧瓶中,向其中50ml干燥ccl4,然后加入1.2倍当量的nbs和0.1倍当量aibn,回流反应48h。将反应体系抽滤除掉不溶物后减压蒸馏除掉ccl4,取少量ch2cl2溶解固体后硅胶拌样,经柱层析提纯得到化合物5,收率43-77%。
(6)取5mmol化合物5和1.1倍当量炔丙醇于100ml圆底烧瓶中,向其中加入20ml无水dmf,冰浴下搅拌溶解,然后加入1.2倍当量nah反应2h。向体系中加入饱和20ml氯化铵溶液和60ml乙酸乙酯萃取,水相用50ml乙酸乙酯萃取2次后合并有机相,减压蒸馏除掉溶剂后用硅胶拌样,经柱层析提纯后得到化合物6,收率43-66%。
(7)取5mmol化合物6溶解于15ml干燥ch2cl2,冰浴下搅拌溶解,然后向体系中加入3倍当量的mcpba反应2h。将反应体系抽滤除掉固体不溶物,减压蒸馏除掉部分ch2cl2,剩下的体系用硅胶拌样,经柱层析提纯后得到目标产物探针1-6,收率40-70%。
反应流程如下所示:
探针1-6的结构表征如下:
探针1:2-(甲磺酰基)-5-(4-氟-3-(丙炔基氧基)甲基)苯基-1,3,4-噁二唑;1hnmr(500mhz,cdcl3)δ8.26(dd,j=6.6,2.2hz,1h),8.10(ddd,j=8.5,4.8,2.3hz,1h),7.25(t,j=8.9hz,1h),4.74(s,2h),4.30(d,j=2.4hz,2h),3.53(s,3h),2.52(t,j=2.4hz,1h).13cnmr(125mhz,cdcl3)δ165.89,164.48,162.43,162.23,129.89,129.57,127.10,118.53,116.95,78.98,75.54,64.53,58.24,43.08.hrms(esi)calculatedforc13h11fn2o4s[m+h]+m/z311.0496,found311.0493.
探针2:2-(乙磺酰基)-5-(4-氟-3-(丙炔基氧基)甲基)苯基-1,3,4-噁二唑;1hnmr(500mhz,cdcl3)δ8.26(dd,j=6.6,2.3hz,1h),8.10(ddd,j=8.5,4.8,2.3hz,1h),7.25(t,j=8.9hz,1h),4.75(s,2h),4.31(d,j=2.4hz,2h),3.62(q,j=7.4hz,2h),2.52(t,j=2.4hz,1h),1.55(t,j=7.4hz,3h).13cnmr(125mhz,cdcl3)δ165.90,164.46,162.42,161.42,129.90,129.56,127.08,118.59,116.92,78.98,75.50,64.50,58.23,50.16,6.92.hrms(esi)calculatedforc14h13fn2o4s[m+h]+m/z325.0653,found325.0648.
探针3:2-(甲磺酰基)-5-(3-(丙炔基氧基)甲基)苯基-1,3,4-噁二唑;1hnmr(500mhz,cdcl3)δ8.12(d,j=8.4hz,2h),7.55(d,j=8.5hz,2h),4.70(s,2h),4.26(d,j=2.4hz,2h),3.53(s,3h),2.51(t,j=2.4hz,1h).13cnmr(125mhz,cdcl3)δ166.57,162.17,143.50,128.49,127.96,121.44,79.21,75.28,70.78,57.88,43.08.hrms(esi)calculatedforc13h12n2o4s[m+h]+m/z293.0591,found293.0587.
探针4:2-(乙磺酰基)-5-(3-(丙炔基氧基)甲基)苯基-1,3,4-噁二唑;1hnmr(500mhz,cdcl3)δ8.11(d,j=8.3hz,2h),7.55(d,j=8.1hz,2h),4.70(s,2h),4.25(d,j=2.3hz,2h),3.61(q,j=7.4hz,2h),2.50(t,j=2.4hz,1h),1.54(t,j=7.4hz,3h).13cnmr(125mhz,cdcl3)δ166.59,161.37,143.47,128.47,127.94,121.53,79.22,75.25,70.79,57.87,50.17,6.91.hrms(esi)calculatedforc14h14n2o4s[m+h]+m/z307.0747,found307.0744.
探针5:2-(甲磺酰基)-5-(2,4-二氯-3-(丙炔基氧基)甲基)苯基-1,3,4-噁二唑;1hnmr(500mhz,cdcl3)δ7.93(d,j=8.5hz,1h),7.54(d,j=8.5hz,1h),4.97(s,2h),4.30(d,j=2.4hz,2h),3.54(s,3h),2.52(t,j=2.4hz,1h).13cnmr(125mhz,cdcl3)δ164.55,162.69,141.97,136.88,135.66,132.18,129.01,121.33,79.12,75.33,66.34,58.53,43.07.hrms(esi)calculatedforc13h10n2o4scl2[m+h]+m/z360.9811,found360.9807.
探针6:2-(乙磺酰基)-5-(2,4-二氯-3-(丙炔基氧基)甲基)苯基-1,3,4-噁二唑;1hnmr(500mhz,cdcl3)δ7.93(d,j=8.5hz,1h),7.54(d,j=8.5hz,1h),4.97(s,2h),4.30(d,j=2.4hz,2h),3.62(q,j=7.5hz,2h),2.52(t,j=2.4hz,1h),1.56(t,j=7.4hz,3h).13cnmr(125mhz,cdcl3)δ164.60,161.94,141.92,136.84,135.64,132.18,129.00,121.42,79.12,75.30,66.33,58.51,50.25,6.94.hrms(esi)calculatedforc14h12n2o4scl2[m+h]+m/z374.9968,found374.9966.
以上所述仅为本发明的优选实施例,本发明的实施方式并不受上述实施例的限制。对于本领域的技术人员,在不脱离本发明原理的前提下仍然可以继续做出改进,这些改进也应包含在本发明的保护范围之内。
- 还没有人留言评论。精彩留言会获得点赞!