纳流分馏器装置的制作方法
本实用新型一般涉及色谱,并且更具体地说,涉及多维纳流色谱。
背景技术:
蛋白质组学旨在全面覆盖空间和时间的细胞蛋白质组。自成立以来,自下而上的蛋白质组学旨在从细胞、组织或整个生物体中鉴定和量化完整的蛋白质组(wilhelm,m.等人,基于质谱分析的人类蛋白质组草案(mass-spectrometry-baseddraftofthehumanproteome).《自然(nature)》.2014may29,509(7502),582-7)。尽管在过去15年中取得了许多进展,但仍有三个主要挑战需要克服。第一是通过在给定时间内鉴定所有表达的蛋白质来获得蛋白质组的完全覆盖(hebert,a.s.等人.1小时酵母蛋白质组(theonehouryeastproteome).《分子和细胞蛋白质组学(molcellproteomics)》.2014jan,13(1),339-47)。第二是使用有限量的样本进行工作,例如临床活组织检查(wu,x.等人.全球三阴性乳腺癌中的磷酸酪氨酸调查揭示多种酪氨酸激酶信号传导途径的激活(globalphosphotyrosinesurveyintriple-negativebreastcancerrevealsactivationofmultipletyrosinekinasesignalingpathways).《肿瘤标靶(oncotarget)》.2015),第三是实现足够的分析通量((livesay,e.a.等人.用于最大化蛋白质组学分析的通量的全自动四柱毛细管lc-ms系统(fullyautomatedfour-columncapillarylc-mssystemformaximizingthroughputinproteomicanalyses).《分析化学(analchem)》.2008jan1,80(1),294-302)。
色谱肽分离和串联质谱鉴定是现代蛋白质组学分析的支柱。了解蛋白质组的动态需要在整个细胞生命周期的不同条件和时间点进行此类分析。这种综合研究通常需要对许多单个样品进行质谱分析。此外,每个样品的自下而上蛋白质组学分析的主要实验目标是实现尽可能多的肽鉴定。因此,大多数此类研究需要以高效、高通量的方式进行。为了使问题进一步复杂化,任何样品中重要肽的丰度可以跨越几个数量级(cox,j.;mann,m.用于数据驱动系统生物学的定量、高分辨率蛋白质组学(quantitative,high-resolutionproteomicsfordata-drivensystemsbiology).《生物化学年鉴(annurevbiochem)》.2011,80,273-99.)。因此,为了区分构成给定细胞状态的最重要的蛋白质,需要在宽动态范围的检测中进行精确的肽测量。
为了在肽鉴定和定量中达到所需的分析效率水平,在质谱分析之前采用了所谓的多维色谱分离。多维度的概念意味着,对于每个样品,进行两次或更多次连续色谱分离,第一次色谱分离产生的馏分在随后的色谱分离中进一步分馏,其中第一次和后续的色谱分离是不同的类型或者其它使用不同的运行参数进行。自下而上的lc-ms(液相色谱,质谱)研究通常需要多维色谱分离,因为如果仅使用单次分离,那么在分馏期间的时间的任何点上呈现给质谱仪的共洗脱肽的总数通常会超过质谱仪可以通过串联质谱(ms/ms)分析+的肽的最大数量。ms/ms分析通常包括选择用于碎裂的离子物质、将选择的离子物质与其它离子物质隔离、使选择的和隔离的离子物质碎裂,从而产生碎片离子物质并分析特定的碎片离子物质。在仅包括单阶段色谱分离的典型情况下,仅有足够的时间来分析最丰富的肽离子物质,这种情况可能导致无法识别低丰度的重要肽物质的存在。
理想地,多维色谱分离的两个或更多个色谱分离是相互“正交的”。在这个意义上使用的正交性概念意味着第一次分离的结果与第二次分离的结果之间几乎没有相关性。换句话说,如果通过第一次分离保持未分离(就保留时间而言)的分析物通过第二次分离而广泛分离(再次,就保留时间而言),那么第一次和第二次色谱分离是正交的,反之亦然(当顺序逆转时)。通常,在色谱分离的第一维中,使用强阳离子交换色谱或高ph反相色谱来分馏肽。传统上,色谱分离的第一维是作为常规的高效液相色谱(hplc;以前称为高压液相色谱)程序在相对高的流速10μl/min-1ml/min下使用具有内径的大直径毛细管柱进行,该内径允许非常稳健和有效的分馏,但是需要相对大量的肽(例如,1-2mg总肽)。通过第一次分离产生的各种馏分暂时储存在相应的容器中,例如常规多孔板的各个100μl-500μl容量的孔中。随后,在典型的分离的第二维中,对每个孔的内容物进行低ph反相肽分离,其中将第二次分离得到的馏分直接转移到质谱仪中,按照常规lc-ms程序进行分析。
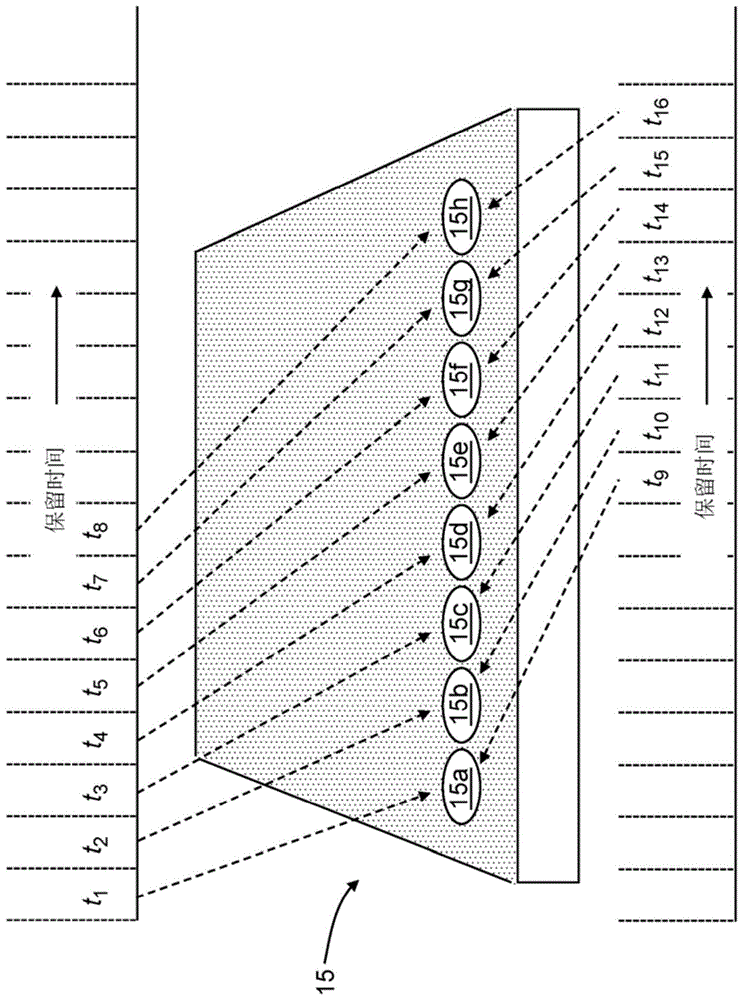
遗憾的是,通常采用的常见色谱分离形式基于固相和肽之间的疏水相互作用,因此不存在如上定义的完全“正交”分离。通常,当根据第一色谱程序分离时各种肽分析物的保留时间分离与根据不同色谱程序分离时相同分析物的保留时间分离之间存在至少部分相关性。为了减少这种部分保留时间相关性的有害影响,已经开发并利用了馏分汇集的概念。图1a示意性地示出了分馏汇集通常采用的方式。具体地说,图1a描述了典型的多孔板15的扩展部分(即,一特定排的孔),其中一假定排孔的各个孔标记为15a-15g。在多孔板部分的描绘的上方和下方示出了第一分离阶段的实验色谱时间线。色谱时间线被划分为总共十六个时间片,它们标记为t1至t16。时间线的每个时间片代表在第一个分馏阶段洗脱的一个馏分;源自每个分区的箭头指示哪个孔接收对应于相应分区的馏分。
从图1a中的示意图描绘,可以看出的是,根据馏分池,孔15a接收对应于时间片的t1和t9的样品馏分,孔15b接收对应于时间片t2和t10的样品馏分,孔15c接收对应于时间片t3和t11的样品馏分,等。将在下面描述汇集这类馏分的操作过程。尽管图1a中仅示出了十六种馏分的洗脱,但是根据操作程序,典型的色谱分离可以分成许多馏分(或者,可能,更少的馏分)。此外,尽管图1a中示出了总共八个馏分容器(例如,孔),但是除了包括两个或更多个这样的容器或孔的基本要求之外,不需要任何具体数量的容器或孔。无论馏分的具体数量或容器或孔的具体数量如何,应该注意的是,将馏分引入孔或其它容器中在所有孔或容器中重复地循环。换句话说,一旦一个孔已经接收了特定的馏分,下一馏分被引入该系列的下一个孔中,除了在最后一个孔(该实例中的孔15h)已经收到馏分之后,沿着时间轴的下一馏分被引入该系列的第一个孔(在该实例中为孔15a),从而开始新的孔填充循环。在图1a所示的实例中,每个孔可以接收几个馏分,其中每个孔内的馏分通过八个时间片的增量分开。例如,根据图1a中描绘的实例,在第一色谱分离的结束时,孔15a的内容物将包含馏分t1、t9、t17等;孔15b的内容物将包含馏分t2、t10、t18等;孔15c的内容物将包含馏分t3、t11、t19等,等等。
仍然参考图1a,应该注意的是,尽管在引入特定孔的每个馏分中可以包括多种共洗脱肽分析物,但是将减少来自前一个和后一个馏分中洗脱的分析物的干扰。例如,在图1a所示的实例中,第二孔(孔15b)接收馏分t2和t10等等。尽管第一多种分析物可以共洗脱在馏分t2中并且第二多种分析物可以共洗脱在馏分t10中。在孔15b的内容物的不同的第二色谱分离后,预期洗脱在馏分t2中的分析物和洗脱在馏分t10中的分析物之间没有干扰,因为通过第一次分离这两个馏分中的保留时间被广泛分离。此外,在第二阶段分馏后,在相邻的馏分t1、t3、t9和t11中来自可能更丰富的分析物的任何潜将被减少或完全消除。更进一步地,因为色谱分离的第一和第二阶段之间存在较不理想的保留时间的相关性(由实验设计),馏分t2的分析物的第二阶段洗脱将比在第一阶段分离更广泛分离彼此(在保留时间方面),同样对于馏分t10的分析物的洗脱。因此,作为多维色谱分离的结果,更有机会检测不太丰富的分析物,从而产生更宽的动态检测范围。
如上所述,即使采用多维色谱分离,第一次分离传统上通过常规毛细管hplc以高流速(在约10μl/分钟至1ml/分钟范围内)用大柱内径进行。然而,质谱分析是高度敏感的,通常每个馏分分析仅需要约200ng(纳克)总肽。每个馏分超过约200ng总肽的肽量会使质谱仪过载。因此,由于各种原因,传统的多维lc-ms分析可能是低效的。首先,稀释步骤是样品制备程序的必要部分。在稀释和分馏的第一阶段之后,可能需要冻干步骤以将肽分析物与过量的稀释剂分离;这种冻干之后可以是延长的干燥时间以蒸发稀释剂。作为一个实例,具有100μl容量孔的常规96孔板通常需要5-6小时的干燥时间,以便完全蒸发9.6ml(毫升)的总溶剂量。
事实证明,所谓的纳米色谱在提高lc-ms效率方面特别成功。如果在高压(>300巴)下进行,纳米色谱法通常采用内径为50-150μm的熔融二氧化硅毛细管,其填充有2-3μm的二氧化硅颗粒和反相固定相。如果通过使用官能化的整料代替二氧化硅颗粒在较低的背压下进行分离,那么可以使用其它材料如聚醚醚酮(peek)来保持固定相。通常,使用含有0.1%甲酸的水/乙腈梯度,第一阶段分离利用通过75μm内径毛细管的200至400nl/min(纳升/min)的流动相流速。本发明人的目标是利用这种纳米流技术从可获得大量蛋白质的样品中获取丰富的蛋白质组数据,并进一步将该技术的使用扩展到样品可用性稀缺的应用中,如分析稀有细胞亚群、激光显微切割样品等。为了实现这些目标,预分馏阶段需要采用纳流系统(即采用高压、柱内径等的纳米色谱法)。
图1b是用于将样品纳米色谱分离成各种馏分的已知系统1的示意性实例,其中每个馏分含有少于约1微克的分析物材料。在系统1中,样品9在注射器7处注入流动相溶液的高压色谱流中,注射器7包含多端口注射阀10和低压内注射泵8。泵8从样品容器中抽取一部分样品9,所述样品容器如烧杯、小瓶、试管或多孔取样板的孔。然后泵将样品部分分配到多端口注射阀10的端口中,而阀门处于使样品被输送到管11中第一配置,管11的每个端部联接到多端口注射阀10的相应的其它端口。从容器中抽取样品的一部分,将样品转移到多端口注射阀并将样品部分分配到其上的过程可以部分地通过已知的自动进样器系统进行。
一旦将样品部分分配到管中,多端口注射阀10就切换到第二阀配置,其中通过流动相溶液的加压流将样品部分冲洗出管11并进入出口管16。通常,移动溶液可包含第一溶剂溶液3a(通常称为“流动相a”)或第二溶剂溶液3b(通常称为“流动相b”)或其某些混合物中的任一种。第一溶剂通过第一溶剂输送子系统2a提供给第一溶剂输送管线17a,所述第一溶剂输送子系统2a包括第一高压泵4a和第一切换阀5a。同样,第二溶剂通过第二溶剂输送子系统2b提供给第二溶剂输送管线17b,所述第二溶剂输送子系统2b包括第二高压泵4b和第二切换阀5a。溶剂输送管线17a、17b将相应的溶剂输送到梯度阀6,所述梯度阀6可操作以选择性地输送溶剂溶液中的一种或另一种,或者将溶剂溶液的可变混合物输送到流动相输送管线,所述流动相输送管线将选择的溶液或选择的溶液混合物转移到喷射器7的多端口喷射阀10的另一个端口。
当多端口注射阀10处于其第二阀配置时,包含用于色谱的流动相的溶剂或混合溶剂的高压流流入管11中,在管11中,其与包含在其中的样品部分混合并且将样品部分冲出管11并进入出口管16。出口管16如上所述以在100nl/分钟至2μl/分钟的流速将流动相和溶解的样品输送到纳流流动色谱柱12的入口端。在纳流流动色谱柱12内,取决于固定相的各种物理和化学性质以及化学成分的各种化学性质,样品部分的各种化学成分(其中一些可能是感兴趣的分析物)在流动的流动相和柱的固定相之间可变地分配。通常,在流动相的受控可变组成的流动下,通过梯度阀6的流动相a和流动相b溶剂的流量的可变比例控制,不同的化学成分将保留在纳米流色谱柱12中持续不同的相应时间段(保留时间),之后它们从柱的出口端洗脱。因此,样品部分在纳米流色谱柱12内被分离成不同的化学馏分,不同的馏分包含样品化学成分的不同的相应子集。
在系统1(图1b)中,从纳流色谱柱12洗脱的不同馏分依次输送到柱出口管线18,所述柱出口管线18顺序地将馏分转移到分配阀13。分配阀13包含与出口管线联接的入口端口以及多个出口端口,每个这样的出口端口联接到不同的单独馏分输送管线。例如,图1b中描绘的系统1的分配阀13包含总共八出口端口,每个出口端口联接到八个馏分输送管线14a-14h中的相应一个。每个馏分输送管线将一个或多个馏分(一次一个馏分)引导至相应的容器,如小瓶或试管,每个这样的容器包含一定体积,优选不大于100μl。在图1b所示的实例中,每个这样的容器是多孔板15的各个孔。在系统1的操作中,分配阀13一次仅将洗出液输送到一个馏分输送管线(并因此输送一个容器),但是重复地重新配置,以便顺序地将洗出液输送重新导向馏分输送管线的下一个按顺序的馏分输送管线。执行可以以预编程的相等或不等时间增量发生的重复阀配置以使洗出液输送循环通过所有馏分输送管线14a-14h。因此,在馏分输出管线的出口端处的每个接收容器一次接收一个馏分,其中每个特定馏分可以在样品分馏级过程期间由特定时间片限定。
在系统1的操作中,洗出液递送依次循环通过馏分输送管线14a-14h中的每一个。例如,如图所示,一组八个不同馏分的顺序洗脱馏分可以分别以下列顺序输送到馏分输送管线:14a、14b、14c、14d、14e、14f、14g和14h。随后,重新配置分配阀13以将下一馏分输送到管线14a并重复整个循环。以这种方式,洗脱的馏分如在图1a中示意性地描绘并以参考该图描述的方式汇集。从图1b中可以看出,装置1的馏分输送管线14a-14h将单个样品的馏分分配到多孔板15的一排孔中。一旦第一样品的第一阶段纳米色谱分馏分离完成,就可以重新定位多孔板15或输送管线14a-14h或两者,使得通过不同样品的第一阶段纳米色谱分馏产生的馏分以上述方式分配到多孔板15的第二不同排的孔中。在以这种方式完成多个样品的第一阶段纳米色谱分馏之后,可以将多孔板15的孔的内容物输送至lc-ms系统,其中色谱系统被配置成用于根据不同的色谱技术进行第二阶段的纳米色谱。
当馏分被分配到容器(如图1中所描绘的孔15a-15h)时,由于收集探针/毛细管上的表面张力阻止液滴离开探针,所以纳米级方式的分馏收集是非常具有挑战性的。图1b中描绘的装置1能够通过馏分输送管线14a-14h中的相应一个将多个馏分按顺序输送到每个单独的孔,从而至少部分地克服该挑战。通过这种方式,通过随后输送的馏分的后续流动,将早期输送的馏分的液滴从每个馏分输送管线的出口端冲洗出来。然而,提供至少一个附加精密移动部件,即分配阀13,以及在系统1内提供附接馏分传输管线可能导致其它缺点,因为在某些情况下附加部件可能会使整个系统比在不存在这些附加组件的情况下更脆弱且更容易出现故障。
技术实现要素:
本发明人已经开发了一种新的纳流分馏器装置,其在以馏分输送流速小于10μl/分钟和在200ng/输送的馏分至1μg/输送的馏分范围内的总肽含量将馏分输送至收集容器期间,有助于液滴形成和聚焦。该新型装置采用辅助流体的辅助流动,所述辅助流体的辅助流动限制从馏分输送管的出口端排出的液滴,所述馏分输送管将从纳米色谱柱洗脱的分馏的肽转移到收集容器。辅助流体包含流动相流体组合物或流动相组合物的混合物,其以在样品馏分流速的两倍至样品馏分流速的五倍范围内的辅助流速与样品-馏分流体流混合。辅助流体的辅助流动可以由辅助低压泵,通过引入压缩空气或通过借助旁路管线转换流动相流体的一部分来提供,所述旁路管线将转换的流动相部分从将流动相输送到纳流柱的流动相输送管线转移到单个馏分输送管线的出口端。馏分收集器可包括多个容器,如多孔板的孔,其接收来自单个馏分输送管线的各种洗脱馏分。支撑馏分输送管线的可移动样品台或可移动机械臂在自动控制下周期性地相对于多个容器移动馏分输送管线的出口端,这样顺序洗脱的馏分以周期性方式输送到不同的容器中,从而在每个容器内汇集馏分的相应子集。新型装置能够实现低样品体积(1μg或更少)的无损失分馏。此外,装置的简单性允许最终用户以自动方式且无需监督分馏非常少量的肽。
在根据本教导的第一方面,公开了纳流分馏器装置,所述装置包含:一个或多个流动相溶剂源;辅助溶剂源;样品注射阀;色谱柱,其内径小于75微米(μm)且具有柱入口端和柱出口端;第一流体管线,其联接在一个或多个流动相溶剂源和样品注射阀的入口端口之间;第二流体管线,其联接在样品注入阀的出口端口和色谱柱之间;溶剂馏分输送管线,其包含:入口端,其被配置成接收从柱出口端排出的洗出液,和出口端,其被配置成将洗出液分配到多个样品馏分容器中的每一个;和流体接头,其被配置成接收从柱出口端排出的洗出液并接收从辅助溶剂源输送的辅助溶剂流并将洗出液和辅助溶剂流输送到溶剂馏分输送管线。
在各种实施例中,一个或多个流动相溶剂源可包含单个流动相源。在各种实施例中,辅助溶剂源可以从一个或多个容器中抽取辅助溶剂,所述容器包含一个或多个流动相溶剂源的流动相溶剂。在各种实施例中,装置可进一步包含机械臂,其被配置成将溶剂馏分输送管线的出口端移动到每个样品馏分容器的接收部分。在各种其它实施例中,装置可以包含将多个样品馏分容器支撑在其上的可移动样品台,其中可移动台被配置成将每个样品馏分容器的接收部分定位在溶剂馏分输送管线的出口端。如果样品馏分容器是多孔板的孔,那么每个孔的接收部分仅是孔上方和邻近孔的一定体积空间。如果样品馏分容器是试管,那么接收部分是试管的开口端。
在各种实施例中,流体接头可包含t形接头,其被配置成在其处将洗出液与辅助溶剂流混合。在各种其它实施例中,流体接头可以包含将辅助传输管线穿过溶剂馏分输送管线的套筒并进入溶剂馏分输送管线的圆柱形环形导管。在这些和其它实施例中,辅助溶剂可以作为鞘流排出,所述鞘流至少部分地包围从溶剂馏分输送管线的出口端排出的洗出液。辅助溶剂源可包含泵,例如注射泵,和多端口切换阀。替代地,辅助溶剂源可包含加压气体或空气源,如但不限于气缸、空气压缩机或“室内气体”喷嘴,其以受调节的流速将辅助溶剂推出容器。
附图说明
本实用新型的上述和各种其它方面将从以下描述中变得显而易见,所述描述仅通过示例的方式并参考附图给出,附图未必按比例绘制,其中:
图1a是在色谱分离过程期间多孔收集板的多个孔内的馏分汇集的示意图;
图1b是用于借助馏分汇集将样品纳米色谱分离成各种馏分的已知系统的示意图;
图2a是根据本教导的第一色谱纳流分馏器的示意图;
图2b是根据本教导的第二色谱纳流分馏器的示意图;
图2c是根据本教导的第三色谱纳流分馏器的示意图;和
图3是根据本教导的馏分输送管的端部的示意图。
具体实施方式
呈现以下描述以使得本领域技术人员能够制造和使用本实用新型,并且在特定应用及其要求的背景下提供以下描述。对所述实施例的各种修改对于本领域技术人员来说是显而易见的,并且这里的一般原理可以应用于其它实施例。因此,本实用新型并不旨在限于所示的实施例和实例,而是根据所示和所述的特征和原理给予最宽的范围。为了更详细地充分理解本实用新型的特征,请参考图1a、1b、2a-2c和3,其中相同的附图标记表示相同的元件,并结合以下讨论。应当注意,当才那可流体的移动或结合流体使用时,词语“管线”的所有例子(例如,“输送管线”、“传输管线”、“出口管线”等)在一般意义上应理解为指的是将流体从一个位置转移到另一个位置的导管,如管或管道或管子等,而没有对任何特定材料或材料、性质、尺寸、形状、长度或形式的暗指或限制。
图2a是根据本教导的色谱纳流分馏器系统100的示意图。与图1b中所示的系统1类似,系统100包含第一溶剂输送子系统2a、第二溶剂输送子系统2b、注射器7、从注射器7接收溶解在流动相中的样品部分的色谱柱12和流体地联接在注射器7和两个溶剂输送子系统2a、2b之间的梯度阀6。然而,不同于已知的系统1,系统100的柱出口管线18并不将洗出液馏分输送到多端口分配阀,但是,代替地将洗出液馏分输送到流体接头113,其合并洗出液与来自辅助溶剂源102的附加溶剂103的辅助流。如图2a中所描绘,辅助溶剂源102包含附加泵104和附加切换阀105。辅助传输管线119将附加溶剂的辅助流输送到流体接头113,在流体接头113处,其与通过柱出口管线18转移的来自色谱柱12的洗出液合并。附加泵104是低压泵,因此,附加溶剂流动通过辅助传输管线119在大约大气压下发生。这与流体管线内的高压流动(例如,通常100-350巴压力)形成对比,所述流体管线将第一溶剂输送子系统2a和第二溶剂输送子系统2b联接到梯度阀6和多端口注射阀10并联接在出口管16内,所述出口管16将多端口注射阀10联接到纳流色谱柱12。柱后管线(出口管线18和馏分输送线114)可以包含具有小直径(大约10μm内径)以避免扩散的二氧化硅或peek管。柱后管线和传输管线在柱12的出口端和收集板15之间几乎没有背压(小于150巴),这取决于这些管线的长度和内径。在任何情况下,柱后管线和传输管线内的压力显著小于柱前管线16中的压力。
在系统100(图2a)中,合并的洗出液馏分和辅助溶剂流通过单个馏分输送线114从流体接头113转移到一系列馏分收集容器(在该描述中,通过多孔板15示例)。如下面将更详细描述的,系统100的操作使得各种洗出液馏分以如上所述的循环顺序方式输送到不同的馏分容器。然而,由于该系统仅包含单个馏分输送管线114(而不是在系统1的多个馏分输送管线),接收容器借助于容器和馏分输送线114的出口端之间的机械相对移动而改变。在图2a所示的系统100中,这种相对移动是通过机械联接到馏分输送管线114的机械臂结构117重新定位馏分输送管线114的出口端(假设包含柔性管)来实现的。替代地,馏分输送管线114可保持静止,而容器在单独的馏分的转移之间重新定位。在图2a所示的系统中,这种重新定位可以通过支撑多孔板15的机动可移动支撑台(未具体示出)的横向移动来进行。电子控制器80包含与阀、泵和机械臂(和/或机动可移动支撑台)的电子连接,并且包含程序指令,该程序指令出于以下目的使泵的操作与阀的配置同步:向纳流柱提供适当的流动相组合物,控制样品注入注射阀,和通过控制机械臂或机动可移动支撑台,控制馏分输送管线相对于多个馏分收集容器的定位。如果样品部分由自动进样器装置(未在图2a中具体示出)提供,那么控制器80还可以包含到自动进样器装置的通信链路,所述通信链路使注射器的操作与通过自动进样器装置将样品部分输送到注射器同步。
图2b是根据本教导的第二色谱纳流分馏器系统130的示意图。图2b中描绘的系统130在大多数方面类似于图2a中描绘的系统100,不同之处在于辅助传输管线119内的附加溶剂的流动由加压或流量调节的气源133而不是辅助溶剂源102内的专用泵推进。尽管气源133在图2b中示意性地表示为气缸,但是气源133可包含任何替代气源,如空气压缩机。气源133可以远离系统130的位置定位,在这种情况下,气流可以经由现有的基础设施(例如,“房屋气体”)流体地联接到辅助溶剂源102。如前所述,附加溶剂流动通过辅助传输管线119在大约大气压下发生。
图2c是根据本教导的第二色谱纳流分馏器系统140的示意图。图2c中描绘的系统140在大多数方面类似于图2a中描绘的系统100,不同之处在于辅助传输管线119内的附加溶剂的流动经由如图所示的辅助溶剂供应管线145由一个多个现有溶剂储存器提供(例如,由第一溶剂输送子系统2a的流动相a储存器、第二溶剂输送子系统2b的移动相b储存器或两个储存器的组合提供)。相比于在流体管线内移动相的高压流动,辅助溶剂供应管线145的流动是在大约大气压下,所述流体管线将第一溶剂输送子系统2a和第二溶剂输送子系统2b联接到梯度阀6和多端口喷射阀10。
在所有本文所述的色谱纳流分馏器系统中,在柱出口管线18和馏分输送管线114内流动的分馏的样品流体,在离开纳流色谱柱12之后,处于大约大气压下。同样地,在辅助传输管线119内流动的辅助流体同样在近大气压下。分馏的样品流体和辅助流体在流体接头113处或下游混合,辅助流体的流速是分馏的样品流体的流速的两倍至五倍。辅助流体的附加流动克服在馏分输送管线114的端部处的表面张力,否则该表面张力将延迟或阻止分馏的样品流体的分配到容器15中。
在许多情况下,流体接头113可包含简单的t形接头。然而,替代地,流体接头与馏分输送管线一起可包含专门的结构,如图3所示,这使得出现的辅助流体作为鞘流离开馏分输送管线的端部,所述鞘流同轴地包围馏分输送管线的排出流。图3示出这样专门的结构,其中馏分输送线114包含两个流体导管,其中第一个是运送分馏的样品流体149a的柱出口管线18的延伸部分,其中第二个是包围柱出口管线18的延伸部分的环形圆柱形间隙148。环形圆柱形间隙148安置在柱出口管线18的延伸部分和外套筒管147之间。辅助传输管线119在馏分输送管线114的出口端146上游的点处穿过流体接头113处的外套筒管147,此时辅助流体149b被输送到环形圆柱形间隙148中。由此产生的两种流体同轴流动通过馏分输送管线114使得辅助流体以鞘流的形式离开馏分输送管线,所述鞘流同轴地包围可能在出口端146处形成的任何样品流体的液滴并且促使所述液滴从尖端脱离。
已经公开了用于一般和多维纳流色谱的改进的色谱分馏器。本申请中包含的讨论旨在作为基本描述。本实用新型的范围不受本文所述的具体实施例的限制,这些实施例旨在作为本实用新型各个方面的单一说明,并且功能上等同的方法和组件也在本实用新型的范围内。实际上,除了本文所示和所述的那些之外,对于本领域技术人员来说,本实用新型的各种修改将从前面的描述和附图中变得显而易见。这些修改旨在落入所附权利要求书的范围内。
- 还没有人留言评论。精彩留言会获得点赞!