具有多官能配体的量子点珠以及使用其的目标抗原检测方法和生物诊断设备与流程
本公开涉及具有多官能配体的量子点珠和使用其检测目标抗原的方法和生物诊断设备。
背景技术:
近年来,随着医学关注点从治疗转变为诊断并且从集中医院诊断转变为现场和个性化诊断,需要能够以最简单的方式就地直接作出诊断并测量多种类型疾病的诊断设备。为了实现这种设备,三种最必需的因素可以包括诊断设备的高灵敏度、适合的价格以及多种诊断是否可能,并且为了达到这些因素,已研究了多种诊断平台。
目前,体外诊断中最普遍的方法是蛋白-基(基于蛋白的)测定,如免疫测定,或者核酸-基(基于核酸的)分子诊断技术,并且这些技术逐渐占据了市场。这是因为这些技术可以放大目标材料,从而导致高灵敏度并且能够通过使用设备进行多种诊断。尽管如此,它们仍具有问题,如昂贵的设备和试剂,长反应时间以及需要专业操作人员以将其应用于就地诊断。
因此,为了使它们直接就地应用,这两种技术具有限制,其中作为免疫测定技术之一的侧流免疫测定能够以简单的方式和低价格就地诊断,但是由于其低灵敏度,就可以应用的目标而言具有限制,而作为后一种技术的分子诊断方法是具有高灵敏度,但由于需要复杂的设备和专业人员而仅可以在大型实验室中使用的方法。
因此,需要可以使用用于侧流免疫分析的平台,可以将灵敏度提高至分子诊断领域并且可以进行定量评价的诊断平台。
侧流免疫测定中常用的荧光物质是与生理学物质形成免疫复合物并且通过独特的等离子体振子现象而显示出红色的金纳米颗粒。由于这些特征,这些荧光物质具有易于通过肉眼从真实产品中检测和鉴别生理学物质的存在或不存在的优势。
然而,当使用金纳米颗粒时,由于检测基于目测评价,因此灵敏度不出色并且分析灵敏度较低,并因此金纳米颗粒主要应用于血液中过量存在的生理学物质。因此,由于检测或测量血液中以极低浓度存在的生理学物质的困难,因此对于疾病的早期诊断存在限制。另外,存在其中生理学物质定量分析困难的问题。
因此,为了检测低浓度的生理学物质,继续进行了放大在侧流免疫测定中使用的荧光物质的检测强度的工作。作为这些工作之一,国际专利公开第wo2008-071345号公开了使用与胶体金纳米颗粒互补的核苷酸来堆积金纳米颗粒,借此放大它们的荧光强度。
然而,根据上述技术,具有互补核苷酸的金纳米颗粒可以在与生理学物质,如抗原缀合前彼此结合,并且当同时添加金纳米颗粒时,它们结块。这种结块现象干扰生物样品在侧流免疫测定中的流动,从而使目标生理学物质的检测困难。为了防止这种现象,在具有不同核苷酸的金纳米颗粒的注射之前,除去通常存在的纳米颗粒的清洗步骤是必需的。因此,为了应用于真实侧流传感器,在将新的金纳米颗粒加入至传感器之前需要清洗步骤,并因此上述技术在对实际传感器的应用中具有限制。
出于这些原因,在具有比金纳米颗粒更高的效率并且使得能够进行多种诊断的荧光物质中,量子点作为最强的候选出现并因此已进行了大量研究。
最近,在cheng等人(analbioanalchem,409(1):133-141,2016年10月25日)、savin等人(talanta.2018年2月1日;178:910-915)和wu等人(analyticachimicaacta,1008卷,2018年5月30日,1-7页)发表的论文中,为了提高发光效率,通过应用量子点而不是常规金纳米颗粒或另一种荧光物质来提高效率的研究正在进行,并且根据zeus提交的韩国专利申请第10-2018-0046848号,通过复合物的形成,而不是使用单一荧光物质来放大信号或者通过堆积荧光物质来放大检测强度以实现高灵敏度的研究正在进行。
另外,已发展了通过经由荧光物质的堆积所制备的珠复合物的光放大来提高灵敏度的多种技术,如zhang等人所提议的(chemicalpapers,70(8),1031-1038,2016)或者通过量子点反应的100次循环形成多层结构,如park等人所提议的(acsnano,7卷,no10,9416~9427,2013)。
然而,珠复合物的限制在于其增加了珠的表面积并且通过荧光物质堆积的灵敏度提高需要对每个步骤进行单独的清洗程序,并因此它难以将珠复合物应用于就地诊断设备。
另一方面,为了显示出通过侧流分析在分子诊断水平上的灵敏度,需要通过堆积荧光物质的信号放大并且该技术的实施将是就地诊断设备成功的重要指示。
因此,本公开的发明人提供了使用多官能配体和量子点珠的检测方法作为通过侧流免疫测定的稳定且非常显著地放大检测荧光强度的技术,而无需使用堆积量子点和量子点珠的方法的单独清洗程序,其可以提高荧光强度。
[参考文献]
1.us2010-0068727a1
2.wo2008-071345a1
3.chengetal.,analbioanalchem,409(1):133-141,25oct2016
4.savinetal.,talanta.2018feb1;178:910-915
5.wuetal.,analyticachimicaacta,volume1008,30may2018,pages1-7
6.zhangetal.,chemicalpapers,70(8),1031-1038,2016
7.parketal.,acsnano,vol7,no10,9416~9427,2013。
技术实现要素:
本公开的多个实施方式提供了对其应用光放大系统的检测材料,其可以通过同时形成多个量子点结合,从而与量子点珠(珠粒,bead)(量子点珠是母体结构)的多官能配体形成互补键,而不是通过顺序堆积,来显示出100次或以上的堆积循环作用,而无需单独的清洗步骤,从而放大荧光信号,借此应用简单免疫色谱,提供廉价诊断平台并且在分子诊断水平显示出灵敏度,并且提供了使用材料的诊断方法或侧流免疫传感器。
根据本公开的一个方面的用于生物样品中目标抗原的免疫色谱检测方法可以包括在包含具有大量第一结合材料的多官能配体和第二抗体的量子点珠和具有第二结合材料的量子点之间形成多个键。
根据本公开的一个方面中,可以在诊断目标抗原-相关疾病、病症或病况的方法中、在用于检测生理学物质的侧流免疫传感器中和在生物诊断试剂盒中使用免疫色谱检测方法。
根据本公开,在一些实施方式中,使用具有多官能配体的量子点珠和可以结合至配体的量子点,免疫色谱检测方法可以通过简单方法非常显著地放大检测强度并且显著改善检测灵敏度而无抗原损失。
根据本公开的一个方面的免疫色谱检测方法还可以显示出显著放大检测强度的效果,而无需连续输入用于信号放大的荧光物质和单独的清洗步骤,借此在真实商业化期间快速且简单地检测和鉴别生物样品中的生理学物质,这对于价格竞争力而言是有利的。
附图说明
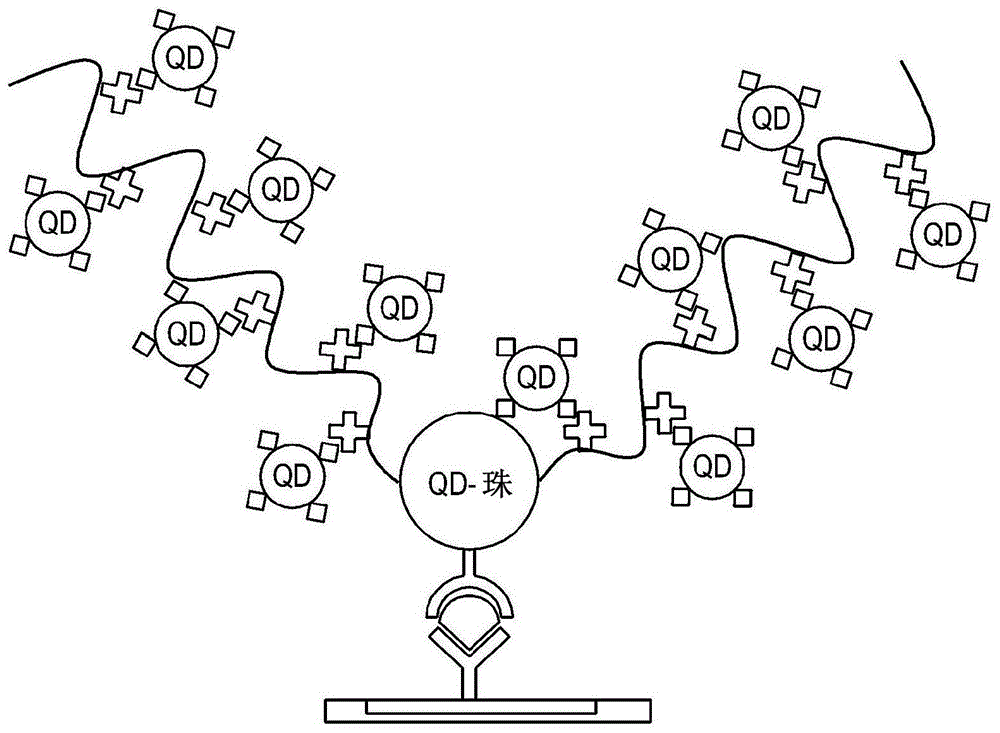
图1a和图1b是示出了其中在根据本公开的一个方面的免疫色谱检测方法中通过具有多官能配体的量子点珠与可以结合至配体的量子点的结合来放大检测强度的状态的示意图。图1a是示出了其中抗原-特异性第二抗体存在于量子点珠的表面上的情况的示意图,而图1b是示出了其中抗体结合至存在于量子点珠上的多官能配体末端的情况的示意图。
图2是示出了根据本公开的一个方面的免疫色谱检测方法中使用的量子点和量子点珠的ζ电位的图。
图3是示出了可以在根据本公开的一个方面的免疫色谱检测方法中使用的量子点和量子点珠的量子效率的图。
图4a和图4b示出了在根据本公开的一个方面的免疫色谱检测方法中使用的量子点的透射式电子显微镜照片(图4a)和量子点珠的扫描电子显微照片(图4b)。
图5是示出了在根据本公开的一个方面的免疫色谱检测方法中使用的量子点珠的粒径分析结果的图。
图6是示出了当量子点和量子点珠单独用作对比例时和当使用量子点珠多重复合物而不是本公开的实施例时的荧光强度的图。
具体实施方式
在本公开的一个方面中,“量子点”是指半导体纳米颗粒并且具有由于量子限制效应,根据颗粒尺寸而发射不同颜色的光的特征。量子点比荧光染料,如代表性的荧光物质,荧光罗丹明亮约20-倍,并且对光致漂白的稳定性强约100-倍,并且具有约3倍更窄的光谱线宽。
在本公开的一个方面中,“量子点珠”是包括大量量子点的颗粒,并且是宽泛的概念,其表示不考虑构成量子点珠的核的类型,显示出比量子点亮至少100-倍并且制备以包括多个量子点的特征的所有颗粒。
在本公开的一个方面中,“配体”可以表示具有链结构的材料,链结构具有能够结合至第一结合材料的官能团或结合位点,并且配体还可以表示多官能配体。使用第一结合材料,将配体用于放大荧光检测强度。因此,未具体限制构成配体的材料类型,并且可以在本公开的方法中使用任何配体,只要它具有第一结合材料或能够结合至抗体的官能团或结合位点。配体可以包括作为结合至量子点珠或第二抗体的一部分的第一区域,形成配体主链的第二区域和作为结合至第一结合材料的一部分的第三区域。配体可以通过官能团或结合位点与第一结合材料形成共价键,并且可以具有一种或多种第一结合材料。在本文中,官能团可以是(但不限于)羟基、胺基、硫醇基、羰基或羧基,并且可以使用能够实现与第一结合材料的缀合的任何材料。由于配体上的第一结合材料和量子点上的第二结合材料彼此反应并结合,因此可以显著放大检测强度。随着配体上第一结合材料的数目增加,更多的量子点可以结合至配体并因此可以进一步放大检测强度。
在本公开的一个方面中,“聚合物”可以表示通过单体聚合反应产生的化合物,它是重复单元并且表示本领域普通技术人员通常理解的范围内的概念。
在本公开的一个方面中,“核苷酸链”可以表示由核苷酸组成的长聚合物链,并且表示本领域普通技术人员通常理解的范围内的概念。存在于核苷酸中的碱基可以包括腺嘌呤、鸟嘌呤、胸腺嘧啶、胞嘧啶、尿嘧啶及其变体,但是本发明不限于此。
在本公开的一个方面中,“肽链”可以表示由氨基酸组成的长聚合物链,并且表示本领域普通技术人员通常理解的范围内的概念。
在本公开的一个方面中,“第一结合材料”和“第二结合材料”可以具有彼此结合的特征。这些材料可以在室温下天然地彼此结合。例如,这些材料可以表示彼此特异性结合的材料,如抗原和抗体、彼此互补的核苷酸链、适体及其目标材料以及抗生物素蛋白(亲和素,avidin)或抗生蛋白链菌素(链霉亲和素,streptavidin)和生物素;或者可以通过氢键、二硫键或范德华力彼此结合的肽的对,但是本公开不限于此。
在本公开的一个方面中,“形成多个键”可以表示结合以在一个配体上具有多个量子点。
在本公开的一个方面中,“抗原”或“目标抗原”是存在于生物样品中的生理学物质,并且是包括所有与受试者的多种疾病或身体状况有关的要检测的材料的宽泛概念。例如,在本公开的一个方面中,抗原是在通常提及的生物样品中导致免疫应答的物质并且包括所有微生物、病毒等。
在本公开的一个方面中,“生物样品”是涵盖了具有其中可以存在抗原的生理环境的所有样品的概念,例如,尿液、血液、血清、血浆和唾液等。
在本公开的一个方面中,“抗体”是包括对抗原特异地引起免疫应答并且与之结合以检测和鉴别抗原的分子的宽泛概念。另外,“第一抗体”和“第二抗体”识别相同抗原的不同表位并且是涵盖了存在于抗原检测对中的分子的宽泛概念。例如,可以将第二抗体固定在诊断装置的膜上以捕获存在于生物样品中的抗原,并且第二抗体可以具有可检测标志物,再结合至第二抗体所捕获的抗原以检测和鉴别生物样品中抗原的存在。
在本公开的一个方面中,“直径”可以表示通过接头、量子点或量子点珠的中心的最长线段的长度,并且平均直径可以表示穿过中心的10条线段的平均值,并且就量子点来说,直径可以表示核-稳定层-壳层的尺寸或者核-稳定层-壳-水溶性配体层的尺寸。
在下文中,将详细描述本公开。
在本公开的一个方面中,可以提供用于生物样品中目标抗原的免疫色谱检测方法,其包括在量子点珠和量子点之间形成多个键。
在本公开的一个方面中,量子点珠可以包含具有第一结合材料的多官能配体,以及第二抗体。
在本公开的一个方面中,量子点可以具有第二结合材料。
在本公开的一个方面中,第一结合材料和第二结合材料可以彼此反应并结合。在本公开的一个方面中,第一抗体和第二抗体可以使对目标抗原特异的,并且这些抗体可以对目标抗原的不同位点,即不同表位特异。
在本公开的一个方面中,第一结合材料和第二结合材料可以分别存在于配体和量子点中以使得多个量子点结合至配体。在本公开中,通过将多个量子点结合至量子点珠的配体,显著放大了抗原的荧光检测信号。
在本公开的一个方面中,第一抗体可以连接或固定至膜并且可以与存在于生物样品中的抗原反应并将其捕获。第二抗体可以用于检测第一抗体所捕获的抗原,并且可以表示抗体对不同于第一抗体的抗原结合位点的位点特异。第二抗体可以结合至量子点珠,并且作为检测标志物具有量子点珠,从而量子点珠可以检测所捕获的抗原。
在本公开的一个方面中,检测方法可以包括:(a)用量子点珠结合生物样品中的目标抗原;和(b)通过第一结合材料和第二结合材料的结合,形成量子点珠和量子点之间的多个键。在本公开的一个方面中,检测方法还可以在步骤(b)之后包括步骤(c)测量通过辐射的荧光。
在本公开的一个方面中,配体可以包括作为结合至量子点珠或第二抗体的一部分的第一区域、形成配体主链的第二区域、以及作为结合至第一结合材料的一部分的第三区域。
在本公开的一个方面中,第一结合材料和配体可以共价结合在一起。在本公开的一个方面中,第一结合材料和配体之间的共价键可以是选自由以下项组成的组中的一种或多种:酯键、环氧键、醚键、亚酰胺键、亚胺键和酰胺键。
在本公开的一个方面中,配体可以是选自由以下项组成的组中的一种或多种:聚合物、核苷酸链、和肽链。
在本公开的一个方面中,配体可以具有选自由以下项组成的组中的一种或多种取代基:羟基、胺基、硫醇基、羰基、羧基、环氧基、乙烯基、乙炔基、酰胺基、膦酸酯基、磷酸酯基、磺酸酯基、硫酸酯基、硝酸酯基和铵基。
在本公开的一个方面中,配体的第一区域可以包括选自由以下项组成的组中的一种或多种取代基:羟基、胺基、硫醇基、羰基、酰胺基、膦酸酯基、磷酸酯基、磺酸酯基和硫酸酯基。
在本公开的一个方面中,配体的第三区域可以包括选自由以下项组成的组中的取代基:羟基、胺基、硫醇基、羰基、磺酸酯基、硝酸酯基、膦酸酯基和铵基。
在本公开的一个方面中,聚合物可以是选自由以下项组成的组中的一种或多种:聚乙烯亚胺(polyethylenimine)、聚乙二醇、聚丙烯酰胺、聚磷腈、聚乳酸、聚乳酸-共-乙交酯(丙交酯乙交酯共聚物,聚乙丙交酯,polylactide-co-glycolide)、聚己酸内酯、聚酐、聚苹果酸及其衍生物、聚氰基丙烯酸烷酯、聚羟基丁酸酯、聚碳酸酯、聚原酸酯、聚-l-赖氨酸、聚乙交酯、聚甲基丙烯酸甲酯、聚乙烯吡咯烷酮、聚(乙烯基苄基三烷基铵)、聚(4-乙烯基-n-烷基-吡啶)、聚(丙烯酰基-氧烷基-三烷基铵)、聚(丙烯酰胺基烷基-三烷基铵)、聚(二烯丙基二甲基-铵)、聚(苯乙烯磺酸)、聚(乙烯磺酸)、聚(衣康酸)、马来酸-二烯丙基胺共聚物和超支化聚合物。
在本公开的一个方面中,核苷酸链可以由10至500个核苷酸组成,但是本公开不限于此。具体地,在本公开的一个方面中,核苷酸链可以由多至使其具有10至100nm的范围内的长度的核苷酸组成,例如,10至1,000个核苷酸。
在本公开的一个方面中,肽链可以由10至500个氨基酸组成。具体地,在本公开的一个方面中,肽链可以由多至使其具有10至100nm的范围内的长度的氨基酸组成,例如,10至1,000个氨基酸。
在本公开的一个方面中,配体可以具有100mw(g/mol)至1,000,000mw的分子量。在本文中,配体的分子量可以对应于上述范围中存在的所有整数的范围。在本公开的一个方面中,配体长度可以是量子点珠平均直径的2至10-倍。具体地,在本公开的一个方面中,配体的分子量(mw)可以为100mw或以上,500mw或以上,1,000mw或以上,5,000mw或以上,10,000mw或以上,30,000mw或以上,50,000mw或以上,70,000mw或以上,100,000mw或以上,300,000mw或以上,500,000mw或以上或700,000mw或以上,或者1,000,000mw或以下,800,000mw或以下,600,000mw或以下,400,000mw或以下,200,000mw或以下,100,000mw或以下,80,000mw或以下,60,000mw或以下,40,000mw或以下,20,000mw或以下,10,000mw或以下,8,000mw或以下,4,000mw或以下,2,000mw或以下,800mw或以下,400mw或以下或200mw或以下。当配体长度超过1μm时,在侧流免疫传感器中,它可以是有问题的,因为配体难以通过免疫传感器的膜。
在本公开的一个方面中,第一结合材料和第二结合材料可以是选自由以下项组成的组中的一种或多种:非目标抗原的抗原与抗体的对、彼此互补的核苷酸链的对、适体与目标材料的对、彼此结合的肽的对和抗生物素蛋白或抗生蛋白链菌素与生物素的对。在本公开的一个方面中,第一结合材料和第二结合材料可以是抗生物素蛋白或抗生蛋白链菌素与生物素的对。在本公开的一个方面中,第一结合材料可以是生物素,并且第二结合材料可以是抗生物素蛋白或抗生蛋白链菌素。
在本公开的一个方面中,肽对可以通过氢键、二硫键或范德华力结合在一起。
在本公开的一个方面中,第二抗体可以存在于量子点珠的表面上或在配体末端结合至配体。
在本公开的一个方面中,量子点可以具有核-稳定层-壳-水溶性配体层结构。
在本公开的一个方面中,核可以包括镉(cd)和硒(se)中的一种或多种;稳定层可以包括镉(cd)、硒(se)、锌(zn)和硫(s)中的一种或多种;并且壳可以包括镉(cd)、硒(se)、锌(zn)和硫(s)中的一种或多种。
在本公开的一个方面中,量子点可以包括12至16族元素基(基于第12至16族元素的)化合物、13至15族元素基(基于13至15族元素的)化合物和14至16族元素基(基于14至16族元素的)化合物中的一种或多种。
在本公开的一个方面中,12至16族元素基化合物包括以下中的一种或多种:硫化镉(cds)、硒化镉(cdse)、碲化镉(cdte)、硫化锌(zns)、硒化锌(znse)、碲化锌(znte)、硫化汞(hgs)、硒化汞(hgse)、碲化汞(hgte)、氧化锌(zno)、氧化镉(cdo)、氧化汞(hgo)、硒硫化镉(cdses)、硒碲化镉(cdsete)、硫碲化镉(cdste)、硫化镉锌(cdzns)、硒化镉锌(cdznse)、硫硒化镉(cdsse)、碲化镉锌(cdznte)、硫化镉汞(cdhgs)、硒化镉汞(cdhgse)、碲化镉汞(cdhgte)、硒硫化锌(znses)、硒碲化锌(znsete)、硫碲化锌(znste)、硒硫化汞(hgses)、硒碲化汞(hgsete)、硫碲化汞(hgste)、硫化汞锌(hgzns)、硒化汞锌(hgznse)、氧化镉锌(cdzno)、氧化镉汞(cdhgo)、氧化锌汞(znhgo)、氧化锌硒(znseo)、氧化锌碲(znteo)、硫氧化锌(znso)、硒氧化镉(cdseo)、氧化镉碲(cdteo)、硫氧化镉(cdso)、氧化汞硒(hgseo)、氧化汞碲(hgteo)、硫氧化汞(hgso)、硫化镉锌硒(cdznses)、碲化镉锌硒(cdznsete)、硫碲化镉锌(cdznste)、硫化镉汞硒(cdhgses)、碲化镉汞硒(cdhgsete)、硫碲化镉汞(cdhgste)、硫化汞锌硒(hgznses)、碲化汞锌硒(hgznsete)、硫碲化汞锌(hgznste)、氧化镉锌硒(cdznseo)、氧化镉锌碲(cdznteo)、硫氧化镉锌(cdznso)、氧化镉汞硒(cdhgseo)、氧化镉汞碲(cdhgteo)、硫氧化镉汞(cdhgso)、氧化锌汞硒(znhgseo)、氧化锌汞碲(znhgteo)和硫氧化锌汞(znhgso),但是本公开不限于此。
在本公开的一个方面中,13至15族元素基化合物可以包括以下中的一种或多种:磷化镓(gap)、砷化镓(gaas)、锑化镓(gasb)、氮化镓(gan)、磷化铝(alp)、砷化铝(alas)、锑化铝(alsb)、氮化铝(aln)、磷化铟(inp)、砷化铟(inas)、锑化铟(insb)、氮化铟(inn)、磷砷化镓(gapas)、磷锑化镓(gapsb)、磷氮化镓(gapn)、砷氮化镓(gaasn)、锑氮化镓(gasbn)、磷砷化铝(alpas)、磷锑化铝(alpsb)、磷氮化铝(alpn)、砷氮化铝(alasn)、锑氮化铝(alsbn)、磷砷化铟(inpas)、磷锑化铟(inpsb)、磷氮化铟(inpn)、砷氮化铟(inasn)、锑氮化铟(insbn)、磷化铝镓(algap)、砷化铝镓(algaas)、锑化铝镓(algasb)、氮化铝镓(algan)、砷氮化铝(alasn)、锑氮化铝(alsbn)、磷化铟镓(ingap)、砷化铟镓(ingaas)、锑化铟镓(ingasb)、氮化铟镓(ingan)、砷氮化铟(inasn)、锑氮化铟(insbn)、磷化铝铟(alinp)、砷化铝铟(alinas)、锑化铝铟(alinsb)、氮化铝铟(alinn)、砷氮化铝(alasn)、锑氮化铝(alsbn)、磷氮化铝(alpn)、磷砷化镓铝(gaalpas)、磷锑化镓铝(gaalpsb)、磷砷化镓铟(gainpas)、砷化镓铟铝(gainalas)、磷氮化镓铝(gaalpn)、砷氮化镓铝(gaalasn)、锑氮化镓铝(gaalsbn)、磷氮化镓铟(gainpn)、砷氮化镓铟(gainasn)、氮化镓铟铝(gainaln)、锑磷氮化镓(gasbpn)、砷磷氮化镓(gaaspn)、砷锑氮化镓(gaassbn)、磷锑化镓铟(gainpsb)、磷氮化镓铟(gainpn)、锑氮化镓铟(gainsbn)、磷锑氮化镓(gapsbn)、磷砷化铟铝(inalpas)、磷氮化铟铝(inalpn)、磷砷氮化铟(inpasn)、锑氮化铟铝(inalsbn)、磷锑氮化铟(inpsbn)、砷锑氮化铟(inassbn)和磷锑化铟铝(inalpsb),但是本公开不限于此。
在本公开的一个方面中,14至16族元素基化合物可以包括以下中的一种或多种:氧化锡(sno)、硫化锡(sns)、硒化锡(snse)、碲化锡(snte)、硫化铅(pbs)、硒化铅(pbse)、碲化铅(pbte)、氧化锗(geo)、硫化锗(ges)、硒化锗(gese)、碲化锗(gete)、硒硫化锡(snses)、硒碲化锡(snsete)、硫碲化锡(snste)、硒硫化铅(pbses)、硒碲化铅(pbsete)、硫碲化铅(pbste)、硫化锡铅(snpbs)、硒化锡铅(snpbse)、碲化锡铅(snpbte)、氧硫化锡(snos)、氧硒化锡(snose)、氧碲化锡(snote)、氧硫化锗(geos)、氧硒化锗(geose)、氧碲化锗(geote)、硫硒化锡铅(snpbsse)、硒碲化锡铅(snpbsete)和硫碲化锡铅(snpbste),但是本公开不限于此。在本公开的一个方面中,存在于水溶性配体层中的水溶性配体可以是选自由以下项组成的组中的一种或多种:二氧化硅、聚乙二醇(peg)、聚乙烯亚胺(pei)、巯基丙酸(mpa)、半胱胺、巯基乙酸、巯基-十一醇、2-巯基-乙醇、1-硫代-甘油、脱氧核糖核酸(dna)、巯基-十一烷酸、1-巯基-6-苯基-己烷、1,16-二巯基-十六烷、18-巯基-十八基胺、三-辛基膦、6-巯基-己烷、6-巯基-己酸、16-巯基-十六酸、18-巯基-十八基胺、6-巯基-已胺、8-羟基-辛基硫醇、1-硫代-甘油、巯基乙酸、巯基-十一烷酸、异羟肟酸、氧肟酸衍生物、乙二胺、谷胱甘肽、n-乙酰半胱氨酸、硫辛酸、硫普罗宁、巯基琥珀酸、二硫苏糖醇、二氢硫辛酸和布西拉明,但是本公开不限于此。在本公开的一个方面中,量子点可以由cdse和zns组成。
在本公开的一个方面中,量子点的平均直径可以是1至20nm,并且具体地,1至15nm或1至10nm。在本文中,量子点的平均直径可以对应于上述范围中存在的所有整数的范围。具体地,量子点的平均直径可以为1nm或以上,2nm或以上,3nm或以上,4nm或以上,5nm或以上,6nm或以上,7nm或以上,8nm或以上,9nm或以上,10nm或以上,15nm或以上或者20nm或以下,19nm或以下,18nm或以下,17nm或以下,16nm或以下,15nm或以下,14nm或以下,13nm或以下,12nm或以下,11nm或以下或10nm或以下。
在本公开的一个方面中,量子点珠的平均直径可以为50nm至2μm。在本文中,量子点珠的平均直径可以对应于上述范围中存在的所有整数的范围。具体地,量子点珠的平均直径可以为50nm或以上,100nm或以上,120nm或以上,140nm或以上,160nm或以上,180nm或以上,200nm或以上,250nm或以上,300nm或以上,400nm或以上,450nm或以上,500nm或以上,700nm或以上,900nm或以上或者1μm或以上或2μm或以下,1.5μm或以下,1μm或以下,900nm或以下,800nm或以下,750nm或以下,700nm或以下,650nm或以下,600nm或以下,550nm或以下,500nm或以下,450nm或以下,400nm或以下,350nm或以下或300nm或以下。当量子点珠的平均直径大于1μm时,使用量子点珠是不适合的,因为当在侧流传感器中使用时,珠难以移动。
在本公开的一个方面中,目标抗原可以是选自由以下项组成的组中的一种或多种:c-反应蛋白(crp)、流感、疟疾、丙型肝炎病毒(hcv)、人类免疫缺陷性病毒(hiv)、乙型肝炎病毒(hbv)、肌酸激酶mb(ck-mb)、肌钙蛋白i、肌红蛋白、前列腺特异性抗原(psa)、甲胎蛋白(afp)、癌胚抗原(cea)、促甲状腺激素(tsh)、绒毛膜生长催乳激素(csh)、人绒毛膜促性腺激素(hcg)、皮质醇、黄体酮和睾酮。
在本公开的一个方面中,在步骤(b)之前,步骤(a)中产生的抗原-量子点珠复合物可以结合至固定在测试区中的第一抗体。
在本公开的一个方面中,第一抗体可以是选自由以下项组成的组中的一种或多种:单克隆抗-crp抗体、单克隆抗-流感抗体、单克隆抗-疟疾抗体、单克隆抗-hcv抗体、单克隆抗-hiv抗体、单克隆抗-hbv抗体、单克隆抗-ck-mb抗体、单克隆抗-肌钙蛋白i抗体、单克隆抗-肌红蛋白抗体、单克隆抗-psa抗体、单克隆抗-afp抗体、单克隆抗-cea抗体、单克隆抗-tsh抗体、单克隆抗-csh抗体、单克隆抗-hcg抗体、单克隆抗-皮质醇抗体、单克隆抗-黄体酮抗体和单克隆抗-睾酮抗体。
在本公开的一个方面中,第二抗体可以是选自由以下项组成的组中的一种或多种:多克隆抗-crp抗体、多克隆抗-流感抗体、多克隆抗-疟疾抗体、多克隆抗-hcv抗体、多克隆抗-hiv抗体、多克隆抗-hbv抗体、多克隆抗-ck-mb抗体、多克隆抗-肌钙蛋白i抗体、多克隆抗-肌红蛋白抗体、多克隆抗-psa抗体、多克隆抗-afp抗体、多克隆抗-cea抗体、多克隆抗-tsh抗体、多克隆抗-csh抗体、多克隆抗-hcg抗体、多克隆抗-皮质醇抗体、多克隆抗-黄体酮抗体和多克隆抗-睾酮抗体。
在本公开的一个方面中,生物样品可以是选自下列中的一种或多种:尿液、血液、血清、血浆和唾液,但是本公开不限于此。
在本公开的一个方面中,可以提供用于生物样品中目标抗原的免疫色谱检测方法,其包括:(a)将生物样品注射至第一入口;(b)在所注射的生物样品展开(铺展,扩散,develop)的同时,通过将其通过量子点珠垫(量子点珠层,quantumdotbeadpad),将样品中的目标抗原与包含具有生物素的多官能配体和第二抗体的量子点珠结合;(c)将抗原-量子点珠复合物与固定在测试区中的第一抗体结合;(d)将具有抗生物素蛋白的量子点注射至第二入口;和(e)在量子点展开的同时,使量子点结合至存在于测试区中的抗原-量子点珠复合物。
在本公开的一个方面中,可以提供用于生物样品中目标抗原的免疫色谱检测方法,其包括:(a)将生物样品注射至第一入口;(b)在所注射的生物样品展开的同时,通过将其通过量子点珠垫,将样品中的目标抗原与包含具有抗生蛋白链菌素或抗生物素蛋白的多官能配体和第二抗体的量子点珠结合;(c)将抗原-量子点珠复合物与固定在测试区中的第一抗体结合;(d)将缓冲溶液注射至第二入口或通过外力使含有缓冲溶液的容器破碎以将缓冲溶液释放至量子点垫;和(e)在缓冲溶液展开的同时,将包含在量子点垫中的、具有生物素的量子点移动至测试区,并且使量子点与存在于测试区中的抗原-量子点珠复合物中的配体中的生物素结合。
在本公开的一个方面中,免疫色谱检测方法还可以在步骤(e)之后包括步骤(f):通过用uv光辐照测试区来测量量子点珠的荧光。
在本公开的一个方面中,可以将缓冲溶液加入缓冲溶液容器,可以通过外力(例如,通过手指的压力)破碎容器以将缓冲溶液释放至量子点垫。在本文中,外力是指通过手指或者破坏缓冲溶液容器的结构或方式的压力所施加的任何类型的作用力。当缓冲溶液容器破碎时,缓冲溶液可以从缓冲溶液容器中流出并移动或展开至量子点垫。因此,存在于量子点垫中的量子点可以展开或移动至测试区。
在本公开的一个方面中,免疫色谱检测方法还可以在步骤(d)之前包括清洗测试区。清洗步骤可以清洗测试区中未反应的材料(例如,抗原和抗原-量子点珠复合物)。
在本公开的一个方面中,可以提供诊断目标抗原-相关疾病、病症或病况的方法,方法使用了根据本公开的一个方面的免疫色谱检测方法并且还包括根据所测量的荧光检测数据相对于目标抗原确定患者状况。
在本公开的一个方面中,可以提供使用量子点珠放大荧光检测强度或生物诊断设备的灵敏度的方法,方法包括:使生物样品中的目标抗原与量子点珠接触,其中量子点珠包括具有第一结合材料的多官能配体和第二抗体;使具有第二结合材料的量子点与抗原-量子点珠复合物接触;和形成抗原-量子点珠-量子点结构,其中通过与量子点珠的配体形成多个键,在配体上存在多个量子点。
在本公开的一个方面中,可以提供使用根据本公开的一个方面的免疫色谱检测方法的侧流免疫传感器。
在本公开的一个方面中,可以提供用于检测生理学物质的生物诊断设备,其包括:包括量子点珠的量子点珠垫(量子点珠层,quantumdotbeadpad),量子点珠包含具有第一结合材料的多官能配体和第二抗体;包括具有第二结合材料的量子点的量子点垫(量子点层,quantumdotpad);包括其中固定了第一抗体的测试区的测试垫(测试层,testpad);和与测试垫相连的吸收剂垫(吸收剂层,absorbentpad)。
在本公开的一个方面中,生物诊断设备可以是侧流免疫传感器。
在本公开的一个方面中,吸收剂垫可以赋予毛细管作用力以使流体(例如,样品和缓冲溶液)展开。
在本公开的一个方面中,流体可以通过压力移到至吸收剂垫。
在本公开的一个方面中,生物诊断设备还可以包括辐照测试区的光辐照单元。在本公开的一个方面中,光辐照单元可以发射uv光。光辐照单元可以帮助在测试中容易地确认抗原抗体反应并对测试区中的量子点珠诱发荧光。因此,可以测量/检测目标抗原的存在或不存在。
在本公开的一个方面中,生物诊断设备还可以包括缓冲溶液容器,其可以单独存在于诊断设备中。可以通过外力破碎缓冲溶液容器以释放缓冲溶液,并且当缓冲溶液容器破碎时,缓冲溶液可以展开至量子点垫或缓冲溶液层。
在下文中,将参考实施例和实验实施例进一步详细描述本公开的构造和作用。然而,仅提供这些实施例和对比例以帮助理解本公开,并且本公开的范围不局限于以下实施例。
[制备实施例1]在其表面上具有生物素的量子点的制备
(1)油溶性量子点的制备
在3-口烧瓶中,将1.0g乙酸锌(zn(ac)2)、0.441g氧化镉(cdo)、20ml油酸和75ml十八碳烯(ode)混合并在150℃,在氮气氛下1小时以除去水。随后,将所得烧瓶加热至300℃,然后注入1ml三辛基(top)和0.045g硒(se)并加热3分钟,借此形成量子点核。
然后,将0.5ml十二硫醇加入至3-口烧瓶并反应10分钟。然后,将含有1mltop和0.025g硫(s)的溶液添加至3-口烧瓶的反应容器并反应20分钟,借此形成壳。然后,用乙醇和甲苯的混合溶液纯化所得的核和壳并将其溶于有机溶剂,借此获得第一量子点。
将0.5g所得的第一量子点、1g乙酸锌、0.21g氧化镉、10ml油酸和35ml十八碳烯置于另外的3-口烧瓶中,并且在300℃反应30分钟。随后,添加0.5ml辛硫醇并搅拌10分钟,将含有1mltop和0.025g硫的溶液置于3-口烧瓶的反应容器中并反应20分钟。然后,用乙醇和甲苯的混合溶液纯化所得化合物并将其溶于有机溶剂,借此获得第二量子点。该量子点具有核-稳定层-壳-油溶性配体层结构。
(2)羧基-取代的水溶性量子点的制备
将20mg第二量子点加入至含有1ml巯基丙酸(mpa)的反应容器中并在60℃反应60分钟,借此获得具有水溶性配体(羧基)的最终的量子点。
(3)pei-取代的水溶性量子点的制备
将pei与四氢呋喃(“thf”)混合,借此制备80mg/mlpei溶液。
将0.25μl浓度为10mg/ml的制备实施例1-(1)的第二量子点与400μlthf混合,向其中缓慢加入500μl的pei-thf溶液,然后在室温下反应过夜。然后,用thf纯化所得产物并溶于蒸馏水,借此制备具有胺基的量子点(pei-量子点)。
(4)具有生物素的量子点的制备
将浓度比量子点高10-倍(基于摩尔数)的生物素、1-乙基-3-(3-二甲基氨丙基)碳二亚胺(edc)和n-羟基琥珀酰亚胺(nhs)混合并在室温下反应2小时。反应后,将所得混合物离心,用三蒸水清洗三次,然后与制备实施例1-(3)的量子点在室温下反应1小时。反应后,将所得产物离心,用三蒸水清洗三次,用牛血清白蛋白(bsa)处理,然后在室温下反应1小时。
反应后,将所得产物离心,用三蒸水清洗三次,并通过分散在含有1mtris缓冲液(ph8)和0.1%bsa的溶液中储存。
[制备实施例2]具有结合至抗生物素蛋白的多官能配体的量子点珠的制备
(1)二氧化硅颗粒基底的合成和表面修饰
通过stober法合成了二氧化硅-基纳米颗粒。首先,将nh4oh、etoh和h2o以3:60:1ml的比例在三角瓶中搅拌,将2ml四乙基原硅酸酯(teos)加入至反应物,并将混合物在50℃搅拌并反应18小时或以上。在本文中,可以根据所期望的尺寸调整反应时间和混合比。随后,通过使用乙醇离心获得了最终样品。在本文中,可以获得约200nm的二氧化硅珠。
随后,对于表面和量子点之间的反应,作为反应性官能团,添加分别为180μl的3-巯丙基三甲氧基硅烷(mpts)和nh4oh并反应12至24小时。在通过使用乙醇离心进行纯化后,获得表面-修饰的二氧化硅颗粒基底。
(2)量子点与基底的结合
制备实施例1-(1)的量子点与表面-修饰的二氧化硅基底的比例为50:100(mg),以比上述混合物高2倍的体积添加氯仿,随后反应30分钟。反应后,获得了量子点珠。
(3)量子点珠的表面修饰
将在制备实施例2-(2)中合成的cdse/zns量子点珠和mpa(50mg:20μl)与氯仿和乙醇(2ml:2ml)混合并通过混合反应10小时,将水溶性配体(即羧基)连接至最终的量子点珠的外表面以修饰表面,随后使用乙醇并离心进行纯化。
(4)具有抗体的量子点珠的制备
输入0.1nmol在制备实施例2-(3)中合成的量子点珠(-cooh)、edc和nhs,并通过涡旋反应2小时。
反应后,将所得混合物离心以使量子点珠(-cooh)旋转沉淀,然后将量子点珠(-cooh)分散在pbs中。随后,添加多克隆抗-crp抗体(invitrogen)以具有比量子点珠(-cooh)高10-倍的浓度(基于摩尔数)并反应1小时。
反应后,用吐温20磷酸盐缓冲盐水(tpbs)清洗所得产物两次并用pbs(ph7.4)清洗一次。随后,将所得产物分散在1ml5%bsa中并通过涡旋反应1小时。反应后,用tpbs清洗所得产物两次并用pbs(ph7.4)清洗一次。
(5)配体的合成(超支化聚合物;hbp)
将0.25gp-苯二胺(pd)、0.52g苯均三酸(tma)、2ml吡啶(py)和20mln-甲基吡咯烷酮(nmp)置于3-口烧瓶中并在氮气流下混合。随后,向其中缓慢加入4ml三苯基膦(tpp),随后在80℃反应3小时。随后,用甲醇纯化所得产物,借此获得hbp。
(6)结合至抗生蛋白链菌素的多官能配体的制备
将edc和nhs加入至制备实施例2-(5)中制备的长配体(-cooh)中并通过涡旋反应2小时。反应后,用蒸馏水(d.w.)清洗所得混合物三次,然后在pbs(ph7.4)中分散。随后,添加抗生蛋白链菌素以获得比配体(-cooh)高100-倍的浓度(基于摩尔数),然后反应1小时。反应后,用蒸馏水(d.w.)清洗所得产物三次,与10%乙醇胺混合,然后反应1小时。反应后,用蒸馏水(d.w.)清洗所得产物三次,然后通过在pbs(ph7.4)中分散来储存。
(7)具有结合至抗生蛋白链菌素的多官能配体和抗体的量子点珠的制备
将在制备实施例2-(4)中制备的具有抗体的量子点珠(-cooh)与在制备实施例2-(6)中制备的结合至抗生蛋白链菌素(-sh)的多官能配体混合并通过涡旋反应1小时。反应后,将量子点珠离心,用蒸馏水清洗三次,然后通过在pbs(ph7.4)中分散来储存。
[实验实施例1]量子点和量子点珠的特征的确认
(1)量子点的ζ电位以及量子点和量子点珠的量子效率
使用els-100zs(otsukacorp.)测量了制备实施例1-(2)和1-(3)的量子点的ζ电位,并且在图2中显示了结果。
使用qe2000(otsukacorp.)测量了制备实施例1-(2)的量子点和制备实施例2-(3)的量子点珠的量子效率,并且图3中显示了结果。根据这些结果,根据本公开的一个方面中,在制备实施例1-(2)和2-(3)中制备的量子点和量子点珠分别显示出92±3%和83±3%的量子效率并且由于两者均大于80%,因此显示出优良的效果。
(2)量子点和量子点珠的尺寸和形状的确认
为了确定制备实施例1-(1)的量子点和制备实施例2-(2)的量子点珠的尺寸和形状,使用了jem-2100f(jeolltd.)和fe-sem(hitachicorp.),并且在图4a中显示了量子点的透射式电子显微镜照片,在图4b中显示了量子点珠的扫描电子显微照片。根据这些结果,可以确认根据本公开的一个方面的量子点和量子点珠两者均具有尺寸均一的球形。
(3)量子点珠的粒径分析
使用els100(otsukacorp.)进行制备实施例2-(2)的量子点珠的粒径分析并且图5显示了结果。根据结果,可以确认可以在本文中使用的量子点珠显示出高多分散性。当纳米荧光物质结块时,效率可以变差并且可以出现非特异性噪音问题。因此,在作为荧光物质使用珠时,是否维持原始尺寸是重要因素。由于可以在本文中使用的量子点珠显示出高多分散性,因此可能不会发生上述问题。
[实验实施例2]确认侧流免疫传感器中荧光反应性的实验
<对比例1和2>
将3pmol(1μl)多克隆抗-crp抗体(invitrogencorp.)注入生物传感器的硝化纤维素(nc)膜测试区,然后干燥。在制备实施例1-(4)的量子点的制备期间,在对比例1中,将量子点与多克隆抗-crp抗体反应而不是与生物素反应,并且在对比例2中,将结合至多克隆抗-crp抗体的制备实施例2-(4)的量子点珠注入缀合物层,然后干燥。
将crp抗原(0.001ng/ml、0.1ng/ml或10ng/ml;invitrogencorp.)置于第一入口并展开5分钟。在进行后,使用qd-j7荧光分析仪测量生物传感器的荧光强度。
<实施例>
将3pmol(1μl)单克隆抗-crp抗体(invitrogencorp.)注入生物传感器的nc膜测试区,然后干燥。
将制备实施例2-(7)的量子点珠注入缀合物层,然后干燥。将crp抗原(0.001ng/ml、0.1ng/ml或10ng/ml;invitrogencorp.)置于第一入口并展开5分钟,然后将制备实施例1-(4)的量子点置于第二入口以将所得溶液展开10分钟。展开后,使用qd-j7荧光分析仪测量生物传感器的荧光强度。
<结果>
根据使用根据本公开的一个方面的具有结合至抗生蛋白链菌素的多官能配体和抗体的量子点珠和具有生物素的量子点两者的检测方法,可以确认在所有抗原浓度范围,用于检测抗原的灵敏度或荧光强度比单独使用量子点和量子点珠时高至少10-倍。
与对比例1的量子点相比,由于对比例2的量子点珠含有至少200至500-倍更多的量子点,因此荧光检测强度或检测灵敏度应相应升高,但是实际上与使用对比例1的量子点类似。这是因为随着量子点数目的升高,结合至一个量子点珠的第二抗体(例如,多克隆抗-crp抗体)的数目类似地升高,从而导致所检测的抗原的数目降低并且检测强度降低。另一方面,根据本公开的方法,通过将具有多个抗生蛋白链菌素的多官能配体结合至量子点珠并将具有特异性结合至抗生蛋白链菌素的生物素的量子点与之结合,可以非常显著地放大检测强度。本公开的方法可以通过简单方法非常显著地放大检测强度而无需单独的清洗步骤。
[实验实施例3]本公开中的荧光强度放大的模拟
为了确认本公开中荧光强度的放大程度,进行了额外的实验。使用了在对比例1中使用的量子点和预期将显示出与上述实施例类似的荧光强度放大的量子点珠多重复合物。
具体地,通过将直径100至300nm的多个小量子点珠结合至直径1μm或以上的大量子点珠(如制备实施例2-(3)中制备的量子点珠)制备了量子点珠多重复合物,然后将多克隆抗-crp抗体结合至复合物。将所得的量子点珠多重复合物和对比例1的量子点加入孔板中单独的孔中,然后将crp抗原(0.001ng/ml、0.01ng/ml、0.1ng/ml、1ng/ml和10ng/ml;invitrogencorp.)加入至各个孔中。随后,使用荧光分光计(fs-2,scinco,ltd.)测量荧光强度并且在图6中显示了结果。
根据图6,与仅使用量子点的对比例1相比,可以确认非常显著地放大了替代本公开的实施例的量子点珠多重复合物的荧光强度并且荧光强度是非常优良的。具体地,以10ng/ml的crp浓度,量子点珠多重复合物显示出比对比例1的量子点高约500-倍的荧光强度,表明当根据本公开检测目标抗原时,可以以比对比例1高500-倍的灵敏度检测目标抗原。
如上,作为已详细描述的说明书的具体部分,尽管对于本领域技术人员明显地,该具体技术仅是优选实施方式,但是本说明书的范围不限于此。因此,将通过所附权利要求及其等价形式限定本说明书的基本范围。
- 还没有人留言评论。精彩留言会获得点赞!