一种单宁酸颗粒的溶出度检测方法与流程
1.本发明涉及饲料添加剂技术领域,具体涉及一种单宁酸颗粒的溶出度检测方法。
背景技术:
2.在动物饲养过程中,长期使用抗生素容易产生耐药性及药物残留等问题,从而影响食品安全。单宁酸作为植物源的抗菌物质,在饲料中应用越来越广泛。单宁酸是一种多酚类化合物,具有很强的生物学特性和药理活性,是植物代谢过程中产生的一种次生物质。研究表明,单宁酸对于禽类动物具有抗菌、抗氧化、消炎、改善肠道微生态环境和促进动物生长等作用,因此应用单宁酸可以有效减少抗生素的用量。
3.但是单宁酸在饲料中的应用还存在很多问题:1、单宁酸容易被高温高湿等环境因素破坏;2、单宁酸呈酸性,直接应用在饲料中容易被碱性物质中和;3、单宁酸的活性成品在胃、十二指肠前段吸收,影响其它营养物质吸收和适口性等。因此,单宁酸无法直接使用到饲料中,需要制成缓释制剂才能避免以上问题。缓释制剂的制备工艺对单宁酸在体内的溶解和药理作用会有严重的影响:溶解太慢,药物则无法达到血药浓度,无法产生药理作用;溶解太快,无法达到缓释效果。
4.因此,十分有必要建立一种单宁酸颗粒的溶出度检测方法,以便于有效判断单宁酸缓释制剂的效果、利于单宁酸颗粒的质量控制。
技术实现要素:
5.为了克服现有技术的不足,本发明的目的在于提供一种单宁酸颗粒的溶出度检测方法,该方法可以可靠地预测单宁酸颗粒的生物有效性。
6.为解决上述问题,本发明所采用的技术方案如下:
7.一种单宁酸颗粒的溶出度检测方法,其采用紫外分光光度法,具体步骤为:从溶出仪中取出待检测的供试品溶液,稀释、滤过,采用紫外分光光度计在274nm波长处测定吸光度,采用外标法计算不同时间内单宁酸的溶出度。
8.具体地,本发明的溶出度检测方法包括如下步骤:
9.称取单宁酸颗粒,照中国药典2020版通则0931第一法溶出度与释放度测定法,以750ml盐酸溶液为溶出介质,转速为每分钟50转,依法操作,经1.5h时,取样滤过,取续滤液滤过作为供试品溶液;照紫外分光光度法,在274nm波长处测定吸光度;取样后,加入250ml磷酸钠溶液,继续运转0.5、1、2h,取续滤液作为供试品溶液,同法测定;
10.另精密称取单宁酸对照品,加水适量,超声溶解,配制成适宜浓度的溶液,作为对照品溶液,同法测定;
11.以外标法计算盐酸溶液和磷酸钠溶液ph6.8中的溶出量。
12.作为本发明优选的实施方式,所述单宁酸颗粒在盐酸溶液中1.5小时的溶出度小于等于20%。
13.作为本发明优选的实施方式,所述单宁酸颗粒在磷酸钠溶液中0.5、1、2h小时的溶
出度分别为10~30%、40~70%、大于等于75%。
14.作为本发明优选的实施方式,所述盐酸溶液的浓度为0.1mol/l。
15.作为本发明优选的实施方式,所述磷酸钠溶液的浓度为0.2mol/l。
16.作为本发明优选的实施方式,所述磷酸钠溶液的温度为37℃
±
0.5℃。
17.作为本发明优选的实施方式,所述超声溶解的超声时间为10
‑
20min。
18.相比现有技术,本发明的有益效果在于:
19.本发明提供的饲料用单宁酸颗粒的溶出度检测方法,设计合理、准确可靠、专属性强且操作简单,据此建立单宁酸颗粒的质量控制标准,填补了饲料中单宁酸颗粒的质量控制空白,该方法能客观反映单宁酸颗粒的溶出行为,可以简便、快速、准确地测定单宁酸颗粒的溶出度及溶出曲线,可有效帮助控制单宁酸颗粒生产、使用等环节中的产品质量,保证生产工艺可控,确保临床使用安全,为产品疗效稳定确切提供了可靠保障。本发明的检测方法专属性强,线性关系好,准确度、稳定性等均符合要求。
附图说明
20.图1为本发明空白溶液、辅料溶液、对照品溶液、供试品溶液的扫描图谱;
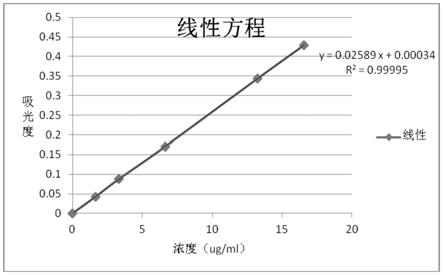
21.图2为本发明所述的溶出度检测方法的线性图。
具体实施方式
22.下面结合附图和具体实施方式对本发明作进一步详细说明。
23.一种单宁酸颗粒的溶出度检测方法,其包括以下具体步骤:
24.称取单宁酸颗粒(约相当于单宁酸130mg),照中国药典2020版通则0931第一法溶出度与释放度测定法,以浓度为0.1mol/l的750ml盐酸溶液为溶出介质,转速为每分钟50转,依法操作,经1.5h时,取样10ml,滤过,取续滤液1ml置10ml量瓶,用水稀释至刻度,摇匀,滤过作为供试品溶液;照紫外分光光度法,在274nm波长处测定吸光度;取样后,加入温度为37℃
±
0.5℃、浓度为0.2mol/l的250ml磷酸钠溶液,继续运转0.5、1、2h,取续滤液1ml置10ml量瓶,用水稀释至刻度,摇匀,作为供试品溶液,同法测定;
25.另精密称取单宁酸对照品约13mg置50ml量瓶中,加水适量,超声溶解,超声时间为10~20min,用水稀释至刻度,精密量取5ml置100ml量瓶中,加水定容至刻度,作为对照品溶液,同法测定;
26.以外标法计算盐酸溶液和磷酸钠溶液ph6.8中的溶出量。其中,单宁酸颗粒在盐酸溶液中1.5小时的溶出度小于等于20%;单宁酸颗粒在磷酸钠溶液中0.5、1、2h小时的溶出度分别为10~30%、40~70%、大于等于75%。
27.一、方法学验证
28.1、专属性
29.1)空白溶液:
30.量取盐酸溶液750ml置烧杯中,加0.2mol/l磷酸钠溶液250ml搅拌均匀,量取1ml置10ml量瓶中,用水稀释至刻度,作为空白溶液。
31.2)辅料溶液:
32.称取辅料33mg置500ml量瓶中,加水适量,超声15min,用水稀释至刻度,摇匀,滤
过,精密量取续滤液1ml置10ml量瓶中,用水稀释至刻度,作为辅料溶液。
33.3)对照品溶液:
34.称取单宁酸13mg置50ml量瓶中,加水适量,超声15min,用水稀释至刻度,摇匀,滤过,精密量取续滤液5ml置100ml量瓶中,用水稀释至刻度,作为对照品溶液。
35.4)供试品溶液:
36.取样品研细,称取细粉(相当于单宁酸13mg)置50ml量瓶中,加水适量,超声15min,用水稀释至刻度,摇匀,滤过,精密量取续滤液5ml置100ml量瓶中,用水稀释至刻度,作为供试品溶液。
37.5)样品测定:
38.取空白溶液、辅料溶液、对照品溶液、供试品溶液,以水作为空白调基线,照紫外
‑
可见分光光度法(中国药典2020年版四部通则0401)在200~400nm的波长范围内测定。
39.6)可接受标准:
40.空白溶液、辅料溶液在最大吸收波长处无吸收峰;对照品溶液与供试品溶液的扫描图谱一致。
41.7)专属性结果统计
42.如图1所示,空白溶液、辅料溶液在最大吸收波长处无吸收峰;对照品溶液与供试品溶液的扫描图谱一致,且最大吸收波长为274nm,因此选择274nm波长作为溶出度的检测波长。
43.2、准确度
44.1)准确度对照品溶液:
45.称取单宁酸13mg置50ml量瓶中,加水适量,超声15min,用水稀释至刻度,摇匀,滤过,精密量取续滤液5ml置100ml量瓶中,用水稀释至刻度,作为对照品溶液。
46.2)准确度供试品溶液:
47.称取单宁酸45.5mg、辅料20mg置250ml量瓶中,加磷酸盐缓冲液ph6.8适量,超声15min,用磷酸盐缓冲液ph6.8稀释至刻度,摇匀,滤过,精密量取续滤液1ml置10ml量瓶中,用磷酸盐缓冲液ph6.8稀释至刻度,作为供试品溶液。
48.3)样品测定:
49.取对照品溶液、供试品溶液,照紫外
‑
可见分光光度法(中国药典2020年版四部通则0401)在274nm处进行吸光度测定;
50.4)可接受标准:
51.以外标法计算3份准确度供试品,回收率在98~102%。
52.5)准确度结果统计如下表所示:
[0053][0054]
可见,准确度供试品溶液的平均准确度为99.36%,满足溶出度测定要求。
[0055]
3、线性
[0056]
1)线性母液:
[0057]
精密称取单宁酸13mg置50ml量瓶中,加水适量,超声溶解,用水稀释至刻度,摇匀,精密量取续滤液6ml置100ml量瓶中,用水稀释至刻度,作为线性母液。
[0058]
2)各浓度线性供试品溶液如下表所示:
[0059]
浓度(μg/ml)配液过程1.6精密量取线性母液1ml置10ml量瓶,用水稀释至刻度3.1精密量取线性母液2ml置10ml量瓶,用水稀释至刻度6.2精密量取线性母液4ml置10ml量瓶,用水稀释至刻度12.5精密量取线性母液8ml置10ml量瓶,用水稀释至刻度15.6取线性母液直接测定
[0060]
3)取各浓度线性供试品溶液,照紫外
‑
可见分光光度法(中国药典2020年版四部通则0401)在274nm处进行标准曲线测定;
[0061]
4)可接受标准:
[0062]
以吸光度为纵坐标,浓度为横坐标,进行线性方程回归,相关系数不得少于0.99。
[0063]
5)线性结果统计如下表和图2所示。
[0064]
浓度(μg/ml)吸光度1.660.0433.310.0886.620.1713.250.34416.560.429
[0065]
可见,本发明单宁酸在浓度1.66~16.56μg/ml范围内线性良好,回归曲线为y=0.02589x+0.00034,r2=0.99995。
[0066]
4、溶液稳定性:
[0067]
1)取室温放置的对照品溶液、溶出度供试品溶液照紫外
‑
可见分光光度法(中国药典2020年版四部通则0401)在274nm处进行吸光度测定;
[0068]
2)可接受标准:
[0069]
对照品溶液、溶出度供试品溶液的吸光值与0天相比,rsd应不大于2%。
[0070]
3)溶液稳定性结果统计如下表所示,结果表明,对照品溶液和供试品溶液在6天内稳定性良好。
[0071]
样品放置条件rsd对照品溶液室温6天1.42%供试品溶液室温6天1.57%
[0072]
5、重复性:
[0073]
1)重复性对照品溶液:
[0074]
称取单宁酸13mg置50ml量瓶中,加水适量,超声15min,用水稀释至刻度,摇匀,滤过,精密量取续滤液5ml置100ml量瓶中,用水稀释至刻度,作为对照品溶液。
[0075]
2)重复性供试品溶液:
[0076]
称取单宁酸45.5mg、辅料20mg置250ml量瓶中,加磷酸盐缓冲液ph6.8适量,超声15min,用磷酸盐缓冲液ph6.8稀释至刻度,摇匀,滤过,精密量取续滤液1ml置10ml量瓶中,用磷酸盐缓冲液ph6.8稀释至刻度,作为供试品溶液。按以上方法配制6次,得重复性供试品溶液1~6。
[0077]
3)样品测定:
[0078]
取对照品溶液、供试品溶液,照紫外
‑
可见分光光度法(中国药典2020年版四部通则0401)在274nm处进行吸光度测定;
[0079]
4)可接受标准:
[0080]
以外标法计算6份准确度供试品,6份含量的rsd应不大于1%
[0081]
5)准确度结果统计如下表所示:
[0082][0083]
可见,6份重复性供试品溶液的平均含量为99.83%,rsd为0.27%,小于1%,重复性良好,满足溶出度测定要求。
[0084]
经过系统的方法学验证,该方法的专属性、线性、准确度、溶液稳定性、重复性符合溶出度测定的要求,可以用于单宁酸颗粒的溶出度测定。
[0085]
6、批内溶出度均一性考察
[0086]
a、按上述确定的溶出度检测方法,检测3批样品在盐酸溶液2小时的溶出度,结果如下表所示:
[0087][0088]
结果显示,3批样品在盐酸溶液2小时中批内差异rsd均不大于10%,3批样品均符合质量标准。
[0089]
b、按上述确定的溶出度检测方法,检测3批样品在ph为6.8的磷酸溶液中0.5小时的溶出度,结果如下表所示:
[0090][0091]
结果显示,3批样品在磷酸ph6.8中0.5小时的批内差异rsd均不大于10%,3批样品均符合质量标准。
[0092]
c、按上述确定的溶出度检测方法,检测3批样品在ph为6.8的磷酸溶液中1.0小时的溶出度,结果如下表所示:
[0093][0094][0095]
结果显示,3批样品在磷酸ph6.8中1.0小时的批内差异rsd均不大于10%,3批样品均符合质量标准。
[0096]
c、按上述确定的溶出度检测方法,检测3批样品在ph为6.8的磷酸溶液中2.0小时的溶出度,结果如下表所示:
[0097][0098]
结果显示,3批样品在磷酸ph6.8中2.0小时的批内差异rsd均不大于10%,3批样品均符合质量标准。
[0099]
二、溶出度体内体外相关性研究
[0100]
溶出度检测方法控制是体外溶出度,其不同时间限度标准制定依据根据动物体内血药浓度确定的,按《药物非临床前药代动力学研究技术指导原则》,选用兔为动物,喂食相同剂量,单次给药3种体外不同溶出度的单宁酸颗粒,采用液相色谱法,测定体内血药浓度,
药代动力学结果如下表所示:
[0101]
样品名称达峰时间tmax(h)最高血药浓度cmax(ug/ml)药物半衰期t1/2(h)快溶出度样1.460.44.0中溶出度样4.635.68.2慢溶出度样7.318.915.4
[0102]
以上各样品的体外溶出度如下表所示:
[0103][0104][0105]
从结果分析,单宁酸颗粒喂养2
‑
3次,选择中溶出度的样品拟定质量标准合适,因此拟定体外溶出度标准为单宁酸在盐酸溶液1.5小时不大于20%、在磷酸缓冲液ph6.8中0.5、1、2小时时分别10~30%、40~70%、不少于75%。
[0106]
三、应用研究
[0107]
将符合质量标准的单宁酸颗粒投入实际应用中验证效果,采用断奶仔猪60头,平均分为3组,第一组喂硫酸粘杆菌素作为对照1组、第二组喂不符合质量标准单宁酸颗粒(快溶出样)作为对照2组、第三组符合质量标准单宁酸颗粒(中溶出度)作为实验组、喂养30天,发增加重量和腹泻情况判断对照组和实验组的优劣,结果如下表所示:
[0108]
项目对照1组对照2组实验组平均初始重量(kg)7.27.47.230天后平均重量(kg)18.616.620.3平均日增重(kg)0.620.550.67腹泻少量较多无
[0109]
结果表明,采用符合质量标准单宁酸颗粒在实际应用过程中,比抗生素相比,具有显著优势。
[0110]
上述实施方式仅为本发明的优选实施方式,不能以此来限定本发明保护的范围,本领域的技术人员在本发明的基础上所做的任何非实质性的变化及替换均属于本发明所要求保护的范围。
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1