CST1、CEA及SCC-Ag在制备食管鳞状细胞癌早期诊断试剂盒中的应用的制作方法
cysteine proteinases.improved purification from egg white,characterization,and detection in chicken serum[j].biochem j,1983,211(1):129
‑
138.)。目前按分子结构将cystatin蛋白家族分为3大类:第1类为含100个氨基酸残基的单链蛋白质,为胞内型,不含二硫键及糖链;第2类为含115个氨基酸残基和2个二硫键,为外泌型;第3类为多结构域蛋白质,哺乳动物的激肽原属于这一类。
[0005]
cst1基因定位于20p11.21染色体,编码的产物cystatin sn属于cystatin超家族中的第2类亚家族;该家族成员包括cystatin sn(cst1)、cystatin sa(cst2)、cystatin c(cst3)、cystatin a(cst4)、cystatin d(cst5)、cystatin e/m(cst6)、cystatin f(cst7)共7种蛋白,均为可外分泌的蛋白,除了cst3在体内各种体液与组织存在广泛分布与表达之外,其余家族成员在体液与组织的分布、表达具局限性,尤其cst1仅在精浆、泪液、胆囊液与颌下腺、泪腺、胆囊存在分布与表达。有研究表明cst1可在一些类型肿瘤包括肠癌、胃癌、肝癌、胰腺癌、乳腺癌的组织中存在异位高表达,且过表达cst1可对肿瘤细胞的增殖、迁移与侵袭具促进作用。有学者报道cst1是转录因子tcf的下游效应分子,可通过介导wnt/β
‑
catenin/tcf信号的传递参与胃癌的发生发展进程(choi eh,kim jt,kim jh,kim sy,song ey,kim jw,kim sy,yeom yi,kim ih,lee hg.upregulation of the cysteine protease inhibitor,cystatin sn,contributes to cell proliferation and cathepsin inhibiton in gastric cancer[j].clin chim acta2009,406(1
‑
2):45
‑
51.);而在肝癌,cst1被发现可通过调节pi3k/akt信号通路影响肿瘤细胞上皮
‑
间质转换(emt)的进程(cui y,sun d,song r,zhang s,liu x,wang y,meng f,lan y,han j,pan s,liang s,zhang b,guo h,liu y,lu z,liu l.upregulation of cystatin sn promotes hepatocellular carcinoma progression and predicts a poor prognosis.j cell physiol,2019,234(12):22623
‑
22634.)。
[0006]
目前,对于cst1与escc的相关性尚未见文献报道,也没有文献报道将cst1与其他肿瘤标志物联合用于食管鳞状细胞癌的早期诊断。
技术实现要素:
[0007]
本发明的目的在于提供一种肿瘤标志物的新应用,通过将多种肿瘤标志物联合应用,使检测的敏感性和特异性提高,从而有效诊断早期食管鳞状细胞癌。
[0008]
本发明人通过对22例escc早期患者癌组织及配对癌旁组织的免疫组化检测,结果显示cst1在癌组织的阳性表达率81.8%(18/22),而配对癌旁组织表达均为阴性,从而在蛋白质层面证明了cst1在escc早期患者的癌组织存在异常高表达。鉴于cst1在escc早期患者癌组织的异常高表达,是否检测血清中cst1有助于escc患者的早期诊断值得探讨。为此,本发明人拟建立用于血清cst1检测的cleia法,并予以系统的方法学评价;检测cst1在escc早期患者血清的表达水平,探讨血清cst1检测对escc的早期诊断价值;分析血清cst1与常规肿瘤标志物cea、cyfra21
‑
1和scc
‑
ag之间的相关性,在保证特异性的前提下,建立两者的联合检测模式,以进一步提高对escc早期诊断的敏感性。
[0009]
通过建立用于血清cst1检测的cleia法,结果显示该方法对血清cst1具有较宽的检测线性范围6.25~400pg/ml,且最低检测限为1.35pg/ml,检测灵敏度高。平均回收率102.65%,介于85%~115%,准确度高。该方法的检测精密度和重复性良好,表现为低、高
水平批内精密度4.43%、1.94%,均<1/4tea;批间精密度1.39%、1.90%,均<1/3tea。此外,该检测体系还具有良好的抗血红蛋白、类风湿因子干扰的能力,以及良好的样本稳定性与试剂稳定性,表现为样本于4℃放置7天仍可被可靠检测;试剂于25℃、37℃存放至7天的检测性能未发生明显的改变,4℃存放的效期可达6个月。以上研究结果表明我们建立的cleia法具有理想的检测线性、灵敏度、准确度、精密度、特异性与稳定性,对血清cst1的检测性能良好,可实现对escc患者血清cst1稳定、可靠的定量检测。
[0010]
另外,本发明人进一步采用建立的cleia法行370例血清样本(112例早期escc患者、107例ebl患者和151例健康体检)cst1的检测,结果显示以68.33pg/ml为cutoff值时,escc早期患者组血清cst1的水平与阳性率均明显高于ebl、hc组(p<0.05,p<0.01);cst1对escc早期患者的auc达0.654,敏感性31.25%(特异性92.64%)高于3种传统肿瘤标志物cea、cyfra21
‑
1和scc
‑
ag的敏感性16.07%
‑
28.57%(特异性93.80%
‑
95.35%),提示血清cst1的检测有助于escc患者的早期诊断。鉴于单项指标检测的敏感性有限,我们分析、比较了血清cst1与3种常规肿瘤标志物的不同组合模式对escc早期患者的诊断性能,结果表明cst1与cea、scc
‑
ag的联合检测可将对escc早期患者的auc进一步提高至0.736,敏感性和特异性显著提高,分别提高至49.11%和89.53%。
[0011]
研究结果显示,cst1与cea、scc
‑
ag的联合检测可以显著区分早期escc患者组与对照组(ebl+hc),其敏感性和特异性显著优于现有肿瘤诊断标志物,适合开发成具有临床应用价值的联合检测试剂盒。因此,根据上述试验研究结果,本发明的技术方案概况如下:cst1、cea及scc
‑
ag作为联合诊断标志物在制备诊断食管鳞状细胞癌的试剂盒中的应用。一种联合检测cst1、cea及scc
‑
ag的试剂在制备食管鳞状细胞癌诊断试剂盒中的应用。进一步优选地,所述的诊断为食管鳞状细胞癌的早期诊断,或者为食管鳞状细胞癌的病情评估、疗效监测、预后评估。进一步优选地,所述的试剂为cst1、cea及scc
‑
ag的捕获剂。再进一步优选地,所述捕获剂包括识别cst1、cea及scc
‑
ag的特异性抗体。
[0012]
与现有技术相比,本发明具有如下优点和有益效果:
[0013]
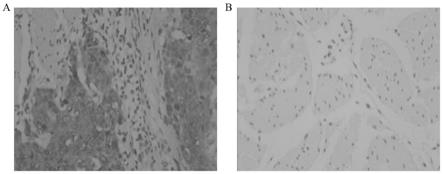
(1)本发明首次采用cst1、cea及scc
‑
ag作为一个肿瘤标志物组合用于escc的早期诊断,具有较高的敏感性和特异性,从而有助于进一步改进escc早期诊断的血清学筛查质量,进而促进患者治愈率的提高与生存率的延长。
[0014]
(2)本发明建立了对血清cst1具良好检测性能的cleia法,发现了血清cst1的检测对escc具有早期诊断的价值,且与cea、scc
‑
ag的联合检测有助于进一步提高对escc的早期诊断性能。
[0015]
(3)本发明首次通过开展的队列研究,在大样本范围内深入阐明了三种肿瘤标志物cst1、cea及scc
‑
ag的组合检测对escc具有理想的早期诊断价值。
附图说明
[0016]
图1为cst1蛋白在escc早期患者癌组织和配对癌旁组织的表达情况(
×
400),其中:a为早期escc癌组织,cst1蛋白强表达(3+);b为a的配对癌旁组织,cst1阴性。
[0017]
图2为化学发光酶免疫法的标准定量曲线。
[0018]
图3为基于cleia法对低、中、高三个血清样本4℃和25℃存放8个时间点的测定结果,其中:a为低、中、高三个血清样本4℃存放0、1、2、3、4、5、6、7d的测定结果;b为低、中、高
三个血清样本25℃存放0、1、2、3、4、5、6、7d的测定结果。
[0019]
图4为25℃和37℃存放五个时间点的cleia试剂对cst1校准品及血清样本的测定结果,其中:a、b为cleia试剂25℃存放0、1、3、5及7d后测定的结果;c、d为cleia试剂37℃存放0、1、3、5及7d后测定的结果。
[0020]
图5为4℃存放0、1、3、6(m)四个时间点三个批次cleia试剂对cst1的测定结果,其中:a
‑
g依次为对cst1校准品2(12.5pg/ml)、校准品3(25pg/ml)、校准品4(50pg/ml)、校准品5(100pg/ml)、校准品6(200pg/ml)、校准品7(400pg/ml)及血清样本(48.8pg/ml)的测定结果。
[0021]
图6为血清cst1和3种常规肿瘤标志物cea、cyfra21
‑
1、scc
‑
ag对escc早期患者的诊断性能,其中:a
‑
d分别为各组血清cst1、cea、cyfra21
‑
1、scc
‑
ag水平比较及其对escc早期患者的roc曲线;e为cst1与cea、scc
‑
ag联合检测对escc早期患者的roc曲线;*:与escc组相比较,p<0.05。
具体实施例
[0022]
下面通过具体实施方式对本发明作进一步详细说明。但本领域技术人员将会理解,下列实施例仅用于说明本发明,而不应视为限定本发明的范围。另外,实施例中未注明具体技术操作步骤或条件者,均按照本领域内的文献所描述的技术或条件或者按照产品说明书进行。所用试剂或仪器未注明生产厂商者,均为可以通过市购获得的常规产品。
[0023]
实施例1:血清半胱氨酸蛋白酶抑制剂1的检测及其对食管鳞状细胞癌早期诊断
[0024]
1材料与方法
[0025]
1.1研究对象
[0026]
收集2017年1月至2019年12月来自福建省立医院的370份血清样本,其中escc早期患者112例,食管良性病变(ebl)患者107例,健康对照(hc)151例。112例escc早期患者在内镜的基础上结合细胞学或组织病理学确诊,未接受手术、放化疗、分子靶向治疗等任何抗肿瘤治疗,tnm分期为0,ⅰ,ⅱ期。107例ebl患者来自同期在福建省立医院住院初治的患者,包括食管良性肿瘤、食管良性溃疡、食管糜烂及反流性食管炎等。151例hc来自福建省立医院体检中心的健康体检成人,未显示任何恶性肿瘤的证据。以上入选研究对象均给予知情同意并获福建省立医院伦理审查委员会的研究批准,其临床及病理资料见表1。所有血清样本均严格按以下要求留取:采集清晨空腹外周静脉血5ml,室温放置2小时,以3000rpm离心5分钟分离出血清,分装2管,
‑
80℃冻存备用。
[0027]
表1早期escc组、ebl组和hc组的临床病理资料
[0028][0029]
1.2方法
[0030]
1.2.1免疫组织化学检测(ihc)
[0031]
cst1的ihc检测试剂盒为ultrasensitivetm sap(mouse/rabbit)ihc kit(福州迈新生物技术开发公司),操作严格按照说明书进行。22例escc早期患者的癌组织及配对癌旁组织切片标本经过水浴展平后37℃烘烤24h,随后行脱蜡、水化及抗原修复,血清封闭,滴加1:100稀释抗cst1抗体、生物素标记的二抗以及链霉菌抗生物素蛋白
‑
过氧化物酶溶液,最后通过dab显色,苏木素复染,脱水至透明,封片。每个切片随机观察5个高倍镜视野,由两位有经验的病理科医师阅片。染色强度分级为:0=阴性,1+=弱阳性,2+=中阳性,3+=强阳性。
[0032]
1.2.2构建用于血清cst1检测的化学发光酶免疫分析(cleia)法
[0033]
用cbs缓冲液(称取na2co
3 1.59g,nahco
3 2.93g,蒸馏水定容至1000ml)将鼠源抗cst1单克隆抗体稀释至1.6ug/ml,包被于96微孔板,100ul/孔,4℃过夜;孔内加满洗液洗板一次后,每孔加入200ul酶标板稳定剂ⅰ(湖州英创生物科技有限公司提供,产品货号el0003,产品编号:ibs
‑
001),于37℃恒温孵育箱,60min;孔内加满洗液洗涤3次后,每孔分别加入100ul的标准品(上海良润生物科技有限公司提供)或样本,封膜封闭微孔反应板;置于37℃环境孵育60min;甩去孔内液体,孔内加满洗液,甩去,重复5次,在吸水纸上拍干;各孔加入100ul辣根过氧化物酶标记的鼠源抗cst1单克隆抗体(1:2000稀释,上海良润生物科技有限公司提供),封膜封闭微孔反应板;置于37℃环境孵育30min;甩去孔内液体,孔内加满洗液,甩去,重复5次,在吸水纸上拍干;每孔加入100ul发光液【北京科跃中楷生物科技有限公司,产品货号dw
‑
013;a液(主要成分为鲁米诺和发光增强剂)、b液(主要成分为双氧水)使用前按照1:1体积比混合】,室温避光反应3min后,在安图生物lumo化学发光仪器上测定
发光强度;根据标准曲线计算最终浓度。
[0034]
1.2.3cleia法的方法学评价
[0035]
1.2.3.1线性实验
[0036]
将cst1校准品(cst1重组抗原)在浓度范围3.125~400pg/ml内作8次梯度倍比稀释,每个稀释浓度(c)测试2次,计算每个稀释浓度测定发光值(rlu)的平均值,以c的log对数(log(c))为纵坐标y,rlu的log对数(log(rlu))为横坐标x,绘制线性曲线,通过拟合曲线,得到回归线性方程“log(c)=a*log(rlu)+b”。
[0037]
1.2.3.2最低检出限
[0038]
对校准品(0pg/ml)进行20次批内重复测定,得到20次的空白限(lob)测定值,计算rlu的均值和标准s,以为y值,代入校准品曲线公式,计算出相对应的的浓度值,即为本方法的最低检出限。
[0039]
1.2.3.3回收率实验
[0040]
选择一标本为基础样本,取900μl基础样本和100μl蒸馏水作为对照样本,分别取900μl基础样本、8μl浓度为200pg/ml的校准品和92μl蒸馏水作为回收样品1;取900μl基础样本、48μl浓度为200pg/ml的校准品和52μl蒸馏水作为回收样品2;取900μl基础样本、72μl浓度为200pg/ml的校准品和28μl蒸馏水作为回收样品3。每份样品在检测系统上测定2次,取平均值。根据以下公式计算回收率:回收率=回收浓度/加入浓度
×
100%;回收浓度=最终测定浓度
‑
基础样本浓度;加入浓度=标准品浓度
×
标准品体积/(标准品体积+基础样本体积)。
[0041]
1.2.3.4精密度实验
[0042]
按照clsi ep15
‑
a2标准:取高、低浓度2个水平,5天实验,每天一批,每批每个水平重复测定3次,取平均值。
[0043]
1.2.3.5干扰试验
[0044]
根据ws
‑
t 416
‑
2013干扰实验指南,在cst1水平分别为20.95pg/ml、65.39pg/ml的血清样本中按1:9比例分别加入浓度为2g/l的血红蛋白(hb)、浓度为750ipg/ml的类风湿因子(rf)、浓度为342umol/l的胆红素、浓度为37mmol/l的甘油三酯,并以蒸馏水为对照。各实验样本和对照样本重复检测3次,取平均值,计算偏倚值,小于10%无显著干扰。
[0045]
1.2.3.6样本稳定性
[0046]
取高浓度(197.03pg/ml)、中浓度(81.60pg/ml)、低浓度(23.74pg/ml)三个水平血清样本置于室温25℃和4℃保存,检测存放0、1、2、3、4、5、6、7d的样本浓度,每个样本重复检测2次,取平均值,计算偏倚值,小于10%为可接受范围。
[0047]
1.2.3.7试剂稳定性
[0048]
使用在25℃存放0、1、3、5、7d共5个时间点的试剂检测cst1校准品以及血清样本;使用在37℃存放0、1、3、5、7d共5个时间点的试剂检测cst1校准品以及血清样本;使用在4℃存放0、1、3、6m共4个时间点的试剂检测cst1校准品以及血清样本。每份标本均检测两次,取均值,计算偏倚,小于10%为可接受范围。
[0049]
1.2.4常规肿瘤标志物检测
[0050]
血清cea、cyfra21
‑
1的检测采用电化学发光法,检测仪器为罗氏cobas e 602电化学发光免疫分析仪;血清scc
‑
ag的检测采用化学发光微粒子分析技术,检测仪器为雅培
i2000sr化学发光分析仪。以上操作严格按照厂家试剂盒的使用说明书进行。
[0051]
1.3血清cst1对escc早期患者的诊断cutoff值、敏感性与特异性
[0052]
使用构建的cleia法对escc早期患者组112例、ebl组107例以及hc组151例的血清样本进行cst1的检测。escc组与ebl组、hc组定量数值的比较采用非参数统计的mann
‑
whitneyu检验,p<0.01认为具有显著性差异;以hc组151例健康体检成人血清cst1检测数值的95%位数作为escc早期患者诊断cutoff值的确定依据。
[0053]
1.4统计学分析
[0054]
应用spss 25.0统计软件进行统计学分析。graphpad prism5制作图表,spss 25.0制作roc曲线,计算auc值,以p<0.05为差异有统计学意义。
[0055]
2结果
[0056]
2.1cst1蛋白在escc癌组织的表达
[0057]
免疫组化结果显示,cst1蛋白在escc早期患者癌组织呈现灶状或弥漫性分布的棕褐色颗粒(图1a),而在配对癌旁组织细胞中不表达或弱表达(图1b)。cst1在癌组织的阳性表达率81.8%(18/22),而配对癌旁组织表达均为阴性,表明cst1在escc早期患者的癌组织存在异常高表达。
[0058]
2.2线性实验
[0059]
对重复两次测定的cst1校准品在线性范围3.125
‑
400pg/ml倍比稀释后的8个浓度点rlu值计算均值后,进行曲线拟合(图2)。但当浓度低于6.25pg/ml时,线性关系不明显(数据未显示),因而本研究决定将6.25
‑
400pg/ml作为构建的cleia法测定血清cst1水平的线性范围。通过计算相应浓度点的log(c)与log(rlu)拟合曲线得到线性回归方程:log(c)=1.213log(rlu)
‑
4.079(r2=0.9935,p<0.01,n=7)。
[0060]
2.3最低检出限
[0061]
对校准品(0pg/ml)进行20次批内重复测定,得出s=157.7,以为y值,代入校准曲线公式,计算得出最低检出限为1.35pg/ml(表2)。
[0062]
表2 cleia法的最低检测限
[0063][0064]
[0065]
2.4回收率实验
[0066]
根据相关公式计算,该检测方法的平均回收率为102.65%,介于85%~115%(表3)。
[0067]
表3 cleia法的回收率测定
[0068][0069]
2.5精密度实验
[0070]
低、高水平的批内精密度分别为4.43%、1.94%,均<1/4tea(clia’88,25%);批间精密度分别为1.39%、1.90%,均<1/3tea(clia’88,25%)(表4)。
[0071]
表4 cleia法的精密度评价
[0072][0073]
2.6干扰试验
[0074]
血红蛋白、类风湿因子对本方法无显著干扰,重度脂血和黄疸对低浓度cst1的检测具一定的干扰(表5)。
[0075]
表5 cleia法的干扰性实验
[0076][0077]
2.7样本稳定性
[0078]
低、中、高3个水平血清样本4℃保存7天的检测结果偏倚均小于10%,结果稳定。而样本置于常温25℃保存对检测结果有一定的影响,低、中、高3个水平血清样本25℃保存2天后结果偏倚均大于10%(图3)。
[0079]
2.8试剂稳定性
[0080]
热稳定性评价:使用25℃、37℃存放0、1、3、5、7d的试剂检测cst1校准品及血清样本,不同时间点测定结果与0d相比较,偏倚均小于10%(图4)。
[0081]
效期稳定性评价:使用4℃存放0、1、3、6月(m)的试剂检测cst1校准品及血清样本,不同时间点测定结果与0m相比较,偏倚均小于10%(图5)。
[0082]
2.9血清cst1对escc早期患者诊断cutoff值的确定以及敏感性、特异性
[0083]
escc早期患者组血清cst1的水平与阳性率均明显高于ebl、hc组(p<0.05,p<0.01,表6,图6a)。151例健康体检成人的血清cst1检测数值的95%位数为68.33pg/ml,以68.33pg/ml为cutoff值,cst1对escc早期患者的诊断敏感性31.25%、特异性92.64%,auc达0.654(图6a)。
[0084]
表6各组血清cst1阳性率的比较
[0085][0086]
**:与早期escc组相比较,p<0.01
[0087]
2.10三种血清常规肿瘤标志物对escc早期患者的诊断性能
[0088]
escc早期患者组血清cea的水平与阳性率均明显高于ebl组/hc组(p<0.05);escc早期患者组血清cyfra21
‑
1、scc
‑
ag的阳性率明显高于ebl组/hc组(p<0.01),而水平与ebl组/hc组相比较无显著差异(p>0.05)。3种常规肿瘤标志物对escc早期患者的诊断敏感性介于16.07%
‑
28.57%,特异性>93.0%,以scc
‑
ag的auc最高,达0.709(图6b
‑
d)。
[0089]
2.11血清cst1与3种常规肿瘤标志物的不同组合模式对escc早期患者诊断性能的比较
[0090]
血清cst1与3种常规肿瘤标志物的不同组合模式对escc早期患者诊断性能的比较见表7,以cst1与cea、scc
‑
ag的联合检测对escc早期患者的auc最高,达0.736(95%ci 0.678
‑
0.793),诊断敏感性49.11%(特异性89.53%)(图6e)。
[0091]
表7:cst1与3种常规肿瘤标志物不同组合模式对escc早期患者诊断性能的比较
[0092][0093]
①
:在任意两项指标联合检测中auc最高;
②
:在任意三项指标联合检测中auc最高。
[0094]
3讨论
[0095]
通过对22例escc早期患者癌组织及配对癌旁组织的免疫组化检测,结果显示cst1蛋白在escc患者癌组织的表达阳性率81.8%(18/22),明显高于配对癌旁组织的0%(0/220)(p<0.01),表明cst1可能参与了escc的发生发展进程。鉴于cst1在escc癌组织的异位高表达,其在escc患者血清中是否存在异常表达值得探讨。为此,我们建立了用于血清cst1检测的cleia法,并予以了系统的方法学评价,结果显示该方法对血清cst1具有较宽的检测线性范围6.25~400pg/ml,且最低检测限为1.35pg/ml,检测灵敏度高。平均回收率102.65%,介于85%~115%,准确度高。该方法的检测精密度和重复性良好,表现为低、高水平批内精密度4.43%、1.94%,均<1/4tea;批间精密度1.39%、1.90%,均<1/3tea。此外,该检测体系还具有良好的抗血红蛋白、类风湿因子干扰的能力,以及良好的样本稳定性与试剂稳定性,表现为样本于4℃放置7天仍可被可靠检测;试剂于25℃、37℃存放至7天的检测性能未发生明显的改变,4℃存放的效期可达6个月。以上研究结果表明我们建立的cleia法具有理想的检测线性、灵敏度、准确度、精密度、特异性与稳定性,对血清cst1的检测性能良好,可实现对escc患者血清cst1稳定、可靠的定量检测。
[0096]
进一步采用建立的cleia法行370例血清样本(112例早期escc患者、107例ebl患者和151例健康体检)cst1的检测,结果显示以68.33pg/ml为cutoff值时,escc早期患者组血清cst1的水平与阳性率均明显高于ebl、hc组(p<0.05,p<0.01);cst1对escc早期患者的auc达0.654,敏感性31.25%(特异性92.64%)高于3种传统肿瘤标志物cea、cyfra21
‑
1和scc
‑
ag的敏感性16.07%
‑
28.57%(特异性93.80%
‑
95.35%),提示血清cst1的检测有助于escc患者的早期诊断。鉴于单项指标检测的敏感性有限,我们分析、比较了血清cst1与3种常规肿瘤标志物的不同组合模式对escc早期患者的诊断性能,结果表明cst1与cea、scc
‑
ag的联合检测可将对escc早期患者的auc进一步提高至0.736,敏感性提高至49.11%(特异性89.53%)。
[0097]
综上所述,本研究建立了对血清cst1具良好检测性能的cleia法;发现血清cst1的检测对escc具有早期诊断的价值,且与cea、scc
‑
ag的联合检测有助于进一步提高对escc的早期诊断性能。
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1