一种无汞测定铁含量的方法
1.本发明涉及一种测定铁含量的方法,尤其涉及一种不必使用含汞试剂的测定铁含量的方法。
背景技术:
2.现行测定含铁试样中全铁含量主要有三个标准方法:edta光度滴定法、三氯化钛还原-重铬酸钾滴定法和氯化亚锡还原-氯化汞-重铬酸钾滴定法。其中,edta光度滴定法测定铁含量,与铁共存的金属离子干扰影响较大,需要精确控制酸度,要用光度电极指示终点并通过计算机软件控制滴定过程,不易普及。而三氯化钛还原-重铬酸钾滴定法中使用的三氯化钛试剂不稳定,易氧化变质,不易控制在还原过程中三氯化钛的量,当三氯化钛的量过量较多时,生成的磷钨蓝颜色过深,使用稀的重铬酸钾除去过量的三氯化钛时磷钨蓝的蓝色很难完全褪色,容易引起实验误差,易生成大量的白色tio2沉淀,影响终点颜色的观察,准确度较低。氯化亚锡还原-氯化汞-重铬酸钾滴定法是测定铁含量的最常用的方法,具有好的准确度和精密度,但是,其在预处理时要用到有毒的氯化汞溶液,测定之后的废液需要做特别回收处理,操作复杂且对环境不友好。
3.另外,氯化亚锡-三氯化钛联合还原或氯化亚锡-甲基橙联合还原的无汞测铁法也是目前常用的方法,该方法虽然避免了汞试剂的使用,但是溶液酸度的控制对甲基橙与fe(iii)被还原的顺序有重要影响,需要严格的条件控制,操作较为复杂,精密度和准确度欠佳。
4.cn 102608112a公开了一种无汞测铁新方法,其用盐酸、硫酸、磷酸的混酸分解试样,以中性红和二苯胺磺酸钠作指示剂,用sncl
2-ticl
3-k2cr2o7容量法测定铁,用φsn 4+
/sn 2+
=+0.16v二氯化亚锡还原φfe
3+
/fe
2+
=+0.76v的fe
3+
,当溶液为淡黄色即溶液中仍有少量fe
3+
时,加中性红试剂,根据中性红试剂在fe
3+
溶液中为蓝色,当fe
3+
时全部还原后,中性红便被还原呈无色,将中性红的变色作fe
3+
完全被还原成fe
2+
的指示剂,滴加φti
4+
/ti
3+
=+0.1v的三氯化钛至蓝色消失,过量三氯化钛以5.000g
·
l-1
二苯胺磺酸钠-重鉻酸钾标准溶液法氧化除去,最后计算出试样的铁品位。该方法在分解样品时加入了磷酸,降低了盐酸的浓度,理论上降低了φfe
3+
/fe
2+
,在预处理过程中可能会使二氯化亚锡更容易过量,在ticl3继续处理和滴定之前,空气中的氧气更容易氧化已经还原的亚铁离子,ticl3在使用中不易保存,要现配现用,且存在ticl3过量的问题,后续不仅需要使用重铬酸钾氧化除去过量的ticl3,步骤繁琐,而且,当ticl3过量较多时,往往会水解生成大量的沉淀,会严重影响结果的准确度。
5.cn 104678050 a本发明涉及一种采用碘量法测定磷酸铁锂中三价铁含量的方法。该方法在盐酸介质中溶解lifepo4时,添加能够产生不与二价/三价铁离子反应的气体的物质,通过产生的气体驱赶氧气,使lifepo4在溶样过程中以及溶解完全后的冷却过程中不发生氧化还原反应;然后采取碘量法测定磷酸铁锂中三价铁含量,即在酸性条件下,三价铁将i-定量氧化为i 2
,然后用硫代硫酸钠滴定,从而测定三价铁的含量。该方法的缺点是:只能
测定组成比较单一的样品中三价铁的含量,无法准确测定复杂样品中常量成分全铁的含量,同时cu
2+
的干扰会严重影响测定的准确度。
6.cn 102590202a公开了一种铁的测定方法,包括以下步骤:配制多个不同浓度的fe
3+
标准溶液;分别向所述多个fe
3+
标准溶液中加入第一硝酸溶液和第一硫氰化钾溶液进行显色反应;取磷酸铁锂样品制备待测品溶液;向所述待测品溶液中加入第二硝酸溶液和第二硫氰化钾溶液进行显色反应;将所述显色反应后的待测品溶液与所述多个显色反应后的fe
3+
标准溶液进行比色,根据比色结果得到待测品溶液中的铁含量。该方法是半定量的比色法测定待测品溶液中的三价铁的含量,测定原理不属于选择性好、准确度高的重铬酸钾滴定法,无法准确测定常量成分全铁的含量。
技术实现要素:
7.本发明要解决的技术问题是,克服现有技术存在的上述缺陷,提供一种不必使用含汞试剂,操作简单,精密度和准确度高的测定铁含量的方法。
8.本发明解决其技术问题采用的技术方案是,一种无汞测定铁含量的方法,包括下列步骤:
9.(1)溶解含铁试样,得含铁待测液;
10.(2)将步骤(1)所得的含铁待测液加热,在近沸状态下滴加sncl2溶液至含铁待测液的浅黄色消失,得溶液a;
11.(3)将步骤(2)所得的溶液a冷却至室温,滴加含i2的溶液至溶液a呈淡黄色,得溶液b;
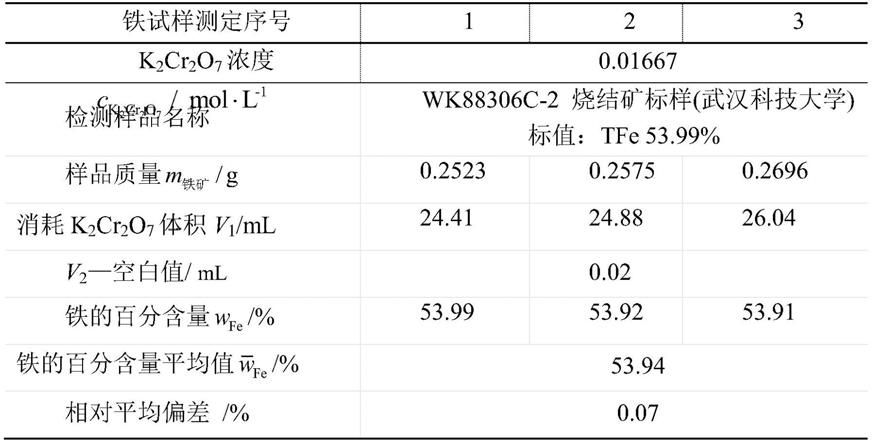
12.(4)向步骤(3)所得的溶液b中加入agcl-nacl混合物或ag2so4溶液,充分摇匀,得溶液c;
13.(5)向步骤(4)所得的溶液c中加入硫磷混酸溶液,然后加入二苯胺磺酸钠指示剂,再用重铬酸钾标准溶液滴定,记录消耗的重铬酸钾标准溶液体积;
14.(6)取硫酸亚铁铵溶液和高锰酸钾溶液混合,代替步骤(1)中的“含铁试样”,然后按照以上步骤(1)-(5)进行滴定,记录消耗的重铬酸钾标准溶液的体积,计算得含铁试样中的铁含量。
15.进一步,步骤(2)中,所述sncl2溶液的浓度为80~110g/l,优选100g/l。
16.进一步,步骤(2)中,所述加热为加热至85~100℃,再在85~100℃(近沸状态)下滴加sncl2溶液。
17.进一步,步骤(3)中,所述含i2的溶液为i
2-冰醋酸、i
2-乙醇溶液、i
2-ki溶液和i
2-丙酮溶液的一种或几种。
18.进一步,步骤(3)中,所述i
2-冰醋酸的浓度为0.01~0.1mol
·
l-1
;所述i
2-乙醇溶液、i
2-ki溶液和i
2-丙酮溶液的浓度均为0.01~0.10mol
·
l-1
。
19.进一步,步骤(4)中,所述agcl-nacl混合物中agcl的质量含量为5%~50%。
20.进一步,步骤(4)中,所述agcl-nacl混合物的加入量为0.01~0.30g。
21.进一步,步骤(5)中,所述硫磷混酸溶液为硫酸、磷酸和水混合而成的混合酸,三者的体积比为(10~30):(10~30):(40~80),优选为15:15:70。
22.进一步,步骤(5)中,所述硫磷混酸溶液的加入量为10~20ml,优选13~17ml,更优
选15ml。
23.进一步,步骤(5)中,所述二苯胺磺酸钠指示剂的质量浓度为0.1~0.3%,优选0.2%。
24.进一步,步骤(5)中,所述二苯胺磺酸钠指示剂的量为2~6滴。
25.进一步,步骤(5)中,所述重铬酸钾标准溶液的浓度为0.008~0.020mol
·
l-1
优选0.01667mol
·
l-1
。
26.进一步,步骤(6)中,所述硫酸亚铁铵溶液的量为1.00ml,浓度为0.1000mol/l;所述高锰酸钾溶液的量为1ml,浓度为0.02mol/l。
27.由于含铁试样中通常同时含有fe
3+
和fe
2+
离子,因此测定全铁时必须先用还原剂将所有fe
3+
预先还原成fe
2+
,才能用k2cr2o7标准溶液进行滴定。现有技术中通常使用sncl2还原fe
3+
,然后用hgcl2溶液氧化除去多余的sncl2,最后在酸性介质中用k2cr2o7溶液滴定生成的fe
2+
离子,但该方法中使用的hgcl2溶液有剧毒,需要十分严格的防护措施,否则会对人体和环境造成危害。而本发明用含i2的溶液替代hgcl2溶液,并用agcl或ag2so4掩蔽生成的i-,避免了汞盐对环境的污染。
28.本发明原理是:首先,根据含铁试样的性质采用不同的方法按gbt6730.70-2013中的分解方法进行试样的分解:对含钒量≤0.05wt%、含钼量≤00.1wt%或含铜量≤00.1wt%的试样,用盐酸溶样,过滤残渣灼烧后用氢氟酸和硫酸处理,去除二氧化硅,用焦硫酸钾熔融,将熔融物溶于盐酸,加氨水沉淀出铁,加盐酸再次溶解沉淀,将该溶液并入到主液中,得含铁待测液;或者,对含钒量>0.05wt%的试样,用碱熔融,用水浸出熔融物并过滤,弃去滤液,用盐酸溶解酸化,得含铁待测液;然后,将所得含铁待测液用sncl2将fe
3+
离子还原至黄色消失,然后用i2氧化过量的sncl2至溶液出现稳定的浅黄色,再加入agcl掩蔽生成的i-,相应的反应式如下:
[0029][0030]
sn
2+
+i2=2i-+sn
4+
[0031]
i-+agcl=agi+cl-[0032]
最后,以二苯胺磺酸钠为指示剂,用k2cr2o7标准溶液滴定亚铁离子,滴定反应式为:
[0033]
6fe
2+
+cr2o
72-+14h
+
=6fe
3+
+2cr
3+
+7h2o
[0034]
滴定突跃范围为0.93~1.34v;由于二苯胺磺酸钠的条件电位为0.85v,低于滴定的突跃范围,因此,当使用二苯胺磺酸钠作为指示剂时,需加入硫磷混酸试剂(含h3po4)使滴定生成的fe
3+
转化为无色的fe(hpo4)
2-络离子,这样一方面减少游离fe
3+
离子的浓度,降低fe
3+
/fe
2+
电对的条件电位,使突跃范围扩大为0.71~1.34v,指示剂可以在此范围内变色,减小滴定终点误差,反应也更完全;另一方面也能消除滴定过程中生成黄色的fecl
4-对终点观察的干扰。
[0035]
与现有技术相比,本发明具有以下有益效果:(1)本发明在测定过程中不需要使用氯化汞试剂,安全环保;(2)与sncl2–
ticl3联合还原法相比较,本发明容易控制在预处理时滴加的sncl2溶液的量,另外适当过量的i2不影响滴定终点的判断,精密度和准确度高;(3)本发明使用的试剂的性质更稳定,操作更简便。
具体实施方式
[0036]
下面结合具体实施例对本发明作进一步说明。
[0037]
本发明实施例所使用硫酸、磷酸、盐酸、氯化亚锡、碘、冰乙酸、nacl、二苯胺磺酸钠,均通过常规商业途径获得,agcl来自处理莫尔法测氯含量实验的废液回收所得的氯化银固体。
[0038]
实施例1
[0039]
本实施例无汞测定铁含量的方法,包括下列步骤:
[0040]
(1)称取适量样品(三次平行实验称量的样品质量略有区别,具体质量见表1)于锥形瓶,加入10ml浓hcl,锥形瓶口上放置一短颈小漏斗,在沸水浴中加热溶解,溶解完全后,用少量水冲洗小漏斗及瓶内壁,控制冲洗时的用水量为10ml,得含铁待测液;
[0041]
(2)将步骤(1)所得的含铁待测液加热至90℃,在近沸状态下(在沸水浴中有石棉网电炉上加热)滴加100g
·
l-1
sncl2溶液至含铁待测液的浅黄色消失并过量2滴,摇匀30秒,在流水下冷却至室温,得溶液a;
[0042]
(3)将步骤(2)所得的溶液a冷却至室温,向其中滴加0.05mol
·
l-1i2-冰乙酸至溶液a呈稳定的淡黄色,得溶液b;
[0043]
(4)向步骤(3)所得的溶液b中加入0.1g agcl-nacl混合物(其中agcl的质量含量为20%),充分摇匀,得溶液c;
[0044]
(5)向步骤(4)所得的溶液c中加入80ml水,15ml硫磷混合酸(硫酸、磷酸和水三者的体积比为15:15:70),然后加入6滴0.2%二苯胺磺酸钠指示剂,再用0.01667mol
·
l-1
重铬酸钾标准溶液滴定,当溶液颜色由绿色变为蓝绿色再突变为紫红色,即为终点,消耗重铬酸钾标准溶液v1.
[0045]
(6)空白值的测定
[0046]
取1.00ml0.1000 mol/l的硫酸亚铁铵溶液加1ml 0.02mol/l的高锰酸钾溶液”代替步骤(1)中的“称取适量样品”,其余步骤及使用试剂和用量按以上步骤(1)-(5)进行,步骤(5)中消耗的重铬酸钾标准溶液的体积为v0,得空白值v2(v2=v
0-1.00);
[0047]
(7)按如下公式计算检测样品中铁的质量分数,其中步骤(1)~(6)的具体数据见表1:
[0048][0049]
式中:—重铬酸钾标准溶液的浓度,mol
·
l-1
[0050]v1
—试样消耗重铬酸钾标准溶液的体积,ml
[0051]v2
—空白值,ml
[0052]
m—铁矿样质量,g
[0053]mfe
—铁元素的摩尔质量,g
·
mol-1
[0054]
6—重铬酸钾与铁的系数比
[0055]
表1实施例1测定铁含量的方法的测试数据及结果
[0056][0057]
实施例2
[0058]
本实施例无汞测定铁含量的操作步骤与实施例1相同,区别在于,其中使用的含银试剂为2ml 0.1mol/l ag2so4溶液(实施例1为0.1g agcl-nacl混合物)。本实施例检测样品中铁的质量分数的计算方法也与实施例1相同。具体测试数据和结果见表2。
[0059]
表2实施例2测定铁含量的方法的测试数据及结果
[0060][0061]
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1