高效测定神经节苷脂GM1及其杂质的药物分析方法与流程
高效测定神经节苷脂gm1及其杂质的药物分析方法
1.本技术为2017年10月27日提交的申请号为201711030431.2专利申请的分案申请。
技术领域
2.本发明属于药物分析技术领域,具体涉及一种高效测定神经节苷脂gm1单组份及有关物质的药物分析方法。该分析方法能够有效分离和测定神经节苷脂gm1单组份及其相关杂质的含量,具有操作简便、快捷,可作为神经节苷脂gm1质量控制的重要组成部分。
背景技术:
3.神经节苷脂(gangliosides)是最复杂的鞘糖脂,广泛分布于脊椎动物的细胞膜上,在中枢神经系统中含量最高。它由带唾液酸的寡糖链和神经酰胺构成,根据唾液酸和寡糖的糖基数目及唾液酸连接位点的不同,可将神经节苷脂进行分类。其中含量较高的神经节苷脂为gm1、gdla、gdlb、gd3及gtlb。
4.gm1主要包括gm1a和gm1b两种组分,且所述gm1a和gm1b具有如下的结构。gm1通过对na+,k+-atp酶活性的“补偿”而发挥作用,在na+,k+-atp酶保持膜稳定和兴奋性方面起着重要的作用,对细胞正常功能非常重要。gm1的功能大致可归纳为以下几种:1.促进神经细胞及大脑组织的正常发育,防治脑瘫等疾病;2.修复损伤神经及大脑组织,防治脑中风;3.增强记忆功能;4.延缓神经细胞的衰老,防治帕金森、老年痴呆等疾病。gm1作用备受医药领域关注,目前国内已有多家产品上市。
[0005][0006]
神经节苷脂gm1的制备来源于生物组织,成分复杂,而产品中杂质的种类和含量直接关系到药品质量和用药安全,因此如何准确测定神经节苷脂gm1单组份有关物质及含量则成为一个丞待解决的问题。国家药典(2015)关于神经节苷脂gm1原料药ws
1-xg-001-2015、注射用ws
1-xg-002-2015、注射剂ws
1-xg-003-2015中规定一种测定神经节苷脂gm1有
关物质及含量的检测方法,特征是均采用氨基柱为分离基质、以大量有机溶剂为流动相的等度分离技术。上述方法的选择性有限,分离能力弱,存在对结构相似的有关物质不能有效分离的风险;使用205nm低紫外波长为检测波长、四氢呋喃为流动相,使得基线基础吸收值增高,基线噪音增大,杂质的检测灵敏度会随之减弱,存在对杂质低估甚至对杂质谱分析不完全的风险;且方法稳定性和重现性较差。为有效分析和检测药品质量,保证用药安全,仍需要开发出一种便捷、高效、准确测定神经节苷脂gm1及有关物质含量的分析方法。
技术实现要素:
[0007]
本发明第一方面提供一种测定神经节苷脂gm1及其有关物质的高效液相色谱方法,该方法采用以十八烷基硅烷键合硅胶为填充剂的色谱柱,以缓冲盐溶液-有机相为流动相。
[0008]
其中,所述缓冲盐溶液选自下列盐的溶液:磷酸盐、高氯酸盐、甲酸盐、乙酸盐,优选磷酸二氢盐,更优选磷酸二氢钾;所述磷酸盐包括磷酸正盐、磷酸氢二盐、磷酸二氢盐;所述盐选自钠、钾、铷、铯、锂、铵或胺、钙的盐;所述有机相选自甲醇、乙醇、乙腈、丙醇、异丙醇中的一种或混合,优选乙腈。
[0009]
优选地,所述缓冲盐溶液的ph值为6.0~9.0,优选6.5~7.5,更优选6.8、7.0、7.2。
[0010]
优选地,所述色谱柱为反向色谱柱,选自kromasil、apollo、waters、merk。
[0011]
优选地,所述色谱柱的规格为150mm
×
4.6mm,3.5um,或其他效能相当的色谱柱。
[0012]
优选地,所述方法的柱温为40℃;检测波长为200~210nm,优选205nm。
[0013]
优选地,所方法的流动相流速为:0.5ml/min~1.5ml/min,优选1.0ml/min;
[0014]
优选地,缓冲盐溶液的ph值可以使用磷酸、碳酸钾、碳酸钠、三乙胺及其溶液进行调解;用于调节ph值的溶液的浓度为本领域的常规浓度,优选0.1~1.0mol/l。
[0015]
优选地,所述方法采用梯度洗脱;具体地,所述流动相包含流动相a、流动相b,或者由流动相a、流动相b组成;所述流动相a为乙腈-磷酸二氢盐溶液混合液,所述流动相b为乙腈;其中,流动相a中乙腈与磷酸二氢盐溶液的体积比为30~80:70~20,优选60~70:40~30,更优选65~70:35~30;在本发明的一个优选技术方案中,流动相a中乙腈与磷酸二氢盐溶液的体积比为68:32。
[0016]
在本发明的流动相中,缓冲盐溶液的浓度为0.001~0.50mol/l,优选0.005~0.10mol/l、0.01~0.05mol/l,更优选0.02mol/l或0.01mol/l;在一个优选技术方案中,所述缓冲盐溶液为0.01mol/l的磷酸二氢钾溶液、0.01mol/l的磷酸二氢钠、或者0.01mol/l的磷酸二氢铵。
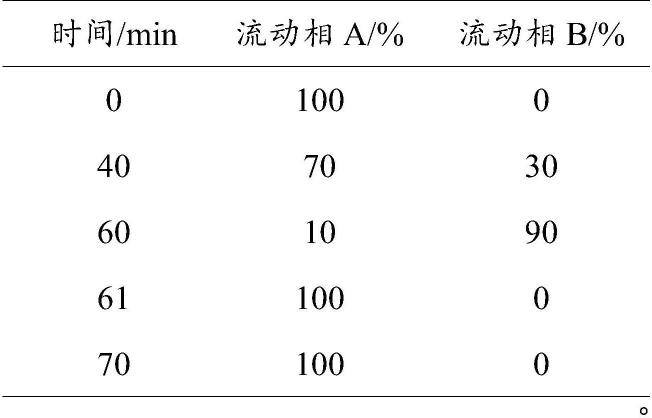
[0017]
优选地,本发明流动相采用如下梯度进行洗脱:
[0018][0019]
注:100-a是指除流动相a以外,其他全部为流动相b;
[0020]
在本发明的一个技术方法中,本发明采用如下的洗脱梯度:
[0021][0022][0023]
供试样品、对照品溶液、系统适用性溶液按照国家药典(2015)关于神经节苷脂gm1原料药ws
1-xg-001-2015标准规定的方法或本领域的其他常规方法制备即可。在本发明的一个技术方案中,供试样品溶液、对照品溶液、系统适用性溶液可以按照下述方法制备:
[0024]
(1)供试品溶液:取供试样品适量,精密称定,加水或乙腈水溶液溶解并稀释制成0.5~10mg/ml的溶液,优选1.0mg/ml~5.0mg/ml,更优选1.0mg/ml,5.0mg/ml,作为供试品溶液。更具体地,供试品溶液可以通过下述方法制备得到:取本品约50mg,精密称定,置10ml容量瓶中,加水溶解并稀释至刻度,摇匀,即得到浓度为5.0mg/ml的供试品溶液。
[0025]
(2)对照品溶液:取神经节苷脂gm1对照品适量,精密称定,选择水或者乙腈水溶液溶解并稀释制成约0.05~1.5mg/ml(优选0.05mg/ml或1mg/ml)的溶液,作为对照品溶液。更具体地,含量对照品溶液可以通过如下方法制备得到:取gm1a、gm1b对照品各约25mg,精密称定,置50ml容量瓶中,加水溶解并稀释至刻度,摇匀;精密量取5ml,置50ml量瓶中,加水稀释至刻度,摇匀,作为对照品溶液。有关物质对照品溶液可以通过如下方法制备得到:取单唾液酸四己糖神经节苷脂钠a(即gm1的钠盐形式)或者单唾液酸四己糖神经节苷脂钠b(即gm1b的钠盐形式)对照品约25mg,精密称定,置50ml容量瓶中,加水溶解并稀释至刻度,摇
匀;精密量取此溶液5ml,置50ml容量瓶中,加水稀释至刻度,摇匀。
[0026]
(3)系统适用性溶液:取神经节苷脂gm1a、gm1b、gd1a、gd3各适量,精密称定,用乙腈水溶液溶解并稀释制成每1ml中约含神经节苷脂gm1的质量为0.5~5mg(优选1mg或5mg)及各杂质分别为20~120μg(优选50μg)的混合溶液。可选地,上述系统适用性溶液还含有适量的唾液酸。
[0027]
在一个技术方案中,所述系统适用性溶液可以通过以下方法制备:取gd1a对照品约2mg和gd3对照品约1mg,置同一容器中,加20ml水溶解,摇匀,作为系统适用性溶液储备液;取gm1a和gm1b各约5mg,加入系统适用性溶液储备液2ml,使溶解,摇匀,作为系统适用性溶液)。
[0028]
其中,上述乙腈水溶液中,乙腈体积分数为0%~40%,优选0%~20%,更优选为10%。
[0029]
在本发明的一个优选技术方案中,在本发明所述测定神经节苷脂gm1及其有关物质的高效液相色谱方法的采用如下色谱条件和步骤:
[0030]
色谱条件:
[0031]
高效液相色谱仪的型号,无特别要求;可以选用如下色谱仪为waters e2695-2489或agilent 1260-vwd、waters acquity arc-2489;
[0032]
色谱柱:c18(waters,4.6
×
150mm,3.5μm);
[0033]
流动相a:0.01mol/l磷酸二氢钾溶液-乙腈(30:70),用三乙胺调节ph=7.0。
[0034]
流动相b:乙腈
[0035]
采用梯度洗脱程序为:
[0036][0037]
流速:1.0ml/min,检测波长205nm,进样体积:10μl,柱温:40℃。
[0038]
本发明第二方面提供一种测定唾液酸的高效液相色谱方法,该方法用氨基键合硅胶为填充剂;磷酸溶液(1
→
100)-乙腈-四氢呋喃(28:62:10)为流动相;检测波长为205nm,柱温为35℃,流速为每分钟1.0ml。
[0039]
上述测定唾液酸的高效液相色谱方法包括以下步骤:精密量取系统适用性溶液、对照品溶液和供试品溶液各20μl,分别注入液相色谱仪,按照上述色谱条件测定,记录色谱图。按外标法以峰面积计算。
[0040]
更具体地,本发明第二方面提供的测定唾液酸的高效液相色谱方法还包括以下步
骤:取样品适量,加水溶解并稀释制成每1ml中约含5mg的溶液,作为供试品溶液;取唾液酸对照品适量加水溶解并稀释制成1ml中约含0.025mg的溶液,作为对照品溶液。取唾液酸对照品和gd3对照品各适量,加水溶解并稀释制成1ml中约含唾液酸0.025mg和gd30.05mg的溶液,作为系统适用性溶液。
[0041]
在本发明中,gm1、gm1a、gm1b不仅指代其游离酸形式,也包括其钠盐形式或其他盐形式。本发明所述gm1、gm1a、gm1b的样品或对照品是指其钠盐形式。本发明附图中标识“tys”的峰为唾液酸峰。
[0042]
本发明的技术效果:
[0043]
本发明采用十八烷基硅烷键合硅胶为填充剂的色谱柱、特定的流动相和洗脱梯度,优化了色谱分离材料和流动相条件,分离能力强、选择性优越,使各成分杂质在色谱柱上的保留差异更加明显,不仅将单唾液酸四己糖神经节苷脂钠的两个成分有效分离,而且将与其相关的数十个杂质有效分离,获得了优异的峰形和分离选择性,可分辨出不同脂肪链的神经节苷脂和岩藻糖化的神经节苷脂,对杂质研究提供了有效工具;而且对于唾液酸在糖残基连接位置不同的神经节苷脂以及其它异构体也有高的分辨率,解决了神经节苷脂及其有关物质的分离测定问题,从而为神经节苷脂产品gm1的质量控制提供了准确的依据。
[0044]
本发明提供的测定唾液酸的方法由gm1主成分自身对照计算修改为唾液酸对照品外标法,对照峰形较好,唾液酸计算结果准确性提高,有利于产品质量控制。
附图说明
[0045]
图1对比例1测定的高效液相色谱图谱;
[0046]
图2实施例1测定得到的高效液相色谱图谱;
[0047]
图3实施例2测定得到的高效液相色谱图谱;
[0048]
图4实施例3测定得到的高效液相色谱图谱;
[0049]
图5系统适用性溶液图谱;
[0050]
图6实施例4测定得到的唾液酸对照品溶液的高效液相色谱图谱;
[0051]
图7按照国家药品标准ws
1-xg-001-2015规定的主成分对照的典型hplc图谱。
具体实施方式
[0052]
下面通过具体实施例来进一步说明本发明。应当理解为:本发明的实施例仅仅是用于说明本发明,而不是对本发明的限制。在本发明技术方案的基础上对本发明的简单改进或者采用惯用手段或成分进行等同替换所得得到的技术方案均属于本发明的保护范围。本发明所使用的杂质对照品可以通过购买或者合成得到。实施例中所述“c18”是指以十八烷基硅烷键合硅胶为填充剂的反向色谱柱
[0053]
对比例1
[0054]
取神经节苷脂gm1及其有关物质适量,用水溶解样品,配制成含神经节苷脂gm1约1.0mg/ml的样品溶液。按ws
1-xg-001-2015号国家药品标准规定的方法进行高效液相色谱分析,记录色谱图,其hplc分析图谱如图1所示。
[0055]
实施例1神经节苷酯gm1的测定
[0056]
仪器与条件
[0057]
高效液相色谱仪:waters e2695-2489
[0058]
色谱柱:c18(waters,4.6
×
150mm,3.5μm)
[0059]
流动相a:0.01mol/l磷酸二氢钾溶液—乙腈(30:70),用三乙胺调节ph=7.1。
[0060]
流动相b:乙腈
[0061]
采用梯度洗脱程序为:
[0062][0063]
流速:1.0ml/min,检测波长205nm,进样体积:10μl,柱温:40℃。
[0064]
实验步骤:
[0065]
取神经节苷脂gm1及其有关物质适量,用水溶液溶解样品,配制成含神经节苷脂gm1约1.0mg/ml的样品溶液。按上述测试条件进行高效液相色谱分析,记录色谱图,其hplc图谱如图2所示。
[0066]
该图谱结果表明,该方法分离能力更强、选择性更加优越。不仅将gm1的两个单组分有效分离,而且将与其相关的数十个杂质有效分离。
[0067]
实施例2神经节苷酯gm1的测定
[0068]
仪器与条件
[0069]
高效液相色谱仪:agilent 1260-vwd
[0070]
色谱柱:c18(waters,4.6
×
150mm,3.5μm)
[0071]
流动相a:0.01mol/l磷酸二氢钾溶液—乙腈(32:68),用三乙胺调节ph=7.1。
[0072]
流动相b:乙腈
[0073]
采用梯度洗脱程序为:
[0074][0075]
流速:1.2ml/min,检测波长205nm,进样体积:10μl,柱温:40℃。
[0076]
实验步骤:
[0077]
取神经节苷脂gm1及其有关物质适量,用水溶液溶解样品,配制成含神经节苷脂gm1约5mg/ml的样品溶液。按上述梯度条件进行高效液相色谱分析,记录色谱图,神经节苷脂gm1的两个成分与其有关物质均得以有效分离,其hplc图谱与图1基本一致。
[0078]
实施例3神经节苷酯gm1的测定
[0079]
仪器与条件
[0080]
高效液相色谱仪:waters e2695-2489
[0081]
色谱柱:c18(symmetry rp18,4.6
×
150mm,3.5μm)
[0082]
流动相a:0.012mol/l磷酸二氢钾溶液-乙腈(35:65),用三乙胺调节ph=7.5。
[0083]
流动相b:乙腈
[0084]
采用梯度洗脱程序为:
[0085][0086]
流速:1.2ml/min,检测波长205nm,进样体积:10μl,柱温:40℃。
[0087]
实验步骤:
[0088]
取神经节苷脂gm1及其有关物质适量,用水溶液溶解样品,配制成含神经节苷脂gm1约1.2mg/ml的样品溶液。按上述梯度条件进行高效液相色谱分析,记录色谱图,结果见
附图4。神经节苷脂gm1的两个成分与其有关物质均得以有效分离。
[0089]
实施例4唾液酸的含量测定
[0090]
色谱条件:用氨基键合硅胶为填充剂;磷酸溶液(1
→
100)-乙腈-四氢呋喃(28:62:10)为流动相;检测波长为205nm,柱温为35℃,流速为每分钟1.0ml;
[0091]
精密量取唾液酸对照品溶液和供试品溶液各20μl,分别注入液相色谱仪,按照上述色谱条件测定,记录色谱图。按外标法以峰面积计算;所得唾液酸对照品溶液的hplc图谱如图6所示;
[0092]
按照国家药品标准ws
1-xg-001-2015规定的主成分对照的典型图谱如图7所示。
[0093]
系统适用性试验:
[0094]
在上述确定的色谱条件下,在分别用系统适用性溶液来分析此色谱条件是否符合要求,有图5可见此条件下各有关物质与主峰之间分离度符合要求,峰纯度均符合要求。
[0095]
专属性
[0096]
(1)酸降解:
[0097]
有关物质供试液:取供试品约50mg,置10ml容量瓶中,加2ml水使样品溶解,加入3ml的浓度为1mol/l的盐酸溶液,降解18h,加1mol/l的氢氧化钠溶液中和后,加水稀释至刻度,摇匀。
[0098]
含量供试液:精密量取有关物质项下供试品溶液2ml,置10ml容量瓶中,加水稀释至刻度,摇匀。
[0099]
碱降解:
[0100]
有关物质供试液:取供试品约50mg,置10ml容量瓶中,加2ml水使样品溶解,加3ml 1mol/l的盐酸溶液,降解18h,加1mol/l的盐酸溶液中和后,加水稀释至刻度,摇匀。
[0101]
含量供试液:精密量取有关物质项下供试品溶液2ml,置10ml容量瓶中,加水稀释至刻度,摇匀。
[0102]
(2)氧化降解:
[0103]
有关物质供试液:取供试品约50mg,置10ml容量瓶中,加2ml水使样品溶解,加入3ml30%的双氧水,降解20h,加水稀释至刻度,摇匀。
[0104]
含量供试液:精密量取有关物质项下供试品溶液2ml,置10ml容量瓶中,加水稀释至刻度,摇匀。
[0105]
(3)高温降解:
[0106]
a)有关物质供试液:取供试品约50mg,置105℃烘箱中10小时,冷却至室温后,加水溶解并稀释至刻度,摇匀。
[0107]
含量供试液:精密量取有关物质项下供试品溶液2ml,置10ml容量瓶中,加水稀释至刻度,摇匀。
[0108]
b)有关物质供试液:取供试品约50mg,加水溶解并稀释至刻度,摇匀。取供试液适量置105℃烘箱中10小时,冷却至室温,作为有关物质供试液。
[0109]
含量供试液:精密量取有关物质项下供试品溶液2ml,置10ml容量瓶中,加水稀释至刻度,摇匀。
[0110]
(4)水解:
[0111]
有关物质供试液:取供试品约50mg,置10ml容量瓶中,加2ml水溶解,加3ml水后,放
置在室温下20h后,加水稀释至刻度,摇匀。
[0112]
含量供试液:精密量取有关物质项下供试品溶液2ml,置10ml容量瓶中,加水稀释至刻度,摇匀。
[0113]
(5)影响因素降解试验:
[0114]
高温降解:
[0115]
有关物质供试液:取在40℃、60℃高温条件下分别放置5天、10天的供试品约50mg,置10ml容量瓶中,加水溶解并稀释至刻度,摇匀。
[0116]
含量供试液:取在40℃、60℃高温条件下分别放置5天、10天的供试品约50mg,置50ml容量瓶中,加水溶解并稀释至刻度,摇匀。
[0117]
高湿降解:
[0118]
有关物质供试液:取在饱和氯化钠溶液、饱和硝酸钾溶液条件下分别放置5天、10天的供试品约50mg,置10ml容量瓶中,加水溶解并稀释至刻度,摇匀。
[0119]
含量供试液:取在饱和氯化钠溶液、饱和硝酸钾溶液条件下分别放置5天、10天的供试品约50mg,置50ml容量瓶中,加水溶解并稀释至刻度,摇匀。
[0120]
光照降解:
[0121]
有关物质供试液:取在照度为4500lx
±
500lx条件下分别放置5天、10天的供试品约50mg,置10ml容量瓶中,加水溶解并稀释至刻度,摇匀。
[0122]
含量供试液:取在照度为4500lx
±
500lx条件下分别放置5天、10天的供试品约50mg,置50ml容量瓶中,加水溶解并稀释至刻度,摇匀。
[0123]
降解结束后按照本发明所述样品配制方法和色谱条件检测,记录色谱图,结果表明,本品于各降解杂质峰均能与主成分有效分离。
[0124]
(6)线性
[0125]
有关物质:分别配制含gm1a对照品loq浓度、5μg/ml、25μg/ml、50μg/ml、250μg/ml、300μg/ml的线性溶液。分别配制含gm1b对照品loq浓度、5μg/ml、25μg/ml、50μg/ml、250μg/ml、300μg/ml的线性溶液。按照本发明所述色谱条件检测,结果表明,神经节苷脂gm1a测定浓度在1.5348μg/ml~294.975μg/ml的范围内,y=3342.8419x-1434.5325,相关系数r=1.0000,相关系数大于0.99,线性符合要求。神经节苷脂gm1b测定浓度在1.8428μg/ml~284.9352μg/ml的范围内,y=3230.8702x-2308.7666,相关系数r=1.0000,相关系数大于0.99,线性符合要求。
[0126]
含量:分别配制含gm1a对照品约0.4mg/ml、0.45mg/ml、0.5mg/ml、0.55mg/ml、0.6mg/ml的线性溶液。分别配制含gm1b对照品约0.4mg/ml、0.45mg/ml、0.5mg/ml、0.55mg/ml、0.6mg/ml的线性溶液。按照本发明所述色谱条件检测,结果表明,神经节苷脂gm1a测定浓度在0.39691mg/ml~0.55936μg/ml的范围内,y=2932303.2462x+20988.1709,相关系数r=0.9999,相关系数大于0.999,线性符合要求。神经节苷脂gm1b测定浓度在0.38824mg/ml~0.53449μg/ml的范围内,y=2991291.3924x+41939.0354,相关系数r=0.9998,相关系数大于0.999,线性符合要求。
[0127]
(7)溶液稳定性
[0128]
将神经节苷脂gm1有关物质和含量供试液,分别于0、7、14、21小时进样,考察样品溶液的稳定性,结果分别见表1、表2,本溶液在24小时内稳定。
[0129]
表1有关物质结果
[0130][0131][0132]
表2含量结果
[0133][0134]
(8)耐用性
[0135]
由于本品的色谱条件为梯度洗脱,并规定了色谱柱型号、柱温、流速、ph值等,故我们将这些条件做相应的微调,考察方法的耐用性,结果表明,该方法对柱温、流速、ph值等耐用性良好,在不同柱温、流速、ph值等条件下,神经节苷脂gm1及其相邻杂质的分离度能达到有效分离。
[0136]
制备例1单唾液酸四己糖神经节苷脂钠gm1a和gm1b的制备
[0137]
取神经节苷脂粗品600mg,溶于10ml甲醇-10mm磷酸二氢铵缓冲盐水溶液中(ph=2.5),进样量10ml;使用反相色谱柱(柱规格50
×
250mm,粒径10μm,孔径键合填料质量300g),流速0.6mm/s;流动相为甲醇-10mm磷酸二氢铵缓冲盐(ph=2.5),其中甲醇/缓冲盐水溶液的体积比为60/40;紫外检测器,检测波长205nm,分阶段收集样品洗脱液,分别蒸出溶剂得到相应的gm1a、gm1b;经测定,其hplc纯度分别为99.80%和99.20%;其中所述“反相色谱柱”柱指动态轴向压缩制备柱,填料(即键合填料)为十八烷基键合硅胶。
[0138]
附:国家药品标准ws
1-xg-001-2015规定的gm1含量测定方法:
[0139]
【含量测定】照高效液相色谱法(中国药典2010年版二部附录vd)测定。
[0140]
色谱条件与系统适用性试验:用氨基硅烷键合硅胶为填充剂,以磷酸溶液(1
→
100)-乙腈-四氢呋喃(30:60:10)为流动相,检测波长205nm。取单唾液酸四己糖神经节苷脂钠对照品、唾液酸对照品、双唾液酸四己糖神经节苷脂(gd1a)对照品和双唾液酸二己糖神经节苷脂(gd3)对照品各适量,加水溶解并稀释制成每1ml中分别约含1mg、25μg、100μ与50μg的混合溶液,作为系统适用性溶液。取20μl注入液相色谱仪,记录色谱图。理论板数按单唾液酸四己糖神经节苷脂钠峰计算不低于1000,单唾液酸四己糖神经节苷脂钠峰与相邻杂质峰及各已知杂质峰之间的分离度均应符合要求。
[0141]
测定法:取本品,精密测定,加水溶解并定量稀释制成每1ml中约含1mg的溶液,精密量取20μl注入液相色谱仪,记录色谱图;领取单唾液酸四己糖神经节苷脂钠对照品,同法测定。按外标法以封面积计算,即得。
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1