一种细胞自噬表型的预测方法及装置与流程
本发明涉及图像识别领域,具体而言,涉及一种细胞自噬表型的预测方法及装置。
背景技术:
细胞自噬是细胞清除有害蛋白和物质重新利用以维持细胞稳态的一种机制。在正常生理条件下,自噬依赖于溶酶体(或液泡)包裹受损的细胞器,蛋白质聚集体,长寿蛋白等,并将它们运送到溶酶体或液泡进行降解。根据自噬功能和作用底物的不同可以将自噬分为巨自噬,微自噬和分子伴侣介导的自噬。我们通常所讲的细胞自噬为巨自噬。细胞在饥饿,缺氧及低能量等条件下,胞质内会形成双层囊泡结构并不断包裹胞质成分最后封闭形成自噬体,自噬体进而与溶酶体或液泡融合并通过其中的酸性水解酶降解包裹物质。细胞自噬是一个复杂而保守的过程,由于酵母细胞在遗传上的可操作性和自噬过程的高度保守,酵母成为目前自噬研究最充分的模式生物。在酵母自噬过程中,atg8(一种蛋白质)对于自噬体的形成起着至关重要的作用,其关系到自噬体膜的弯曲、自噬底物的募集的过程,是自噬过程中唯一一直定位于自噬体膜的蛋白质。因此一种最便捷的观测自噬发生的方法就是直接观察n端连接gfp(greenfluorescentprotein,绿色萤光蛋白)的atg8是否顺利运输到液泡。
自噬未发生时,gfp-atg8会均匀的分布于细胞质中,当自噬被诱导发生时,gfp-atg8会迅速招募到自噬体内外膜上,内膜上的gfp-atg8会随着自噬体和液泡的融合被降解为游离的gfp。研究表明,通过计算gfp-atg8定位于液泡内的细胞所占的百分比可以作为衡量自噬活性的方法。但是人工分析荧光图像、搜索感兴趣区域和提取图像特征非常耗时和费力,目前虽然出现了一些智能学习系统,但均无法达到对细胞自噬表型进行批量的智能预测识别的目的。
技术实现要素:
有鉴于此,本发明实施例的目的在于提供一种细胞自噬表型的预测方法及装置,该方法能够对细胞自噬表型进行批量预测和识别。
本发明的实施例是这样实现的:
一种细胞自噬表型的预测方法,包括:获取细胞图像,对所述细胞图像进行预处理,得到分析图像;根据所述分析图像中细胞的位置,将所述分析图像分割为单细胞图像;将所述单细胞图像输入经过训练的卷积神经网络模型进行计算,得到自噬概率;将所述自噬概率大于预设分类阈值的单细胞图像所对应的细胞确定为自噬细胞。
优选地,采集细胞图像,对所述细胞图像进行预处理,得到分析图像的步骤,包括:获取经过染色处理的细胞图像,对所述经过染色处理的细胞图像进行预处理,得到分析图像。
优选地,所述根据所述分析图像中细胞的位置,将所述分析图像分割为单细胞图像的步骤,包括:根据所述分析图像中细胞所在区域的灰度均值,以及所述分析图像中细胞所在区域之外的灰度均值,以及所述分析图像的整体灰度均值,获得所述分析图像的类间方差;根据所述分析图像的类间方差与预设的由量子粒子群算法计算获得的最佳阈值向量,得到所述分析图像的分割阈值;根据所述分割阈值,将所述分析图像分割为单细胞图像。
优选地,在所述根据所述分析图像中细胞的位置,将所述分析图像分割为单细胞图像之后,且在所述将所述单细胞图像输入经过训练的卷积神经网络模型进行计算,得到自噬概率的步骤之前,还包括:从所述单细胞图像中分出训练组;采用所述训练组对所述卷积神经网络模型进行学习训练,得到经过训练的所述卷积神经网络模型。
优选地,所述训练组中的每个细胞都包含代表该细胞绿色荧光蛋白的绿色亮斑与代表该细胞液泡膜位置的红色荧光之间的相对位置关系;所述相对位置关系包括:所述绿色亮斑位于所述红色荧光的区域之内,和所述绿色亮斑位于所述红色荧光的区域之外。
优选地,所述绿色荧光蛋白为gfp-atg8。
优选地,所述从所述单细胞图像中分出训练组的步骤之后,还包括:从所述单细胞图像中分出测试组;将所述测试组输入到多个所述经过训练的所述卷积神经网络模型中进行测试,得到差错率;每个所述经过训练的所述卷积神经网络模型对应一个不同的训练组;将差错率最低的所述经过训练的所述卷积神经网络模型作为最终使用模型;其中,所述将所述单细胞图像输入经过训练的卷积神经网络模型进行计算,得到自噬概率,包括:将所述单细胞图像输入经过所述最终使用模型进行计算,得到自噬概率。
优选地,在从所述单细胞图像中分出训练组之后,并在所述采用所述训练组对所述卷积神经网络模型进行学习训练,得到经过训练的所述卷积神经网络模型之前,还包括:将所述训练组中的单细胞图像根据细胞是否发生自噬行为进行标记;其中标记包括,所述单细胞图像中发生自噬行为的细胞用第一符号标记,未发生自噬行为的细胞用第二符号标记。
优选地,所述获取细胞图像,将采集的所述细胞图像进行预处理,得到分析图像的步骤,具体包括:对所述采集的所述细胞图像进行归一化;和\或增加所述采集的所述细胞图像的对比度;和\或将所述采集的所述细胞图像的颜色进行反转;和\或对所述采集的所述细胞图像进行sobel滤波处理。
一种细胞自噬表型的预测装置,包括:采集模块,用于采集细胞图像,对所述细胞图像进行预处理,得到分析图像;分割模块,用于根据所述分析图像中细胞的位置,并将所述分析图像分割为单细胞图像;计算模块,用于将所述单细胞图像输入经过训练的卷积神经网络模型进行计算,得到自噬概率;识别模块,用于将所述自噬概率大于预设分类阈值的单细胞图像所对应的细胞确定为自噬细胞。
与现有技术相比,本发明实施例提供的一种细胞自噬表型的预测方法及装置,该方法通过对所获取的细胞图像进行预处理后,将细胞图像进行分割得到单细胞图像,保证对图像中的每个细胞进行单独分析与识别。然后将单细胞图像放入经过训练的卷积神经网络模型进行计算分析,得到自噬概率,最终将自噬概率大于预设分类阈值的单细胞图像所对应的细胞确定为自噬细胞,避免了目前人工直接对细胞图像的分析,达到了对细胞图像中的细胞自噬表型进行批量预测识别的目的,同时分割得到的单个细胞图像数量可以做为细胞图像中细胞的计数。
为使本发明的上述目的、特征和优点能更明显易懂,下文特举较佳实施例,并配合所附附图,作详细说明如下。
附图说明
为了更清楚地说明本发明实施例的技术方案,下面将对实施例中所需要使用的附图作简单地介绍,应当理解,以下附图仅示出了本发明的某些实施例,因此不应被看作是对范围的限定,对于本领域普通技术人员来讲,在不付出创造性劳动的前提下,还可以根据这些附图获得其他相关的附图。
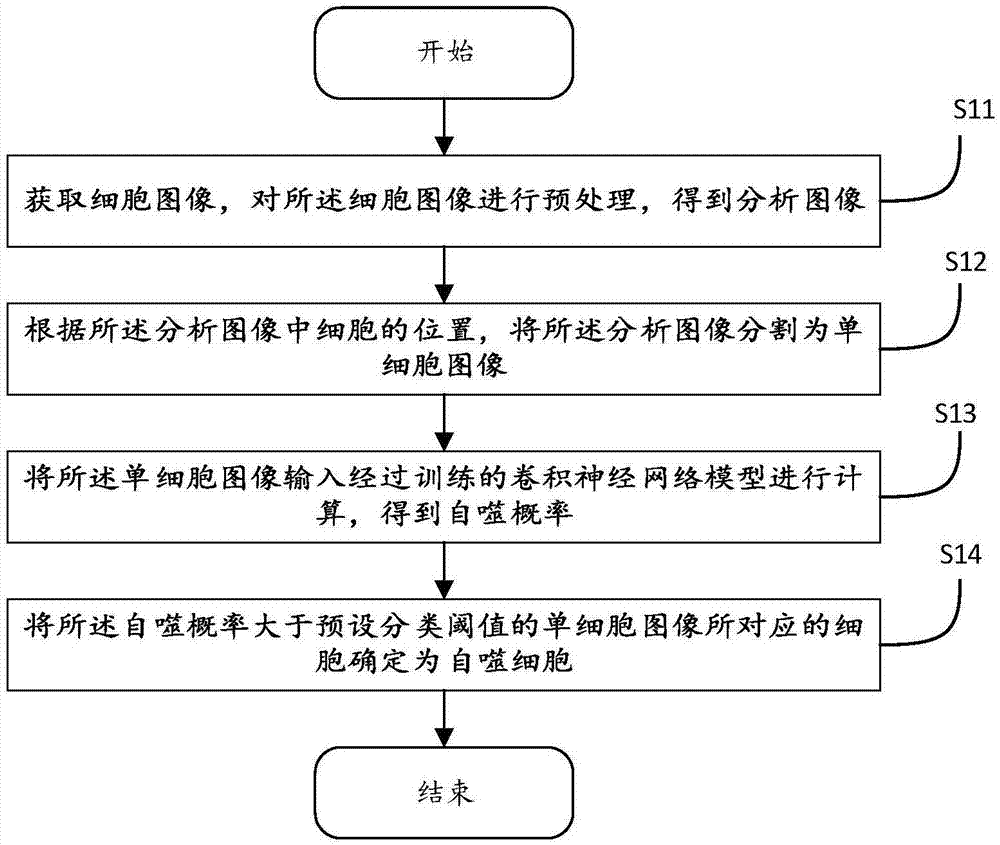
图1为本发明较佳实施例提供的一种细胞自噬表型的预测方法的方法流程图。
图2为图1中步骤s12的具体步骤的流程图。
图3为图1中步骤s13之前的步骤的流程图。
图4为是本发明较佳实施例提供的细胞自噬表型的预测装置的模块图。
图标:100-细胞自噬表型的预测装置;101-采集模块;102-分割模块;103-计算模块;104-识别模块。
具体实施方式
下面将结合本发明实施例中附图,对本发明实施例中的技术方案进行清楚、完整地描述,显然,所描述的实施例仅仅是本发明一部分实施例,而不是全部的实施例。通常在此处附图中描述和示出的本发明实施例的组件可以以各种不同的配置来布置和设计。因此,以下对在附图中提供的本发明的实施例的详细描述并非旨在限制要求保护的本发明的范围,而是仅仅表示本发明的选定实施例。基于本发明的实施例,本领域技术人员在没有做出创造性劳动的前提下所获得的所有其他实施例,都属于本发明保护的范围。
应注意到:相似的标号和字母在下面的附图中表示类似项,因此,一旦某一项在一个附图中被定义,则在随后的附图中不需要对其进行进一步定义和解释。同时,在本发明的描述中,术语“第一”、“第二”等仅用于区分描述,而不能理解为指示或暗示相对重要性。
如图1所示,是本发明较佳实施例提供的一种细胞自噬表型的预测方法的方法流程图。该方法可直接应用于电子设备,或实体装置中;例如以软件的形式安装在具有操作系统的电子设备中(或直接作为固件以代码或其他形式写入到可擦写只读存储器中),电子设备(或实体装置)根据软件控制执行本发明中的细胞自噬表型的预测方法的各个步骤。
下面将对图1所示的具体流程进行详细阐述。
步骤s11:采集细胞图像,对细胞图像进行预处理,得到分析图像。
在步骤s11中所采集的细胞图像可以来自于采用聚焦荧光显微镜采集的细胞图片。本发明主要应用于酵母细胞自噬的预测,其中细胞图像可以为酵母细胞(也可以为其他能够发生自噬的细胞,不作限制),在采集所述细胞图像之前可以诱导酵母细胞自噬。
步骤s11中所述的对细胞图像进行预处理,具体为:对细胞图像进行归一化处理、增强对比度、颜色反转、sobel滤波等,上述预处理的方式可以使用一种或同时使用多种,不作限制。
对所述采集的所述细胞图像进行归一化,保证后续图像分析的快速收敛,提高计算效率;增加所述采集的所述细胞图像的对比度,与将所述采集的所述细胞图像的颜色进行反转,提高图像分割时的识别度;对所述采集的所述细胞图像进行sobel滤波处理,识别图像或单个细胞的边缘信息,保证图像分割的准确性。
还需要说明的是,为了保证在识别时具有更明确的位置参考信息,在不周s11之前还可将欲采集细胞图像的对象细胞进行染色处理,例如,直接使用红色荧光染料fm4-64(酵母细胞可以很好的被红色染料fm4-64进行标记,如此可直接分析单细胞图像中代表gfp-atg8的绿色荧光与代表fm4-64的红色荧光之间的位置关系,从而判断酵母的自噬表型)对细胞的液泡膜进行染色,使得细胞的分析图像中具有红色荧光;此外也可采用其他染料进行染色操作,例如fm5-95(fm4-64、fm5-95为苯乙烯基染料)通过本步骤可准确找到或显示细胞中的液泡膜位置。
步骤s12:根据所述分析图像中细胞的位置,将所述分析图像分割为单细胞图像。
该步骤s12中得到的单细胞图像可直接用于细胞计数,实现批量计数的目的。
在步骤s12中所述的细胞的位置具体指:在分析图像中存在多个单独的细胞,而每个细胞都位于不同的位置;而将各个位置的细胞单独分割出来就形成了单细胞图像。
在步骤s12中,所述的分割,可以是将各个细胞所在的位置及轮廓进行识别后定位,也可以是将各个细胞的特征进行单独提取出来形成单个图片。
如图2所示,在步骤s12中,具体还包括子步骤:
步骤s121:根据所述分析图像中细胞所在区域的灰度均值,以及所述分析图像中细胞所在区域之外的灰度均值,以及所述分析图像的整体灰度均值,获得所述分析图像的类间方差,
步骤s122:根据所述分析图像的类间方差与预设的由量子粒子群算法计算获得的最佳阈值向量,得到所述分析图像的分割阈值。其中将阈值向量中的第一个值作为分割阈值,后文进行举例说明。
步骤s123:根据所述分割阈值,将所述分析图像分割为单细胞图像。
例如,具体的实施方式可以是:采用量子粒子群多阀值otsu分割方法,该方法可对不同亮度的细胞进行有效分割。如下:
目标函数的选取:
多阀值otsu函数为最优函数,多阀值otsu是单阀值otsu[120]的扩展。设总像素个数为n,目标和背景的分割阈值为t,这种分割方法下,细胞区域像素点占总数n的比例,该区域的平均灰度值为:
其中p(i)是标准化的强度值(0-1)。
背景区域像素点占总数n的比例w0(t),该区域的平均灰度值为:
根据式1-2,得到图像的灰度均值为:
u=w0(t)×u0(t)+w1(t)×u1(t)····(式3)
根据式1-3,细胞区域和背景区域的类间方差为:
σ2(t)=w0(t)×[u0(t)-u]2+w1(t)×[u1(t)-u]2····(式4)
如果将上述单阀值扩展到多阀值{t1,…,tk,…,td}时,类间方差变为:
其中,d是阈值个数。
量子粒子群的构建:
量子粒子群(qpso)算法为通过有限次迭代运算找到一组{t1,…,tk,…,td}使σ2(t1,…,tk,…,td)值最大。因此,这组{t1,…,tk,…,td}
是otsu的多阀值,σ2(t1,…,tk,…,td)是最优目标函数。本实施
方式中称{t1,…,tk,…,td}为阀值向量。本实施方式中构建了5个量子粒子来执行qpso算法,其中,每个粒子i由6维向量(d=6个阀值)表示。粒子的基本属性包括:
粒子的位置参数,即阀值向量{t1,…,tk,…,td}(但不一定是最优的):
粒子的速度参数:
粒子的最优适应性值,即粒子最优位置参数:
粒子群的最优适应性值,即整个群落中最优位置参数:
此处的一个量子粒子,在本质上是一个阀值向量{t1,…,tk,…,td},而向量值tk对应其位置参数值
粒子的进化:
在执行量子粒子群算法的过程中,粒子会随机地改变位置和速度,这种变换符合进化公式:
其中,
粒子进化的终止:
采用两个参数同时决定了粒子是否执行下一步进化计算。
第一个参数是迭代步骤数。本文设置了迭代次数maxiter等于1000次,即变换1000次位置后,进化自动结束,该迭代次数可以根据图像分割的具体效果进行调整,不做限制。
另一个参数是gbest的下限值(如10-7,亦可以进行调整设置)。当gbest达到下限值时,进化自动结束。
分割阀值的确定:
在本实施方式中,将上述量子粒子群多阀值otsu分割方法中得到的最佳阈值向量
步骤s13:将所述单细胞图像输入经过训练的卷积神经网络模型进行计算,得到自噬概率。
在步骤s13中,在该处为了保证单细胞图像的识别或预测的准确性,需要在第一次对单细胞图像进行识别和预测之前需要对卷积神经网络模型进行训练。如图3所示,具体的,可以包含:
步骤s13a:从所述单细胞图像中分出训练组。在进行该步骤的同时或之后,可以从单细胞图像中分出测试组,用于测试训练组训练过后的模型准确性。
在该步骤s13a之后,并且在卷积神经网络训练之前还应到包括:将所述训练组中的单细胞图像根据细胞是否发生自噬行为进行标记。
具体的,其中标记包括,所述单细胞图像中发生自噬行为的细胞用第一符号标记,未发生自噬行为的细胞用第二符号标记,第一符号和第二符号为具有可识别性的符号,例如颜色,符号形状等;其中标记的对细胞是否发生自噬进行区分,利于未训练的卷积神经网络进行预测学习,保证结果的准确性。其中,标记可为:发生细胞自噬行为的细胞采用红色符号标记(红色符号可对应第一符号),未发生自噬行为的细胞用黄色符号标记。
步骤s13b:采用所述训练组对所述卷积神经网络模型进行学习训练,得到经过训练的所述卷积神经网络模型。
需要说明的是,上述步骤的训练组或测试组中都存在绿荧光蛋白,绿色荧光蛋白在单细胞图像中表现为绿色亮斑,并且在细胞中能够显示出绿色亮斑与红色荧光之间的相对位置关系;具体的为所述绿色亮斑位于红色荧光的区域之内,和所述绿色亮斑位于所述红色荧光的区域之外,对相对位置关系的识别就可达到识别细胞自噬的目的。在本实施例中,绿色荧光蛋白为gfp-atg8,红色荧光为通过红色染料对液泡膜进行染色后产生的。
在步骤s13b之后,还可对模型进行筛选,选出最佳的经过训练的卷积神经网络模型。由于,每个训练组都对应产生一个所述经过训练的卷积神经网络模型。可将测试组放入多个所述经过训练的卷积神经网络模型中进行测试,得到差错率(表征模型分类\识别\预测的结果准确度)。最终,将差错率最低的模型作为最终使用的经过训练的卷积神经网络模型(即作为步骤s13的使用模型),该模型即为测试模型中准确率、鲁棒性最高的模型。
例如,在本实施例中,可采用十折交叉检验(其他,八折、二十折均可,不作限制),即训练组分为9组,测试组分为1组,来训练与筛选模型。
进一步的,训练过程可表述如下:
步骤1:训练组的图片通过卷积神经网络的第一个卷积层(convolution1),用高斯滤波器生成特征图,修正线性单元层(relu1)拟合非线性函数,使网络自行引入稀疏性,局部响应标准化层(lrn1)在relu层之后可以防止数据过拟合,并提高训练速度,池化层(pooling1)可合并相似特征,从而有效地减少参数数量。整体来说,这四层可以强化绿色荧光信号、探测gfp-atg8荧光斑点。
步骤2:将通过步骤1的图片继续通过第二个卷积层(convolution2),修正线性单元层(relu2),局部响应标准化层(lrn2)和池化层(pooling2),强化红色荧光标记、提取液泡轮廓。
步骤3:通过步骤2的图片继续通过第三个卷积层(convolution3),修正线性单元层(relu3),局部响应标准化层(lrn3)和池化层(pooling3),提取出对细胞自噬分类有用的标志性信息即gfp-atg8代表的绿色亮斑是否定位于红色荧光标记的液泡中。
步骤4:通过步骤3的图片作为降层(dropout)的输入,可有效地防止模型过拟合,接着通过两个内积层(inner_product)将学习到的特征映射到样本分类空间,最后softmax层,softmax_loss层和accuracy层估算并输出细胞发生自噬的概率,模型损失率和准确率。
以例对上述训练过程进行进一步说明:
若卷积神经网络有18个层,包括:三个卷积层、修正线性单元层、局部响应标准化层、池化层和一个降层,两个内积层,一个softmax层、softmax_loss层和accuracy层。由于本发明中的方法可应用于实体装置,实体装置终端基本上是cpu(centralprocessingunit,中央处理器)进行运算,每批次训练的图片数被设置为10张(若为gpu(图形处理器)可进行相应调整)。将1-3个通道图(rgb通道)输入网络。输入的每张图像尺寸是61×61像素,每张图像的输出为阳性和阴性两个置信概率值。最终采用阀值分割方法来分类酵母细胞,阳性概率大于分类阀值的细胞是自噬细胞,否则是非自噬细胞,将阳性概率作为自噬概率(阳性概率=1-阴性概率)。分类阀值根据经验来调整确定。
每个层的基本属性如下:
卷积层:卷积层使用滤波器来生成特征图。卷积层的公式是
本工作采用25个滤波器生成25张属性图,卷积核大小是3*3像素,滑块步长是1像素,滤波方式是guassian(高斯滤波);在本例中,滑块的步长不作限定,具体的可根据设备的计算能力或图像的复杂程度进行调整,例如,2、3、6、10像素等;卷积核大小亦不做限定。
修正线性单元层:将所有负的输入值截断为零,它能拟合非线性的特征函数。
局部响应标准化层:可使部分区域数据归一化,通过减少内部协变量的变换来加快训练速度。
池化层:使卷积层的节点减少,解决过拟合问题。池化的方法有均值(avg)和最大值(max)池化两种。
均值(avg)池化的公式是
最大值(max)池化的公式是
这两个公式中k是滑块的总像素个数,滑块通常是3×3或5×5大小的矩形框。本文采用max方法,滑块步长是2像素,滑块尺寸是3*3像素。在本实施例中可采取其中任一种池化方法,不作限定。
降层:可解决过拟合问题,在样本量较少时,可得到更好的效果。
内积层:起到分类器的作用,将学习到的特征映射到样本分类空间。
softmax层,softmax_loss层和accuracy层:计算二分类的阳性概率和阴性概率。softmax_loss层计算损失,accuracy层计算自噬概率。softmax公式如下
其中:0≤p(cr|x,θ)≤1,
步骤s14:将所述自噬概率大于预设分类阈值的单细胞图像所对应的细胞确定为自噬细胞。达到了细胞表型预测的目的。
在步骤s14中,所述的分类阈值,可根据自噬概率的分布,或对分类、预测结果进行校验来确定,或直接经验确定。同时,还可对分类后的自噬概率进行计数,实现自噬或非自噬细胞的计数。
请参阅图4,本实施例中还提供一种可应用上述细胞自噬表型的预测方法的细胞自噬表型的预测装置,在该装置中的各个模块可执行上述细胞自噬表型的预测方法的步骤与子步骤。该装置包括:采集模块101、分割模块102、计算模块103和识别模块104。
具体的:
采集模块101,用于采集细胞图像,对所述细胞图像进行预处理,得到分析图像。
分割模块102,用于根据所述分析图像中细胞的位置,将所述分析图像分割为单细胞图像。
计算模块103,用于将所述单细胞图像输入经过训练的卷积神经网络模型进行计算,得到自噬概率。
识别模块104,用于将所述自噬概率大于预设分类阈值的单细胞图像所对应的细胞确定为自噬细胞。
综上所述:
本发明中通过对所采集的细胞图像进行预处理后,将细胞图像进行分割得到单细胞图像,分割时采用量子粒子群优化的多阀值otsu分割方法,防止陷入局部最优值,保证对图像中的每个细胞进行分割的准确性。然后将单细胞图像放入经过训练的卷积神经网络模型进行计算分析,得到自噬概率,该模型是通过相同类型的单细胞图像进行训练得到,并且同时在多个训练模型中挑选出鲁棒性与准确率最高的模型。最终将模型输出的自噬概率,其中大于预设分类阈值的单细胞图像所对应的细胞确定为自噬细胞,避免了目前人工直接对细胞图像的进行分析;在模型建立之后,对于同一种类型的细胞识别(例如酵母细胞)可进行批量的识别预测操作,达到了对细胞图像中的细胞表型进行批量预测识别的目的,同时分割得到的单个细胞图像数量可以做为分析图像中细胞的计数,实现批量计数,以本发明中的计数与识别功能为目的,而开发的软件也具有更高更友好的操作性。
在本申请所提供的实施例中,应该理解到,所揭露的装置和方法,也可以通过其它的方式实现。以上所描述的装置实施例仅仅是示意性的,例如,附图中的流程图和框图显示了根据本发明的多个实施例的装置、方法和计算机程序产品的可能实现的体系架构、功能和操作。在这点上,流程图或框图中的每个方框可以代表一个模块、程序段或代码的一部分,所述模块、程序段或代码的一部分包含一个或多个用于实现规定的逻辑功能的可执行指令。也应当注意,在有些作为替换的实现方式中,方框中所标注的功能也可以以不同于附图中所标注的顺序发生。例如,两个连续的方框实际上可以基本并行地执行,它们有时也可以按相反的顺序执行,这依所涉及的功能而定。也要注意的是,框图和/或流程图中的每个方框、以及框图和/或流程图中的方框的组合,可以用执行规定的功能或动作的专用的基于硬件的系统来实现,或者可以用专用硬件与计算机指令的组合来实现。
另外,在本发明各个实施例中的各功能模块可以集成在一起形成一个独立的部分,也可以是各个模块单独存在,也可以两个或两个以上模块集成形成一个独立的部分。
所述功能如果以软件功能模块的形式实现并作为独立的产品销售或使用时,可以存储在一个计算机可读取存储介质中。基于这样的理解,本发明的技术方案本质上或者说对现有技术做出贡献的部分或者该技术方案的部分可以以软件产品的形式体现出来,该计算机软件产品存储在一个存储介质中,包括若干指令用以使得一台计算机设备(可以是个人计算机,服务器,或者网络设备等)执行本发明各个实施例所述方法的全部或部分步骤。而前述的存储介质包括:u盘、移动硬盘、只读存储器(rom,read-onlymemory)、随机存取存储器(ram,randomaccessmemory)、磁碟或者光盘等各种可以存储程序代码的介质。需要说明的是,在本文中,诸如第一和第二等之类的关系术语仅仅用来将一个实体或者操作与另一个实体或操作区分开来,而不一定要求或者暗示这些实体或操作之间存在任何这种实际的关系或者顺序。而且,术语“包括”、“包含”或者其任何其他变体意在涵盖非排他性的包含,从而使得包括一系列要素的过程、方法、物品或者设备不仅包括那些要素,而且还包括没有明确列出的其他要素,或者是还包括为这种过程、方法、物品或者设备所固有的要素。在没有更多限制的情况下,由语句“包括一个……”限定的要素,并不排除在包括所述要素的过程、方法、物品或者设备中还存在另外的相同要素。
以上所述仅为本发明的优选实施例而已,并不用于限制本发明,对于本领域的技术人员来说,本发明可以有各种更改和变化。凡在本发明的精神和原则之内,所作的任何修改、等同替换、改进等,均应包含在本发明的保护范围之内。应注意到:相似的标号和字母在下面的附图中表示类似项,因此,一旦某一项在一个附图中被定义,则在随后的附图中不需要对其进行进一步定义和解释。
以上所述,仅为本发明的具体实施方式,但本发明的保护范围并不局限于此,任何熟悉本技术领域的技术人员在本发明揭露的技术范围内,可轻易想到变化或替换,都应涵盖在本发明的保护范围之内。因此,本发明的保护范围应所述以权利要求的保护范围为准。
- 还没有人留言评论。精彩留言会获得点赞!