一种基于深度学习的右心室自动分割方法与流程
本发明涉及医学图像处理领域,具体为一种基于深度学习的右心室自动分割方法。
背景技术:
随着医学图像处理技术的不断进步,医学图像分割,特别是重要器官的分割,是计算机辅助诊断和治疗的基础。磁共振成像(magneticresonanceimaging)是一种广泛应用于医学诊断的标准技术。在心脏磁共振电影图像中,右心室的精准分割可以帮助人们有效的计算心室的收缩末期和舒张末期容量、每搏输出量及射血分数等参数,从而对心脏进行进一步功能分析和疾病诊断。
左心室形状规则,被较厚的心肌包围,其分割任务相对容易,研究也比较深入。比起左心室,右心室形状呈不规则的半月形、且心肌壁薄、与脂肪毗邻等,使右心室的精确分割成为了一项难点。常用的右心室分割方法有主动轮廓模型、水平集、图割、聚类及多图谱分割等,这些方法在有限的数据集上显示出了良好的效果,但往往在训练数据之外的数据库中表现不佳,需要手工介入,导致分割时间增加且受到的主观影响大。
技术实现要素:
本发明的目的是:提高右心室的分割精度,减少人工参与的成本。
为了达到上述目的,本发明的技术方案是提供了一种基于深度学习的右心室自动分割方法,其特征在于,包括以下步骤:
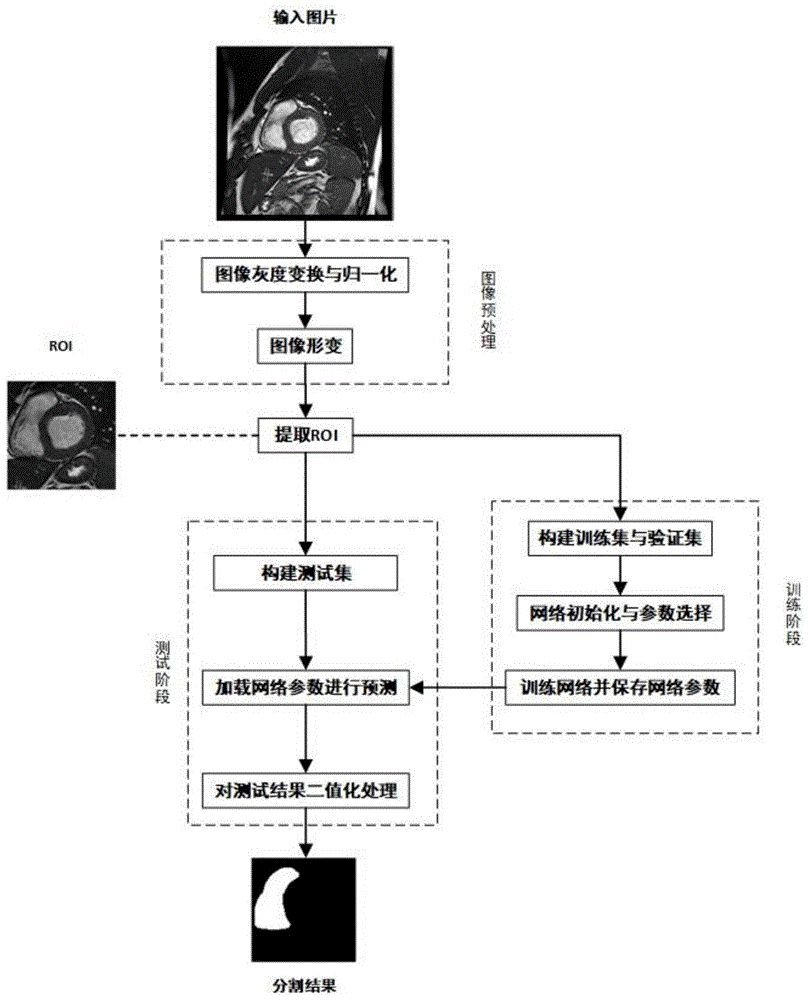
步骤1、对采集的所有心脏磁共振电影短轴图像进行灰度归一化的预处理,将像素值统一到[0,255]区间;
步骤2、提取感兴趣区域roi:求步骤1中预处理后的心脏磁共振电影短轴图像每两个连续时相的差值绝对值图像之和,在差值图像上利用霍夫圆变换确定左心室中心位置,根据左、右心室的位置关系同时截取含有左、右心室的部分作为感兴趣区域roi图像;
步骤3、扩充步骤2中得到的所有感兴趣区域roi图像的图像数据的数据集,将所有图像数据调整为同样大小并将扩充后的数据集分成训练集、验证集及测试集三部分;
步骤4、在深度学习的keras库中构建u型网络模型;
步骤5、将步骤3中得到的训练集及验证集作为u型网络模型的输入,对构建好的u型网络模型进行训练及参数调整,得到训练好的u型网络模型;
步骤6、采用步骤5中训练好的u型网络模型对测试集进行预测,对预测的结果进行后处理,即对u型网络预测得到的概率图进行二值化处理,得到分割的二值图,通过分割结果计算右心室的不同生理指标,并对结果进行评估分析,其中,对结果进行评估分析包括精确度、相关性、一致性分析,精确度的评价指标为dice系数(dicemetric,dm)及豪斯多夫距离(hausdorffdistance,hd),dice系数用于度量自动分割结果与金标准的相似度,采用公式:
式中,dm(a,b)表示a与b的dice系数,a为自动分割结果所得的面积大小,b为专家手动标注的金标准的面积大小;
豪斯多夫距离用来度量两幅图像的最大不对称差异,采用公式:
hd(a,b)=max(maxa∈a(minb∈bd(a,b)),maxb∈b(mina∈ad(a,b)))
式中,hd(a,b)表示a与b的豪斯多夫距离,a表示自动分割的轮廓,b表示专家手动标注的金标准的轮廓,a为轮廓a中的点,b为轮廓b中的点,d(a,b)为a点与b点的欧几里得距离。
优选地,步骤3中,对步骤2中得到的感兴趣区域roi图像进行平移、旋转、翻转、拉伸达到扩充数据集的目的。
优选地,步骤4中,所述u型网络模型包括:卷积核为3×3的卷积层、批归一化处理层、leakyrelu激活函数层、核大小为2×2的最大池化层、扩展卷积层、上采样层、反卷积层以及softmax激活函数层。
优选地,步骤6中,所述生理指标包括舒张末期容积(enddiastolicvolume,edv)、收缩末期容积(endsystolicvolume,esv)、每搏输出量(strokevolume,sv)、射血分数(ejectionfraction,ef)。
与现有技术相比,本发明的有益效果是:
本发明提供了一种基于深度学习的右心室全自动分割方法,首先通过自动识别心室区域降低周围组织对分割结果的影响,对原有的u型网络进行改进,从而实现对右心室的准确全自动分割,为心脏的进一步功能分析和疾病诊断提供了基础。
附图说明
图1是本发明方法的流程示意图;
图2是本发明方法的网络结构示意图;
图3是心脏短轴图像舒张末期底部分割结果;
图4是心脏短轴图像舒张末期中部分割结果;
图5是心脏短轴图像舒张末期顶部分割结果;
图6是心脏短轴图像收缩末期底部分割结果;
图7是心脏短轴图像收缩末期中部分割结果;
图8是心脏短轴图像收缩末期顶部分割结果,图3至图8中,从左往右依次为感兴趣区域、本发明分割结果及专家分割金标准。
具体实施方式
下面结合附图,进一步阐述本发明。应理解,这些实施例仅用于说明本发明而不用于限制本发明的范围。此外应理解,在阅读了本发明讲授的内容之后,本领域技术人员可以对本发明作各种改动或修改,这些等价形式同样落于本申请所附权利要求书所限定的范围。
本实施例公开的一种基于深度学习的右心室自动分割方法包括以下几个步骤:
(1)数据预处理
本发明对心脏电影磁共振图像进行回顾性分析(1.5tge磁共振成像系统),本实施例中一共包括61例病人的844幅mri图像数据,其中,男性22例,女性39例,年龄涵盖23~93岁,具体成像参数为:图像大小256×256,层厚6-8mm,层间距2-4mm,每例数据包含6-10层,每层20-28个时相。每例数据根据收缩末期和舒张末期的图像的差值绝对值图像进行感兴趣区域的提取,感兴趣区域包含左右心室,并且将感兴趣区域统一进行灰度归一化预处理,使图像灰度大小取值在[0,255]区间内,用于后续数据处理。41例数据共计569幅mri图像用来训练和调整网络的各项参数,其中80%的图像作为训练集,20%的图像作为验证集;20例数据共计275幅mri图像作为测试集进行分割。针对训练样本不足问题,本发明采用平移、旋转、翻转、拉伸的方法扩充样本量。
(2)网络搭建与训练
本实施例的网络架构采用python语言和keras深度学习库,使用nvidiageforcegtx1050ti进行加速。
在深度学习的keras库下搭建改进的u型网络模型,将调整到同样120×120大小的训练集和验证集输入网络进行训练和参数调整,网络的输出为每个像素点属于右心室的概率。
网络模型结构包括:卷积核为3×3的卷积层,批归一化处理层、leakyrelu激活函数层、核大小为2×2的最大池化层、扩展卷积层、上采样层、反卷积层以及softmax激活函数层,网络结构如图2所示,其参数设置如表1所示。在原有的u型网络的基础上减少下采样次数,利用扩展卷积扩大感受野,加入批归一化处理、改变激活函数及损失函数提高精度。
表1
卷积层(convolutionallayer)的参数是通过反向传播算法最佳化得到的。卷积运算的目的是提取输入的不同特征,第一层卷积层可能只能提取一些低级的特征如边缘、线条,更多层的网络能从低级特征中迭代提取更复杂的特征。每一层卷积层的输出大小与输入的关系采用如下公式表示:
式中,heightinput、heightoutput、heightkernel分别为输入、输出和卷积核的长;widthinput、widthoutput、widthkernel分别为输入、输出和卷积核的宽;padding为0填充大小,stride为步长,本实施例中,padding=1,stride=1,保证每一层的输出大小与输入相同。
批归一化处理层用来处理训练过程中中间层的数据分布发生改变的问题。本实施例通过预处理过程将输入层的数据归一化,但网络的每一层输入数据分布是一直在发生变化的,前面层训练参数的更新将导致后面层输入数据分布的变化,因此必然会引起后面每一层输入数据分布的改变,使用批归一化处理减小数据分布不同带来的影响。
池化层用来减少网络的输出参数,选择有效特征输出,本实施例中采用卷积核为2×2的最大池化层,即取窗口中包含的四个值中的最大值作为输出,其余值忽略。激活函数采用leakyrelu,在修正线性单元relu的基础上给所有负值赋予一个非零斜率,本实施例中斜率设为10。
由于数据集图片大小较小,故将u型网络的下采样过程减少为3次,即可有效提取图像特征。根据一幅图像中只会存在一个心脏的事实,减少周围组织对特征提取的影响,利用扩展卷积层代替卷积层,可以指数倍的增加每一层的感受野,减小神经网络对相似特征的错误提取。利用上采样与反卷积可以将图片恢复到与输入图片相同的尺寸大小。
本实施例的损失函数l(w)采用了dice系数,定义为:
式中,yn表示第n个样本训练标签,对右心室二值图像来说,即0代表背景,1代表右心室;
(3)对测试数据进行分割
利用训练好的网络对测试集中的每一个病人的舒张末期和收缩末期的图像进行预测,网络预测的输出结果为每一个像素点属于右心室的概率,概率大于0.5则认为将其为右心室,通过设置阈值对概率图像进行二值化处理得到最后的分割结果。本实施例所得最终分割结果见图5。
- 还没有人留言评论。精彩留言会获得点赞!