miR‑375‑3p在鳞翅目害虫防治中的应用的制作方法与工艺
miR-375-3p在鳞翅目害虫防治中的应用技术领域本发明涉及miR-375在斜纹夜蛾防治中的应用,具体涉及miR-375-3p抑制斜纹夜蛾抗植物毒素机制从而达到高效杀虫这一功能,从而围绕miR-375-3p开展转基因或抑制剂研发,达到高效害虫防治的目的。
背景技术:
microRNA(miRNA)为20世纪90年代发现的一类内源性的非编码RNA(LeeRC,FeinbaumRL,AmbrosV.TheC.elegansheterochronicgenelin-4encodessmallRNAswithantisensecomplementaritytolin-14.Cell,1993,75(5):843-54.),约22个核苷酸。它们的生物合成由RNA聚合酶II(RNApolymeraseII,polII)转录,形成长度为几百甚至上千个碱基的初级转录本(pri-miRNA),其中pri-miRNA的5’端具有帽子结构和poly(A)尾巴。pri-miRNA于细胞核内在RNaseIII的作用下,被剪切生成miRNA前体(pre-miRNA)。前体miRNA通过Ran-GTP介导的exportin-5蛋白转运到细胞质中(BartelDP.MicroRNAs:genomics,biogenesis,mechanism,andfunction.Cell,2004,Vol.116(2):281-297)。在RNaseIII/Dicer复合体的作用下,pre-miRNA被剪切成两个不完全配对的miRNA和miRNA*(miRNA*就是与miRNA不完全互补配对的序列)。最后在解旋酶的作用下miRNA/miRNA*复合体解旋形成成熟单链的miRNA。成熟的miRNA会与沉默复合体(RISC)结合,而剩下的miRNA*在细胞质中被RNase所降解。miRNA作用机制主要包括两点:抑制翻译和降解mRNA。miRNA与靶mRNA的3’UTR不完全互补配对进而破坏靶基因mRNA转录本的稳定性,从而达到抑制核糖体翻译的目的。而降解作用则是通过加速靶mRNA中的多聚腺苷酸尾巴(poly(A)tail)去腺苷酸化,使mRNA的结构被破坏,导致mRNA失去保护而迅速被核酸外切酶降解。就目前研究而言,miRNA对靶基因mRNA的翻译抑制和对靶基因mRNA的加速降解是两个相互独立的机制,不仅如此,这两个不同的机制所产生的结果也有明显的区别:miRNA对mRNA的降解是一个不可逆的过程,一旦被降解就彻底地消失了;但是,miRNA对mRNA翻译的抑制却是可以被解除的调控(WuL,FanJ,BelascoJG.MicroRNAsdirectrapiddeadenylationofmRNA.ProcNatlAcadSciUSA,2006,Vol.103(11):4034-4039.)。大量的研究工作表明,miRNA具有调控生物体生长和发育,细胞分化和凋亡,激素的分泌和信号的传导以及应答各种胁迫。但是在昆虫与植物关系中的重要miRNA仍没见有报道。斜纹夜蛾是一种杂食性昆虫,可以进食290多种植物,对农业生产影响很大,研究调控其进食植物的重要miRNA对发展害虫防治新靶标有着重要的意义。
技术实现要素:
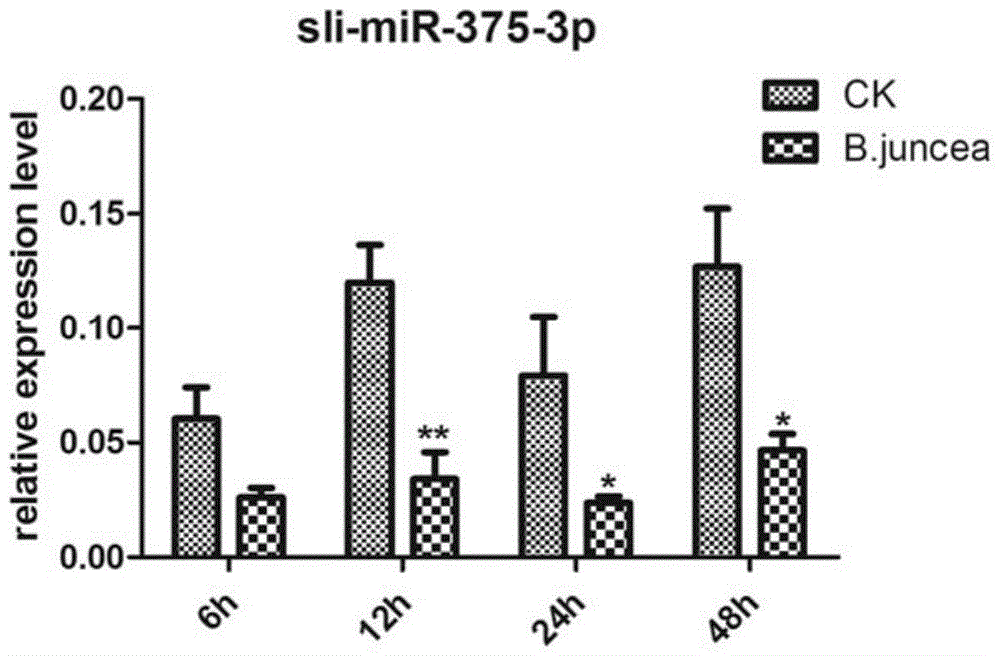
本发明的目的在于提供昆虫miR-375-3p在制备杀虫剂中的应用。本发明所采取的技术方案是:昆虫类miR-375-3p在制备杀虫剂中的应用。进一步的,上述昆虫为鳞翅目昆虫。进一步的,上述鳞翅目昆虫为斜纹夜蛾、蚕、茶尺蠖、小菜蛾、草地贪夜蛾、水稻二化螟。进一步的,上述昆虫类miR-375-3p的序列如SEQIDNO:1所示。本发明的有益效果是:本发明发现斜纹夜蛾类miR-375-3p可有效防治斜纹夜蛾,该序列在别的鳞翅目昆虫内也存在,高度保守,因此也可用于防治其他害虫。本发明发现斜纹夜蛾miR-375-3p可用于任何鳞翅目昆虫的害虫防治,同理,任何鳞翅目昆虫的miR-375-3p皆可用于其他同类昆虫的害虫防治。附图说明图1为注射miR-375-3p后斜纹夜蛾幼虫的生长情况;图2为qRT-PCR分别检测进食芥菜和人工培养基后斜纹夜蛾中肠miR-375-3p的表达水平,CK代表培养基对照,B.juncea为芥菜;图3为qRT-PCR检测进食培养基斜纹夜蛾不同组织中miR-375-3p的表达情况并与斜纹夜蛾细胞株进行比较;FB:脂肪体;spli221:斜纹夜蛾细胞株;mg:中肠;head:头部;EP:表皮;图4为qRT-PCR检测相关基因的表达与miR-375-3p之间的关系;图5为western检测注射了miR-375-3p斜纹夜蛾幼虫体内蛋白GSTE1的表达量;图中NC表示对照组,给幼虫体内注射的序列为SEQIDNO:2;375mimic表示处理组,给幼虫体内注射的序列为SEQIDNO:1;图6为家蚕幼虫体内注射斜纹夜蛾miR-375-3p72h的表征;左边三条虫体为注射NC序列后的表型,右边三条虫为注射斜纹夜蛾miR-375-3p后的表型,其中间一条为死亡虫;图7为不同物种的miR-375-3p序列比较;其中,序号1-13包括了人、哺乳动物和昆虫;15-19为鳞翅目昆虫;图8为不同物种miR-375-3p聚类图。具体实施方式本发明将5龄大的斜纹夜蛾喂食其喜好的芥菜,然后提取其消化吸收主要场所中肠的RNA,通过高通量测序分析,并与已有数据库数据进行比对分析,确定了有差异表达的163个miRNA。对其中几个表达量显著下调的miRNA进行了人工序列合成,并注射入5龄大的斜纹夜蛾,结果发现miR-375-3p显著抑制斜纹夜蛾的生长,注射后一天,昆虫死亡率增加了约70%。表明MiR-375-3p对斜纹夜蛾防治的有效性。目前miR-375-3p在人类胰岛素代谢,癌症,细胞凋亡等途径中都有报道参与调控,在昆虫中只有一篇报道,在蚊子吸血后miR-375-3p表达上升。miR-375-3p通过抑制人类磷脂酰肌醇依赖性激酶1,从而抑制胰岛素的分泌的(OuaamariA,BaroukhN,MartensGA,LebrunP,PipeleersD,vanObberghenE.miR-375targets3'-phosphoinositide-dependentproteinkinase-1andregulatesglucose-inducedbiologicalresponsesinpancreaticbeta-cells.Diabetes.2008,57(10):2708-17.),但我们发现斜纹夜蛾miR-375-3p并不作用胰岛素分泌过程的相关基因,而是作用一些免疫基因。下面结合具体实施例对本发明作进一步的说明,但并不局限于此。实施例1一、miR-375-3p处理影响斜纹夜蛾的生长选取大小一致、健康状况一致的五龄第一天斜纹夜蛾幼虫,称量每只虫子的重量,随机分为miR-375-3p处理组和NC对照组,每组40只,重复3次。顺血液循环流动方向,用微量注射器从斜纹夜蛾幼虫的侧腹部第一和第二腹足之间,分别注射人工合成的miR-375-3p,序列为5’-UUUGUUCGCCCCGGCUCGAGUCG-3’(SEQIDNO:1)和NC:5'-UUCUCCGAACGUGUCACGU-3’(SEQIDNO:2),已知的不作用任何基因的无义小分子片段;注射量为每只虫4μg,注射后喂饲芥菜。注射后第1、2、3天观察虫子的形态变化并拍照取证,每天统计虫子的死亡率。表1注射miR-375-3p后斜纹夜蛾幼虫的死亡情况实验结果如表1和图1所示,从表1中可以看出注射miR-375-3p的处理组在注射24后,死亡率达68.97%,远远高于对照组的7.14%,72小时后死亡率达86.21%,而对照组仅为10.71%。图1为注射miR-375-3p和NC3天后斜纹夜蛾幼虫的生长情况,从中可以看出miR-375-3p处照后存活的幼虫瘦小,而对照组的幼虫明显肥大许多。二、MiR-375-3p在斜纹夜蛾进食芥菜时表达量下降将五龄第二天的斜纹夜蛾分别分为两组,一组继续喂食人工培育基作为对照,另一组改喂食芥菜,分别于喂食芥菜后6、12、24和48h取斜纹夜蛾中肠进行miR-375-3p含量的测定,测定方法为qRT-PCR。并且,对喂食芥菜的斜纹夜蛾中脂肪体(FB)、中肠(mg)、头部(head)、和表皮(EP)中miR-375-3p的表达量进行检测,并与斜纹夜蛾细胞株(spli221)中miR-375-3p表达量进行比较。从图2中可以看出,进食芥菜6h后,与进食培养基的斜纹夜蛾相比,进食芥菜组的中肠miR-375-3p含量显著下降。因此如果此时注射大量miR-375-3p将抑制相关基因的表达,而导致斜纹夜蛾的死亡(表1和图1)。从图2和图3中可以看出,五龄第二天的斜纹夜蛾改喂食芥菜后,miR-375-3含量显著下降。它是通过自身对miR-375-3p的降解,解除了对靶基因的抑制作用,从而促进了靶基因的表达上调,从而响应芥菜的进食。图3分析了miR-375-3p在各组织的分布,其含量在脂肪体最高,暗示其可能与斜纹夜蛾的免疫功能有关。三、miR-375-3p通过调控免疫相关基因响应斜纹夜蛾进食芥菜为了了解miR-375-3p可能的靶基因,本发明对斜纹夜蛾进食芥菜的中肠进行了高通量测序,通过分析,发现表达量上调显著的基因多与免疫和生长有关,将这些显著上调基因的3’末端序列与miR-375-3p进行配对,最后挑出结合可能性高的靶基因(自由能ΔG<-19)。如下表2所示,miR-375-3p与多个二相解毒酶如GST和UGT、抗氧胁迫基因如氧化还原酶和转录因子Ets、参与代谢的蛋白水解酶和脂肪酶等。表2高通量测序法筛选miR-375-3p可能的靶基因为了进一步研究表2中筛选出的靶基因与miR-375-3p的关系,将斜纹夜蛾幼虫注射miR-375-3p并喂食芥菜72h后,对斜纹夜蛾幼虫中肠进行qRT-PCR,以检测这些靶基因的表达情况。qRT-PCR方法:喂食芥菜的虫子解剖,取中肠、前肠、后肠、脂肪体、表皮、血淋巴等组织,按Trizol法抽提总RNA,测定浓度后取2μg总RNA进行反转录(参考TAKARA的OneStepPrimeScriptmiRNAcDNASynthesisKit说明书进行),得到的cDNA产物稀释后用于荧光定量PCR的模板,按照说明书进行qRT-PCR。采用相对定量的方法(2−ΔΔCt)来确定目标基因相对内标基因(GAPDH,HQ012003)的相对表达倍数。应用SPSS16.0统计分析软件,采用ANOVA(多个处理间的两两比较)或独立样本T检验(两个样品间比较)来进行处理间的差异比较分析。实验结果如图4所示,从中可以看出,在注射miR-375-3p的斜纹夜蛾幼虫体内,蛋白水解酶chymotrypsin-likeprotease、解毒酶UGT和GSTe1表达量显著下调,说明miR-375-3p在体内抑制这些基因的表达。本实施例还用western方法作进一步检测,将斜纹夜蛾幼虫注射了miR-375-3p后再喂食芥菜,然后分别在注射24h、48h后提取斜纹夜蛾中肠蛋白,用western方法检测目的蛋白GSTE1(解毒酶)的表达量。检测结果如图5所示,从结果可以看出在处理组(注射了miR-375-3p斜纹夜蛾幼虫体)中GSTE1蛋白表达水平明显低于对照组(NC),说明miR-375-3p抑制GSTE1蛋白表达。而正常情况下该蛋白在斜纹夜蛾进食芥菜后表达量上调。实施例2Sl-miR-375-3p对家蚕生长发育的影响既然miR-375-3p在鳞翅目昆虫较保守,那么斜纹夜蛾Sl-miR-375-3p是否同样影响其他鳞翅目昆虫的生长发育?为此对家蚕5龄幼虫进行了同实施例1中“一”相似的注射实验,注射后观察虫子的形态变化并拍照取证,每天统计虫子的死亡率。检测结果如图6所示,可以看出注射2ug斜纹夜蛾Sl-miR-375-3p后的家蚕100%生长不正常,虫体瘦小,72h后,死亡率达54%(见表3)。表3注射斜纹夜蛾miR-375-3p的家蚕死亡率统计下面将斜纹夜蛾Sl-miR-375-3p序列与鳞翅目其他昆虫的miR-375-3p序列进行比较,同时与其他物种(如人、哺乳动物)的miR-375-3p序列进行比较,比较结果如图7和图8所示。从图7中可以看出鳞翅目昆虫中小菜蛾(Plutellaxylostella)、家蚕(Bombyxmori)和水稻二化螟(Chilosuppressalis)的miR-375-3p序列完全一样,而草地贪夜蛾(Spodopterafrugiperda)和斜纹夜蛾(Spodopteralitura)的miR-375-3p序列完全一样,两组鳞翅目昆虫间的miR-375-3p序列只有一个碱基的差异,一个为U,另一个为A。而鳞翅目昆虫的miR-375-3p序列与别的物种差别较大。从图8中可以看出鳞翅目昆虫miR-375-3p聚为一类,而与其他物种差距较大。上述结果说明,miR-375-3p抑制虫体内用于消化食物所需的解毒酶和代谢酶的表达,从而影响虫体进食,最终导致虫体的瘦小甚至死亡。斜纹夜蛾miR-375-3p可用于任何鳞翅目昆虫的害虫防治。同理,任何鳞翅目昆虫的miR-375-3p皆可用于其他同类昆虫的害虫防治。可将昆虫miR-375-3p用于杀虫剂的制备,或制备表达miR-375-3p的转基因植物进行害虫防治。为本领域的专业技术人员容易理解,以上所述仅为本发明专利的较佳实施例,并不用以限制本发明,凡本发明的精神和原则之内所作的任何修改、等同替换和改进等,均落在本发明要求的保护范围之内。<110>华南师范大学<120>miR-375-3p在鳞翅目害虫防治中的应用<130><160>2<170>PatentInversion3.5<210>1<211>23<212>RNA<213>人工序列<400>1uuuguucgccccggcucgagucg23<210>2<211>19<212>RNA<213>人工序列<400>2uucuccgaacgugucacgu19
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1