用于治疗水肿的组合物和方法与流程
对相关申请的交叉引用
本申请要求2015年2月5日提交的美国临时专利申请号62/112,273的优先权权益,其全部内容通过引用并入本文。
政府支持的声明
本发明在由国立卫生研究所授权的拨款号r01hl111130-01、t32ca009685-21a1和1s10rr028889-01,以及国立癌症研究所授予的拨款号p30ca008748下得到政府支持完成。政府具有本发明的某些权利。
版权
本专利文献的公开内容的一部分含有受版权保护的材料。版权所有者不反对任何人复制专利文献或专利公开,就像它在专利商标局专利文件或记录中出现一样,但无论如何以其它方式保留所有版权。
通过引用并入
对于允许通过引用并入的国家,本公开中引用的所有参考文献的全部内容通过引用并入本文。此外,任何制造商对本文中引用或提及的任何产品的说明或目录均通过引用并入。通过引用并入本文的文献或其中的任何教导可以用于本发明的实践中。通过引用并入本文的文件不承认是现有技术。
背景
淋巴水肿是一种慢性虚弱性疾病,其在美国和西方国家最常作为癌症治疗的并发症出现。在这种背景下,淋巴水肿最常在淋巴结清除术后由于对淋巴系统的医源性损伤,而且还由于较宽的皮肤切除和用辐射的辅助疗法而发生。purushotham等人,j.clin.oncol.23:4312-4321(2005);szuba等人,cancer95:2260-2267(2002);tsai等人,ann.surg.oncol.16:1959-72(2009)。据估计,经历淋巴结清扫术的3名患者中的多达1名将继续发展淋巴水肿,并且保守估计提示每年诊断出多达50,000名新患者。disipio等人,lancetoncol.14:500-515(2013);petrek等人,cancer83:2776-2781(1998)。由于淋巴水肿是一种无法治愈的终身疾病,受影响的个体的数目每年都在增加,目前的估计值在5-6百万美国人之间(rockson等人,ann.nyacad.sci.1131:147-154(2008))和全球超过2亿人。由于淋巴水肿的发展与癌症存活几乎呈线性关系,并且因为随着淋巴水肿的已知危险因素(如肥胖和放射)的流行日益提高,此数目在未来可能会继续增加。erickson等人,j.natl.cancerinst.93:96-111(2001)。
淋巴水肿是令人难看和虚弱的;患者具有受影响肢体的慢性肿胀、复发性感染、有限的运动性和生活质量下降。hayes等人,cancer118:2237-2249(2012)。此外,一旦淋巴水肿发展,它通常是进行性的。尽管淋巴水肿是常见且高度病态的实情,但目前尚无治愈,并且治疗是姑息的,其目的是预防疾病进展而不是恢复淋巴功能。velanovich等人,am.j.surg.177:184-187(1999);beaulac等人,arch.surg.137;1253-1257(2002)。因此,需要患者在其生命的剩余部分穿紧身、不舒服的衣服,以防止受影响的肢体中的淋巴液积聚,并且经受激烈和耗时的物理疗法治疗。koul等人,int.j.radiat.oncol.biol.phys.,67:841-846(2007)。此外,尽管进行中的慢性护理,一些患者仍然有严重的疾病进展,伴有淋巴水肿肢体的肿胀增加和频繁的感染。目前没有可以阻止淋巴水肿进展或促进消退的已知的药理学疗法。cormier等人,ann.surg.oncol.19:642-651(2012)。因此,淋巴水肿的靶向治疗的开发是一个重要的目标,并且是未满足的生物医学需要。
最近的研究表明,纤维化不仅是淋巴水肿的临床特征,而且也是疾病的关键病理调节物。cheville等人,semin.radiat.oncol.13:214-225(2003);mihara等人,plosone7:e41126(2012);rasmussen等人,curr.opin.biotechnol.20:74-82(2009)。转化生长因子β-1(tgf-β1)是多种器官系统中纤维化的关键调节物,通过直接机制起作用以增加成纤维细胞的胶原产生,并且降低基质产物的周转。willis等人,am.j.pathol.166:1321-1332(2005);sakai等人,am.j.pathol.184:2611-2617(2014);qi等人,am.j.physiol.renalphysiol.288:f800-f809(2005);bonniaud等人,j.immunol.173:2099-2108(2004);fujimoto等人,biochem.biophys.res.commun.305:1002-1007(2003);stramer等人,j.cellphysiol.203:226-232(2005);kawakami等人,j.invest.dermatol.110:47-51(1998);li等人,circulation96:874-881(1997);martinez等人,hepatology21:113-119(1995);peltonen等人,j.invest.dermatol.97:240-248(1991);vanlaethem等人,gastroenterology110:576-582(1996)。此外,tgf-β1是炎性应答的关键调节物,并且认为通过调节慢性炎症间接调节纤维化。pesce等人,plospathog.5:e1000371(2009)。我们最近已经显示了在淋巴水肿组织中,在临床上以及淋巴水肿的小鼠模型中,tgf-β1的表达显著增加。使用免疫疗法抑制tgf-β1可显著加速小鼠尾模型中的淋巴再生,减少纤维化,减少炎症,以及改善淋巴功能。avraham等人,plast.reconstr.surg.124:438-450(2009);clavin等人,am.j.physiol.heartcirc.physiol.295:h2113-h2127(2008);avraham等人,am.j.pathol.177:3202-3214(2010)。
纤维化应答的抑制保留了淋巴系统输送组织液和炎性细胞的能力。我们实验室的最近研究已经显示了,淋巴水肿的临床和动物模型中,cd4+细胞在调节纤维化中起关键作用。avraham等人,am.j.pathol.177:3202-3214(2010);avraham等人,fasebj.27:1114-1126(2013);zampell等人,am.j.physiol.cellphysiol.302:c392-c404(2012);zampell等人,plosone7:e49940(2012)。例如,我们发现了临床淋巴水肿活检标本和淋巴水肿的动物模型被cd4+细胞浸润,并且这些细胞的数目与纤维化程度和疾病的临床严重程度相关。avraham等人,fasebj.27:1114-1126(2013)。晚期淋巴水肿患者一般比早期疾病患者具有显著更多的浸润性t细胞,特别是更多的cd4+细胞。淋巴静脉旁路(一种将阻塞性淋巴系统分流到静脉循环的过程)后淋巴水肿临床症状的改善与组织纤维化减少和cd4+细胞浸润减少有关。torrisi等人,lymphat.res.biol.13:46-53(2015)。
淋巴水肿中的cd4+细胞应答(与其它纤维增生性病症相似)特征在于混合的th1/th2细胞群体。avraham等人,fasebj.27:1114-1126(2013)。首次用于实验的cd4+t细胞,也称为t辅助细胞或th细胞,巡查次级淋巴样结构,并且在激活时沿着许多不同/重叠的细胞类型(例如th1、th2、th17、t调节等)分化。th2细胞亚组在调节对寄生物的应答和一些自身免疫应答中起关键作用。这些细胞也涉及包括心脏、肺、肾和皮肤在内的许多器官系统中的纤维增生性疾病的病理学。最近的研究已经显示了,从淋巴水肿患者获得的组织活组织检查中th2的数目增加,并且th2分化的抑制降低了小鼠模型中淋巴水肿的病理学。
cd4+细胞(但不包括其它炎症细胞类型,包括cd8+细胞或巨噬细胞)的消耗或th2分化的抑制(但不是全身性炎症或抑制白细胞介素-6)显著降低纤维化程度,增加淋巴管生成和淋巴液转运,并有效地治疗临床前小鼠模型中建立的淋巴水肿。avraham等人,fasebj.27:1114-1126(2013);zampell等人,plosone7:e49940(2012);ghanta等人,am.j.physiol.heartcirc.physiol.308:h1065-1077(2015)。这些发现得到最近的研究证实,所述研究证明了t细胞通过产生抗淋巴管生成细胞因子/生长因子,包括干扰素γ(ifn-γ)、白细胞介素(il)-4、il-13和tgf-β1,有力抑制淋巴管生成。kataru等人,immunity34:96-107(2011);shin等人,nat.commun.6:6196(2015);shao等人,j.interferon.cytokineres.26:568-574(2006);oka等人,blood111:4571-4579(2008)。这些研究结果一起表明,淋巴水肿组织中浸润性cd4+细胞通过多种机制减少淋巴功能,包括诱导继发于组织纤维化的淋巴管的结构变化和抑制侧淋巴管形成。
以前的用于淋巴水肿的实验性治疗集中于递送淋巴管生成性细胞因子。skobe等人,nat.med.7:192-198(2001)。例如,以前的一些研究集中于使用淋巴管生成性细胞因子如血管内皮生长因子c(vegf-c)修复损伤的淋巴系统。tammela等人,nat.med.13:1458-1466(2007);baker等人,breastcancerres.12:r70(2010)。尽管有前景,但是这种方法的应用(特别对癌症患者)可能是站不住脚的,因为这些相同的机制调节肿瘤生长和转移,提高癌症转移或复发的风险。zhang等人,cancerres.70:2495-2503(2010);yu等人,j.exp.clin.cancerres.28:98(2009);sugiura等人,int.j.oncol.34:673-680(2009);gu等人,clin.exp.metastasis25:717-725(2008);kazama等人,hepatogastroenterology54:71-76(2007);hirakawa等人,blood109:1010-1017(2007)。相比之下,局部消耗cd4+t细胞可以治疗潜在的病理学,而非仅仅促进淋巴管生成,因此可以安全得多地用于癌症患者。因此,这种方法能够在淋巴水肿爆发/恶化期间治疗癌症幸存者,在非手术患者中添加到保守疗法,预防高危患者中的疾病发展,或改善淋巴水肿的手术治疗的结果。
他克莫司是fda批准为局部制剂并用于治疗皮肤炎症/纤维化疾病,包括特应性皮炎(ruzicka等人,n.engl.j.med.337:816-821(1997))、银屑病(wang等人,j.cutan.med.surg.18:8-14(2014))和局部化硬皮病(mancuso等人,br.j.dermatol.152:180-182(2005))的抗t细胞剂。他克莫司是由土壤细菌筑波链霉菌(streptomycestsukubaensis)产生的大环内酯,当用于预防移植排斥和治疗多种自身免疫性疾病时,其是完全耐受的。它通过结合fk-506结合蛋白12(fkbp-12)发挥其抗t细胞特性,从而抑制钙调神经磷酸酶,并最终降低il-2表达。clipstone等人,nature357:695-697(1992)。因为il-2对cd4+t细胞的t细胞活化和分化是至关重要的,所以钙调神经磷酸酶抑制剂具有深刻的cd4+细胞免疫抑制作用。liao等人,immunity38:13-25(2013);rautajoki等人,ann.med.40:322-335(2008)。
特立氟胺(teriflunomide)是减少t细胞炎症应答的免疫抑制剂。特立氟胺的口服施用经fda批准用于治疗多发性硬化。williamson等人,j.biol.chem.270:22467-22472(1995);davis等人,biochem.35:1270-1273(1996);iglesias-bregna等人,j.pharmacol.exp.ther.347:203-211(2013)。特立氟胺是来氟米特(leflunomide)的活性代谢物,并且通过阻断酶二氢乳清酸脱氢酶抑制从头嘧啶合成。也已经显示了特立氟胺抑制信号转导物和转录激活物-6(stat-6)(th2分化的关键调节物)的激活。olsan等人,proc.natl.acad.sci.usa108:18067-18072(2011)。作为这些机制的结果,特立氟胺抑制活跃分裂的th2细胞并减少炎症应答。
吡非尼酮是具有抗纤维化和抗炎作用的化合物。最近的研究表明,这种活性至少部分是由于抑制tgf-β的产生和活性。iyer等人,j.pharmacol.exp.ther.291:367-373(1999);tada等人,clin.exper.pharmacol.physiol.28:522-527(2001);oku等人,eur.j.pharmacol.590:400-408(2008);tian等人,chin.med.sci.j.21:145-151(2006);schaefer等人,eur.respir.rev.20:85-97(2011)。目前,在1,247例ipf患者的3项临床试验中建立其安全性和功效后,它在美国被fda批准用于在治疗特发性肺纤维化(ipf)中口服施用。taniguchi等人,eur.respir.j.35:821-829(2010);noble等人,lancet377:1760-1769(2011);king等人,n.engl.j.med.370:2083-2092(2014)。除了ipf的治疗之外,吡非尼酮已被临床评估其治疗其它慢性纤维化病症(包括肾纤维化、肝纤维化和骨髓纤维化)的安全性和功效。tada等人,clin.exper.pharmacol.physiol.28:522-527(2001);cho等人,clin.j.am.soc.nephrol.2:906-913(2007);nagai等人,intern.med.41:1118-1123(2002);raghu等人,am.j.respir.crit.caremed.159:1061-1069(1999);gahl等人,mol.genet.metab.76:234-242(2002);armendariz-borunda等人,gut55:1663-1665(2006);angulo等人,dig.dis.sci.47:157-161(2002);mesa等人,brit.j.haematol.114:111-113(2001)。
卡托普利是血管紧张肽转换酶(ace)抑制剂,由fda批准用于在治疗高血压和确定型心力衰竭和糖尿病肾病中口服施用。ace将血管紧张肽i(angi)转化为血管紧张肽ii(angii)并引起血管收缩,抑制血管扩张,并通过对肾素-血管紧张肽系统(ras)的作用间接调节血管内液体积。因此,ace的抑制已经成为高血压的主要疗法。最近的研究显示了angii也是各种器官系统(包括肾、肝和肺)纤维化的关键调节物。langham等人,diabetescare29:2670-2675(2006);alvesdealbuquerque等人,kidneyintl.65:846-859(2004);osterreicher等人,hepatology.50:929-938(2009);mak等人,mol.ther.23:1434-1443(2015);wang等人,cellphysiol.biochem.36:697-711(2015)。angii的促纤维化作用由许多机制介导,包括活性氧物质的产生、趋化因子和细胞因子的产生、粘附分子的表达增加、以及tgf-β表达/活性的调节。相比之下,angi通过激活其细胞表面受体mas而具有抗增殖和抗纤维化活性。clarke等人,int.j.hypertens.2012:307315(2011)。因此,已经提出ace和/或angii的抑制剂如卡托普利、氯沙坦和其它类似药物作为肺、肾和肝纤维化病症的潜在治疗选择。
目前还没有可用于治疗淋巴水肿的药物疗法。以前对淋巴水肿的研究主要集中在全身药物治疗。例如,口腔服用的香豆素已经用于淋巴水肿患者,取得适度的成功。casley-smith等人,bmj307:1037-1041(1993);casley-smith等人,n.engl.j.med.329:1158-1163(1993);casley-smith等人,australasj.dermatol.33:69-74(1992);loprinzi等人,n.engl.j.med.340:346-350(1999)。然而,这种药物的广泛临床应用受到显著的毒性(包括肝衰竭和死亡)的阻碍。loprinzi等人,n.engl.j.med.340:346-350(1999)。靶向纤维化的策略(特别是抑制全身性cd4+炎症应答、th2分化和/或tgf-β2途径)具有治疗淋巴水肿的临床前景。尽管高度有效,但由于不可接受的发病率和全身性并发症如感染、癌症复发和自身免疫性疾病,cd4+细胞的全身性消耗不是临床可行的。相比之下,局部递送药剂治疗与淋巴水肿相关的病理事件是一种可能限制全身毒性的新方法。因为淋巴水肿主要是四肢的皮肤和皮下软组织疾病,所以可以使用局部方法,这可以是更好耐受的,并提供更有靶向性的方法,从而避免全身并发症。因此,本领域中需要淋巴水肿的新治疗,特别是局部治疗。
发明概述
下文总结了本发明的一些主要方面。在本公开的发明详述、实施例、附图和权利要求书部分中描述了另外的方面。本公开的每个部分中的描述旨在与其它部分一起阅读。此外,本公开的每个部分中描述的各种实施方案可以以各种不同的方式组合,并且所有此类组合旨在落入本发明的范围内。
在一方面,本发明提供了药物组合物,其包含抗t细胞、抗tgf-β1和/或抗血管紧张肽剂的组合。例如,本发明提供了药物组合物,其包含:(i)有效量的一种或多种抗t细胞剂和(ii)有效量的一种或多种抗tgf-β1剂和/或有效量的一种或多种抗血管紧张肽剂。在具体的实施方案中,本发明提供了药物组合物,其包含(i)有效量的一种或多种抗t细胞剂和(ii)有效量的一种或多种抗tgf-β1剂。在另一个实施方案中,本发明提供了药物组合物,其包含:(i)有效量的一种或多种抗t细胞剂和(ii)有效量的一种或多种抗血管紧张肽剂。在又一个实施方案中,本发明提供了药物组合物,其包含:(i)有效量的一种或多种抗t细胞剂和(ii)有效量的一种或多种抗tgf-β1剂和(iii)有效量的一种或多种抗血管紧张肽剂。
在一个实施方案中,抗t细胞剂选自由以下组成的组:他克莫司、特立氟胺、来氟米特、环孢霉素、吡美莫司、地尼白介素2和巴利昔单抗。在一个实施方案中,抗tgf-β1剂或抗血管紧张肽剂选自由以下组成的组:吡非尼酮、卡托普利、佐芬普利、依那普利、赖诺普利、雷米普利、喹那普利、培哚普利、贝那普利、咪达普利、群多普利、西拉普利、福辛普利、氯沙坦、厄贝沙坦、奥美沙坦、坎地沙坦、替米沙坦、缬沙坦和非马沙坦。在具体的实施方案中,抗血管紧张肽剂是ace激动剂,例如ace-2激动剂。组合物可以被配制用于全身施用或局部施用。在优选的实施方案中,组合物被配制用于局部施用。
本发明的药物组合物可以包含抗t细胞、抗tgf-β1和/或抗血管紧张肽剂的任何组合。例如,在一个实施方案中,组合物包含他克莫司和吡非尼酮。在另一个实施方案中,组合物包含他克莫司、吡非尼酮和特立氟胺。在另一个实施方案中,组合物包含他克莫司、吡非尼酮和来氟米特。在其它方面,组合物包含他克莫司和卡托普利;或特立氟胺和卡托普利;或来氟米特和卡托普利;或吡非尼酮和卡托普利;或他克莫司、卡托普利和特立氟胺;或他克莫司、卡托普利和来氟米特;或他克莫司、卡托普利和吡非尼酮。
在药物组合物被配制用于局部施用的药物组合物的实施方案中,组合物可以包含约0.01%至约1%他克莫司,优选地约0.05至约0.2%他克莫司;约0.1mg/ml至约5mg/ml吡非尼酮,优选地约0.5mg/ml至约2mg/ml吡非尼酮;约10mg/ml至约50mg/ml特立氟胺,优选地约20mg/ml至约30mg/ml特立氟胺;约1%至约20%来氟米特,优选地约5%至约15%来氟米特;和/或约1%至约20%卡托普利。药物组合物优选地为选自以下的形式:软膏剂、乳膏、洗剂、糊剂、凝胶、摩丝、泡沫、漆、混悬剂、液体和喷雾剂。在优选的实施方案中,组合物为软膏剂的形式。
本发明的药物组合物可以用于治疗或预防水肿。
本发明还提供了治疗或预防水肿的方法,所述方法包括对有此需要的受试者施用药物组合物,所述药物组合物包含有效量的一种或多种选自由以下组成的组的药物:他克莫司、特立氟胺、来氟米特、环孢霉素、吡美莫司、地尼白介素2、巴利昔单抗、吡非尼酮、卡托普利、佐芬普利、依那普利、赖诺普利、雷米普利、喹那普利、培哚普利、贝那普利、咪达普利、群多普利、西拉普利、福辛普利、氯沙坦、厄贝沙坦、奥美沙坦、坎地沙坦、替米沙坦、缬沙坦和非马沙坦。
在一方面,水肿是淋巴水肿。
在一方面,本发明的方法可以包括施用抗t细胞、抗tgf-β1和/或抗血管紧张肽剂的组合。在具体的实施方案中,方法包括施用药物组合物,其包含:(i)有效量的一种或多种抗t细胞剂,其选自由以下组成的组:他克莫司、特立氟胺、来氟米特、环孢霉素、吡美莫司、地尼白介素2和巴利昔单抗;和(ii)有效量的一种或多种抗tgf-β1剂和/或抗血管紧张肽剂,其选自由以下组成的组:吡非尼酮、卡托普利、佐芬普利、依那普利、赖诺普利、雷米普利、喹那普利、培哚普利、贝那普利、咪达普利、群多普利、西拉普利、福辛普利、氯沙坦、厄贝沙坦、奥美沙坦、坎地沙坦、替米沙坦、缬沙坦和非马沙坦。方法可以包括施用抗t细胞、抗tgf-β1和/或抗血管紧张肽剂的任何组合。例如,在一个实施方案中,方法包括施用包含他克莫司和吡非尼酮的药物组合物。在另一个实施方案中,方法包括施用包含他克莫司、吡非尼酮和特立氟胺的药物组合物。在另一个实施方案中,方法包括施用包含他克莫司、吡非尼酮和来氟米特的药物组合物。在其它方面,方法包括施用包含他克莫司和卡托普利;或特立氟胺和卡托普利;或来氟米特和卡托普利;或吡非尼酮和卡托普利;或他克莫司、卡托普利和特立氟胺;或他克莫司、卡托普利和来氟米特;或他克莫司、卡托普利和吡非尼酮的药物组合物。
在本发明的方法中,可以全身或局部施用药物组合物。在优选的方法中,局部施用药物组合物。在本发明的此方面,药物组合物可包含约0.01%至约1%他克莫司,优选地约0.05至约0.2%他克莫司;约0.1mg/ml至约5mg/ml吡非尼酮、优选地约0.5mg/ml至约2mg/ml吡非尼酮;约10mg/ml至约50mg/ml特立氟胺、优选地约20mg/ml至约30mg/ml特立氟胺;约1%至约20%来氟米特、优选地约5%至约15%来氟米特;和/或约1%至约20%卡托普利。在局部施用的方法中,药物组合物为选自以下的形式:软膏剂、乳膏、洗剂、糊剂、凝胶、摩丝、泡沫、漆、混悬剂、液体和喷雾剂。优选地,药物组合物为软膏剂的形式。
确定用于全身或局部施用的给药日程表和持续时间在普通技术人员的技术范围内。在一个实施方案中,一天至少一次局部施用药物组合物。在另一个实施方案中,一天至少两次局部施用药物组合物。在药物组合物或方法牵涉预防水肿,特别地预防淋巴水肿的情况下,可以在淋巴损伤的约6周,优选地在淋巴损伤的约2周内施用组合物。
附图简述
图1a-1e显示了局部他克莫司降低尾部淋巴水肿。图1a显示了在手术切除浅表/深层集合淋巴系统并且在手术后2周(早期治疗)或6周(晚期治疗)开始用或不用局部他克莫司治疗后小鼠尾部的代表性照片。箭头指示疗法开始。图1b是与对照相比用他克莫司的早期(*p=0.021)或晚期(*p=0.018)治疗后尾部体积变化的图示。图1c(上图)显示了在淋巴消融后6周收获的对照和早期他克莫司治疗的小鼠尾部的截面组织学图像。括号显示了软组织厚度。图1c(下图)显示了用他克莫司的早期或晚期治疗后的软组织变化的量化(*p=<0.001)。图1d显示了全血他克莫司水平的量化,证明了全身治疗动物(4mgkg-1ip每日)中的免疫抑制浓度和局部治疗组中的非免疫抑制水平(*p=0.007)。图1e显示了用媒介物对照、局部他克莫司或全身性他克莫司治疗的动物中流式细胞术图(上图)和血液t细胞的量化(下图)。流式图代表y轴上的侧向散射面积(ssa)和x轴上的cd3+代表t细胞。注意仅在全身治疗的动物中t细胞的显著减少(*p=0.012)。
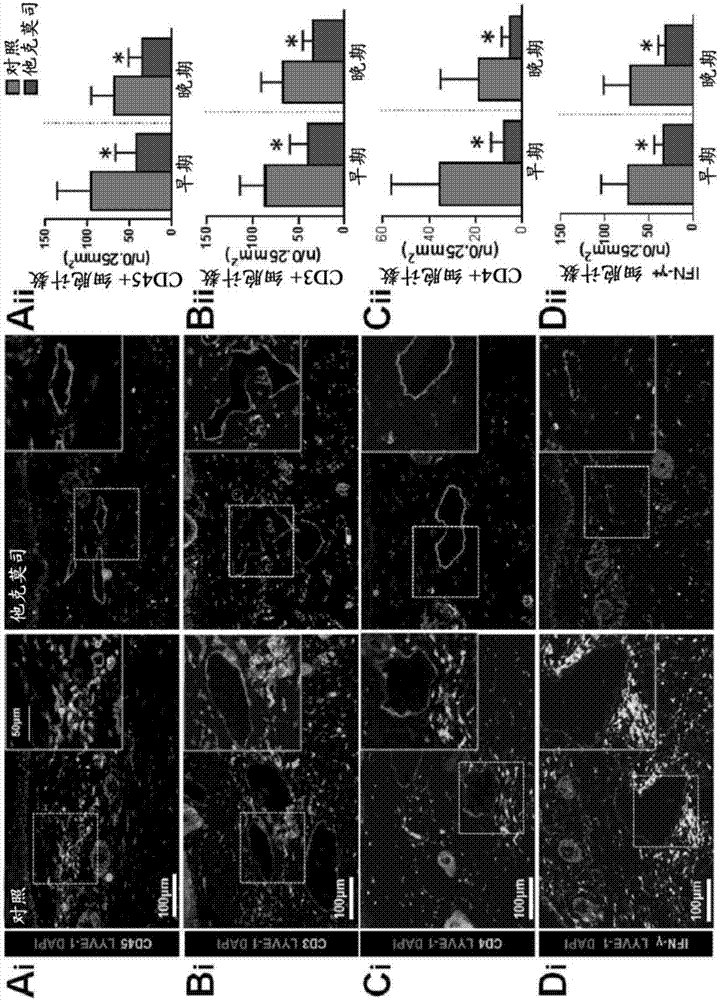
图2a-2d显示了局部他克莫司在淋巴损伤后降低炎症。图2a-2d显示了在cd45+(图2ai和2aii)、cd3+细胞(图2bi和2bii)、cd4+细胞(图2ci和2cii)和ifn-γ+细胞(图2di和2dii)的免疫荧光局部化的情况下手术后6周从对照和他克莫司治疗动物收获的尾部组织切片的代表性40x图像。在每个图的右上角插图中显示更高放大率(80x)图像。在每个图中染色淋巴管(lyve-1)。在每个图的右边显示了早期和晚期治疗两者的细胞计数的量化(全部为p<0.001)。
图3a-3d显示了局部他克莫司降低淋巴水肿中的纤维化。图3ai和3aii显示了在i型胶原和淋巴管的免疫荧光局部化的情况下在手术后6周从用对照或用他克莫司的早期治疗收获的尾部组织的代表性40x图像。在右边显示了早期和晚期治疗两者中的胶原i染色区域的量化(两者为p<0.001)。图3bi和3bii显示了从对照和早期他克莫司治疗动物收获的尾部组织的天狼猩红(picrosiriusred)染色的代表性40x图像(胶原i和胶原iii沉积)。右边显示了瘢痕指数(红色:绿色比)的量化(p=0.036早期;p<0.001晚期)。图3ci/ii和3di/ii显示了手术后6周从用对照或用他克莫司的早期治疗来治疗的动物收获的尾部组织中tgf-β1或psmad3与淋巴管的代表性40x免疫荧光共定位。在每个图的右边显示了两者的阳性细胞数目/0.25mm2面积的量化。
图4a-4g显示了他克莫司改善手术淋巴损伤后的淋巴功能。图4a显示了用或不用他克莫司的早期治疗后手术后6周小鼠尾部的代表性icg图像。注意在他克莫司治疗动物中创伤间近端icg的流动。插图显示了方向上相同的小鼠的照片。图4bi和4bii显示了对照和早期他克莫司(手术后2周开始)治疗动物中的浅表/深层淋巴系统的手术缝合后6周通过骶淋巴结对99mtc的衰变调节的摄取(*p=0.005)。图4bii的上图中显示的小鼠尾部的大体照片用于取向,并且显示了99mtc注射部位和骶淋巴结的位置;在下图中显示了代表性热图,白色箭头指向骶淋巴结。图4c显示了在plnd后4周用或不用他克莫司治疗的小鼠中的远端足注射后50分钟获得的后肢的代表性icg图像。白色箭头显示了icg的皮肤淋巴管回流。插入照片显示了方向。图4di和4dii是在plnd后4周用或不用他克莫司治疗的小鼠的后肢集合管中的淋巴管脉动的图示。右边显示了脉动频率的量化(*p=0.001)。图4e显示了plnd后4周从用对照或他克莫司治疗的动物的远端后肢收获的组织中炎性细胞(cd45+;上图)、inos+细胞(下图)和淋巴管(lyve-1+)的代表性40x荧光共定位图像。注意cd45+和inos+细胞的外淋巴积聚。图4f和4g显示了plnd后4周收获的对照或他克莫司治疗动物的远端后肢组织中外淋巴cd45+细胞(图4f)和inos+细胞(图4g)的量化。
图5a-5d显示了局部他克莫司增加淋巴损伤后的侧淋巴管形成。图5ai显示了桥接淋巴损伤后6周收获的对照和早期治疗他克莫司小鼠的手术创建尾部创伤的lyve-1管的代表性纵向免疫荧光40x图像;插图显示了获得纵向切片的区域。图5aii显示了对照对早期或晚期治疗他克莫司小鼠中尾部的创伤部分中的桥接淋巴管密度(lvd)的量化(两者都为p<0.001)。图5aiii显示了从淋巴损伤后6周收获的对照和早期治疗他克莫司小鼠尾部组织收获的rna的qpcr,证明了vegf-c(p=0.264)、tgf-β1(p=0.006)和ifn-γ(p=0.014)的相对表达。图5b是小鼠后肢的照片,显示了在plnd之前和之后引流到腹股沟淋巴结的侧支管形成的部位。图5c显示了plnd后4周在对照和他克莫司治疗动物中lyve-1+管的代表性icg(左图)和40x免疫荧光图像(右图显示了框中的区域)。图5d显示了用对照或他克莫司治疗的动物的前侧腿区中的侧支淋巴lvd的量化(p<0.001)。
图6a-6f显示了他克莫司增加炎性淋巴管生成。(a)在缝线放置和用媒介物对照或全身他克莫司治疗后2周收获的对淋巴管(lyve-1+/弱cd31+)和血管(cd31+/lyve-1-)染色的小鼠角膜的代表性大体(左图)和整装5x图像(右图)。框表示整装图像中显示的区域。图6b和6c显示了角膜淋巴管(lyve-1+)和血管(cd31+/lyve-1-)的量化。图6d显示了产生创伤后4周收获的对照或局部他克莫司治疗动物中耳创伤定位lyve-1+的代表性荧光整装5x图像。插入照片显示了获得切片的区域。图6e显示了耳皮肤中的lyve-1+染色区域的量化(在创伤的400μm内),证明了他克莫司治疗动物中的淋巴管生成的增加(p<0.001)。图6f显示了用或不用他克莫司治疗的耳创伤中每单位面积的淋巴管分支点的量化,证明了他克莫司治疗动物中增加的分支(p<0.001)。
图7显示了局部他克莫司不降低循环cd4+t细胞。在用局部他克莫司、全身性他克莫司或媒介物对照的2周治疗后显示了外周血cd4+细胞的代表性流式图(上图)及cd4+t细胞的量化(下图)。
图8显示了局部他克莫司在手术后淋巴水肿中减少巨噬细胞浸润。上图中显示了在f4/80+细胞的免疫荧光定位的情况下手术后6周收获的对照和早期局部他克莫司治疗动物的尾部组织切片的代表性40x图像。下面显示了早期和晚期治疗实验两者的量化。
图9a-9c显示了腘淋巴结清扫术模型。图9a显示了腘淋巴结,用依文斯蓝造影剂填充,在腘脂肪垫中可见。图9b显示了腘淋巴结,以及传入和传出集合器与其周围的脂肪垫一起分离。图9c显示在手术切除后在手术部位中自由溢出的依文斯蓝造影剂。
图10a-10b显示了与假对照肢相比,plnd导致增加的ros和damp。图10a显示了代表性小鼠图像(左图),显示了plnd后立即(6小时)和1周后后肢中的发光(指示ros)。发光光子的量化(右图)显示了在1周时plnd区域中,而非假对照中显著增加的ros水平。图10b显示了对hsp-70(上图)和hmgb1(下图)染色的来自假手术和plnd小鼠的后肢皮肤切片的代表性免疫荧光图像。
图11显示了局部他克莫司减少plnd后外淋巴cd4+细胞浸润。上图显示了用对照或他克莫司治疗并且在plnd后4周收获的动物中cd4+细胞和淋巴管(lyve-1+)的免疫荧光定位的代表性图像。下面显示了量化。
图12a-12b显示了局部他克莫司在plnd后减少了外淋巴f4/80+细胞浸润。图12a显示了对淋巴管(lyve-1)和巨噬细胞(f4/80)染色的他克莫司和媒介物治疗的plnd后肢皮肤组织切片的代表性免疫荧光图像。图12b显示了外淋巴f4/80+巨噬细胞的量化。
图13显示了局部他克莫司在缺乏淋巴损伤或炎症的情况下不改变集合淋巴管脉动或淋巴管生成。上图是在用对照或局部他克莫司治疗2周后在假手术小鼠(即麻醉而无切割或plnd)中后肢淋巴系统的nir淋巴图像的代表性图像。下面显示了用他克莫司治疗3或14天后集合淋巴管脉动频率的量化。
图14a-14b显示了局部他克莫司治疗在淋巴损伤后不改变血管通透性。图14a显示了在尾静脉伊文斯蓝注射后他克莫司或媒介物治疗plnd小鼠后肢的代表性大体图像以测量血管通透性。图14b显示了来自他克莫司和媒介物治疗plnd后肢组织的甲酰胺提取的伊文斯蓝的吸光度的量化。
图15a-15d显示了plnd后的局部他克莫司不改变后肢淋巴集合器的α-sma覆盖或管腔直径。图15a显示了(从左到右)小鼠后肢的侧面的亮视野图像,截面水平以黄色椭圆形显示;小鼠后肢的nir图像,显示了后肢淋巴管的解剖学,在侧面上有两个大管径管;小鼠后肢的5xif图像,黄色框指示前侧腿,其中定位两个占优势的集合淋巴管;定位有占优势的集合管的区域的20x图像(用白色箭头指示)。图15b显示了平足蛋白(podoplanin)和α-sma的双重免疫荧光染色后集合淋巴管的截面的代表性100x图像。图15c显示了管腔区域的量化。图15d显示了α-sma厚度的量化。
图16显示了局部他克莫司在缺乏损伤/炎症的情况下不增加淋巴管生成。上图显示了应用局部他克莫司或媒介物对照4周后无创伤的小鼠耳中淋巴管的免疫荧光染色的代表性5x图像。下面显示了lyve-1+染色区域的量化。
图17a-17i显示了对tgf-β的抑制改善淋巴功能并且降低腘淋巴结清扫术后的炎性细胞的外淋巴积聚。图17a显示了在plnd后4周用同种型对照或tgf-β单克隆抗体(mab)治疗的小鼠的远端后肢的近红外图像的代表性照片(上图)和集合淋巴系统中的泵送频率(下图)。注意tgf-βmab治疗描述中的后肢集合器的增加的泵送频率。还注意对照而非tgf-βmab治疗小鼠中的皮肤淋巴管回流(白色箭头)。图17b显示了对照和tgf-βmab治疗小鼠中的集合淋巴泵送(脉冲)频率的量化。图17c显示了对照和tgf-βmab治疗小鼠中的皮肤淋巴管回流的量化。图17d显示了plnd后4周来自对照和tgf-βmab治疗小鼠的远端后肢组织的代表性流式细胞术图。注意tgf-βmab治疗小鼠中cd3+cd4+细胞的减少的百分比。图17e显示了对照和tgf-βmab治疗小鼠中外淋巴(lyve-1+)炎性细胞(cd45+;顶部)和inos+(底部)细胞的代表性低和高(插图)放大率显微照片。图17f显示了对照和tgf-βmab治疗小鼠中后肢组织中cd4+细胞的流式细胞术的量化。图17g显示了对照和tgf-βmab治疗小鼠中lyve-1+管数目的量化。图17h显示了对照和tgf-βmab治疗小鼠中外淋巴cd45+细胞数目的量化。图17i显示了对照和tgf-βmab治疗小鼠中外淋巴inos+细胞数目的量化。
图18a-18g显示了全身性吡非尼酮在手术淋巴损伤后改善后肢中的淋巴功能。图18a(上图)显示了在plnd后4周在用或不用吡非尼酮治疗的小鼠中icg的远端足注射后50分钟获得的后肢的代表性nir图像。白色箭头显示了icg的皮肤淋巴管回流。插图照片是用于取向。下图显示了plnd后4周用或不用吡非尼酮治疗的小鼠的后肢集合管中的淋巴管脉动的图示。图18b在右侧显示了脉动频率(脉冲/分钟)的量化(n=6只动物/组;*p<0.05)。图18c显示了对照和吡非尼酮治疗小鼠中的皮肤淋巴管回流的量化。图18d显示了plnd后4周收获的对照或吡非尼酮治疗动物的远端后肢组织中lyve-1+管/0.25mm2面积的量化(n=6只动物/组;对于lyve-1为*p<0.001)。图18e显示了plnd后4周从用或不用吡非尼酮治疗的动物的远端后肢收获的组织中炎性细胞(cd45+;上图)、inos+细胞(下图)和淋巴管(lyve-1+)的代表性低和高(插图)放大率荧光共定位图像,比例尺=100μm。在每个图的右下角插图中显示了更高放大率(80x)图像,比例尺=20μm。注意cd45+和inos+细胞的外淋巴积聚。图18f显示了对照和吡非尼酮治疗小鼠中的外淋巴cd45+细胞的量化。图18g显示了对照和吡非尼酮治疗小鼠中的外淋巴inos+细胞/hpf的量化。
图19a-19i显示了全身性和局部吡非尼酮减少小鼠尾部淋巴水肿和炎症。图19a显示了用吡非尼酮或媒介物对照的全身性和局部治疗后小鼠尾部的代表性照片。在尾部淋巴损伤后7周开始治疗。注意吡非尼酮治疗小鼠中的明显改善。图19b显示了对照、局部吡非尼酮和全身性吡非尼酮治疗小鼠中小鼠尾部体积的量化。注意吡非尼酮治疗小鼠中的显著降低(箭头显示了在开始吡非尼酮治疗时)。图19c显示了对照和吡非尼酮治疗小鼠中纤维脂肪组织沉积的量化。图19d显示了对照和吡非尼酮治疗小鼠中i型胶原沉积的量化。图19e显示了用对照或吡非尼酮(全身性或局部)治疗的小鼠尾部的代表性截面显微照片。图19f显示了对i型胶原和淋巴管(lyve-1)染色的尾部截面的代表性高放大率显微照片。注意吡非尼酮治疗小鼠中减少的i型胶原沉积。图19g显示了硫胶体缀合的99tc的远端尾部注射后99tc的峰结节摄取。注意吡非尼酮治疗小鼠中骶淋巴结的增加的摄取。图19h显示了远端尾部注射后99tc的淋巴结摄取速率。注意吡非尼酮治疗小鼠中较快速的摄取。图19i显示了对白细胞(cd45+)和淋巴管(lyve-1)染色的尾部截面的代表性高放大率显微照片。注意吡非尼酮治疗小鼠中减少的外淋巴cd45+细胞积聚。
图20a-20k显示了吡非尼酮减少外淋巴炎症和tgf-β表达。图20a显示了后肢切片的代表性显微照片,证明了对照和吡非尼酮治疗动物中cd4+细胞的外淋巴积聚(左图中显示了全身性治疗;右图中显示了局部治疗)。插图中显示了高放大率图像。图20b显示了后肢切片的代表性显微照片,证明了对照和吡非尼酮治疗动物中tgf-β1+细胞的外淋巴积聚(左图中显示了全身性治疗;右图中显示了局部治疗)。图20c显示了后肢切片的代表性显微照片,证明了对照和吡非尼酮治疗动物中smad3+细胞的外淋巴积聚(左图中显示了全身性治疗;右图中显示了局部治疗)。图20d显示了对照和吡非尼酮治疗小鼠中外淋巴cd4+细胞的量化。图20e显示了对照和吡非尼酮治疗小鼠中外淋巴tgf-β1+细胞的量化。图20f显示了对照和吡非尼酮治疗小鼠中外淋巴smad3+细胞的量化。图20g显示了对平足蛋白、α-sma和i型胶原染色的来自对照和吡非尼酮治疗小鼠的后肢集合管的高放大率的显微照片。注意对照小鼠中的增厚和α-sma+细胞的增殖。图20h显示了对照和吡非尼酮治疗小鼠中的集合淋巴系统周围的i型胶原沉积的量化。图20i显示了对照和全身性吡非尼酮治疗小鼠中血清tgf-β1表达。图20j显示了对照和全身性吡非尼酮治疗小鼠中血清ifn-γ表达。图20k显示了对照和全身性吡非尼酮治疗小鼠中血清vegf-c表达。
图21a-21f显示了t细胞而非髓样细胞tgf-β表达的丧失防止淋巴损伤后的淋巴水肿的发展。图21a显示了尾部淋巴损伤后6周从对照、t细胞cre和髓样cre动物收获的尾部组织中tgf-β1mrna的相对表达。图21b显示了对照、髓样tgf-β1cre和t细胞-tgf-β1cre小鼠的代表性显微照片。注意t细胞cre小鼠中缺乏肿胀。图21c显示了各组中小鼠尾部体积的量化。注意与野生型对照相比t细胞cre小鼠中降低的尾部体积。图21d显示了各组中对h&e(顶部)、i型胶原/lyve-1(中间)染色的尾部截面的代表性显微照片和纤维脂肪组织沉积和i型胶原表达的量化(下部)。注意t细胞cre小鼠中减少的纤维脂肪组织沉积。图21e显示了远端尾部中注射的99tc的峰结节摄取。注意t细胞cre小鼠中增加的摄取。图21f显示了各组中99tc的骶结节摄取速率。注意t细胞cre小鼠中较快速的摄取。
图22a-22g显示了缺乏表达tgf-β1的t细胞的小鼠已经降低外淋巴炎症和tgf-β1表达。图22a显示了对cd4+细胞(顶部)、il13+细胞(中间)、psmad3+细胞(底部)和淋巴管(lyve-1+)染色的来自各组的小鼠后肢的代表性显微照片。注意t细胞cre小鼠中减少的cd4+细胞积聚、减少的il13+细胞数目和减少的psmad3+细胞数目。图22b显示了各组中的动物的后肢组织中的cd4+细胞的量化。图22c显示了各组中的动物的后肢组织中的th2细胞(cd4+/il13+)的量化。图22d显示了各组中的动物的后肢组织中的psmad3+细胞的量化。图22e-22g显示了来自对照、髓样cre和t细胞cre小鼠的ifn-γ(图22e)、tgf-β1(图22f)和vegf-c(图22g)蛋白质浓度的血清水平。
图23a-23h显示了受损的lectgf-β1响应性没有尾部淋巴水肿、炎症或纤维化的变化,但是改善了淋巴管生成。图23a显示了在psmad+和lyve-1的免疫荧光共定位的情况下从对照和flt4cre小鼠收获的淋巴结切片的代表性高放大率(80x)图像,比例尺=10μm。箭头指示lyve-1+管中psmad3的共定位。图23b显示了手术后6周对照和flt4cre小鼠中尾部tgf-β1蛋白浓度的量化(n=5只动物/组;两组都为p=ns)。图23c显示了手术后6周手术切除浅表/深层集合淋巴系统后对照和flt4cre小鼠尾部的代表性照片。图23d显示了与对照相比flt4cre小鼠尾部的尾部体积变化的图示(n=5只动物/组;p=ns)。图23e显示了对照和flt4cre小鼠的软组织变化的量化(n=5只动物/组;p=ns)。图23f显示了胶原i染色区的量化(n=5只动物/组;p=ns)。图23g(上图)显示了淋巴消融后6周收获的对照和flt4cre小鼠尾部的代表性截面组织学图像。括号指示软组织厚度。比例尺=500μm。图23g(中间图)显示了在i型胶原和淋巴管的免疫荧光共定位的情况下在手术后6周从对照和flt4cre动物收获的尾部组织的代表性40x图像。图23g(下图)显示了psmad3和淋巴管的定位。比例尺=100μm。图23h显示了在lyve-1的免疫荧光定位的情况下在手术后6周从对照和flt4cre小鼠的尾部创伤收获的纵向尾部组织切片的代表性较高放大率(60x)图像,比例尺=50μm。对照和flt4cre小鼠的桥接lyve-1+管密度(lvd)(n/0.25mm2面积)的量化(n=5只动物/组;*p<0.01)。
图24a-24d显示了特立氟胺减少淋巴水肿。图24a显示了淋巴消融后6周用媒介物(对照)或局部特立氟胺治疗的小鼠尾部的大体显微照片。图24b显示了用媒介物或局部特立氟胺治疗的动物中淋巴消融后6周的尾部体积变化((*p<0.0002)。图24c显示了在对照和特立氟胺治疗小鼠中淋巴损伤区域远端1cm收获的小鼠尾部的组织学截面。括号显示了纤维脂肪组织沉积的区域。图24d显示了用媒介物对照或局部特立氟胺治疗的小鼠的尾部截面中的纤维脂肪组织沉积的量化(*p<0.0001)。
图25a-25d显示了特立氟胺减少纤维化。图25a显示了来自对照和特立氟胺治疗小鼠的小鼠尾部截面的代表性显微照片,定位i型胶原纤维和皮肤淋巴系统。注意特立氟胺治疗小鼠中明显降低纤维化。图25b显示了用媒介物对照或局部特立氟胺治疗的小鼠尾部中的i型胶原沉积的量化(*p<0.001)。图25c显示了用对照或特立氟胺治疗的动物中主要后肢集合管的代表性显微照片,定位α-sma和平足蛋白。注意特立氟胺治疗小鼠中α-sma阳性细胞的减少的增殖和集合淋巴系统的较宽的腔。图25d显示了plnd后在对照和特立氟胺治疗小鼠中外淋巴平滑肌厚度的量化(*p<0.05)。
图26a-26b显示了特立氟胺减少炎症。图26a显示了来自对照和特立氟胺治疗小鼠的小鼠尾部截面的代表性显微照片,定位cd4+细胞和皮肤淋巴系统。特立氟胺治疗动物中存在有cd4+细胞浸润的明显减少。框插入显示了高放大率视图(80x)。图26b显示了用媒介物对照或局部特立氟胺治疗的小鼠尾部中cd4+细胞的量化(*p<0.0001)。
图27a-27d显示了特立氟胺增加淋巴管生成。图27a显示了用媒介物对照或特立氟胺治疗的动物中小鼠后肢淋巴系统和侧支管形成(白色圆圈)的近红外成像的代表性显微照片。新形成的侧支淋巴系统在特立氟胺治疗小鼠中绕过腘淋巴结。图27b显示了在plnd后并且用媒介物对照或特立氟胺治疗的动物中的侧支淋巴形成的量化(*p<0.001)。图27c显示了用媒介物对照或局部特立氟胺治疗的小鼠中的尾部创伤的代表性显微照片,定位新形成的横断淋巴管。特立氟胺治疗小鼠中有明显的淋巴管生成增加。图27d显示了淋巴消融后6周的对照和特立氟胺治疗动物的小鼠尾部创伤中的侧支淋巴系统的量化(*p<0.001)。
图28显示了局部特立氟胺减少淋巴泄漏。plnd后用媒介物对照或特立氟胺治疗的小鼠的后肢中淋巴管的代表性近红外图像。注意特立氟胺治疗小鼠中淋巴管(箭头)的减少的泄漏。
图29a-29b显示了局部特立氟胺增加淋巴功能。图29a显示了plnd后用媒介物对照或特立氟胺治疗的小鼠的腹股沟淋巴结中运输的树突细胞(dc)的代表性流式细胞术图。在远端后肢中用fitc的局部制剂治疗小鼠以标记组织驻留dc,并且在24小时后,收获腹股沟淋巴结,并且使用流式细胞术分析以量化已经从外周转运的dc的数目。dc运输中的明显增加指示特立氟胺治疗动物中改善的淋巴功能。图29b显示了对照和特立氟胺治疗动物中dc运输的量化(n=6;*p<0.0001)。
图30a-30b显示了局部特立氟胺增加淋巴泵送。图30a显示了plnd后对照和特立氟胺治疗小鼠中后肢集合淋巴泵送的图。图30b显示了plnd后对照和特立氟胺治疗小鼠中后肢集合淋巴泵送频率的量化。注意特立氟胺治疗动物中泵送的显著增加(*p<0.002)。
图31a-31b显示了卡托普利治疗增加淋巴损伤后树突细胞的运输。图31a显示了来自腹股沟淋巴结的代表性流式细胞术,证明了plnd后对照和卡托普利治疗小鼠中的fitc+cd11c细胞。图31b显示了plnd后对照和卡托普利治疗小鼠的腹股沟淋巴结中fitc+cd11c细胞的百分比(左边)和绝对数目(右边)。
图32a-32b显示了卡托普利治疗增加后肢集合淋巴泵送。图32a显示了集合淋巴泵送的代表性图,如通过plnd后对照和卡托普利治疗小鼠中的icg淋巴管造影术评估。图32b显示了后肢集合淋巴系统的包频率(泵送)的量化。
图33a-33c显示了卡托普利治疗减少plnd后的t细胞浸润。显示了对cd3+(t细胞标志物)和lyve-1(淋巴标志物)染色的对照(图33a)和卡托普利治疗(图33b)小鼠后肢切片的代表性高放大率显微照片。用dapi显示核复染色。图33c显示了对照和卡托普利治疗小鼠的后肢组织中的cd3+细胞的量化。
图34a-34c显示了卡托普利治疗减少plnd后的巨噬细胞浸润。显示了对f4/80+(巨噬细胞标志物)和lyve-1(淋巴标志物)染色的对照(图34a)和卡托普利治疗(图34b)小鼠后肢切片的代表性高放大率显微照片。用dapi显示核复染色。图34c显示了对照和卡托普利治疗小鼠的后肢组织中的f4/80+细胞的量化。
图35a-35d显示了卡托普利治疗增加plnd后的淋巴管生成。显示了对lyve-1(淋巴标志物)染色的对照(图35a)和卡托普利治疗(图35b)小鼠后肢切片的代表性高放大率显微照片。用dapi显示核复染色。图35c显示了对照和卡托普利治疗小鼠中lyve-1+管的量化(*p<0.05)。
图36显示了卡托普利治疗减少用dt的后肢淋巴消减后的足肿胀。在dt淋巴消减后各个时间时对照(顶部)和卡托普利治疗(底部)组中小鼠足的代表性照片。注意卡托普利治疗小鼠中足肿胀的明显降低。
图37a-37c显示了卡托普利治疗在用dt的后肢淋巴消减后减少t细胞浸润。对cd3+(t细胞标志物)和lyve-1(淋巴标志物)染色的对照(图37a)和卡托普利治疗(图37b)小鼠后肢切片的代表性高放大率显微照片。从用dt治疗的肢收获同侧组织,而对侧组织来自相反的未治疗肢。用dapi显示核复染色。图37c显示了对照和卡托普利治疗小鼠的后肢组织中cd3+细胞的量化。注意同侧对照和同侧卡托普利肢之间的显著差异(*p<0.05)。
图38a-38c显示了卡托普利治疗减少用dt的淋巴消融后的后肢巨噬细胞浸润。显示了对f4/80(巨噬细胞标志物)和lyve-1(淋巴标志物)染色的对照(图38a)和卡托普利治疗(图38b)小鼠后肢切片的代表性高放大率显微照片。用dapi显示核复染色。图38c显示了对照和卡托普利治疗小鼠的后肢组织中f4/80+细胞的量化。注意同侧对照和同侧卡托普利肢之间的显著差异(*p<0.005)。
图39a-39c显示了卡托普利治疗减少dt的淋巴消融后后肢集合管平滑肌沉积。对α平滑肌肌动蛋白(α-sma)(平滑肌标志物)和平足蛋白(淋巴标志物)染色的对照(图39a)和卡托普利治疗(图39b)小鼠后肢切片的代表性高放大率显微照片。用dapi显示核复染色。图39c显示了对照和卡托普利治疗小鼠的后肢组织中α-sma+细胞的量化。注意同侧对照和同侧卡托普利肢之间的显著差异(*p<0.005)。
图40a-40c显示了卡托普利治疗减少用dt的淋巴消减后后肢i型胶原沉积。显示了对i型胶原(纤维化标志物)和lyve-1(淋巴标志物)染色的对照(图40a)和卡托普利治疗(图40b)小鼠后肢切片的代表性高放大率显微照片。用dapi显示核复染色。图40c显示了对照和卡托普利治疗小鼠的后肢组织中的i型胶原的量化。注意同侧对照和同侧卡托普利肢之间的显著差异(*p<0.0001)。
图41a-41c显示了卡托普利治疗减少用dt的淋巴消融后后肢血管紧张肽转化酶(ace)表达。对ace和lyve-1(淋巴标志物)染色的对照(图41a)和卡托普利治疗(图41b)小鼠后肢切片的代表性高放大率显微照片。用dapi显示核复染色。图41c显示了对照和卡托普利治疗小鼠的后肢组织中ace的量化。注意同侧对照和同侧卡托普利肢之间的显著差异(*p<0.0001)。
图42显示了卡托普利治疗增加用dt的后肢淋巴消融后侧支淋巴系统的形成。显示了对照(左图)、卡托普利(中间)和正常淋巴构造(即无dt治疗)后肢的代表性icg照片。点圆圈代表形成侧支淋巴系统以引流到腹股沟淋巴结中的区域。
图43a-43d显示了卡托普利治疗减少用dt的淋巴消融后后肢淋巴管生成。对lyve-1(淋巴标志物)染色的对照(图43a)和卡托普利治疗(图43b)小鼠后肢切片的代表性高放大率显微照片。用dapi显示核复染色。图43c显示了对照和卡托普利治疗小鼠的后肢组织中lyve-1+淋巴管的量化。注意同侧对照和同侧卡托普利肢之间的显著差异(*p<0.0001)。图43d显示了对照和卡托普利治疗小鼠的后肢组织中lyve-1+淋巴管面积的量化。注意同侧对照和同侧卡托普利肢之间的显著降低(*p<0.005)。
图44显示了卡托普利治疗减少用dt的后肢淋巴消融后的肢体积。在用dt的淋巴消融后对照和卡托普利治疗小鼠中后肢体积的量化。注意卡托普利治疗小鼠中的明显减少(*p<0.007)。
图45a-45b显示了卡托普利治疗在淋巴消融后6周减少小鼠尾部淋巴水肿。图45a显示了手术前和每周,在淋巴消融和用媒介物对照或卡托普利治疗后小鼠尾部的代表性照片。箭头指示治疗开始的时机。图45b显示了对照和卡托普利治疗小鼠中的小鼠尾部体积变化的量化。
图46a-46b显示了卡托普利治疗在淋巴消融后6周减少淋巴水肿的小鼠尾部模型中的纤维脂肪组织沉积。图46a显示了在淋巴消融后6周并且用对照(左边)或卡托普利局部治疗的代表性h&e染色小鼠尾部截面。括号表示纤维脂肪组织沉积。图46b显示了在尾部淋巴消融后6周用对照或卡托普利局部治疗的小鼠中的皮下纤维脂肪沉积的量化。注意卡托普利治疗小鼠中的显著降低(*p<0.0001)。
图47a-47c显示了卡托普利治疗增加淋巴消融后6周的小鼠尾部集合管泵送频率。显示了用对照(图47a)或卡托普利软膏剂(图47b)局部治疗6周的小鼠尾部的吲哚菁绿分析(顶部)的代表性照片。在照片下显示了代表集合淋巴收缩的线图。注意卡托普利治疗动物中的增加的收缩数目。图47c显示了对照和卡托普利治疗动物中小鼠尾部集合淋巴系统的收缩频率的量化。注意卡托普利治疗小鼠的增加频率(*p<0.01)。
图48a-48c显示了卡托普利治疗在淋巴消融后6周增加淋巴水肿的小鼠尾部模型中尾部创伤区域间的淋巴管数目。显示了对lyve-1(淋巴标志物)染色的对照(图48a)和卡托普利(图48b)治疗动物中的小鼠尾部的代表性纵向切片。图48c显示了尾部淋巴消融后6周对照和卡托普利治疗动物中lyve-1+管密度的量化。
图49a-49c显示了卡托普利治疗减少淋巴管面积,并且与淋巴消融后6周在淋巴水肿的小鼠尾部模型中减少的淋巴淤滞相关联。显示了对lyve-1(淋巴标志物)染色的对照(图49a)和卡托普利(图49b)治疗动物中的小鼠尾部的代表性截面。注意卡托普利治疗小鼠中减少的淋巴管直径。图49c显示了对照和卡托普利小鼠中的lyve-1+管面积的量化。注意与减少的淋巴淤滞对应的淋巴管面积的显著减少。
图50a-50c显示了卡托普利治疗在淋巴消融后6周减少淋巴水肿的小鼠尾部模型中的皮肤纤维化和i型胶原沉积。显示了对i型胶原、lyve-1和dapi染色的对照(图50a)和卡托普利(图50b)治疗动物的小鼠尾部的代表性截面。注意卡托普利治疗动物中的减少的纤维化。图50c显示了对照和卡托普利治疗小鼠中小鼠尾部皮肤i型胶原染色面积的量化。注意卡托普利治疗动物中的显著减少(*p<0.0001)。
图51a-51c显示了卡托普利治疗减少淋巴消融后6周的淋巴水肿的小鼠尾部模型中的血管紧张肽转化酶(ace)表达。显示了对ace、lyve-1和dapi染色的对照(图51a)和卡托普利(图51b)治疗动物的小鼠尾部的代表性截面。注意卡托普利治疗动物中的减少的ace表达。图51c显示了对照和卡托普利治疗小鼠中小鼠尾部ace染色面积的量化。注意卡托普利治疗动物中的显著减少(*p<0.0001)。
图52a-52c显示了卡托普利治疗减少淋巴消融后6周的淋巴水肿的小鼠尾部模型中的t细胞(cd3+)的外淋巴积聚。显示了对cd3、lyve-1和dapi染色的对照(图52a)和卡托普利(图52b)治疗动物的小鼠尾部的代表性截面。注意卡托普利治疗动物中的减少的ace表达。图52c显示了对照和卡托普利治疗小鼠中小鼠尾部外淋巴cd3+细胞/管的量化。注意卡托普利治疗动物中的显著减少(*p<0.0001)。
图53a-53c显示了卡托普利治疗减少淋巴消融后6周的淋巴水肿的小鼠尾部模型中的巨噬细胞(f4/80+细胞)的外淋巴积聚。显示了对f4/80、lyve-1和dapi染色的对照(图53a)和卡托普利(图53b)治疗动物的小鼠尾部的代表性截面。注意卡托普利治疗动物中的减少的ace表达。图53c显示了对照和卡托普利治疗小鼠中小鼠尾部外淋巴f4/80细胞/管的量化。注意卡托普利治疗动物中的显著减少(*p<0.0001)。
发明详述
本发明部分涉及抗-t细胞剂和/或抗tgf-β1剂和/或抗血管紧张肽剂作为用于水肿,特别是淋巴水肿的新颖、安全和有效的治疗的用途。本发明部分地基于惊人的发现,即全身或局部施用抗t细胞、抗tgf-β1和/或抗血管紧张肽剂,例如他克莫司、吡非尼酮、特立氟胺、来氟米特和/或卡托普利,显著改善了淋巴水肿和淋巴功能,并且当对哺乳动物受试者施用时,具有各种其它有益的生物学效应,包括刺激淋巴管生成。此外,由于这些试剂在纤维化途径的不同步骤中起作用,抗t细胞、抗tgf-β1和/或抗血管紧张肽剂的组合可以比施用单一试剂更有效,潜在地表现出协同效应。
因此,本发明提供用于治疗或预防水肿,例如淋巴水肿,和/或用于产生各种其它有益的生物学效应的组合物和方法,所述生物学效应包括但不限于:减少组织肿胀、减少淋巴液淤滞或“汇集”、减少组织纤维化、减少组织炎症、减少白细胞浸润、减少巨噬细胞浸润、减少初始和分化的t细胞的浸润、减少tgf-β1表达和降低下游介质(例如psmad3)的表达和/或活化、降低的血管紧张肽和/或ace水平、减少胶原沉积和/或瘢痕形成、改善或增加淋巴功能、改善或增加淋巴液转运、改善或增加淋巴管生成和/或改善或增加淋巴脉动频率。
除非另有定义,本文使用的所有技术和科学术语具有与本发明相关的本领域普通技术人员通常理解的相同的含义。例如,thedictionaryofcellandmolecularbiology(第5版j.m.lackie编,2013),oxforddictionaryofbiochemistryandmolecularbiology(第2版r.cammack等人编,2008),和theconcisedictionaryofbiomedicineandmolecularbiology(第2版p-s.juo,2002)可以为技术人员提供本文使用的一些术语的一般定义。
如本说明书和所附权利要求术中所使用,单数形式“一个”、“一种”和“所述”包括复数指示物,除非上下文另有明确规定。术语“一个”(或“一种”)以及术语“一个或多个”和“至少一个”可以互换使用。
此外,“和/或”将被视为明确公开两个规定特征或组分中每个,与或不与另一个一起。因此,在诸如“a和/或b”短语中使用的术语“和/或”旨在包括a和b、a或b、a(单独)和b(单独)。同样,如短语如“a、b和/或c”中使用的术语“和/或”旨在包括a、b和c;a、b或c;a或b;a或c;b或c;a和b;a和c;b和c;a(单独);b(单独);和c(单独)。
单位、前缀和符号以其系统国际单位制(si)接受形式表示。数字范围包括定义范围的数字。在数字术语前面有“约”的情况下,该术语包括所述数字和所述数字的值±10%。本文提供的标题不是本发明的各个方面或实施方案的限制,其可以通过参考整个说明书进行描述。因此,下文中定义的术语通过参考整个说明书来更全面地定义。
无论何处使用“包括”语言描述实施方案,包括按照“由…组成”和/或“基本上由...组成”所描述的其它方面类似的实施方案。
如本文中所用,术语“水肿”包括淋巴水肿、淋巴功能障碍、淋巴组织纤维化、特发性水肿、外周水肿和眼水肿。如本文中所用,“水肿”不包括肺水肿或脑水肿。水肿可包括急性水肿、慢性水肿、手术后水肿和逐渐发作性水肿。水肿症状可以包括肿胀、饱胀或组织浮肿、炎症、纤维化、沉重、疼痛、运动范围减少、酸痛、复发性感染、皮肤增厚或不适。
“活性剂”是其本身具有生物活性或作为体内转化成具有生物活性的药剂的前体或前药的药剂。用于治疗或预防水肿的活性剂可包括免疫抑制剂、抗纤维化剂、抗t细胞剂、抗tgf-β1剂和抗血管紧张肽剂。在一些实施方案中,药剂是小分子化合物。在其它实施方案中,药剂是大分子,如多核苷酸(例如抑制性rna)或多肽(例如抗体)。
“抗t细胞剂”是减少t细胞介导的炎症、t细胞活化、t细胞分化和/或t细胞增殖的分子。抗t细胞剂的类别包括钙调神经磷酸酶抑制剂和il-2抑制剂。小分子抗t细胞剂的实例包括他克莫司、特立氟胺、来氟米特、环孢霉素和吡美莫司。大分子抗t细胞剂的实例包括地尼白介素2(denileukindiftitox)和巴利昔单抗(basiliximab)。
“抗tgf-β1剂”是抑制转化生长因子β1的表达、分泌、激活、信号传导或活性的分子。吡非尼酮是小分子抗tgf-β1剂的实例。
“抗血管紧张肽剂”是抑制angi或angii的活性的分子,或抑制angi至angii转化的分子(例如ace抑制剂或ace激动剂)。抗血管紧张肽剂的实例包括卡托普利、佐芬普利、依那普利、赖诺普利、雷米普利、喹那普利、培哚普利、贝那普利、咪达普利、群多普利、西拉普利、福辛普利、氯沙坦、厄贝沙坦、奥美沙坦、坎地沙坦、替米沙坦、缬沙坦、非马沙坦、乙酰甘氨酸重氮氨苯脒(diminazeneaceturate)、呫吨酮和ave099。
术语“抑制”、“阻断”和“抑制”可互换使用,并且指生物活性的任何统计学显著降低,包括完全阻断活性。
一方面,本发明的方法可以包括施用抗t细胞、抗tgf-β1和/或抗血管紧张肽剂的组合。在一个具体实施方案中,所述方法包括施用本发明的药物组合物,其包含:(i)有效量的一种或多种抗t细胞剂,其选自由以下组成的组:他克莫司、特立氟胺、来氟米特、环孢霉素、吡美莫司、地尼白介素2和巴利昔单抗;和(ii)有效量的一种或多种抗tgf-β1剂和/或一种或多种抗血管紧张肽剂,其选自由以下组成的组:吡非尼酮、卡托普利、佐芬普利、依那普利、赖诺普利、雷米普利、喹那普利、培哚普利、贝那普利、咪达普利、群多普利、西拉普利和福辛普利、氯沙坦、厄贝沙坦、奥美沙坦、坎地沙坦、替米沙坦、缬沙坦和非马沙坦。本发明的方法可以包括施用本发明的药用化合物,其包含抗t细胞、抗tgf-β1和/或抗血管紧张肽剂的任何组合。例如,在一个实施方案中,方法包括施用药物组合物,其包含他克莫司和吡非尼酮。在另一个实施方案中,方法包括施用药物组合物,其包含他克莫司、吡非尼酮和特立氟胺。在另一个实施方案中,方法包括施用药物组合物,其包含他克莫司、吡非尼酮和来氟米特。在其它方面,方法包括施用药物组合物,其包含他克莫司和卡托普利;或特立氟胺和卡托普利;或来氟米特和卡托普利;或吡非尼酮和卡托普利;或他克莫司、卡托普利和特立氟胺;或他克莫司、卡托普利和来氟米特;或他克莫司、卡托普利和吡非尼酮。
“受试者”或“个体”或“患者”是指需要诊断、预后或治疗的任何受试者,优选哺乳动物受试者。哺乳动物受试者包括人类、家畜、农场动物、运动动物和动物园动物,包括例如人类、非人灵长类动物、狗、猫、豚鼠、兔、大鼠、小鼠、马、牛等。
在一些实施方案中,受试者可以具有或可以已经具有癌症,例如包含实体瘤的癌症。在一些实施方案中,受试者可以具有或可以已经具有乳腺癌或影响女性生殖器官、皮肤系统、肌肉骨骼系统、四肢或躯干的软组织、男性生殖系统、泌尿系统或头颈部的癌症。在一些实施方案中,受试者可以已经经历了腋淋巴结切除。在一些实施方案中,受试者已经接受了癌症治疗,并且水肿、淋巴水肿或淋巴损伤与癌症治疗或诊断相关。例如,受试者可以正在接受或可以已经接受用于癌症治疗或其它适应症的化学疗法或放射疗法,或者可以在癌症治疗或诊断过程中手术切除了一个或多个淋巴结。
在一些实施方案中,受试者可以具有持续性淋巴损伤(例如作为淋巴结或淋巴管的移除、结扎或阻塞或淋巴组织的纤维化的结果),或者受试者可以是肥胖的或具有或已经具有导致水肿,如淋巴水肿的感染。在一些实施方案中,感染可以是与淋巴水肿或淋巴损伤相关的皮肤感染或皮肤感染史。在一些实施方案中,感染可以是妨碍淋巴流动或损伤淋巴系统的寄生性感染。在一些实施方案中,受试者可以具有来自关节置换、创伤、烧伤、放射或化学疗法的持续性淋巴损伤。
术语诸如“治疗”或“处理”或“减轻”或“缓解”是指治愈、减缓诊断的病理状况或病症、减轻诊断的病理状况或病症的症状和/或停止诊断的病理状况或病症的进展的治疗措施。因此,需要治疗的患者包括已经患有该病症的那些患者。在某些实施方案中,如果患者显示例如全部、部分或短暂缓解或消除与疾病或病症相关的症状,则受试者根据本文提供的方法成功地“治疗”疾病或病症。例如,“治疗水肿”可以包括但不限于减少肿胀、减少炎症、减少纤维化、减少疼痛、增加运动范围、减轻沉重、降低紧密度、减少皮肤增厚和/或改善淋巴功能。
“预防”是指预防和/或减缓靶向病理状况或病症发展的防范或预防措施。因此,需要预防的人包括那些有风险发展或易于发展病症的人。有风险发展或易于发展淋巴水肿的受试者包括但不限于进行放射疗法、化学疗法和/或手术淋巴结清除的癌症患者。在某些实施方案中,如果患者比尚未进行本发明的方法的患者短暂地或永久地发展,例如更少或不太严重的与疾病或病症相关的症状或更晚的与疾病或病症相关的症状的发作,则根据本文提供的方法,成功预防疾病或病症。
在预防性背景下,本发明的药物组合物可以在使受试者有淋巴损伤和/或发展水肿的风险或易于淋巴损伤和/或发展水肿的事件,例如放射疗法、化学疗法或手术淋巴结清除之前或之后的任何时间施用。在某些方面,在事件之前直至约一周,如事件之前1、2、3、4、5、6或7天预防性施用药物组合物。在一些情况下,与事件在同一天预防性施用药物组合物。在一些实施方案中,在事件的6周内,例如在事件的约1、2、3、4、5或6天内,或在约1、2、3、4、5或6周之内预防性施用药物组合物。在一个实施方案中,预防性施用药物组合物达约2-4周或约1、2、3、4、5或6周。
在一些实施方案中,本文所述的治疗和/或预防方法可以与本领域已知的一种或多种另外的水肿或淋巴水肿治疗和/或预防方法组合进行,例如涉及施用其它治疗剂的治疗方法和/或涉及手术、按摩、压迫疗法、排液疗法、针灸、激光的治疗方法或任何其它合适的治疗方法。
术语“药物组合物”是指处于使得允许活性成分的生物活性有效的形式,并且不含对接受组合物施用的受试者有无法接受的毒性的另外的组分的制剂。药物组合物可以是多种剂型,例如片剂、胶囊、液体、溶液、软胶囊、悬浮液、乳剂、糖浆剂、酏剂、酊剂、薄膜、粉末、水凝胶、软膏剂、糊剂、乳液、洗剂、凝胶、摩丝、泡沫、漆、喷雾、气溶胶、吸入器、雾化器、滴眼剂、贴剂、栓剂和/或灌肠剂。药物组合物通常包含药学上可接受的载体,并且可以包含下列一种或多种:缓冲液(例如乙酸盐、磷酸盐或柠檬酸盐缓冲液)、表面活性剂(例如聚山梨醇酯)、稳定剂(例如人白蛋白)、防腐剂(例如苄醇)、渗透促进剂、增强生物利用度的吸收促进剂和/或其它常规的增溶剂或分散剂。剂型和赋形剂的选择取决于待递送的活性剂和待治疗或预防的疾病或病症,并且对于本领域普通技术人员是常规的。
“全身性施用”是指施用药物组合物,使得活性剂进入循环系统,例如通过肠、肠胃外、吸入或经皮途径。肠施用途径涉及胃肠道,包括但不限于口服、舌下、含服和直肠递送。肠胃外施用途径涉及除胃肠道之外的途径,包括但不限于静脉内、肌内、腹膜内、鞘内和皮下。“局部施用”是指药物组合物直接施用于需要其作用的地方(例如,或损伤或症状处或附近)。局部施用途径包括但不限于局部、吸入、皮下、眼和耳。配制适合其预定施用途径的药物组合物在本领域普通技术人员的范围内。
如本文中公开的组合物的“有效量”是足以实施明确叙述目的的量。关于所述目的、施用途径和剂型,可以根据经验和常规方式确定“有效量”。
在一些实施方案中,施用抗t细胞剂和/或抗tgf-β1剂和/或抗血管紧张肽剂可以包括以任何合适剂量和/或根据任何合适的给药方案的全身性施用,如本领域技术人员所确定的。例如,在一些实施方案中,以约0.01mg/kg至约5mg/kg的日剂量对受试者全身性施用他克莫司或其类似物、变体或衍生物。更具体地,可以以约0.01、0.015、0.02、0.025、0.03、0.035、0.04、0.045、0.05、0.055、0.06、0.065、0.07、0.075、0.08、0.085、0.09、0.095、0.1、0.2、0.3、0.4、0.5、0.6、0.7、0.8、0.9、1.0、1.1、1.2、1.3、1.4、1.5、1.6、1.7、1.8、1.9、2.0、2.25、2.5、2.75、3.0、3.25、3.5、3.75、4.0、4.25、4.5、4.75或5.0mg/kg的日剂量对受试者施用他克莫司或其类似物、变体或衍生物。
在一些实施方案中,以约0.1mg/kg至约5mg/kg的日剂量对受试者全身性施用特立氟胺或其类似物、变体或衍生物。更具体地,可以以约0.1、0.2、0.3、0.4、0.5、0.6、0.7、0.8、0.9、1.0、1.1、1.2、1.3、1.4、1.5、1.6、1.7、1.8、1.9、2.0、2.25、2.5、2.75、3.0、3.25、3.5、3.75、4.0、4.25、4.5、4.75或5.0mg/kg的日剂量对受试者施用特立氟胺或其类似物、变体或衍生物。
在一些实施方案中,以约0.1mg/kg至约5mg/kg的日剂量对受试者全身性施用来氟米特或其类似物、变体或衍生物。更具体地,可以以约0.1、0.2、0.3、0.4、0.5、0.6、0.7、0.8、0.9、1.0、1.1、1.2、1.3、1.4、1.5、1.6、1.7、1.8、1.9、2.0、2.25、2.5、2.75、3.0、3.25、3.5、3.75、4.0、4.25、4.5、4.75或5.0mg/kg的日剂量对受试者施用来氟米特或其类似物、变体或衍生物。
在一些实施方案中,以约50mg/kg至约2500mg/kg的日剂量对受试者全身性施用吡非尼酮或其类似物、变体或衍生物。更具体地,可以以约50、55、60、65、70、75、80、85、90、95、100、110、120、130、140、150、160、170、180、190、200、220、240、260、280、300、325、350、375、400、450、500、550、600、650、700、750、800、850、900、950、1000、1100、1200、1300、1400、1500、1600、1700、1800、1900、2000、2100、2200、2300、2400或2500mg/kg的日剂量对受试者施用吡非尼酮或其类似物、变体或衍生物。
在一些实施方案中,以约0.1mg/kg至约10mg/kg的日剂量对受试者全身性施用卡托普利或其类似物、变体或衍生物。更具体地,可以以约0.1、0.2、0.3、0.4、0.5、0.6、0.7、0.8、0.9、1.0、1.1、1.2、1.3、1.4、1.5、1.6、1.7、1.8、1.9、2.0、2.25、2.5、2.75、3.0、3.25、3.5、3.75、4.0、4.25、4.5、4.75、5.0、5.5、6.0、6.5、7.0、7.5、8.0、8.5、9.0、9.5或10mg/kg的日剂量对受试者施用卡托普利或其类似物、变体或衍生物。
在一些实施方案中,抗t细胞剂和/或抗tgf-β1剂和/或抗血管紧张肽剂的施用可以包括以任何合适的剂量和/或根据任何合适的给药方案的局部施用,如由本领域技术人员确定。例如,在一些实施方案中,以包含约0.01mg/ml至约5mg/ml、或约0.1mg/ml至2mg/ml、或约0.01、0.015、0.02、0.025、0.03、0.035、0.04、0.045、0.05、0.055、0.06、0.065、0.07、0.075、0.08、0.085、0.09、0.095、0.1、0.2、0.3、0.4、0.5、0.6、0.7、0.8、0.9、1.0、1.1、1.2、1.3、1.4、1.5、1.6、1.7、1.8、1.9、2.0、2.25、2.5、2.75、3.0、3.25、3.5、3.75、4.0、4.25、4.5、4.75或5.0mg/ml他克莫司或其类似物、变体或衍生物的局部组合物形式对受试者施用他克莫司或其类似物、变体或衍生物。在一些实施方案中,以包含约0.01%至约1%、或约0.03%至约0.5%、或约0.05至约0.2%或约0.01、0.015、0.02、0.025、0.03、0.035、0.04、0.045、0.05、0.055、0.06、0.065、0.07、0.075、0.08、0.085、0.09、0.095、0.1、0.15、0.2、0.25、0.3、0.35、0.4、0.45、0.5、0.55、0.6、0.65、0.7、0.75、0.8、0.85、0.9、0.95或1.0%他克莫司或其类似物、变体或衍生物的局部组合物形式对受试者施用他克莫司或其类似物、变体或衍生物。
在一些实施方案中,以包含约10mg/ml至约50mg/ml、或约20mg/ml至约30mg/ml、或约10、11、12、13、14、15、16、17、18、19、20、21、22、23、24、25、26、27、28、29、30、31、32、33、34、35、36、37、38、39、40、41、42、43、44、45、46、47、48、49、50mg/ml特立氟胺或其类似物、变体或衍生物的局部组合物形式对受试者施用特立氟胺或其类似物、变体或衍生物。在一些实施方案中,以包含约1%至约20%、或约5%至约15%、或约1.0、1.1、1.2、1.3、1.4、1.5、1.6、1.7、1.8、1.9、2.0、2.25、2.5、2.75、3.0、3.25、3.5、3.75、4.0、4.25、4.5、4.75、5.0、5.5、6.0、6.5、7.0、7.5、8.0、8.5、9.0、9.5、10、10.5、11、11.5、12、12.5、13、15、14、14.5、15、15.5、16、16.5、17、17.5、18、18.5、19、19.5或20%特立氟胺或其类似物、变体或衍生物的局部组合物形式对受试者施用特立氟胺或其类似物、变体或衍生物。
在一些实施方案中,以包含约10mg/ml至约50mg/ml、或约20mg/ml至约30mg/ml、或约10、11、12、13、14、15、16、17、18、19、20、21、22、23、24、25、26、27、28、29、30、31、32、33、34、35、36、37、38、39、40、41、42、43、44、45、46、47、48、49、50mg/ml来氟米特或其类似物、变体或衍生物的局部组合物形式对受试者施用来氟米特或其类似物、变体或衍生物。在一些实施方案中,以包含约1%至约20%、或约5%至约15%、或约1.0、1.1、1.2、1.3、1.4、1.5、1.6、1.7、1.8、1.9、2.0、2.25、2.5、2.75、3.0、3.25、3.5、3.75、4.0、4.25、4.5、4.75、5.0、5.5、6.0、6.5、7.0、7.5、8.0、8.5、9.0、9.5、10、10.5、11、11.5、12、12.5、13、15、14、14.5、15、15.5、16、16.5、17、17.5、18、18.5、19、19.5或20%来氟米特或其类似物、变体或衍生物的局部组合物形式对受试者施用来氟米特或其类似物、变体或衍生物。
在一些实施方案中,以包含约0.1mg/ml至约5mg/ml、或约0.5mg/ml至2mg/ml、或约0.01、0.015、0.02、0.025、0.03、0.035、0.04、0.045、0.05、0.055、0.06、0.065、0.07、0.075、0.08、0.085、0.09、0.095、0.1、0.2、0.3、0.4、0.5、0.6、0.7、0.8、0.9、1.0、1.1、1.2、1.3、1.4、1.5、1.6、1.7、1.8、1.9、2.0、2.25、2.5、2.75、3.0、3.25、3.5、3.75、4.0、4.25、4.5、4.75或5.0mg/ml吡非尼酮或其类似物、变体或衍生物的局部组合物形式对受试者施用吡非尼酮或其类似物、变体或衍生物。在一些实施方案中,以包含约0.1%至约20%、或约1%至约10%、或约0.1、0.2、0.3、0.4、0.5、0.6、0.7、0.8、0.9、1.0、1.1、1.2、1.3、1.4、1.5、1.6、1.7、1.8、1.9、2.0、2.25、2.5、2.75、3.0、3.25、3.5、3.75、4.0、4.25、4.5、4.75、5.0、5.5、6.0、6.5、7.0、7.5、8.0、8.5、9.0、9.5、10、10.5、11、11.5、12、12.5、13、15、14、14.5、15、15.5、16、16.5、17、17.5、18、18.5、19、19.5或20%吡非尼酮或其类似物、变体或衍生物的局部组合物形式对受试者施用吡非尼酮或其类似物、变体或衍生物。
在一些实施方案中,以包含约0.1mg/ml至约5mg/ml、或约0.5mg/ml至约2mg/ml、或约0.01、0.015、0.02、0.025、0.03、0.035、0.04、0.045、0.05、0.055、0.06、0.065、0.07、0.075、0.08、0.085、0.09、0.095、0.1、0.2、0.3、0.4、0.5、0.6、0.7、0.8、0.9、1.0、1.1、1.2、1.3、1.4、1.5、1.6、1.7、1.8、1.9、2.0、2.25、2.5、2.75、3.0、3.25、3.5、3.75、4.0、4.25、4.5、4.75或5.0mg/ml卡托普利或其类似物、变体或衍生物的局部组合物形式对受试者施用卡托普利或其类似物、变体或衍生物。在一些实施方案中,以包含约1%至约20%、或约5%至约15%、或约1.0、1.1、1.2、1.3、1.4、1.5、1.6、1.7、1.8、1.9、2.0、2.25、2.5、2.75、3.0、3.25、3.5、3.75、4.0、4.25、4.5、4.75、5.0、5.5、6.0、6.5、7.0、7.5、8.0、8.5、9.0、9.5、10、10.5、11、11.5、12、12.5、13、15、14、14.5、15、15.5、16、16.5、17、17.5、18、18.5、19、19.5或20%卡托普利或其类似物、变体或衍生物的局部组合物形式对受试者施用卡托普利或其类似物、变体或衍生物。
抗t细胞剂和/或抗tgf-β1和/或抗血管紧张肽剂可以根据任何合适的给药方案施用,例如其中日剂量分为两个或多个单独剂量。确定全身或局部施用的给药日程表和持续时间在普通技术人员的技能范围内。在一些实施方案中,一天至少一次或一天至少两次口服施用药物组合物。在一些实施方案中,一天至少一次或一天至少两次静脉内施用药物组合物。在一些实施方案中,一天至少一次或一天至少两次局部施用药物组合物。在一些实施方案中,一天至少一次或一天至少两次皮下施用药物组合物。
在其中施用多于一种活性剂的实施方案中,所述药剂可一起施用(例如,在相同的制剂中和/或同时)或分别施用(例如,在不同制剂和/或不同时间)。在一些此类实施方案中,全身施用药剂。在一些此类实施方案中,局部施用药剂。在一些此类实施方案中,全身施用一种(或多种)药剂,并且局部(例如局部)施用一种(或多种)药剂。当使用两种此类试剂时,与单独使用每种试剂时必需的剂量相比,可以使用更低剂量或量的每种试剂。
可以通过参考以下非限制性实施例进一步限定本公开的实施方案。对于本领域技术人员显而易见的是,在不脱离本公开的范围的情况下,可以实施对材料和方法的许多修改。
实施例
实施例1:使用他克莫司治疗和预防淋巴水肿
他克莫司在没有全身性免疫抑制的情况下降低尾部淋巴水肿
为了研究局部他克莫司对淋巴水肿的作用,我们使用了以前描述的淋巴水肿的小鼠尾部模型。goldman等人,circ.res.96:1193-1199(2005);shimizu等人,j.am.heartassoc.2:e000438(2013);choi等人,circulation125:872-882(2012);tabibiazar等人,plosmed.3:e254(2006);yoon等人,j.clin.invest.111:717-725(2003)。小鼠尾部的浅表和深层淋巴系统的破坏导致手术后2周尾部体积增加大于100%(图1a,1b)。我们以前已经显示了,在这个时间点的肿胀主要是由于间质液的积聚。avraham等人,fasebj.27:1114-1126(2013)。尾部慢性淋巴阻塞导致纤维脂肪组织逐渐替代间质液,并在随后的4周内发生炎性细胞的积聚。avraham等人,fasebj.27:1114-1126(2013)。这些病理变化紧密反映了临床淋巴水肿,并且一旦建立淋巴水肿,再持续至少6-9周。goldman等人,circ.res.96:1193-1199(2005);shimizu等人,j.am.heartassoc.2:e000438(2013);choi等人,circulation125:872-882(2012);tabibiazar等人,plosmed.3:e254(2006);yoon等人,j.clin.invest.111:717-725(2003)。
基于此知识,我们使用了两种不同的他莫司治疗方法。一组动物在手术后2周开始用他克莫司治疗4周(尾部手术后总共6周),以阻止淋巴水肿的发展(即早期治疗)。在另一组中,我们在淋巴消融后等待6周以建立淋巴水肿,然后用他克莫司治疗直至9周,意图治疗建立的软组织变化(即晚期治疗)。在所有研究中,我们用0.1%他克莫司(0.05g/应用)或媒介物对照(凡士林)每天治疗动物两次。他克莫司或媒介物对照作为薄层施加到手术部位远端(即不包括手术部位)的整个尾部。
用局部他克莫司的早期治疗明显减少尾部肿胀,并且阻止永久性肿胀的发展(图1a,1b)。从实验动物的尾部的大体检查证明了淋巴水肿的接近完全的消退,并且这种变化对应于尾部体积减少95%和软组织厚度减少几乎50%(图1b,1c)。尽管在这些动物中尾部体积没有恢复到术前水平,但晚期治疗在减少大体尾部肿胀、尾部体积和软组织厚度方面也是非常有效的(图1b,1c)。
我们还分析了他克莫司和外周t细胞计数的全身水平,以确定是否局部应用的他克莫司以可察觉的方式被吸收。该分析证明了,局部他克莫司(平均值为1.06ngml-1)的全身性吸收仍然显著低于用全身施用(5-15ngml-1;图1d)达到的已知治疗免疫抑制水平。此外,与媒介物治疗的对照相比,用局部他克莫司治疗的动物显示循环血液t细胞或cd4+细胞的没有变化(图1e,图7)。
他克莫司在淋巴损伤后减少炎症和纤维化
慢性炎症是临床淋巴水肿的组织学特征,并且特征在于t辅助细胞、t调节细胞和巨噬细胞的积聚增加。avraham等人,fasebj.27:1114-1126(2013);zampell等人,plosone7:e49940(2012);ghanta等人,am.j.physiol.heartcirc.physiol.308:h1065-1077(2015);olszewski等人,lymphology23:23-33(1990)。与此一致,我们发现了与对照相比,他克莫司治疗的动物具有显著降低数目的浸润真皮和皮下脂肪的白细胞(cd45+细胞;56%减少-早期治疗;49%晚期治疗;图2a)。从对照动物收获的淋巴水肿组织中的炎性细胞位于紧邻毛细血管和集合淋巴系统,但在他克莫司治疗的小鼠中几乎不存在。类似地,我们注意到浸润性cd3+细胞(53%减少-早期;49%-晚期治疗;图2b)、cd4+细胞(78%减少-早期治疗,71%晚期治疗;图2c)和产生ifn-γ的细胞(54%减少-早期治疗,57%晚期治疗;图2d)的数目的明显减少。此外,我们注意到巨噬细胞的软组织浸润的减少(f4/80+细胞;86%减少-早期治疗;73%晚期治疗;图8)。总之,这些发现显示了在淋巴损伤后,炎性细胞大量积聚在皮肤/皮下淋巴管附近,并且通过局部应用他克莫司来缓解此应答。
淋巴水肿患者具有进行性软组织纤维化,并且纤维化程度与疾病的严重程度相关。tassenoy等人,lymphat.res.biol.7:145-151(2009)。因此,我们分析了尾部组织中的几种纤维化标志物,以了解他克莫司治疗对疾病的此方面的作用。我们发现与对照小鼠相比,用他克莫司的局部治疗显著降低了皮肤和皮下i型胶原沉积和瘢痕指数(天狼猩红双折射测量胶原i/iii的比率)(图3a,3b)。对照小鼠的淋巴管被厚i型胶原层包围;相比之下,他克莫司治疗的动物具有基本正常的淋巴管。与此观察结果和我们以前的报道(clavin等人,am.j.physiol.heartcirc.physiol.295:h2113-2127(2008))一致,我们还发现他克莫司治疗显著降低了促纤维化生长因子tgf-β1和其激活的下游信号传导分子、磷酸化smad3(psmad-3;图3c,3d)的细胞表达。对于早期和晚期他克莫司治疗,此应答的程度是相似的。
他克莫司提高淋巴功能
为了评估淋巴功能,我们用吲哚菁绿(icg)进行了近红外(nir)淋巴管造影术,其已经被描述为通过实现淋巴管的实时成像、计算包频率(或淋巴液的脉动流)、以及皮肤淋巴管回流和染色清除的分析来定量人、猪和小鼠的淋巴功能的有效手段。kwon等人,lymphat.res.biol.5:219-231(2007);sharma等人,am.j.physiol.heartcirc.physiol.292:h3109-3118(2007);unno等人,j.vasc.surg.52:946-952(2010)。在淋巴结扎后6周,使用nir成像,我们注意到在淋巴损伤后2周开始治疗的动物中的尾部创伤间在近端快速转运间质液(早期治疗;图4a)。相比之下,对照动物表明淋巴切除部位远端的icg的合并,未在损伤区间转运。使用锝-99m(99mtc)淋巴系闪烁造影术(一种将放射性示踪剂注射在远端尾部并且随着时间测量骶淋巴结的摄取的技术)证实了这一发现。与对照相比,早期治疗动物中骶淋巴结的衰减调整摄取表明他克莫司治疗动物中99mtc摄取量增加了多于6倍(图4b)。用他克莫司的晚期治疗类似地增加结节摄取(2倍);然而,这种差异没有达到统计学显著性。
鉴于他克莫司在尾部模型中预防和治疗淋巴水肿的功效,我们接下来试图使用前述的腘淋巴结剥离模型(plnd)研究他克莫司如何在淋巴损伤后调节淋巴功能(图9)。blum等人,breastcancerres.treat.139:81-86(2013)。这种模式在临床上是相关的,因为癌症治疗过程中的淋巴结剥离是发达国家中淋巴水肿的最常见原因。我们首先利用plnd小鼠模型来更好地了解淋巴损伤后慢性炎性反应被激活的机制。
以前的研究已经证明,淋巴内皮细胞(lec)对活性氧物质(ros)高度敏感(kasuya等人,sci.rep.4:4173(2014)),并且ros可以激活慢性炎症。gorlach等人,redoxbiol.6:372-385(2015)。为了确定在plnd后是否存在ros,我们根据淋巴管在去除细胞代谢产物中的已知作用,分析损伤后1周损伤区域远端的组织中的ros积聚。实际上,此分析证明了在用plnd治疗的动物中,腘区域立即远端的后肢组织中ros显著积聚(图10)。相比之下,在无淋巴结切除术的情况下用皮肤切除治疗的对照动物几乎没有ros的积聚。ros可以激活先天性免疫应答,包括与危险相关的分子模式分子(damp)。yin等人,j.immunol.194:429-437(2015)。与这些研究和我们发现plnd后增加的ros,以及与我们以前使用淋巴水肿的尾部模型的研究(其中我们证实了淋巴组织中各种细胞类型中hmgb1的表达增加)(zampell等人,am.j.physiol.cellphysiol.300:c1107-1121(2011))一致,我们注意到damp,如热休克蛋白70(hsp70)和高迁移率组盒1(hmgb-1)的表达显著增加(图10)。这些发现指示了,淋巴损伤导致ros的产生,这又导致细胞损伤、damp的表达和炎性应答的启动。
以前的临床和实验室研究已经将皮肤淋巴管回流描述为将icg合并到由渗漏性功能障碍性淋巴系统引起的间质空间中。blum等人,breastcancerres.treat.139:81-86(2013);tashiro等人,ann.plast.surg.doi:10.1097/sap.599(2015);yamamoto等人,plast.reconstr.surg.128:314e-321e(2011)。与这些报道一致,我们发现单独用凡士林局部治疗4周的对照动物显示了足垫的初始淋巴系统的明显渗漏(白色箭头所示的明亮icg积聚的点状区域;图4c)和皮肤淋巴管回流(icg在真皮中的全身化保留;图4c)。在用局部他克莫司治疗的动物中,这种病理应答显著降低,导致淋巴泄漏降低和注射icg的清除改善。
使用时间差摄影术分析集合管中icg荧光强度的波动是以前用于测量淋巴泵送速率的技术。sevick-muraca等人,j.clin.invest.124:905-914(2014)。该分析能够计算“icg包频率”,并且已经用于分析plnd后的集合淋巴功能。blum等人,breastcancerres.treat.139:81-86(2013)。使用这种技术,我们发现与对照相比,局部他克莫司疗法明显增加集合淋巴包频率(>2倍增加),表明这种治疗增加了集合淋巴功能(图4d)。
另外,与我们用尾部模型的发现相似,我们发现plnd后用局部他克莫司治疗明显降低炎性细胞的外淋巴浸润(cd45+细胞减少39%(图4e上图,图4f)、cd4+细胞的56%减少(图11)和f4/80+细胞的36%减少(图12)。用局部他克莫司治疗也导致炎性细胞的诱导型一氧化氮合酶(inos)的外淋巴表达的显著降低(inos表达细胞的数目的42%减少)(图4e下图,图4g)。这是重要的,因为先前的研究已经显示了外淋巴inos表达是集合淋巴泵送能力的重要调节剂。liao等人,proc.natl.acad.sci.usa108:18784-18789(2011)。重要地,仅在淋巴损伤的背景中观察到响应局部他克莫司的淋巴收缩性的改变,因为用他克莫司治疗非手术动物(即仅麻醉但没有手术)没有增加炎性细胞的淋巴收缩频率或外淋巴积聚(图13)。
另外,为了确保他克莫司对淋巴功能观察到的作用不是血管通透性和血管渗漏降低的结果,我们进行了一项miles测定法以测量在有和无他克莫司的情况下plnd手术后的血管通透性。我们没有观察到他克莫司治疗和媒介物对照之间的血管通透性差异,表明他克莫司在增加淋巴功能中的作用确实是由于淋巴功能升高而不是血管渗漏减少所致(图14)。
我们接下来根据以前的临床报道显示长期存在的严重淋巴水肿患者收缩淋巴系统及平滑肌细胞肥大的事实,在对照和他克莫司治疗的动物中检查了plnd后后肢集合淋巴管的管腔直径和α平滑肌细胞覆盖。mihara等人,plosone7:e41126(2012)。不令人惊讶的是,在淋巴损伤后的相对较早的时间段(即4周)内,当比较他克莫司和对照治疗小鼠时,我们未发现围绕管或后肢集合器的腔区域中α平滑肌的数目的差异。这一发现指示,他克莫司治疗后集合淋巴包频率的增加不受淋巴结构变化的调节,而是由于淋巴微环境的变化(例如,外淋巴炎症或inos的表达;图15)。
他克莫司增加侧支淋巴管形成
由于已知t细胞有力抑制创伤修复期间的淋巴结淋巴管生成(kataru等人,immunity34:96-107(2011))和炎性淋巴管生成(zampell等人,am.j.physiol.cellphysiol.302:c392-c404(2012)),我们接下来试图确定用他克莫司治疗是否增加侧支淋巴系统的形成。事实上,使用lyve-1免疫荧光(if)染色的尾部创伤的组织学分析和淋巴系统鉴定表明桥接淋巴损伤区域的新形成的淋巴管明显增加(早期治疗后增加189%;晚期治疗后增加106%;图5a)。由于我们注意到对照和他克莫司治疗的动物之间的vegf-cmrna表达没有差异,这种淋巴管生成应答似乎与vegf-c表达无关(图5a)。然而,与我们的if染色分析一致,我们注意到两种有力抗淋巴管生成的生长因子和细胞因子tgf-β1(oka等人,blood111:4571-4579(2008);clavin等人,am.j.physiol.heartcirc.physiol.295:h2113-2127(2008))和ifn-γ(kataru等人,immunity34:96-107(2011);shao等人,j.interferoncytokineres.26:568-574(2006))的表达的显著降低(图5a)。通过nir成像进行的淋巴管造影分析和plnd后4周的后肢淋巴管的if染色,证实了我们的尾部模型发现,证明用他克莫司治疗的动物一致具有明显更多的引流到腹股沟淋巴结的侧支淋巴系统,从而绕过损伤区(图5b-5d)。
为了在淋巴液的引流不被手术阻塞的其它炎症和创伤模型中确定他克莫司的淋巴管生成作用,我们接下来使用另外两种炎性淋巴管生成模型。角膜是用于研究淋巴管生成的有用组织,因为它通常不含血管和淋巴管,而是在炎症的背景中发展。cursiefen等人,j.clin.invest.113:1040-1050(2004)。我们将缝线放在小鼠的角膜中,每天用全身性他克莫司或媒介物对照治疗2周,并且发现他克莫司治疗导致淋巴管(增加48%)而非血管增生的显著增加(图6a-6c)。
我们还使用耳穿孔创伤模型研究创伤愈合过程中的淋巴管生成,并应用局部他克莫司或对照软膏剂4周。与角膜模型类似,我们发现与对照相比,局部他克莫司显著增加了创伤附近的耳皮肤的淋巴管密度和分支(图6d-6f)。为了测试他克莫司的直接淋巴管生成作用的可能性,我们将他克莫司应用于无创伤的小鼠耳4周,然后进行淋巴管的整装共聚焦成像。我们观察到在这个未受伤的非炎性环境中淋巴管生成没有增加(图16)。这些结果一起表明,他克莫司通常在炎症的背景中和特别在淋巴水肿/淋巴损伤的背景中促进新的淋巴管的形成。
方法
研究设计
本研究的目的是测试t细胞的局部抑制既能预防淋巴损伤后淋巴水肿的发展又在其发展后治疗已建立的淋巴水肿的假设。使用淋巴损伤和淋巴水肿的两种不同小鼠模型,我们分析了他克莫司(fda批准的局部抗t细胞药物)对这些结果的功效。发现了他克莫司确实有效预防和治疗淋巴水肿,然后我们试图分析调节这种响应的细胞和分子机制。在这些随后的研究中,我们测试了cd4+炎性应答的抑制通过增加侧支淋巴系统的形成,减少围绕初始淋巴系统的细胞外基质中的胶原沉积以及增加集合淋巴系统的泵送频率来改善淋巴功能的假说。我们的研究都使用成年雌性(10-14周龄)c57bl/6j小鼠(jacksonlaboratories,barharbor,me)进行,其保持在控制光和温度的无病原体环境中并随意进食。所有研究均获得了memorialsloanketteringcancercenter的机构动物护理和使用委员会(iacuc)的批准。每个实验使用至少6-8只动物进行,并且测定一式三份进行。所有细胞计数由对干预不知情的审阅者进行。
动物模型和治疗
尾部手术和淋巴消融如以前公布的那样进行。clavin等人,am.j.physiol.heartcirc.physiol.295:h2113-h2127(2008)。简言之,使用2mm圆周切除术切除尾部中部的浅表和深层集合淋巴系统。他克莫司0.1%(astellas,tokyo,japan)/媒介物对照(凡士林)在不同组的动物中在手术后2周(早期治疗)开始以及在手术后6周开始(晚期治疗)局部治疗。对于这两种方法,我们用0.1%他克莫司或媒介物对照治疗动物,每天两次,持续4周时段(早期治疗)和3周时段(晚期治疗)。他克莫司(约0.05g)作为薄层施加到整个尾部区域。为了能够分析淋巴集合管泵送能力,我们利用了前述的小鼠腘淋巴结切除术模型。blum等人,breastcancerrestreat139:81-86(2013);sharma等人,am.j.physiol.heartcirc.physiol.292:h3109-h3118(2007)。简言之,鉴定后肢集合管和腘淋巴结,并且用腘脂肪垫切除淋巴结。手术后2周开始,将动物随机化至用0.1%局部他克莫司或媒介物对照(凡士林)治疗,每日两次,持续2周。
如以前报道,进行角膜淋巴管生成测定。cursiefen等人,cornea25:443-447(2006)。简言之,将10-0尼龙缝线(ethicon,cincinnati,oh)以120°角放置在角膜中。在缝线放置后立即开始,动物用全身性他克莫司或媒介物对照每天治疗,持续两周,然后使用共聚焦显微镜(leicamicrosystems,weitziar,germany)进行分析。将全身性他克莫司(biotanginc.,lexington,ma)溶解在具有pbs中的1%tween80的10%乙醇中(rozkalne等人,neurobiol.dis.41:650-654(2011);butcher等人,j.neurosci.17:6939-6946(1997)),每日ip给药4mgkg-1。全身性他克莫司的媒介物对照是等体积的在pbs中的10%乙醇、1%tween80。使用先前报道的耳冲孔创伤模型评价皮肤淋巴管生成。cho等人,proc.natl.acad.sci.usa103:4946-4951(2006)。受伤后,耳皮肤用局部他克莫司或媒介物对照治疗4周。然后,收获耳并在1%pfa中固定过夜。然后,分开耳皮肤的前部和后部,除去软骨,并进行lyve-1和cd31的整装染色。使用共焦显微镜(leicamicrosystems,weitziar,germany)获得平铺扫描图像,并使用metamorph软件(moleculardevices,sunnyvale,ca)分析创伤边缘400μm内的皮肤。通过两名不知情审阅者分析了标准化(200μmx200μm)视野的单位面积存在的分支点数。
流式细胞术
如前所报道对外周血样品进行流式细胞术。zampell等人,plosone7:e49940(2012)。简言之,将红细胞用rbc裂解缓冲液(ebioscience,sandiego,ca)裂解,然后用荧光团缀合的抗体(cd45、cd3和cd4;全部来自biolegend,sandiego,ca)染色,并用facscalibur流式细胞仪(bdbiosciences,franklinlakes,nj),使用flowjo软件(treestar,ashland,or)分析。
通过质谱术得到的他克莫司血液水平
在先前报道的方法的修改中使用质谱术测量他克莫司的血液水平。donaldson等人,meth.mol.biol.603:479-487(2010)。简言之,在edta钠包被的管(terumo,shibuya,japan)中收集全血,然后使用与tsqquantumultra三重四极杆质谱仪(thermoscientific,franklin,ma)偶联的thermoscientificariatlx-2湍流层析(tfc)分析。使用的turboflow柱是cyclonep-50x0.5mm,而分析柱是hypersilgoldc-18柱,3x50mm。对全血(50μl)添加200μl含有子囊霉素作为内部标准品的0.2mmznso4。在30分钟温育和离心后,将50μl上清液注射到tfc系统中。用含有10mm甲酸铵和0.1%甲酸的水和乙醇溶液的梯度将分析物洗脱流过柱(0.75mlmin-1)。分析运行时间是4.5分钟。在10天时段内在三个浓度测定测定法的日间不精确性。在3.3、12.6和31.9ngml-1的浓度下,变异系数分别是9.8、7.0和7.8%。测定具有0至40ngml-1的线性范围。
淋巴功能的分析
如先前报道(clavin等人,am.j.physiol.heartcirc.physiol.295:h2113-h2127(2008)),使用截锥公式计算尾部体积,并且使用mirax成像软件(carlzeiss,munich,germany)以标准化方式使用皮肤/皮下组织的软组织厚度的组织学测量确认。
使用我们以前发表的方法进行淋巴系闪烁造影术。avraham等人,am.j.pathol.177:3202-3214(2010)。简言之,将50μl过滤的锝-99m(99mtc)硫胶体(nucleardiagnosticproducts,rockaway,nj)在远端尾部中注射。使用x-spect照相机(gammamedica,northridge,ca)拍摄图像,并进行感兴趣区域分析以获得骶淋巴结中的衰减调整计数,并使用asipro软件(ctimolecularimaging,knoxville,tn)计算结节摄取的峰值和速率。
使用以前发表的结果的修改进行近红外成像(nir)。tassenoy等人,lymphat.res.biol.7:145-151(2009)。简言之,将15μl(0.15mgml-1)吲哚菁绿(icg,sigma-aldrich,saintlouis,mo)皮内注射到背部后肢的蹼空间中,并使用具有led光源(coolled,andover,unitedkingdom)的evosemccd照相机(lifetechnologies,carlsbad,ca)进行可视化。使用zeissv12stereolumar显微镜(caliperlifesciences,hopkinton,ma)获得静态/视频图像,并使用fiji软件(nih,bethesda,md)通过鉴定腿的优势集合管上的感兴趣区域并减去随时间绘制的背景荧光强度分析淋巴泵送功能。
组织学和免疫染色
使用我们发表的方法进行免疫组织化学染色。clavin等人,am.j.physiol.heartcirc.physiol.295:h2113-h2127(2008)。简言之,将组织在4℃下在4%多聚甲醛中固定,在5%edta钠(santacruzbiotechnology,dallas,tx)中脱钙,在石蜡中包埋,并以5微米切片。将切割切片再水合,并使用90℃的柠檬酸钠(sigma-aldrich)进行热介导的抗原暴露。用2%bsa/20%动物血清封闭非特异性结合。组织在4℃下与一抗温育过夜。用于免疫组织化学染色的一抗包括山羊抗小鼠lyve-1、大鼠抗小鼠cd45、兔抗小鼠cd4和大鼠抗小鼠f4/80(均来自r&d,minneapolis,mn)、兔抗小鼠cd3(来自dako,carpinteria,ca)、cy3缀合的小鼠抗αsma(来自sigma-aldrich)、兔抗人ifn-γ、兔抗小鼠tgf-β1、兔抗小鼠p-smad3、兔抗小鼠胶原i、兔抗小鼠inos和仓鼠-抗小鼠平足蛋白、兔抗小鼠hmgb-1和hsp-70(均来自abcam,cambridge,ma)。
使用alexafluor荧光团缀合的二抗(lifetechnologies,norwalk,ct)进行免疫荧光染色。使用mirax成像软件(carlzeiss)扫描图像。通过在腿的每个象限中最发炎的淋巴管的50μm内计数阳性染色的细胞来评估外淋巴cd45+和cd4+细胞计数。在四个随机选择的40x高放大率视野中,两名不知情审阅者在每个动物的最少4个视野中计数阳性染色细胞。使用metamorph软件(moleculardevices,sunnyvale,ca)在5μm横截面的真皮区域中定量胶原i沉积。如先前报道,使用天狼星红染色和瘢痕指数计算确认了该分析。flanders等人,am.j.pathol.163:2247-2257(2003)。在每个尾部4个不同高放大率视野的重新上皮化手术部位中计数小鼠尾部中的桥接淋巴管。
天狼星红染色
用天狼星红染色试剂盒(polysciences,warrington,pa)根据制造商的说明书对尾组织的石蜡切片进行染色。通过axiocam2显微镜(carlzeiss)上的偏振光获得图像,并且用metamorph软件通过计算具有代表增加的瘢痕形成的更高数目的红-橙色:绿-黄色纤维的比率来量化瘢痕指数。
实时pcr
使用trizol(invitrogen,lifetechnologies,carlsbad,ca)根据制造商的建议在尾部皮肤上进行rna提取。使用agilent生物分析仪(agilenttechnologies,inc;santaclara,ca)评估rna质量和数量。使用taqman逆转录酶试剂盒(roche,branchburg,nj)将分离的rna转化为cdna,使用delta-deltactpcr分析并且使用gapdhrna扩增标准化基因表达进行组间的基因表达的相对表达,如先前所述。schmittgen等人,nat.protoc.3:1101-1108(2008)。使用以下公式计算相对表达:2[-(ct感兴趣基因–ct内源对照)样品a–(ct感兴趣基因–ct内源对照)样品b)]。所有样品一式三份进行。用于感兴趣的pcr靶物的引物是针对vegf-c、tgf-β1和ifn-γ(appliedbiosystems,lifetechnologies,carlsbad,ca)。
体内检测ros和用于血管通透性的miles测定法
如han等人(j.vis.exp.doi:10.3791/3925(2012))描述,通过nadph氧化酶的生物发光成像进行ros的体内检测。简言之,在plnd之后的不同时间点,对小鼠全身性注射溶解在pbs中的l-012(鲁米诺的类似物)(20μg/g),并且对plnd手术部位处代表ros的发光信号成像并使用ivis谱200(xenogencorporation)量化。如所述进行血管通透性的miles测定。radu等人,j.vis.exp.doi:10.3791/50062(2013)。简言之,通过尾静脉将200μl0.5%无菌伊文思蓝注射至2周他克莫司治疗的plnd小鼠。30分钟后,对plnd后肢成像以观察伊文思蓝色渗漏。切下后肢,并在55℃在甲酰胺中温育48小时以提取伊文思蓝。通过测量610nm处的吸光度来量化提取的伊文思蓝。
统计学分析
使用graphpadprism软件(graphpadsoftware,lajolla,ca)分析和显示数据。除非另有说明,数值以平均值±标准偏差表示。统计学显著性设定为p≤0.05,并且2组之间的差异用student'st检验进行评估,而使用anova及事后检验进行多次分析以在组内进行比较。
结论
由于cd4+t细胞在淋巴水肿病理学中发挥关键作用,本研究的目的是评估局部他克莫司预防和治疗淋巴水肿的功效。我们良好使用了描述的淋巴水肿的小鼠尾部模型以及以前描述的由腘淋巴结清扫术(plnd)引起的淋巴损伤模型,以显示局部他克莫司通过降低慢性炎症应答、减少组织和淋巴纤维化、增加集合淋巴泵送、并增加侧支淋巴管形成在淋巴损伤后有力阻止淋巴水肿的发展。这些发现对淋巴水肿的治疗具有重要含义,因为以前的实验尝试主要集中在使用外源性淋巴管生长因子增加淋巴再生。
我们还发现他克莫司能有效地减少淋巴损伤后的真皮和皮下t细胞浸润和组织纤维化。这些变化阻止了淋巴水肿的发展,并且一旦建立淋巴水肿,就可逆转病理变化。用他克莫司治疗通过增加侧支淋巴系统的形成和通过增加集合淋巴泵送频率来增加淋巴功能。据我们所知,这是预防和治疗手术后淋巴水肿的首选靶向局部药理学手段。
我们发现他克莫司在手术后立即较早期应用时更有效,可能反映出这种治疗不需要逆转已建立的病理学的实情。此发现与其它纤维增生性病症如肝纤维化的先前研究一致,其中预防比逆转组织学变化有效得多。friedman等人,hepatology43:s82-s88(2006)。
实施例2:使用吡非尼酮治疗和预防淋巴水肿
吡非尼酮减少尾部淋巴水肿
小鼠尾部浅表和深层淋巴系统的破坏导致手术后2周尾部体积增加几乎80%(图19a,19b)。我们以前显示了,在这个时间点的肿胀主要是由于间质液的积聚。avraham等人,fasebj.27:1114-1126(2013)。尾部慢性淋巴阻塞导致纤维脂肪组织逐渐替代间质液,并在随后的4周内积聚炎性细胞。avraham等人,fasebj.27:1114-1126(2013)。这些病理变化紧密反映了临床淋巴水肿,并且一旦建立淋巴水肿,再持续至少8-10周。根据这些知识,我们在手术后等待7周以建立淋巴水肿,然后用吡非尼酮开始治疗,目的是治疗这些建立的软组织变化。我们最初开始全身性治疗,因为大多数以前关于吡非尼酮的研究使用这种施用途径来治疗纤维化疾病。然而,一旦我们建立了吡非尼酮作为有效的治疗,我们就开发局部制剂,因为局部施用是优选的,以使由于全身性疗法引起的任何潜在副作用最小化。与对照相比,用全身性和局部吡非尼酮二者的治疗显著减少大体尾部肿胀、尾部体积和软组织厚度(图19a-19c,19e;对于这两种治疗组,尾部体积p<0.01而厚度p<0.05)。
吡非尼酮增加尾部中的淋巴功能
鉴于吡非尼酮在尾部模型中治疗淋巴水肿的功效,我们接下来尝试研究吡非尼酮是否调节淋巴损伤后的淋巴功能。使用99tc淋巴系闪烁造影术(将放射性示踪剂注射到远端尾部的技术),我们在90分钟内测量了其被骶淋巴结的摄取。与对照相比,全身性和局部吡非尼酮治疗的动物中骶淋巴结的衰减调整摄取表明吡非尼酮治疗的动物中99tc摄取增加了几乎4倍。此外,全身性和局部治疗的动物均表明峰值结节摄取增加了几乎4倍(图19g;两者均为p<0.01)。类似地,全身性和局部治疗的动物的摄取速率增加,如衰减调整曲线的斜率增加所示(图19h;分别为p<0.01和p<0.05)。
吡非尼酮减少淋巴损伤后尾部炎症和纤维化
慢性炎症是临床淋巴水肿的组织学特征,并且特征在于炎性细胞,特别是t辅助细胞的积聚增加。avraham等人,fasebj.27:1114-1126(2013);zampell等人,plosone7:e49940(2012);ghanta等人,am.j.physiol.heartcirc.physiol.308:h1065-1077(2015);olszewski等人,lymphology23:23-33(1990)。与此一致,我们发现与对照相比,全身性和局部治疗的动物都具有浸润真皮和皮下脂肪的白细胞数目的明显减少。从对照动物收获的淋巴水肿组织中的炎症细胞位于紧邻毛细血管和集合淋巴系统,但在吡非尼酮治疗的小鼠中几乎不存在。类似地,我们注意到浸润的cd3+细胞和cd4+细胞的数目显著减少(图20a,20d;两者为p<0.001)。此外,我们注意到ifn-γ蛋白(一种t辅助细胞(th)1细胞产生的细胞因子,其先前已被发现是有力抗淋巴管生成)的积聚显著减少(图20j;p<0.01)。kataru等人,immunity34:96-107(2011);shao等人,j.interferoncytokineres.26:568-574(2006)。
此外,我们以前已经显示巨噬细胞积聚在淋巴损伤远端的组织中。zampell等人,plosone7:e49940(2012)。我们分析了吡非尼酮对巨噬细胞浸润的作用,因为它们既调节纤维化(主要通过tgf-β1)又调节淋巴管生成(通过vegf-c)。我们发现了与对照相比,使用吡非尼酮治疗(全身性和局部两者)的淋巴水肿尾部组织中f4/80+细胞浸润无差异。与此一致,我们发现用吡非尼酮治疗后vegf-c蛋白积聚没有差异(图20k;p=ns)。总之,这些发现显示了在淋巴损伤后,炎性细胞(特别是t细胞)大量积聚在皮肤/皮下淋巴管附近,并且通过全身性和局部吡非尼酮治疗减轻了此应答。
淋巴水肿患者具有进行性软组织纤维化,并且纤维化程度在临床上与疾病严重程度相关。tassenoy等人,lymphat.res.biol.7:145-151(2009)。与其它纤维化病症一致,我们以前已经显示了tgf-β1是淋巴水肿中关键的促纤维化生长因子。avraham等人,am.j.pathol.177:3202-3214(2010)。此外,我们已经显示tgf-β1对lec具有直接的抗淋巴管生成作用。clavin等人,am.j.physiol.heartcirc.physiol.295:h2113-h2127(2008)。因此,我们分析了tgf-β1+细胞的浸润和其激活的下游信号传导分子psmad3的细胞表达。在全身性和局部吡非尼酮治疗组中,我们发现与对照相比,tgf-β1+细胞和psmad3+细胞的积聚显著降低(图20b,20c,20e,20f;全部为p<0.001)。与这一致,我们发现了吡非尼酮治疗后,tgf-β1蛋白积聚减少(图20i;p<0.05)。这与如与对照小鼠相比两种治疗组中的皮肤和皮下i型胶原沉积显著减少相关(图19d,19f;对于全身性为p<0.001以及对于局部为p<0.05)。
由于在淋巴水肿的人患者中已经描述了集合淋巴管的结构变化(平滑肌肥大、厚i型胶原层、管腔收缩),我们检查了我们动物的集合淋巴系统的类似的变化。mihara等人,plosone7:e41126(2012)。与这些人研究一致,对照小鼠的集合淋巴系统(α-sma+/平足蛋白+)被厚i型胶原层包围,而吡非尼酮治疗的动物具有基本正常的淋巴管(图20h)。
吡非尼酮增加后肢中的淋巴功能
为了理解吡非尼酮增加淋巴功能的机制,我们利用小鼠后肢plnd模型分析了初始淋巴系统中的皮肤淋巴管回流和集合淋巴泵送能力。blum等人,breastcancerres.treat.139:81-86(2013)。在plnd后4周使用nir淋巴管造影术,与媒介物治疗的对照相比,用2周的全身性吡非尼酮治疗的动物具有明显更少的真皮淋巴管回流和毛细血管渗漏(图18a,白色箭头)。此外,吡非尼酮治疗的动物与对照相比具有集合淋巴管收缩的速率显著增加(增加2倍;图18a,18b;p<0.0015)。这种与我们对尾部模型的发现相似的应答与用吡非尼酮治疗的小鼠中炎性细胞的外淋巴浸润显著减少相关(图18e(上图),图18f;p<0.01)。此外,用吡非尼酮治疗导致炎症细胞对inos的外淋巴细胞表达显著降低(图18e(下图),图18g;p<0.01)。这是一项关键的发现,因为增加的外淋巴inos积聚在炎症的背景中已显示破坏正常一氧化氮梯度,这对于正常的、协调的淋巴管收缩性至关重要。liao等人,proc.natl.acad.sci.usa108:18784-18789(2011)。这提供了吡非尼酮如何改善淋巴管收缩性的重要机制。
吡非尼酮增加侧支淋巴管形成
由于已知t细胞(特别是th1和th2细胞因子)在创伤修复期间有效抑制淋巴结淋巴管生成和炎性淋巴管生成,我们接下来试图确定用吡非尼酮治疗是否增加了侧支淋巴系统的形成。kataru等人,immunity34:96-107(2011);clavin等人,am.j.physiol.heartcirc.physiol.295:h2113-h2127(2008);zampell等人,am.j.physiol.cellphysiol.302:c392-c404(2012);savetsky等人,plosone10:e0126908(2015)。事实上,使用lyve-1免疫荧光染色的淋巴系统的组织学分析和鉴定证明尾部和后肢两者中的淋巴管密度显著增加(图18d,18e;p<0.001)。由于我们注意到,与非对照相比,吡非尼酮治疗的淋巴水肿尾部中的vegf-c蛋白分析没有差异,因此淋巴管生成应答似乎与vegf-c表达无关,而抗淋巴管生成t细胞细胞因子如ifn-γ和tgf-β1深刻降低(图20e,20i,20k;tgf-β1为p<0.05,ifn-γ为p<0.01,以及vegf-c为p=ns)。
用吡非尼酮的tgf-β1免疫疗法不进一步改善淋巴功能
鉴于吡非尼酮的主要作用机制是阻断tgf-β1活性,我们比较了单独研究中吡非尼酮治疗与tgf-β1免疫疗法在plnd后的作用。schaefer等人,eur.respir.rev.20:85-97(2011)。使用nir成像,与同种型对照相比,我们发现单独的tgf-β1免疫疗法以及tgf-β1免疫疗法和吡非尼酮的组合已经减少了真皮淋巴管回流,并且显著增加了集合淋巴管收缩的速率。更重要的是,与单独的免疫疗法相比,组合疗法没有增加益处,表明我们以我们使用的剂量最大限度地抑制tgf-β1(图21a-21c;p=ns)。类似地,使用流式细胞术,与同种型对照相比,我们发现单独的tgf-β1免疫疗法以及tgf-β1免疫疗法和吡非尼酮的组合显著降低了淋巴损伤远端的t辅助细胞的组织积聚,而与单独的免疫疗法相比,组合疗法没有额外的作用。
来自t细胞的tgf-β1ko在淋巴损伤后减少尾部淋巴水肿,改善淋巴功能,并且减少尾部炎症和纤维化
为了确定淋巴水肿背景中tgf-β1的细胞来源,我们开发了具有t细胞和髓细胞的tgf-β1产生的选择性ko的转基因小鼠。使用聚合酶链式反应(pcr)证实这些转基因小鼠的表型确认,显示了与对照小鼠相比,来自t细胞cre和髓样cre小鼠的分离的t和髓样细胞的tgf-β1表达显著降低(图21a;两者都为p<0.05)。进行尾部手术,并且手术后6周进行分析。与髓样cre和对照小鼠相比,t细胞cre具有显著降低的大体尾部肿胀、尾部体积和纤维脂肪厚度(图21b-21d;尾部体积为p<0.01以及厚度为p<0.05)。99tc淋巴系闪烁造影术分析表明与髓样cre和对照小鼠相比,t细胞cre小鼠的骶淋巴结中示踪剂的衰减调节摄取增加了几乎4倍。类似地,与髓样cre和对照小鼠相比,t细胞cre小鼠中的峰结节摄取以及示踪剂摄取速率有所增加(图21e-21f;分别p<0.05和p<0.01)。
以前,我们已经显示了除了减少的纤维化外,在我们的淋巴水肿尾部模型中tgf-β1免疫疗法导致减少的炎症,特别是t辅助细胞组织浸润。avraham等人,am.j.pathol.177:3202-3214(2010)。有趣的是,与髓样cre和对照小鼠相比,t细胞cre小鼠具有浸润真皮和皮下脂肪的t辅助细胞数目的明显减少(图22a,22b;p<0.01)。此外,与我们在吡非尼酮治疗动物中的发现相似,我们注意到ifn-γ蛋白的积聚显著减少(图22d;p<0.01)。与髓样cre和对照小鼠相比,发现tgf-β1+细胞和蛋白质积聚的分析以及其活化的下游信号传导分子psmad3的细胞表达在t细胞cre小鼠中显著降低(图22a,22c,22e;对于psmad3为p<0.01以及对于tgf-β1蛋白为p<0.05)。我们发现所有组之间的f4/80+细胞或vegf-c蛋白积聚无差异(图22f;p=ns)。与髓样cre和对照小鼠相比,这与t细胞cre小鼠中的皮肤和皮下i型胶原沉积显著减少相关(图21d;p<0.05)。虽然髓样cre小鼠中似乎有炎症、纤维化和抗淋巴管生成细胞因子表达减少的趋势,但是它未达到显著性。这些发现是重要的,因为它们表明淋巴水肿中tgf-β1的主要细胞来源是t细胞。
受损的lectgf-β1响应性在淋巴损伤后在尾部中的尾部淋巴水肿、炎症或纤维化上没有变化
为了分析tgf-β1在淋巴水肿背景中对lec的直接作用并且将我们以前的体外发现应用于体内模型,我们对flt4cre小鼠进行了尾部手术,并在手术后6周进行了分析。avraham等人,plast.reconstr.surg.124:438-450(2009)。通过针对lyve-1和psmad3对淋巴结染色证实这些转基因小鼠的表型确认。flt4cre小鼠在lec上没有检测到psmad3染色,表明lec对tgf-β1无响应性(图23a,白色箭头表示psmad3+lec)。与对照小鼠相比,flt4cre小鼠没有大体尾部肿胀、尾部体积和纤维脂肪厚度的差异(图23c-23e,23g;p=ns)。有趣地并且类似于我们以前的体外发现,我们发现创伤的桥接部分中的淋巴管密度增加(图23h;p<0.01)。clavin等人,am.j.physiol.heartcirc.physiol.295:h2113-h2127(2008)。创伤的桥接部分是手术切除所有皮肤淋巴管的区域。因此,这表明由于lec在淋巴水肿的背景中对tgf-β1的无响应性,导致淋巴管生成改善。
flt4cre和对照小鼠之间炎性浸润细胞和细胞因子积聚的分析揭示,cd4+细胞和ifn-γ蛋白质积聚(两者均为p=ns)、f4/80+细胞或vegf-c蛋白积聚(p=ns)、tgf-β1+细胞和蛋白质积聚(图23b;p=ns),以及其激活的下游信号传导分子psmad3的细胞表达(图23g;p=ns)无差异。类似地,flt4cre和对照小鼠之间胶原i沉积没有显著差异(图23f,23g;p=ns)。这些发现表明tgf-β1在促进炎症、纤维化和最终淋巴功能障碍中的主要作用是在细胞外基质中,而其直接的抗淋巴管生成在淋巴水肿的背景中起相对较小的作用。
方法
研究设计
我们的假设是淋巴水肿可以通过tgf-β1抑制来治疗,从而减少炎症和纤维化二者。我们在几种不同的动物模型中探讨了此假设的不同方面,以让我们彻底评估损伤后的肿胀、炎症、纤维化、淋巴管功能和淋巴管生成。将成年雌性(10-14周龄)c57bl/6j小鼠(jacksonlaboratories,barharbor,me)保持在控制光和温度的无病原体环境中并随意进食。所有研究均获得了memorialsloanketteringcancercenter的机构动物护理和使用委员会(iacuc)的批准。在进行尾部手术后,若它们经历远端尾部坏死,则从实验中排除动物。在将动物随机化到治疗或对照组前进行此评估。每个实验使用最少6-8只动物进行,并且测定一式三份进行。所有计数由对干预不知情的审阅者进行。
动物模型和治疗
动物使用良好描述的淋巴水肿的小鼠尾部模型进行淋巴消融,其中尾部的浅表和深层淋巴系统通过在尾部中部的2mm的周边皮肤切除被切除。clavin等人,am.j.physiol.heartcirc.physiol.295:h2113-h2127(2008);avraham等人,am.j.pathol.177:3202-3214(2010);rutkowski等人,microvasc.res.72:161-271(2006);tabibiazar等人,plosmed.3:e254(2006)。我们小组和其他人以前已经显示了,这种模型在手术后导致远端尾部的持续淋巴水肿、淋巴功能的严重受损和临床淋巴水肿的组织学特征(如慢性炎症、脂肪沉积、纤维化)至少10周。clavin等人,am.j.physiol.heartcirc.physiol.295:h2113-h2127(2008);avraham等人,am.j.pathol.177:3202-3214(2010);rutkowski等人,microvasc.res.72:161-271(2006);tabibiazar等人,plosmed.3:e254(2006)。手术后七周,当淋巴水肿建立时,将动物随机化到实验组(吡非尼酮)或对照组,并且每日治疗一次持续3周,随后分析,如下文概述。
尾部模型可用于分析组织学组织变化(即纤维化和脂肪沉积);然而,由于集合管的口径小,这种模型对于分析淋巴泵送功能并不理想。因此,为了确定吡非尼酮在恢复集合淋巴系统的淋巴泵送能力方面的功效以及分析这种治疗对淋巴损伤区域远端的组织中淋巴增生的作用,我们进行了腘淋巴结清扫术(plnd),如前所述。blum等人,breastcancerres.treat.139:81-86(2013)。简言之,将50μl3%伊文思蓝注射入后爪后使淋巴系统可视。切除腘区中的集合淋巴系统以及腘淋巴结。手术后两周,将动物随机化到用全身性吡非尼酮或对照每天一次的治疗,持续2周,随后分析。
在全身性实验中,每天用吡非尼酮(caymanchemical,annarbor,mi)以溶解于pbs中10%dmso/0.5%羧甲基纤维素(cmc)的400mg/kg的剂量或用媒介物(在pbs中的10%dmso/0.5%cmc)口服治疗小鼠。该剂量是根据在各种纤维化模型中显示有效治疗方案的先前研究确定的。oku等人,eur.j.pharmacol.590:400-408(2008);kakugawa等人,eur.respir.j.24:57-65(2004);tanaka等人,chest142:1011-1019(2012)。吡非尼酮的局部制剂是与memorialsloanketteringcancercenter的researchpharmacycorefacility合作开发的。在这些实验中,每日用41%凡士林中1mg/ml的局部吡非尼酮(caymanchemical,annarbor,mi)治疗小鼠,而对照动物接受单独的媒介物(41%凡士林)。
为了研究淋巴水肿中tgf-β1的细胞来源,我们开发了非诱导型转基因小鼠,从t细胞和髓细胞中选择性敲除tgf-β1产生。来自jacksonlaboratories(barharbor,me),我们购买了在lck(淋巴细胞蛋白酪氨酸激酶)启动子控制下表达cre的b6.cg-tg(lck-cre)548jxm/j,使得loxp侧接的目标序列的胸腺细胞特异性切除。lck基因主要由t淋巴细胞表达,其中它磷酸化参与细胞内信号传导途径的蛋白质的酪氨酸残基。另外,我们从jacksonlaboratories(barharbor,me)购买了具有lysmcre敲入等位基因的b6.129p2-lyz2tm1(cre)ifo/j转基因株,其具有插入到溶菌酶2基因(lyz2)的第一编码atg中的核定位的cre重组酶;消除内源lyz2基因功能,并将nls-cre表达置于内源性lyz2启动子/增强子元件的控制下。将这些转基因小鼠中的每只与tgfb1tm2.1doe/j突变体小鼠(jacksonlaboratories,barharbor,me)杂交,所述突变体小鼠携带tgf-β1基因的侧接外显子6的loxp位点。结果,cre介导的重组导致t淋巴细胞和髓样细胞谱系(包括单核细胞、成熟巨噬细胞和粒细胞)中靶向基因(tgf-β1)的缺失。
为了研究tgf-β1对lec的直接作用,我们开发了在lec上具有非功能性tgf-β受体的诱导型转基因小鼠。我们使用flt4cre小鼠(sagrarioortega博士的赠品),其中这些小鼠中vegfr-3的flt4启动子处于雌激素受体2型(er2)的控制下,并且在成年小鼠中被所有lec高度表达。martinez-corral等人,proc.natl.acad.sci.usa109:6223-6228(2012)。我们将flt4cre小鼠与拥有转化生长因子β受体ii的侧接外显子4的loxp位点的b6;129-tgfbr2tm1karl/j(jacksonlaboratories,barharbor,me)突变体小鼠杂交。使用他莫昔芬(300mg/kg/天皮下5天)在成年雌性flt4cre小鼠中诱导cre表达。
对于所有转基因小鼠,通过基因型分型(transnetyx,memphis,tn)证实了这两个转基因的基因表达,并将双重纯合小鼠回交6代以确保一致性。此外,我们的实验室使用pcr、使用酶联免疫吸附测定(elisa)的蛋白质定量和组织学染色(见下文)对我们所有新开发的具有基因表达的转基因模型进行了验证性表型研究。
尾部体积、淋巴系闪烁造影术和组织学分析
使用淋巴损伤区域远端的多个数字卡尺尾部圆周测量分析尾部体积,并使用截锥公式计算,如前所述。clavin等人,am.j.physiol.heartcirc.physiol.295:h2113-h2127(2008)。如前所述,也进行淋巴系闪烁造影术,以通过将50μl过滤的锝(tc99m)硫胶体注入远端尾部,定量到骶淋巴结的淋巴流。avraham等人,fasebj.27:1114-1126(2013)。使用x-spect照相机(gammamedica,northridge,ca)在骶淋巴结中记录衰减调整的摄取,并且利用asipro软件(ctimolecularimaging,knoxville,tn)进行感兴趣区域分析。clavin等人,am.j.physiol.heartcirc.physiol.295:h2113-h2127(2008)。
对于组织学和免疫组织化学分析,收获尾部切片,在4%冰冷多聚甲醛(sigma-aldrich,st.louis,mo)中短暂固定,使用5%乙二胺四乙酸(edta;santacruz,santacruz,ca)脱钙,并且在石蜡中包埋。使用标准技术制备苏木精和曙红切片,并在每组最少6只动物中由两名不知情的审阅者通过在尾部的四个象限中测量皮肤和软组织的厚度在标准化的组织学截面中量化皮下组织厚度。
根据我们建立的技术进行免疫组织化学染色。avraham等人,am.j.pathol.177:3202-3214(2010)。将石蜡包埋的组织再水化,并使用沸腾的柠檬酸钠(sigma-aldrich,st.louis,mo)进行抗原暴露,随后用2%bsa/20%动物血清猝灭内源性过氧化物酶活性。将组织在4℃下与一抗温育过夜。用于免疫组织化学染色的一抗包括lyve-1、cd45和cd4(均来自r&d,minneapolis,mn)、f4/80、tgf-β1、psmad3、平足蛋白(均来自abcam,cambridge,ma)、α-sma(sigma-aldrich,st.louis,mo)、inos(bdbiosciences,sanjose,ca)和cd3(dakonorthamerica,inc.carpinteria,ca)。所有二抗获自vectorlaboratories。在使用mirax载玻片扫描仪(zeiss,munich,germany)扫描后分析载玻片。使用针对小鼠i型胶原的抗体(abcam,cambridge,ma)进行i型胶原免疫组织化学,并使用metamorphoffline软件(moleculardevices,sunnyvale,ca)定量为固定阈值内的阳性染色真皮面积与总计组织面积的比率。两名不知情的审阅者在高放大率切片上进行细胞计数,每组最少4-6只动物且4-5个hpf/动物。
蛋白质分析
在淋巴损伤远端1.5cm收集用于蛋白质分析的尾组织,快速冷冻,粉碎并用与磷酸酶和蛋白酶抑制剂(sigma-aldrich,st.louis,mo)混合的组织提取蛋白质试剂(thermofisherscientific,waltham,ma)提取。通过elisa分析来自样品(n=3-5个动物/组)的20-30mg蛋白质,以根据制造商的方案(ebioscience,sandiego,ca)定量tgf-β1、干扰素-γ(ifn-γ)和血管内皮生长因子c(vegf-c)。所有实验一式两份进行。
淋巴管功能的体内成像
为了评估后肢集合淋巴管的收缩性,在后足的背面皮内注射15μl0.15mg/ml吲哚菁绿(icg)(sigma-aldrich,saintlouis,mo)后,用近红外成像(nir)记录视频。注射后允许20分钟以允许摄取到集合管中。然后,使用定制的evosemccd照相机(lifetechnologies,carlsbad,ca)和led光源(coolled,andover,uk)对动物进行成像。使用zeissv12stereolumar显微镜(caliperlifesciences,hopkinton,ma)获得视频图像。每8秒钟获取图像30分钟。使用fiji软件(由国立卫生研究所(nationalinstitutesofhealth),bethesda,md开发的免费开源数据分析工具)分析淋巴泵送功能。在优势性集合管上选择感兴趣区域,并且随时间绘制噪声扣除的荧光强度。为了评估内在泵送功能,由于来自定位的淋巴刺激排除每个视频的最初10分钟,并且仅分析每个视频的最后20分钟。泵送功能以每分钟脉动量化。
基因表达pcr
为了确认来自t细胞和髓细胞的tgf-β1敲除的表型,从这些小鼠中收获脾脏。使用阳性选择cd3磁珠(miltenyibiotec,cambridge,ma)根据制造商的推荐从t细胞cre转基因小鼠的脾中分离t细胞。类似地,使用阳性选择cd11b磁珠(miltenyibiotec,cambridge,ma)根据制造商的推荐从髓样cre转基因小鼠的脾脏中分离髓样细胞。然后,将分离的细胞置于trizol中。使用标准trizol提取方法分离rna。chomczynski等人anal.biochem.162:156-159(1987);ribaudo等人,curr.protocolsimmunol.,(coligan等人编)第10章,第1011单元(2001)。使用taqman逆转录试剂(appliedbiosystems,fostercity,ca)进行逆转录,然后使用taqmanuniversalmastermix(appliedbiosystems)和lightcyclerthermocycler(rochediagnostics,indianapolis,in)进行定量逆转录酶聚合酶链式反应(rt-pcr)。相对于gapdh标准化tgf-β1表达水平。实验一式三份进行。
tgf-β1活性的调节
由于以前的研究表明,吡非尼酮的主要作用机制是阻断tgf-β1的活性,我们比较了在单独的研究中plnd后吡非尼酮治疗与tgf-β1免疫疗法的作用。schaefer等人,eur.respir.rev.20:85-97(2011)。重要的是,我们以前已经表明,针对tgf-β1的单克隆抗体不仅有效中和tgf-β1的生物活性,而且这种治疗显著降低淋巴水肿,改善淋巴功能。avraham等人,am.j.pathol.177:3202-3214(2010)。动物经历plnd,如上文概述,并且手术后两周随机化到以每周腹膜内递送三次在150μlpbs中稀释的5mg/kg剂量用单独的tgf-β单克隆小鼠中和抗体(tgfmab;克隆1d11;bio-x-cell,westlebanon,nh)或吡非尼酮加tgfmab的治疗。ruzek等人,immunopharmacol.immunotoxicol.25:235-257(2003)。用以与tgfmab相同的日程表腹膜内递送的吡非尼酮的媒介物对照或非特异性同种型抗体治疗对照动物。
统计分析
使用graphpadprism(graphpadsoftware,inc.,sandiego,ca)软件进行统计分析。student’st检验用于比较两组之间的差异。使用双因素anova及事后检验进行多个时间点(淋巴系闪烁造影术)之间的分析以比较各组。使用描述性分析和图形化方法对结果进行分析和总结。除非另有说明,数据以平均值±标准差表示,p<0.05认为是显著的。
结论
本研究的一个目的是分析吡非尼酮对淋巴水肿和淋巴损伤的临床前小鼠模型中淋巴水肿治疗的功效。使用两种不同的小鼠模型,我们显示全身性和局部吡非尼酮两者治疗建立的淋巴水肿,明显减少纤维化和改善淋巴功能。用吡非尼酮治疗减少慢性炎症反应,并且显著增加淋巴结切除术后淋巴集合管泵送能力。此外,吡非尼酮在预防淋巴损伤后的纤维化中是高度有效的,并且这种响应可能继发于tgf-β1的抑制。在我们的plnd模型中使用tgf-β1免疫疗法,我们显示吡非尼酮作为tgf-β1抑制的主要作用,并且在我们使用的剂量下实现了tgf-β1的最大抑制。此外,在我们的小鼠中使用我们的淋巴水肿的尾部模型,我们显示t细胞,特别是cd4+细胞是淋巴水肿背景中tgf-β1的主要来源。此外,我们显示,t细胞缺乏tgf-β1减少了淋巴水肿引起的慢性炎症,如cd4+细胞以及th1和th2细胞因子。
实施例3:使用特立氟胺治疗和预防淋巴水肿
为了测试特立氟胺在淋巴损伤后预防淋巴功能障碍中的功效,我们使用了良好描述的腘淋巴结清扫术(plnd)小鼠模型,其中使用小皮肤切口切除腘淋巴结。为了测试这种治疗在治疗已建立的淋巴水肿中的功效,我们使用淋巴水肿的小鼠尾部模型,其中尾部的浅表和深层淋巴系统被破坏,并且动物产生与临床疾病一致的组织学变化。
将动物随机化到plnd或尾部淋巴水肿组,并且手术后2周用特立氟胺的局部制剂(27mg/ml;tocrisbioscience,minneapolis,mn)或媒介物对照(aquaphor/甘油软膏剂)每日治疗一次,持续2-4周(plnd后2周;尾部淋巴水肿后4周)。我们的局部制剂是与memorialsloanketteringcancercenter的researchpharmacycorefacility合作开发的。然后处死小鼠,并淋巴功能、纤维化、淋巴管生成都使用标准测定法评估。
在尾部淋巴消融后用局部特立氟胺治疗小鼠显著降低淋巴水肿和纤维脂肪沉积,即疾病的组织学标志(图24)。虽然对照小鼠具有明显的尾部肿胀和纤维化(由不对称的胶原沉积引起的固定的“j构造”),特立氟胺治疗的小鼠在淋巴损伤后6周具有基本正常外观的尾部(图24a)。这些大体变化对应于特立氟胺治疗的小鼠中尾部体积减少几乎6倍(图24b)。对照小鼠尾部的组织学横截面显示出纤维脂肪组织的显著积聚;相比之下,特立氟胺治疗的小鼠具有最小的脂肪组织沉积(图24c,24d)。该发现通过i型胶原免疫荧光染色证实,证明在对照动物中胶原纤维包被浅表淋巴系统并且在损伤后6周在特立氟胺治疗的动物中胶原沉积明显减少(图25a,25b)。此外,特立氟胺减少了围绕集合淋巴系统的α平滑肌细胞的增殖,从而维持了这些管的更正常的解剖结构(图25c,25d)。
为了确定特立氟胺疗法是否减少cd4+细胞的浸润,我们接下来使用靶向cd4的免疫荧光抗体分析来自对照和治疗小鼠的组织切片(图26a,26b)。与对照相比,该分析证明了从特立氟胺治疗的动物收获的cd4+细胞浸润尾组织显著减少。事实上,特立氟胺疗法将cd4+细胞浸润数减少了多于8倍(p<0.001)。
最近的研究显示了,cd4+细胞产生有力的抗淋巴管生成细胞因子,包括干扰素γ、白细胞介素-4(il4)和il13。与此一致,我们发现用特立氟胺治疗经历plnd的动物显著地增加了(4.5倍;p<0.001)绕过损伤区的侧支淋巴管的形成,如使用吲哚菁绿(icg)近红外成像评估(图27a)。类似地,与对照相比,在尾部淋巴消融后用特立氟胺治疗小鼠导致跨过损伤区的新形成的淋巴系统的显著增加(图27b)。特立氟胺动物中侧支淋巴系统的再生显著降低了真皮中淋巴管的渗漏,使更多量的间质液体能够在近端传播(图28)。
特立氟胺治疗小鼠现有淋巴系统中新形成的淋巴系统和减少的病理改变转换成明显改善的淋巴功能,如通过树突细胞(dc)迁移分析。dc通过淋巴管从外周组织迁移到局部淋巴结以呈递抗原并促进适应性免疫应答。使用标准测定法(fitc绘画)分析plnd后的特立氟胺动物中的dc运输证明与对照相比,已经运输到腹股沟淋巴结(腘淋巴结后一系列中的下一淋巴结)的dc数目增加了多于5倍(图29a,29b)。由于dc只能通过淋巴系统运输,此发现提供了特立氟胺增加淋巴功能的实质证据。
集合淋巴管使用通过周围平滑肌细胞的活性收缩和防止回流的单向阀在近端使淋巴传播。与我们发现特立氟胺增加淋巴转运功能并减少淋巴管周围的α平滑肌细胞的纤维化/增殖相一致,我们发现这种治疗也显著增加了集合淋巴泵送(图30)。plnd后特立氟胺治疗几乎使主要后肢集合淋巴系统的频率翻倍,从而增加淋巴液的近端传播。
我们第一次描述使用特立氟胺预防和治疗淋巴水肿。我们的研究结果显示了,淋巴损伤后用特立氟胺治疗实质性降低淋巴水肿和纤维脂肪组织沉积。此外,我们显示这种作用与cd4+t细胞的浸润减少、增加的侧支淋巴系统形成、降低的淋巴泄漏和改善的淋巴功能相关。这些发现是新颖的,因为它们为淋巴水肿提供了靶向疗法,所述淋巴水肿以前仅用姑息干预治疗。
实施例4:使用卡托普利治疗和预防淋巴水肿
如上所述,我们使用plnd模型测试卡托普利在预防淋巴损伤后淋巴功能障碍中以及在治疗使用小鼠尾部模型建立的淋巴水肿中的功效。动物用卡托普利(5%)或媒介物对照(凡士林或aquaphor/甘油软膏剂)的局部制剂每天一次治疗2-4周(plnd后2周,尾部淋巴水肿后4周)。然后处死小鼠,并使用标准测定法评估淋巴功能、纤维化和淋巴管生成。用局部卡托普利治疗导致plnd模型中淋巴功能改善和尾部模型淋巴水肿减少。图31-53中显示了结果。
实施例5:使用药物组合治疗和预防淋巴水肿
使用plnd和小鼠尾部模型,如实施例1-4所述,对动物施用包含抗纤维化药物或媒介物对照组合的局部制剂。治疗组合物示于表1中。
表1.用于治疗和预防淋巴水肿的药物组合
小鼠每日一次治疗2-4周(plnd后2周;尾部淋巴水肿后4周)。然后处死小鼠,并淋巴功能、纤维化、淋巴管生成都使用标准测定法评估。在plnd模型中,与用单一抗纤维化药物治疗相比,用局部抗纤维化药物的组合治疗导致改善的淋巴功能。同样,在尾部模型中,与用单一抗纤维化药物治疗相比,用局部抗纤维化药物的组合治疗导致淋巴水肿降低。除了更有效之外,组合产生协同效应,使得组合中施用的每种药物的有效剂量低于单独施用的每种药物的有效剂量。
***
具体实施方案的前述描述将充分揭示本发明的一般性质,其他人在不偏离本发明的一般构思的情况下,可以通过应用本领域技术范围内的知识,为了各种应用而无需过度实验容易地修改和/或改变此类具体实施方案。因此,基于本文呈现的教导和指导,此类改变和修改旨在在所公开的实施方案的等同方案的含义和范围内。应当理解,本文中的措词或术语是为了描述而不是限制的目的,使得本说明书的术语或措辞将由技术人员根据教导和指导来解释。本发明由所附权利要求书进一步描述。
- 还没有人留言评论。精彩留言会获得点赞!