有效处理感染真菌病原体的植物的杀真菌剂增强剂的制作方法
本发明总体上涉及杀真菌剂领域,更具体地,涉及杀真菌剂处理感染真菌病原体的植物的增强功效。
背景技术:
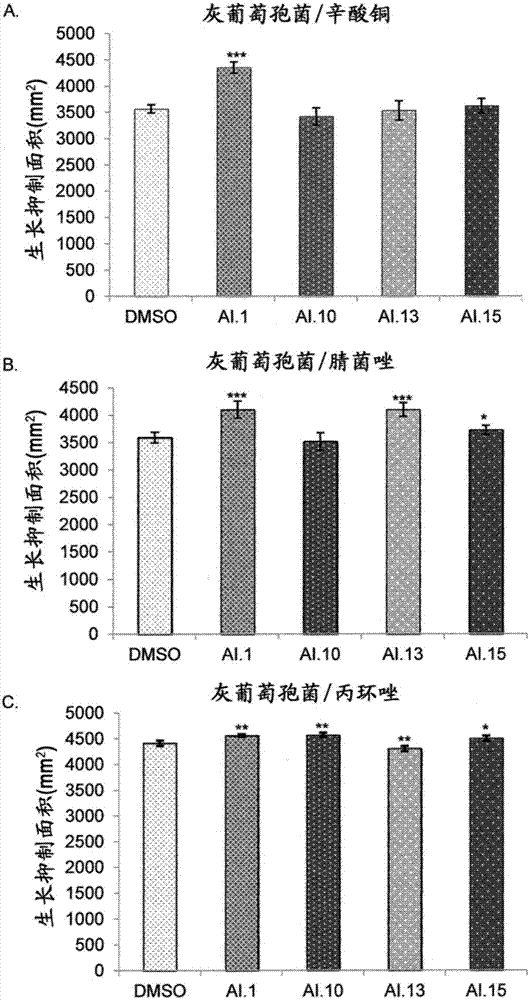
:不限制本发明的范围,该背景涉及可用于处理感染真菌病原体的植物的杀真菌剂组合物。真菌病原体在全世界造成作物和采后果实的毁灭性损失(chen等,2008)。已经以高剂量和频繁的间隔使用很多化学杀真菌剂,以通过杀死不同的真菌物种来防止这些损失。2005年杀真菌剂的全球市场估计超过74亿(morton和staub,2008),预计到2017年将达到超过200亿美元(israel,2013年)。为减少作物疾病的风险并增强食品安全性和保护环境,应当开发新的有效的杀真菌剂或策略以增强目前杀真菌剂的效力。杀真菌剂效力的一个限制是真菌能够通过将其隔离或通过质膜将其排出来快速将其解毒。真菌使用多种机制去除外源性化学物,很明显,对这些过程的任何抑制都会增加杀真菌剂的效力。植物也通过将其排出来解毒外源性化学物。先前的报道记录了abcb1同源物(atpgp1)或三磷酸腺苷双磷酸酶(apyrase,ntpdase)(atapy1)的过表达赋予拟南芥(a.thaliana)植物多种除草剂抗性(windsor等,2003)。此外,三磷酸腺苷双磷酸酶活性的抑制剂抑制植物排出除草剂的能力,从而增加它们对这些毒素的敏感性(windsor等,2003)。一些三磷酸腺苷双磷酸酶的主要功能是帮助维持细胞外atp(eatp)的低稳定状态(knowles,2011;lim等,2014),这已知是植物和动物中各种反应的调节剂(clark等,2014)。总之,windsor等(2003)的数据支持三磷酸腺苷双磷酸酶和abc转运蛋白在除草剂抗性中的双重作用,并表明破坏三磷酸腺苷双磷酸酶活性或外源添加atp可以抑制abc的转运活性,从而阻断有毒化合物的持续流出。发明简述三磷酸腺苷双磷酸酶抑制剂ai.1{n-(间甲苯基)-[1,1’-联苯基]-4-磺胺}、ai.10{2-氧代-2h-苯并吡喃-3-硫代甲酸s-庚基酯}、ai.13{3-(n-(4-溴苯基)氨磺酰)-n-(3-硝基苯)苯甲酰胺}和ai.15{(e)-3-甲基-n’-(1-(萘-2-基)亚乙基)苯甲酰肼}差异性增强铜和三唑杀真菌剂对植物致病真菌的影响。易于增强的优选杀真菌剂是辛酸铜、氢氧化铜、腈菌唑、丙环唑、戊唑醇、氟环唑、苯醚甲环唑、灭菌唑和丙硫菌唑。选择的杀真菌剂和增强剂的组合提供对植物致病真菌的协同杀真菌活性。在一个实施方案中,本发明包括处理感染真菌病原体或有感染真菌病原体风险的植物或植物种子的组合物和方法。本发明的组合物包含杀真菌剂和增强剂的制剂和植物学上可接受的惰性载体。杀真菌剂选自铜化合物杀真菌剂或三唑杀真菌剂,例如辛酸铜、氢氧化铜、腈菌唑、丙环唑、戊唑醇、氟环唑、苯醚甲环唑、灭菌唑或丙硫菌唑。用作增强剂的三磷酸腺苷双磷酸酶抑制剂的实例包括:-ai.1:n-(间甲苯基)-[1,1’-联苯基]-4-磺胺,-ai.10:2-氧代-2h-苯并吡喃-3-硫代甲酸s-庚基酯,-ai.13:3-(n-(4-溴苯基)氨磺酰)-n-(3-硝基苯)苯甲酰胺,或-ai.15:(e)-3-甲基-n’-(1-(萘-2-基)亚乙基)苯甲酰肼。在本发明的组合物中,其中杀真菌作用是协同作用的杀真菌剂和增强剂的重量比为约500:1-5000:1。本发明的另一个实施方案涉及处理感染植物致病真菌或有感染植物致病真菌风险的植物或植物种子。处理包括将植物与杀真菌剂和增强剂的制剂接触,其中所述杀真菌剂是辛酸铜、氢氧化铜、腈菌唑、丙环唑、戊唑醇、氟环唑、苯醚甲环唑、灭菌唑或丙硫菌唑,且所述增强剂是ai.1、ai.10、ai.13或ai.15。本发明的制剂针对以下植物真菌病原体尤其有效:灰葡萄孢菌(botrytiscinerea)、禾生炭疽病菌(colletotrichumgraminicola)、尖孢镰刀菌(fusariumoxysporum)、油菜菌核病菌(sclerotianasclerotiorum)、大丽轮枝菌(verticilliumdahlia)、禾生球腔菌(mycospharellagramincola)和高粱丝黑穗菌(sphacelothecareliana)。在另一个实施方案中,本发明包括足以处理真菌的量的杀真菌剂和三磷酸腺苷双磷酸酶抑制剂,其中所述杀真菌剂包含铜或三唑杀真菌剂。在一个方面,三磷酸腺苷双磷酸酶抑制剂选自以下至少之一:n-(间甲苯基)-[1,1’-联苯基]-4-磺胺、2-氧代-2h-苯并吡喃-3-硫代甲酸s-庚基酯、3-(n-(4-溴苯基)氨磺酰)-n-(3-硝基苯)苯甲酰胺或(e)-3-甲基-n’-(1-(萘-2-基)亚乙基)苯甲酰肼。在另一个方面,将杀真菌剂加入用于生长细胞的生长培养基。在另一个方面,细胞选自以下之一:细菌、真菌、植物、动物、哺乳动物、酵母、两栖动物、禽类、线虫或昆虫细胞。在另一个方面,组合物是协同的,且杀真菌剂和三磷酸腺苷双磷酸酶抑制剂的重量比为约500:1-5000:1。还在另一个实施方案中,本发明包括处理对铜类或三唑杀真菌剂耐药的真菌病原体感染的方法,所述方法包括:将真菌病原体与包含铜类或三唑和真菌三磷酸腺苷双磷酸酶抑制剂组合的组合物接触,其中所述真菌三磷酸腺苷双磷酸酶抑制剂防止真菌将杀真菌剂解毒或排出杀真菌剂。在一个方面,杀真菌剂选自至少以下之一:辛酸铜、丙环唑、戊唑醇或氟环唑。在另一个方面,真菌病原体是选自至少以下之一的植物病原体:灰葡萄孢菌、禾生炭疽病菌、尖孢镰刀菌、油菜菌核病菌、大丽轮枝菌、禾生球腔菌或高粱丝黑穗菌。在另一个方面,真菌病原体是植物病原体,且处理的植物是结果实的植物、蔬菜植物、坚果植物或谷类植物。在另一个方面,真菌病原体是植物病原体,且处理的植物是草莓、香蕉、玉米、大豆、烟草、小麦或棉花。在另一个方面,组合物是协同的,且杀真菌剂和三磷酸腺苷双磷酸酶抑制剂的重量比为约500:1-5000:1。附图说明为更全面地了解本发明的特征和优点,现在参考附图详细描述本发明,其中:图1是显示从不同植物和真菌物种表征的三磷酸腺苷双磷酸酶之间的系统发育关系的系统树图。该树是基于从不同植物和真菌报道的三磷酸腺苷双磷酸酶基因序列推导的氨基酸序列构建的:拟南芥三磷酸腺苷双磷酸酶1(登录号np_187058)、拟南芥三磷酸腺苷双磷酸酶2(登录号np_001154717)、豌豆(pisumsativum)(登录号baa75506)、灰葡萄孢菌(登录号xp_001558134)、禾生炭疽病菌(登录号efq33146)、尖孢镰刀菌(登录号enh75262)、油菜菌核病菌(登录号xp_001590729)和大丽轮枝菌(登录号egy20804)。图2a-2c是显示差异性增强三种不同杀真菌剂的效力的三磷酸腺苷双磷酸酶抑制剂的图。2a.辛酸铜,2b.丙环唑,和2c.腈菌唑,针对致病真菌灰葡萄孢菌。于30℃在65μm三磷酸腺苷双磷酸酶抑制剂(ai#1、10、13和15)存在下,将植物致病真菌菌株(灰葡萄孢菌)在ypd培养基的培养皿中生长12天。加入等体积的二甲基亚砜(dmso)作为对照。重复研究两次,结果相似。误差条表示标准偏差(n=5)。示出了杀真菌剂效力的显著性。***(studentt检验,p<0.001);**(studentt检验,p<0.01)或*(studentt检验,p<0.05)。图3a-3c是显示差异性增强三种不同杀真菌剂的效力的三磷酸腺苷双磷酸酶抑制剂的图。3a.辛酸铜,3b.丙环唑,和3c.腈菌唑,针对致病真菌禾生炭疽病菌。于30℃在65μm三磷酸腺苷双磷酸酶抑制剂(ai#1、10、13和15)存在下,将植物致病真菌菌株(禾生炭疽病菌)在ypd培养基的培养皿中生长7天。加入等体积的二甲基亚砜(dmso)作为对照。重复研究两次,结果相似。误差条表示标准偏差(n=5)。示出了杀真菌剂效力的显著性。***(studentt检验,p<0.001);**(studentt检验,p<0.01)或*(studentt检验,p<0.05)。图4a-4c是显示差异性增强三种不同杀真菌剂的效力的三磷酸腺苷双磷酸酶抑制剂的图。4a.辛酸铜,4b.丙环唑,和4c.腈菌唑,针对致病真菌尖孢镰刀菌。于30℃在65μm三磷酸腺苷双磷酸酶抑制剂(ai#1、10、13和15)存在下,将植物致病真菌菌株(尖孢镰刀菌)在ypd培养基的培养皿中生长12天。加入等体积的二甲基亚砜(dmso)作为对照。重复研究两次,结果相似。误差条表示标准偏差(n=5)。示出了杀真菌剂效力的显著性。***(studentt检验,p<0.001);**(studentt检验,p<0.01)或*(studentt检验,p<0.05)。图5a-5c是显示差异性增强三种不同杀真菌剂的效力的三磷酸腺苷双磷酸酶抑制剂的图。5a.辛酸铜,5b.丙环唑,和5c.腈菌唑,针对致病真菌油菜菌核病菌。于30℃在65μm三磷酸腺苷双磷酸酶抑制剂(ai#1、10、13和15)存在下,将植物致病真菌菌株(油菜菌核病菌)在ypd培养基的培养皿中生长7天。加入等体积的二甲基亚砜(dmso)作为对照。重复研究两次,结果相似。误差条表示标准偏差(n=5)。示出了杀真菌剂效力的显著性。***(studentt检验,p<0.001);**(studentt检验,p<0.01)或*(studentt检验,p<0.05)。图6a-6c是显示差异性增强三种不同杀真菌剂的效力的三磷酸腺苷双磷酸酶抑制剂的图。6a.辛酸铜,6b.丙环唑,和6c.腈菌唑,针对致病真菌大丽轮枝菌。于30℃在65μm三磷酸腺苷双磷酸酶抑制剂(ai#1、10、13和15)存在下,将植物致病真菌菌株(大丽轮枝菌)在ypd培养基的培养皿中生长12天。加入等体积的二甲基亚砜(dmso)作为对照。重复研究两次,结果相似。误差条表示标准偏差(n=5)。示出了杀真菌剂效力的显著性。***(studentt检验,p<0.001);**(studentt检验,p<0.01)或*(studentt检验,p<0.05)。图7示出了研究的三磷酸腺苷双磷酸酶抑制剂(ai)的示例性化学结构和系统命名。发明详述尽管以下详细讨论了本发明的各种实施例的制作和使用,但是应当理解,本发明提供了许多适用的发明概念,其可以在各种具体的上下文中体现。这里讨论的具体实施方案仅仅是制造和使用本发明的具体方式的说明,而不限制本发明的范围。如本文所用,术语“增强剂”、“增效剂”是指抑制酶促的三磷酸腺苷双磷酸酶活性(“三磷酸腺苷双磷酸酶抑制剂”、“ai”或“ai”)从而增强、强化或增效杀真菌剂的一种或多种化合物。例如,当增强剂或增效剂与杀真菌剂联合使用时,增效剂和杀真菌剂的组合由于增效剂的活性而增强杀真菌剂的杀真菌作用和/或使得已经对杀真菌剂耐药的真菌对杀真菌剂敏感。最经常的,这些增强剂或增效剂对真菌本身或已经(或可能)感染真菌的活生物体没有不利的活性。本发明的增效剂是靶向对杀真菌剂耐药的真菌的三磷酸腺苷双磷酸酶抑制剂。本发明的增效剂的非限制性实例包括:n-(间甲苯基)-[1,1’-联苯基]-4-磺胺(三磷酸腺苷双磷酸酶抑制剂1或ai.1)、2-氧代-2h-苯并吡喃-3-硫代甲酸s-庚基酯、3-(n-(4-溴苯基)氨磺酰)-n-(3-硝基苯)苯甲酰胺(ai.10)、3-(n-(4-溴苯基)氨磺酰)-n-(3-硝基苯)苯甲酰胺(ai.13)和/或(e)-3-甲基-n’-(1-(萘-2-基)亚乙基)苯甲酰肼(ai.15)。图7示出了研究的三磷酸腺苷双磷酸酶抑制剂(ai)的示例性化学结构和系统名称。在一些实施方案中,杀真菌剂增强剂或增效剂导致次优量的杀真菌剂成为处理真菌的最佳量,从而降低处理真菌所需的杀真菌剂的量。鉴于由于过度使用杀真菌剂,真菌对杀真菌剂的耐药性增加,本发明不仅使耐药真菌再次变得敏感,还由于使用较低剂量方案而预期减少真菌对杀真菌剂变得耐药的机会。三磷酸腺苷双磷酸酶是统一特征为能够水解atp的γ磷酸盐以及较小程度的adp的β磷酸盐的酶。大多数三磷酸腺苷双磷酸酶表达为质膜相关蛋白,其水解活性面对细胞外基质。细胞外三磷酸腺苷双磷酸酶通常称为外-三磷酸腺苷双磷酸酶。外-三磷酸腺苷双磷酸酶通常水解细胞外atp。对杀真菌剂的真菌耐药性通常由真菌引起,其通过例如隔离杀真菌剂或通过质膜排出杀真菌剂来发展快速解毒杀真菌剂的能力。真菌利用多种机制来去除这些外源性化学物,因而对抗这种效果一直很难。抑制真菌对外源性化合物解毒的耐药性可以增加杀真菌剂的效力和/或使已经对杀真菌剂变得耐药的真菌变得再次敏感。本发明的化合物可以以组合物的形式施用,所述组合物包含杀真菌剂、本发明的三磷酸腺苷双磷酸酶抑制剂和例如任选的植物学上可接受的载体或稀释剂。这些组合物通常是可以在水或另一种液体中稀释的适于施用的浓缩制剂。在一些实施方案中,组合物还可以配制为不经进一步处理而喷雾或施用的颗粒或颗粒制剂。如本文所用,术语“植物学上可接受的”是指通常适用于在其生命周期的任何部分期间的植物的任何部分(包括但不限于种子、幼苗、植物细胞、植物或花)的组合物、稀释剂、赋形剂和/或载体。可以根据农业领域常规的程序、方法和配方来制备组合物。根据本发明的教导,农业和/或化学领域的技术人员能够容易制备所需的组合物。更通常的,本发明的化合物可以配制为纯制备或从组合物的浓缩制剂制备的水性或非水性悬浮液或乳剂而储存和/或施用。也可以将水溶性、水可悬浮或可乳化制剂转化为或配制为固体(例如可湿性粉末),其然后可以被稀释为最终制剂。在一些实施方案中,本发明的组合物也可以提供于生长培养基中,例如用于生长植物或其他类型细胞的离体培养基,提供于实验室植物生长培养基中,提供于土壤中,或提供用于向种子、幼苗、根、茎、秆、叶、花或整株植物喷洒。本发明人认识到,三磷酸腺苷双磷酸酶抑制剂通过抑制abcb转运活性来抑制植物细胞排出除草剂产生这样的可能性:它们可以抑制杀真菌剂从致病真菌排出,从而增强杀真菌剂的效力。abc转运蛋白通过排出杀真菌剂在帮助致病真菌对杀真菌剂的耐药性方面起重要作用(kretschmer等,2009)。不可能预测植物三磷酸腺苷双磷酸酶抑制剂对真菌abc转运蛋白有效(因为它们针对植物abcb转运蛋白),或者它们可以增强杀真菌剂的杀真菌效力,正如它们增强除草剂的除草效力一样。三磷酸腺苷双磷酸酶在动物细胞和植物细胞中得到很好研究,但在植物致病真菌中较少被表征(knowles等,2011;clark等,2014)。真菌外生磷酸酶被更好地表征,且也可以水解atp和adp,尽管它们对这些底物的km远远高于三磷酸腺苷双磷酸酶。已经表明,三磷酸腺苷双磷酸酶在营养、增殖、分化、粘附、毒力和感染过程中发挥重要作用,因此它们可以其他方式影响真菌对杀真菌剂的耐药性。粘附至宿主细胞是建立真菌感染的第一步,且外生磷酸酶可能是与宿主细胞接触的初始寄生蛋白之一。一些结果表明,外生磷酸酶活性增加真菌粘附至宿主细胞的效力(freitas-mesquitaal等,2014)。本发明首次证明,特异性三磷酸腺苷双磷酸酶抑制剂增强常用杀真菌剂的效力,以更有效地限制几种植物致病真菌物种的生长。在一些非限制性实施方案中,可以以下浓度提供三磷酸腺苷双磷酸酶抑制剂:在最终组合物中的0.01、0.05、0.1、0.5、1.0、1.1、1.2、1.3、1.4、1.5、1.6、1.7、1.8、1.9、2.0、2.5、3.0、4.0、5.0、7.5和10%(w/w)。当以液体形式提供时,可以以下浓度提供三磷酸腺苷双磷酸酶抑制剂:在最终组合物中的0.01、0.05、0.1、0.5、1.0、1.1、1.2、1.3、1.4、1.5、1.6、1.7、1.8、1.9、2.0、2.5、3.0、4.0、5.0、7.5和10%(v/v)。本领域技术人员将理解,杀真菌剂和三磷酸腺苷双磷酸酶抑制剂的制剂可以以使用前可以稀释的浓缩物提供,或可以以准备用于处理的稀释形式提供。为测试目的,本发明所用的各种杀真菌剂和抑制剂以某一浓度使用。本领域技术人员将理解,以各种浓度和制剂商业使用各种组合物。例如,由于例如环境规定,杀真菌剂通常以14-30%的浓度商业应用。本发明发现了已知由于真菌耐药性增加而变得不太有效的各种杀真菌剂,例如铜和三唑杀真菌剂的特殊用途。例如,丙环唑是三唑类杀真菌剂(市场份额最大的杀真菌剂组)的成员之一。丙环唑用于水果、蔬菜、中耕作物和草坪草以控制多种真菌疾病。腈菌唑也是三唑类杀真菌剂的成员。腈菌唑用于水果、蔬菜、中耕作物和草坪草以控制多种真菌疾病。辛酸铜是铜化合物类杀真菌剂(美国所用的市场份额第二大类杀真菌剂)的成员之一。辛酸铜主要用于水果和蔬菜以控制多种真菌疾病。本发明期望提供对植物真菌病原体,例如灰葡萄孢菌、禾生炭疽病菌、尖孢镰刀菌、油菜菌核病菌、大丽轮枝菌、禾生球腔菌和高粱丝黑穗菌特别有效的杀真菌剂制剂。灰葡萄孢菌是攻击全球超过200种作物宿主的具有死体营养型生活方式的空气传播的植物病原体。它主要攻击双子叶植物物种,包括重要的蛋白质、油、纤维和园艺作物、葡萄和草莓。许多类型的杀真菌剂由于其遗传可塑性而未能控制灰葡萄孢菌(williamson等,2007)。灰葡萄孢菌还在储存、运输期间和在市场上导致水果和蔬菜的二次软腐(gonzález等,2006)。炭疽病菌属包含~600个物种,攻击超过3200种单子叶和双子叶植物。禾生炭疽病菌主要感染玉米,仅在美国每年造成约10亿美元的损失(connell等,2012)。1874年,在澳大利亚首次报道了香蕉镰刀菌萎蔫病,其是由土壤传播的真菌尖孢镰刀菌古巴转化型(fusariumoxysporumf.sp.cubense)引起。香蕉镰刀菌萎蔫病是全世界香蕉生产的主要威胁。一旦植物被感染,目前没有能有效控制该疾病的杀真菌剂(pengj等,2014)。已知白霉菌油菜菌核病菌攻击超过400种宿主物种,且被认为是范围最广的植物病原体之一。这些物种的大部分是双子叶,以及一些农业上重要的单子叶植物(bolton等,2006)。被油菜菌核病菌侵袭的一些重要作物包括豆科植物(大豆)、大多数蔬菜、核果和烟草。子囊菌大丽轮枝菌是土壤携带的真菌植物病原体,其在广泛范围的双子叶宿主物种中引起维管枯萎病(klosterman等,2009)。在棉花和其他重要作物例如蔬菜、纤维类、果实、坚果树、林木和观赏植物中,大丽轮枝菌可以造成严重的产量和质量损失(bhat和subbarao,1999;pegg和brady,2002)。子囊菌真菌禾生球腔菌(无性型:小麦壳针孢)是小麦叶最重要的叶面疾病之一,发生在小麦种植的地方。由该疾病引起的产量损失为25-50%,在欧洲、地中海地区和东非尤其高。禾生球腔菌感染是由上一季作物的残留物产生的空气传播的子囊孢子引发的。初次感染通常发生在春季或秋季幼苗出现后。成熟疾病的特征在于感染植物的叶和茎上的坏死病变。担子菌真菌高粱丝黑穗菌系统性感染玉米,造成丝黑穗病。该疾病引起的产量损失是变化的,直接取决于该疾病的发生率。真菌在作物碎片或土壤中作为二倍体冬孢子过冬。花结构被转化为含有大量类似于瘤黑粉病成熟虫瘿的粉状冬孢子的孢子囊群。具体实施方式植物致病真菌菌株灰葡萄孢菌、禾生炭疽病菌、尖孢镰刀菌、油菜菌核病菌和大丽轮枝菌从植物基因组学与生物技术研究所,texasa&muniversity,usa获得。常规使用马铃薯葡萄糖琼脂(pda,sigma-aldrich)来生长不同的致病真菌菌株。在本研究中使用外生磷酸酶抑制剂ngxt191(ai.1)、ai.10、ngxt1913(ai.13)和ai.15。使用杀真菌剂辛酸铜(c16h30cuo4)、腈菌唑(c15h17cln4)和丙环唑(c15h17cl2n3o2)。这些化合物的使用浓度为辛酸铜(285mm)、腈菌唑(53.6mm)和丙环唑(418mm)。真菌生长测试:进行标准抗真菌药敏盘试验以测定外生磷酸酶抑制剂对致病真菌生长的任何增效作用。将致病真菌野生型菌株在pda培养基上涂板,其中含有杀真菌剂的纸盘在板中心。板含有外生磷酸酶抑制剂(65μm)或同等浓度的dmso溶剂(作为对照),所述dmso溶剂单独应用时不影响致病真菌的生长。根据真菌的生长速度,将板在30℃孵育7天(禾生炭疽病菌和油菜菌核病菌)或12天(灰葡萄孢菌、尖孢镰刀菌和大丽轮枝菌)。将板拍照,并用imagejtm软件(nih,usa)测量真菌生长抑制区。所有测试重复5次。研究进行2次。用studentt检验分析结果的显著性。三磷酸腺苷双磷酸酶的序列和系统发生分析:将来自不同植物和致病真菌的三磷酸腺苷双磷酸酶(核苷酸三磷酸-二磷酸水解酶)的推导的氨基酸序列进行比较。制备拟南芥三磷酸腺苷双磷酸酶1(登录号np_187058)、拟南芥三磷酸腺苷双磷酸酶2(登录号np_001154717)、豌豆(登录号baa75506)、灰葡萄孢菌(登录号xp_001558134)、禾生炭疽病菌(登录号efq33146)、尖孢镰刀菌(登录号enh75262)、油菜菌核病菌(登录号xp_001590729)和大丽轮枝菌(登录号egy20804)。推导的氨基酸序列的多重比对显示,来自不同致病真菌的三磷酸腺苷双磷酸酶的一级结构的c末端大小与其他已知植物三磷酸腺苷双磷酸酶不同,但保留了功能上重要的保守的gda1/cd39(核苷磷酸酶)超家族结构域。在研究的五种真菌中,灰葡萄孢菌没有糖激酶/hsp70/肌动蛋白超家族结构域的核苷酸结合区域,但该区域存在于禾生炭疽病菌、尖孢镰刀菌、油菜菌核病菌和大丽轮枝菌中。系统发生树显示,禾生炭疽病菌和大丽轮枝菌彼此接近且位于同一分支上,而灰葡萄孢菌、尖孢镰刀菌和油菜菌核病菌位于不同分支上(图1)。三磷酸腺苷双磷酸酶抑制剂抑制植物真菌病原体的生长:在本研究中使用外生磷酸酶(三磷酸腺苷双磷酸酶)抑制剂的以下实例:ai.1:n-(间甲苯基)-[1,1’-联苯基]-4-磺胺。ai.10:2-氧代-2h-苯并吡喃-3-硫代甲酸s-庚基酯。ai.13:3-(n-(4-溴苯基)氨磺酰)-n-(3-硝基苯)苯甲酰胺。ai.15:(e)-3-甲基-n’-(1-(萘-2-基)亚乙基)苯甲酰肼。如通过使用的平板测定(wang等,2012)所判断并在以下章节详细描述的,这些三磷酸腺苷双磷酸酶抑制剂差异性地增强铜化合物和三唑杀真菌剂(辛酸铜、腈菌唑、丙环唑、戊唑醇或氟环唑)对植物致病真菌的作用。当在真菌平板测定中单独测试各个化合物(为方便起见,以上分别简写为ai.1、ai.10、ai.13和ai.15)时,没有检测到杀真菌活性。测试的三磷酸腺苷双磷酸酶抑制剂对真菌生长没有作用。实施例1:灰葡萄孢菌在补充有三磷酸腺苷双磷酸酶抑制剂ai.1、ai.10、ai.13和ai.15的杀真菌剂(辛酸铜、腈菌唑和丙环唑)存在下生长致病真菌灰葡萄孢菌。与单独的辛酸铜相比,辛酸铜与抑制剂ai.1组合对灰葡萄孢菌的生长具有显著更大的抑制效果(22%)(图2a)。同样,与单独的腈菌唑相比,腈菌唑与抑制剂ai.1、ai.13和ai.15组合对灰葡萄孢菌的生长具有显著更大的抑制效果(图2b)。与单独的丙环唑相比,杀真菌剂丙环唑与抑制剂ai.1、ai.13和ai.15组合对灰葡萄孢菌的生长具有更大的抑制效果(图2c)。实施例2:禾生炭疽病菌在补充有三磷酸腺苷双磷酸酶抑制剂ai.1、ai.10、ai.13和ai.15的杀真菌剂(辛酸铜、腈菌唑和丙环唑)存在下生长致病真菌禾生炭疽病菌。与单独的辛酸铜相比,辛酸铜与抑制剂ai.1和ai.13组合对禾生炭疽病菌的生长具有显著更大的抑制效果(图3a)。在抑制剂ai.1、ai.10、ai.13和ai.15存在下,杀真菌剂腈菌唑比单独的腈菌唑对禾生炭疽病菌的生长具有显著更大的抑制效果(图3b)。四种抑制剂与丙环唑一起都不能比单独使用的丙环唑更显著地抑制真菌的生长(图3c)。实施例3:尖孢镰刀菌古巴转化型在补充有三磷酸腺苷双磷酸酶抑制剂ai.1、ai.10、ai.13和ai.15的杀真菌剂(辛酸铜、腈菌唑和丙环唑)存在下生长致病真菌尖孢镰刀菌。与单独的辛酸铜相比,辛酸铜与抑制剂ai.1和ai.13组合对尖孢镰刀菌的生长具有显著更大的抑制效果(图4a)。抑制剂ai.10存在下的杀真菌剂腈菌唑比单独的腈菌唑对尖孢镰刀菌的生长具有显著更大的抑制效果(图4b)。在ai.10存在下,杀真菌剂丙环唑比单独的丙环唑对尖孢镰刀菌的生长具有显著更大的抑制效果(图4c)。实施例4:油菜菌核病菌在补充有三磷酸腺苷双磷酸酶抑制剂ai.1、ai.10、ai.13和ai.15的杀真菌剂(辛酸铜、腈菌唑和丙环唑)存在下生长致病真菌油菜菌核病菌。与单独的辛酸铜相比,辛酸铜与抑制剂ai.1、ai.10、ai.13和ai.15组合对油菜菌核病菌的生长具有显著更大的抑制效果(图5a)。抑制剂ai.1、ai.10、ai.13和ai.15存在下的腈菌唑比单独的腈菌唑对油菜菌核病菌的生长具有显著更大的抑制效果(图5b)。与单独的丙环唑相比,杀真菌剂丙环唑与抑制剂ai.1、ai.10、ai.13和ai.15组合对油菜菌核病菌的生长具有显著更大的抑制效果(图5c)。实施例5:大丽轮枝菌在补充有三磷酸腺苷双磷酸酶抑制剂ai.1、ai.10、ai.13和ai.15的杀真菌剂(辛酸铜、腈菌唑和丙环唑)存在下生长致病真菌大丽轮枝菌。与单独的辛酸铜相比,辛酸铜与抑制剂ai.1、ai.10、ai.13和ai.15组合对大丽轮枝菌的生长具有显著更大的抑制效果(图6a)。与单独的腈菌唑相比,腈菌唑与抑制剂ai.15组合对大丽轮枝菌的生长具有显著更大的抑制效果(图6b)。与单独的丙环唑相比,抑制剂ai.10和ai.15存在下的丙环唑对大丽轮枝菌的生长具有显著更大的抑制效果(图6c)。实施例6:戊唑醇和ai与杀真菌剂(戊唑醇)联合,以及小麦种子上低比率的甲霜灵一起测试化合物的疾病功效。与增强剂ai.1组合测试的戊唑醇的比率为0.15和0.25gmai/100kg,这比商业应用的比率1.5gmai/100kg低7.5倍和10倍。疾病筛选预先使用降低比率的戊唑醇和甲霜灵进行,以确保在这些较低比率下缺乏功效。在研究中包括标准比率1.5gmai/100kg的三唑作为对照。以两种方式应用产品:作为对用戊唑醇+甲霜灵组合预处理的种子进行过度处理,以及用作两种杀真菌剂的单一水性浆料。评估了增强剂ai.1的两个比率:2.5和10gmai/100kg。种子传播的生物测定。在允许检测种子传播的真菌病原体的无菌封闭盒子中进行种子传播的生物测定。将塑料鞋盒表面灭菌,并将无菌吸墨纸置于各容器的底部。基于用来杀死种子的方法,单子叶评估与双子叶评估不同。将单子叶置于用无菌水润湿的吸墨纸上,在25℃孵育1天,随后在0℃放置24小时以杀死种胚。将双子叶种子置于吸收有2,4-d除草剂温和溶液的吸墨纸上以杀死胚。然后将生物测定盒在25℃放置7天。通过显微镜评估各个种子来观察并注意真菌生长。通常进行两次50粒种子的重复。结果提供于表1。表1.杀真菌剂(戊唑醇)和增强剂ai.1种子处理的种子传播的疾病功效。*真菌群是链格孢属(alternaria)、曲霉属(aspergillus)、镰刀菌属(fusarium)、青霉属(penicillium)和分子孢子菌属(cladosporium)的群体的合并计数。nsl+测试。天然沙质肥土筛选(nsl)由1:1混合的沙和肥土组成,其中肥土天然感染腐霉属(pythiumspp.)和土壤特有的其他微生物。nsl+测试保留相同的土壤混合物和额外组分禾谷镰刀菌(fusariumgraminearum)。将适当的禾谷镰刀菌分离物接种入种子区域。将播种的种子置于10℃气氛下以允许腐霉属压力的最佳环境。在上述条件下10天后,将种子转移至温室(27℃)用于幼苗出苗和存活评估。nsl+测试能够在同个测定(与典型的田间条件相似)中评估化合物的腐霉属和镰刀菌属活性。所有处理重复5次,且在温室中的放置随机。评估幼苗的出苗和存活。在所有筛选中包括无菌对照。无菌对照是置于无菌nsl混合物下的未处理种子。结果提供于表2和3。表2处理21天后的站立%未处理20raxil@1.5gmai/100kg96raxil@.25gmai/100kg84raxil@.25gmai/100kg+a.i.#1@2.5gmai/100kg96raxil@.15gmai/100kg80raxil@.15gmai/100kg+a.i.#1@2.5gmai/100kg88无菌对照100表3.田间试验显示玉米中raxil(戊唑醇)对丝黑穗病(玉米丝黑穗病菌(sphacelothecareiliana))的增强。实施例7:比较不同三磷酸腺苷双磷酸酶抑制剂的氟环唑活性在酵母马铃薯葡萄糖琼脂上生长分离物。使用约10000个孢子/孔(显微镜孢子计数),在96孔板中进行基于od测量的杀真菌剂敏感性测试。增强剂的测试浓度为0、0.003、0.016、0.08、0.4、2、10和50μgml-1。测试的杀真菌剂浓度为0、0.00128、0.0064、0.016、0.032、0.08、0.16、0.8、4、10、20和50μgml-1。结果提供于表4和表5。表4.不同三磷酸腺苷双磷酸酶抑制剂对禾生球腔菌分离物flu4-02的氟环唑易感性的作用。增强剂ai.1是n-(间甲苯基)-[1,1’-联苯基]-4-磺胺。增强剂ai.2是3-己基-2,3-二氢-n,4-二苯基噻唑-2-溴化铵。增强剂ai.10是2-氧代-2h-苯并吡喃-3-硫代甲酸s-庚基酯。增强剂ai.12是乙基2-[(n-环己基甘氨酰)氨基]-4,5,6,7-四氢-1-苯并噻吩-3-羧酸酯。增强剂ai.14是(e)-n’-(2-羟基-5-亚硝基亚苄基)己烷酰肼。增强剂ai.16是丙-2-炔基2-(4-氯苯基氨基甲酰)苯甲酸酯。表5.增强剂ai.1对小麦壳针孢分离物g3-03的不同杀真菌剂易感性的作用。本发明的组合物以分散体、溶液、悬浮液、喷雾剂和粉末的形式向植物应用,其包含杀真菌剂和本发明的增强剂,以及植物学上可接受的惰性载体。最常用的载体是水。组合物是在水中分散用于施用的浓缩制剂,或是无需进一步处理而施用的粉剂或颗粒制剂。组合物根据农业化学领域常规的程序和配方制备,但其由于存在本发明的化合物而是新颖且重要的。向植物施用的组合物的实际量不重要,且容易由本领域技术人员确定。通常,预期按重量计10ppm-5000ppm的活性化合物提供良好的控制。对于很多化合物,100-1500ppm的浓度将足够。可以向植物病原体或植物病原体出现的地方或植物病原体可能出现的地方(植物、土壤)施用有效量的创造性组合物来控制植物真菌疾病。可以向植物或允许植物生长的地方施用有效量的组合物来控制植物疾病。具体地,向植物的秆和叶、植物的种子、植物的球茎(包括球茎、球根、根茎、块茎、块根和根托)施用。作为本发明控制方法中的土壤处理,可以包括例如喷洒到土壤上、与土壤混合、将液体试剂灌注到土壤中(灌溉液体试剂、注射到土壤中、滴入液体试剂)。可以在传播之前、传播时、传播后立即、育苗期间、定植前、定植时和定植后的生长时间进行处理。考虑在本说明书中讨论的任何实施方案可以用本发明的任何方法、试剂盒、试剂或组合物实施,反之亦然。此外,本发明的组合物可以用来实现本发明的方法。将理解,本文所述的具体实施方案是以说明性的方式示出,而不作为本发明的限制。在不背离本发明的范围的情况下,本发明的主要特征可以在各个实施方案中采用。本领域技术人员将认识到或能够最多使用常规实验来确定本文所述的特定程序的许多等同物。这些等同物被认为是本发明的范围内,且由权利要求所覆盖。说明书中提及的所有出版物和专利申请指示了本发明所涉及的领域的技术人员的技术水平。所有出版物和专利申请通过引用并入本文,其程度如同每个单独的出版物或专利申请被具体地单独地指明通过引用并入。当与权利要求和/或说明书中的术语“包含”一起使用时,使用的词语“一(a)”可以是指“一个(one)”,但也可以是指含义“一个或多个”、“至少一个”和“一个或超过一个”。权利要求中的术语“或”用于是指“和/或”,除非明确指出是仅指替代物或替代物是相互排斥的,尽管公开内容支持是仅指替代物和“和/或”的定义。贯穿本申请,术语“约”是指值包括以下的固有误差变化:设备,用于确定值的方法,或研究对象之间存在的变化。如在本说明书和权利要求中所用,词语“包含”、“具有”、“包括”或“含有”是广泛的或开放式的,不排除额外的、未记载的元素或方法步骤。如本文所用,术语“或其组合”是指该术语之前列举的项目的所有排列和组合。例如“a、b、c或其组合”意欲包括至少以下之一:a、b、c、ab、ac、bc或abc,如果在特定上下文中顺序是重要的,则还包括ba、ca、cb、cba、bca、acb、bac或cab。继续这个例子,明确地包括包含一个或多个项目或术语的重复的组合,例如bb、aaa、ab、bbc、aaabcccc、cbbaaa、cababb等等。本领域技术人员将理解,除非在上下文中是明显的,通常对任何组合中的项目或术语的数量没有限制。基于本公开,可以制造并实施本文所公开的和要求保护的所有组合物和/或方法而无需过度实验。虽然已经根据优选实施方案描述了本发明的组合物和方法,但是对于本领域技术人员显而易见的是,在不背离本发明的概念、精神和范围的情况下,可以将变化应用于本文所述的组合物和/或方法以及步骤或步骤顺序。对于本领域技术人员显而易见的所有这样的类似替代和修改被认为在由所附权利要求限定的本发明的精神、范围和概念内。当前第1页12
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1