一种沼泽小叶桦离体芽快繁方法与流程
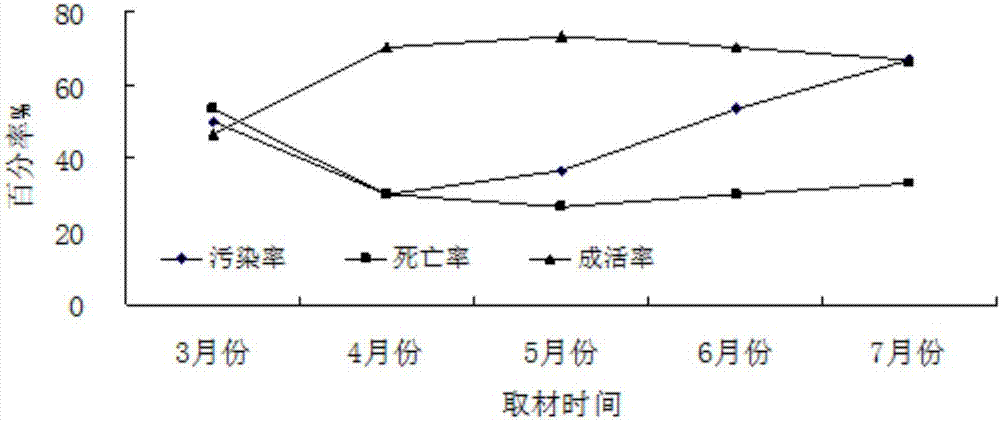
本发明涉及植物组织培养领域,尤其涉及一种沼泽小叶桦离体芽快繁方法。技术背景我国大陆沿海海岸线长18000km,拥有滩涂面积21709km2,且以每年300km2的速度继续淤长。滩涂生态系统受海陆系统的双重干扰,土壤发育时间短,盐分含量高,造成了滩涂自然生态新系统的脆弱性和不稳定性。加之台风、暴雨、冰雹、龙卷风等灾害性天气频繁,每年造成的经济损失达10.6亿元,当地生态安全和社会经济发展受到严重影响。目前,沿海滩涂造林树种缺乏,大面积的滩涂处于荒芜状态,选育和引进耐盐树种成为沿海滩涂造林绿化、合理开发和利用的关键。沼泽小叶桦为落叶小乔木,具有较强的耐盐和耐水能力,可在高盐、高水位环境下生长,在沿海和低湿地上具有应用的潜力。调查发现,我国约有500余种盐生植物,其中木本植物所占比例稀少,由于沼泽小叶桦在改造和利用盐渍土方面特性,将是优良的候选树种之一。在我国广阔的东部沿海滩涂地区,如果能将沼泽小叶桦引种到这些地区,将能丰富该地区的植被类型,改善生态环境。然而,沼泽小叶桦是极为稀有和濒临灭绝的温带落叶阔叶树种,为国家二级重点保护濒危植物,其嫩枝扦插极难生根,目前主要采用种子繁殖,不能规模化育苗,严重限制了沼泽小叶桦的引种移栽及深入研究。因此,需要采取其他方式来提高其繁殖能力。技术实现要素:本发明目的在于克服现有技术存在的外植体污染、褐化、玻璃化现象等阻碍植物组培工作的问题,提供一种繁殖速度快,生产周期短、增殖系数高且成活率高的沼泽小叶桦离体芽快繁方法,通过外植体选择及消毒、启动诱导培养、继代增殖培养、生根诱导培养、炼苗移栽等过程实现沼泽小叶桦离体快繁。为实现上述发明目的,本发明采用的技术方案为:一种沼泽小叶桦的离体芽快繁方法,包括以下步骤:1)挑选株高1~1.5m的未萌动的健壮植株,4~5月份采主枝顶芽、主枝侧芽、侧枝顶芽的新生芽作为外植体;2)在超净工作台上,先用70%的酒精处理外植体20s,再用0.1%升汞消毒5~20min,10%naclo消毒0~20min,用无菌水冲洗数次;3)将处理好的外植体在无菌的条件下接种到初代培养基上,初代培养基成分为:ms+0.6~1.5mg/l6-ba+0.5~1.0g/lpvp,培养20d以上;4)将外植体转入增殖培养基,增殖培养基成分为:ms+0.4~0.6mg/l6-ba+0.02mg/lnaa,培养时间20d以上获得小苗;5)将小苗进行生根培养,生根培养基成分:ms+0.1~0.5mg/lnaa,或1/2ms+0~0.5mg/lnaa,培养20d以上;7)炼苗移栽:选择健壮的无菌苗,用多菌灵溶液浸泡清洗后,移栽到已消毒的蛭石+珍珠岩的基质中,先保湿培养一周,逐渐去掉盖子。步骤1)中,在新生芽萌动前,用50%的多菌灵可湿性粉剂喷洒植株,一周两次,直到植株吐芽、取材为止。步骤1)中,从健壮枝条上采回新生芽,用试管刷蘸洗衣粉轻轻刷洗,流水冲洗表面污物2~3h。步骤2)中,先用70%酒精处理20s,再配合0.1%升汞处理10min,后用无菌水冲洗4-5次。步骤3)中,初代培养基成分为:ms+0.8~1.0mg/l6-ba+1.0g/lpvp。步骤4)中,增殖培养基成分为:ms+0.6mg/l6-ba+0.02mg/lnaa,或ms+0.4mg/l6-ba+0.02mg/lnaa。步骤5)中,生根培养基成分:ms或1/2ms+0.1或0.5mg/lnaa。有益效果:与现有的技术相比,本发明以沼泽小叶桦离体芽为外植体,建立了组培繁殖体系。通过酒精和升汞预处理母本材料,大大降低了外植体的污染率,使外植体成活率最高可达74.19%,污染率降为25.81%。初代培养基中添加pvp,使褐化现象消失,大大降低了组培风险,提高了成活率。本方法得到的组培苗具有增殖系数高,生根率高,栽植成活力高等特点。有利于沼泽小叶桦的保护与开发,具有广泛应用前景。附图说明图1是6-ba浓度过高时,初生代培养无菌苗图。图2是取材时间对污染率的影响结果图。图3是不同植物调节剂对沼泽小叶桦无菌苗生根的影响图(a.ms无添加剂的生根;b.0.1mg/lnaa生根;c.少量多效唑生根;d.多量多效唑生根)。具体实施方式以下结合实例对本发明进一步详细说明。以下实施例中,所使用的材料和试剂如下:材料:挑选株高1~1.5m左右的未萌动的健壮植株,3~7月间采健壮枝条上的新生芽作为试材。在新生芽萌动前,用50%的多菌灵可湿性粉剂喷洒植株,一周两次,直到植株吐芽、取材为止。从健壮枝条上采回新生芽,用试管刷蘸洗衣粉轻轻刷洗,流水冲洗表面污物2~3h,在无菌条件下,用70%酒精进行表面消毒,再用消毒剂溶液处理。消毒后切除芽体基部与药液接触的部分,接种于无菌培养基上。ms培养基:琼脂粉7.0g/l,蔗糖30g/l,用1mol/l的hcl和naoh将培养基ph调到6.0,煮沸,待琼脂彻底融化后,分装到广口培养瓶中,用透气性无菌塑料封口膜包扎培养瓶,在121℃下,高压灭菌20min,后取出,放于培养室内,冷却凝固后待用。若无特殊说明,所有培养条件均为:日光灯照明,培养温度为(25±2)℃,空气相对湿度50~60%,光照时间12~13h/d,光强为1500~2000lx。数据统计与分析方法:用excel进行数据处理和作图,spss软件进行数据分析。污染率(%)=污染的外植体数/接种外植体总数×100%;死亡率(%)=未污染外植体的死亡数/接种外植体总数×100%;萌芽率(%)=未污染外植体芽萌动个数/接种外植体总数×100%;增殖系数=增殖周期结束时苗高大于1.0cm的芽苗总数/增殖周期起始时的芽苗数平均株高(cm)=培养周期结束时幼苗株高之和/接种时幼苗总数;生根率(%)=生根的苗数/培养的苗数×100%;平均根数(条)=根总数/生根株数;平均根长(cm)=生根苗根总长/生根苗总数。实施例1沼泽小叶桦的离体芽快繁方法,以沼泽小叶桦的新生芽为外植体,在超净工作台上,先用70%的酒精处理20s,后用0.1%的hgcl2或10%的naclo消毒剂采用不同的消毒时间(表1)消毒后,用无菌水冲洗5次。经消毒后的外植体放到铺有无菌滤纸的培养皿中,吸干材料表面的水分,用手术刀切掉基部与药液接触的部分,将芽鳞和未展开的托叶切除,接种到ms+6-ba1.0mg/l生长培养基上,每个处理接12瓶,每瓶接3个外植体,定期观察记录,接种25d后统计污染率、死亡率及萌芽率。表1不同消毒剂和消毒时间的设计处理号70%酒精(s)0.1%hgcl2(min)10%naclo(min)120002205032010042015052020062005720010820015920020外植体消经毒处理后接种到培养基中培养,2~3d后部分外植体基部接触培养基的部分周围有水浸状物质产生,呈无色或透明乳白色。随着时间的延长,部分该物质逐渐消失。5d左右,部分培养基表面变得粗糙,有细菌污染的现象,菌落点点状或带水状,颜色红色或黄色等。一周左右开始有霉菌污染,主要分布在芽的表面或芽鳞片的伤口处,菌丝有白色或黑色,并且呈逐渐扩大的趋势。部分芽无污染,不启动,褐变死亡。在只用70%酒精处理20s时,污染很严重,成活率极低,虽然存活下来的外植体生长良好,也不能将其作为消毒的最佳方式(表2)。而当70%酒精和0.1%hgcl2或10%naclo搭配使用时,外植体消毒效果明显改善,污染率降低,且成活率显著提高。0.1%的hgcl2处理时,最佳消毒时间为10min,成活率最高达74.19%,并且外植体长势良好,叶片深绿。10%naclo处理的最佳时间为10min,成活率最高可达72.22%,叶片浅绿色,长势良好。当两种消毒剂处理20min时,污染率虽降低,但由于时间过长,外植体成活率明显下降,生长状况不理想,长势不佳。表2不同消毒处理的影响处理号接种总数污染率成活率生长状况13683.00%10.10%叶片深绿,长势良好23635.00%65.00%叶片深绿,长势良好33625.81%74.19%叶片深绿,长势良好43620.57%71.43%叶片深绿,长势一般53617.89%42.11%萌动较慢63638.89%61.11%叶片浅绿,长势良好73627.78%72.22%叶片浅绿,长势良好83622.22%66.67%叶片浅绿,长势良好93616.67%47.78%叶片浅绿,茎秆细弱实施例2一种沼泽小叶桦的离体芽快繁方法,包括以下步骤:1)外植体的建立:挑选株高1~1.5m左右的未萌动的健壮植株,4~5月份采主枝顶芽、侧芽以及侧枝顶芽等新生芽作为植体材料。在新生芽萌动前,用50%的多菌灵可湿性粉剂喷洒植株,一周两次,直到植株吐芽、取材为止。为减少材料污染,从健壮枝条上采回新生芽,用试管刷蘸洗衣粉轻轻刷洗,流水冲洗表面污物2~3h。2)外植体的消毒:用步骤1)得到的外植体,在超净工作台上,先用70%的酒精处理20s,再用0.1%升汞消毒10min,用无菌水冲洗5次。3)初代培养:将处理好的外植体在无菌的条件下接种到初代培养基上,成分为:ms+1.0mg/l6-ba+0~1.0g/lpvp,培养温度:25±2℃,空气相对湿度50~60%,光照时间:12~13h/d,光强:1500~2000lx,培养时间:25d。初代培养处理好的外植体需放到铺有无菌滤纸的培养皿中,吸干材料表面的水分,用手术刀切掉基部与药液接触的部分,将芽鳞和未展开的托叶切除。5)增殖培养:将外植体转入增殖培养基,成分为:ms+1.0g/lpvp+0.6mg/l6-ba+0.02mg/lnaa,培养时间25d。6)生根培养:将小苗进行生根培养,生根培养基成分:ms+1.0g/lpvp+0.1~0.5mg/lnaa,培养至25d。7)炼苗移栽:选择健壮的无菌苗,用多菌灵溶液浸泡清洗后,移栽到已消毒的蛭石+珍珠岩(体积比1:1)的基质中,先保湿培养一周,逐渐去掉盖子。采用pvp防治外植体的褐化,向培养基中添加不同浓度的pvp(表3),接种处理好的外植体,每处理10瓶,每瓶3个,定期观察记录,25d后统计褐化率、褐斑直径大小。表3不同浓度的pvp防褐化处理从表3可以看出,防治外植体褐化的最佳处理为3号处理,即在培养基中添加1.0g/l的pvp,可以有效降低褐化率,达到较好的防治效果,后续实施例君采用此操作。未添加pvp的1号处理,接种当天外植体基部即出现浅色褐斑,3~4天时褐斑颜色最深,褐斑直径最大可达1.2cm。随时间延长,褐斑有变浅消失的迹象,但外植体长势不佳,基部切口处有长约0.2cm变的干枯、褐色,植株吸收营养受限制,生长受到抑制,严重时褐变死亡,如1号、2号处理。4号处理虽无褐化现象发生,但由于pvp浓度偏高,外植体叶尖有干黄现象发生。实施例3一种沼泽小叶桦的离体芽快繁方法,同实施例2,其中在初生代培养时,以ms为基本培养基,在培养基中添加1.0g/l的pvp和不同浓度的6-ba(表4),每个处理10瓶,每瓶3个外植体,25d后统计萌芽率。表4表明,外植体的萌芽率随着6-ba浓度的增加而升高。未添加6-ba时,萌芽率最低,为16.67%,无愈伤形成,但生长较为缓慢;添加量大于0.8mg/l时萌芽率可达90%以上,虽基部有半球状愈伤形成,但植株长势良好;添加量为1.5mg/l时,萌芽率最高为96.67%,此时茎秆细长,基部愈伤呈球状(图1a),较大较硬,叶片较薄,颜色发黄,长势不佳(图1b)。表4外植体萌芽率结果实施例4一种沼泽小叶桦的离体芽快繁方法,同实施例2,其中分别于2013年3~7月份取当年生新芽,经70%酒精处理20s,再用0.1%hgcl2处理10min后,接种于ms+6-ba1.0mg/l+1.0g/lpvp。每个处理15瓶,每瓶3个外植体,接种25d后统计污染率、死亡率及启动率。由图2可以看出外植体的污染率呈先降低后升高的趋势,在4月份取最低值为30%,到7月份污染率最高为66.67%;成活率曲线先升高后缓慢降低,4月份的成活率为70%,5月份成活率为73.33%,然后缓慢下降,7月份虽有66.67%,但明显高出3月的成活率很多。外植体的死亡率在3月份最高,5月份最低,6、7月份稍有增加,但仍明显低于3月份。综合3条曲线来看,外植体的最佳取材时间为4月底至5月底。实施例5一种沼泽小叶桦的离体芽快繁方法,同实施例3,其中于4月下旬取主枝和侧枝的顶芽和侧芽,经70%酒精处理20s,在用0.1%hgcl2处理10min后,接种于ms+6-ba1.0mg/l+1.0g/lpvp。每处理15瓶,每瓶3个外植体,接种后25d统计污染率、死亡率、启动率及外植体生长状况。对比不同取材部位外植体萌动情况如表5,结果表明主枝顶芽的萌芽率最高达83.33%,与主枝侧芽、侧枝顶芽的萌芽率没有显著差异,而与侧枝侧芽的萌芽率50%差异显著,并且其萌动快、叶色绿、苗健壮,是最佳的取材部位。由于顶芽的顶端优势,使得侧枝顶芽的萌芽率73.33%与主枝上营养较为充足的侧芽萌芽率76.67%间差异不显著,外植体生长状况较好,可以作为摘取外植体的选择部位。因此,此试验应选取主枝顶芽、主枝侧芽、侧枝顶芽为外植体,三者平均萌芽率为77.77%。表5不同取材部位外植体萌动情况比较不同部位萌芽率(%)苗高生长状况主枝顶芽83.33±14.14a3.5cm萌动快,后期苗高生长快,健壮主枝侧芽76.67±4.72a2.8cm萌动慢,长势较均匀,苗高较低侧枝顶芽73.33±9.42ab3.2cm萌动较快,苗高生长较快,较健壮侧枝侧芽50.00±4.71b2.5cm萌动慢,长势较弱,苗高较低实施例6一种沼泽小叶桦的离体芽快繁方法,同实施例2,其中在增殖培养阶段,以ms为基本培养基,添加6-ba、naa,浓度及组合配比如(表6),每处理10瓶,每瓶3个外植体,定期观察芽的长势,培养25d后,统计增殖芽的数目,并计算增殖系数。不同浓度的6-ba和naa对继代苗增殖的影响如表6所示,4号处理组合即ms+0.6mg/l6-ba+0.02mg/lnaa的增殖系数最高,增殖系数达3.70,显著高于其他处理组合;其次是8号处理,增殖系数为3.40;再次优选处理组合为3号,即ms+0.4mg/l6-ba+0.02mg/lnaa,增殖系数为2.80;增殖系数最小的是13号组合ms+0.05mg/l6-ba+1.5mg/lnaa,增殖系数仅为1.07。试验过程中,继代苗的生长状态相差很大。1~4号处理中继代苗基部无愈伤产生,形成腋芽及丛生芽,且长势良好;13~16号处理中,继代苗基部肿大,有愈伤组织形成,愈伤组织上产生大量的不定根,并且下部叶片的切口和叶脉处也形成了大量的不定根,不定根较短,外披绒毛,植株叶片发黄,长势不佳,可以看出此类不定根的吸收功能较差。表6植物生长调节剂对继代苗增殖的影响编号6-banaa增殖系数10.10mg/l0.02mg/l1.53±0.12defg20.20mg/l0.02mg/l1.80±0.36d30.40mg/l0.02mg/l2.80±0.18c40.60mg/l0.02mg/l3.70±0.14a50.10mg/l0.05mg/l1.20±0.09ij60.20mg/l0.05mg/l1.50±0.17efg70.40mg/l0.05mg/l1.70±0.50edf80.60mg/l0.05mg/l3.40±0.18b90.10mg/l0.10mg/l1.27±0.13ij100.20mg/l0.10mg/l1.53±0.13defg110.40mg/l0.10mg/l1.67±0.07edf120.60mg/l0.10mg/l1.77±0.12de130.05mg/l1.50mg/l1.07±0.06j140.10mg/l1.50mg/l1.17±0.06ij150.15mg/l1.50mg/l1.43±0.09fgh160.20mg/l1.50mg/l1.17±0.08ij实施例7一种沼泽小叶桦的离体芽快繁方法,同实施例2,其中在生根培养阶段,选用材料为1.5~2.0cm,较健壮、长势一致的无根苗。选用1/3ms培养基、1/2ms培养基和ms培养基作为不同处理,相互对照。每个处理20瓶,每瓶3株无根苗,进行生根培养。25d后统计每个处理的生根率、平均生根条数、平均根长和植株生长状况。待小苗长至2.0~3.0cm,接种到生根培养基中进行生根培养。一周左右在无菌苗的基部产生白色点状突起,随着时间的延长,这些点状突起继续伸长,长出白色的根。表7中可以看出,1/3ms培养基生根较早,生根率为86.67%,但平均生根条数和根的长度均较1/2ms和ms培养基的少和短,并且由于大量元素的不足,无菌苗茎秆细长叶片发黄,植株长势不佳。1/2ms培养基的生根率最高,为90.0%,但平均生根条数低于ms培养基,且没有侧根形成。ms培养基的生根率较低,但无菌苗植株健壮,根较粗有侧根形成,长势良好。表7不同培养基对生根的影响以1/2ms培养基和ms培养基以及不同浓度的naa组合成10个处理(表8),每个处理接种10瓶,每瓶3个外植体,25d后统计各处理的生根率、平均生根数、平均根长以及植株生长状况。表8生根培养基中naa浓度添加量处理号1/2ms(mg/l)ms(mg/l)10.1-20.5-31.0-41.5-52.0-6-0.17-0.58-1.09-1.510-2.0不同浓度的naa对生根的影响如表9和图3a、图3b所示,以1/2ms为基本培养基时,随着naa浓度的增加,无菌苗的生根率逐渐降低,最高94.44%,最低为61.11%;平均生根数逐渐升高,最低3.12,最高9.45;根长下降趋势明显,最长为4.0~4.5cm,最短1.5~2.0cm;以ms为基本培养基时,除生根率先升高后降低外,平均生根数、根长范围的变化规律均与1/2ms培养基一致。结果表明,naa在调节沼泽小叶桦无菌苗生根过程中起着重要的促进所用,,但浓度高于1.0mg/l时,无菌苗基部愈伤较大,分化出大量的根,这些根呈短粗的锥形,土黄色或浅红色,根尖红色,暴露在培养基外部的根有绒毛,上部植株矮小,叶片枯黄,发育不良。控制naa浓度在0.1~0.5mg/l时促进单株生根,促进根长生长。表9不同浓度naa对生根的影响以ms为基本培养基,添加不同浓度的多效唑(表10),研究多效唑对生根的影响。每个处理接种8瓶,每瓶3株无根苗,25d后统计各处理的生根率、平均生根条数、平均根长及植株生长状况。多效唑对无菌苗生根的作用见表10和图3c、图3d,相对于零添加的ms培养基,0.25mg/l的多效唑对无菌苗生根具有促进作用,可使生根率达83.33%,平均生根数为3.40,根长稍短缩,为2.5~3.0cm。多效唑浓度增加,生根率呈逐渐降低至33.33%,根伸长减短至1.0cm以下,而已生根的无菌苗平均生根数变化规律不明显。多效唑的应用,使得无菌苗植株节间短缩,株高生长不明显,苗高在1.5~2.5cm间;每株3~6片叶不等,叶片生长受到抑制,较小较厚,叶色深绿;基部无愈伤组织形成,根较短较粗,呈均匀短棒形,随时间的延长由米白色渐变为褐色或黑色,发生老化。表10不同浓度多效唑多生根的影响将优选的基本培养基和添加naa、多效唑的优选生根培养基进行差异显著性分析如表11,添加naa的2、3、5、6号培养基的生根率与其他培养基差异显著,生根率最高为97.30%;就平均生根比较,3、5、6、8号培养基明显优于其他生根方法,平均生根最多的为8号处理,3.93,其次是6号处理平均生根3.83;多效唑的添加明显抑制了根的伸长生长,最佳处理为添加naa的2、3、5、6号培养基。对比分析,得出最佳生根培养方法是6号处理,即ms+0.5mg/lnaa,获得无菌苗植株健壮,株高5.0~6.0cm,叶片绿色,根星状分布,白色,细长,部分有侧根形成。表11优选生根培养基的对比分析编号生根方法生根率/%生根数(条)根长(cm)11/2ms90.00±2.36b2.78±0.65d3.75±0.54a21/2ms+0.1mg/lnaa94.44±2.21a3.12±0.11cd4.25±0.26a31/2ms+0.5mg/lnaa94.44±0.85a3.59±0.12abc4.25±0.42a4ms81.66±1.75c2.90±0.22d3.75±0.21a5ms+0.1mg/lnaa94.44±3.56a3.71±0.15ab4.25±0.39a6ms+0.5mg/lnaa97.30±1.46a3.83±0.14ab4.25±0.23a7ms+0.25mg/l多效唑83.33±3.00c3.40±0.64bc2.75±0.22b8ms+0.5mg/l多效唑77.78±1.04d3.93±0.13a1.25±0.23c当前第1页12
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1