冷冻保护试剂,冷冻保护和冷冻保存的组合物,其用途,和冷冻保存方法与流程
技术领域
本发明涉及冷冻保护剂,冷冻保护试剂,冷冻保护组合物,冷冻保存组合物,其用途,和冷冻保存方法。
背景技术:
活的生物样品如细胞,组织或器官(其是已经从一个供体来源获得的)的冷冻保存是在科学界和医学界非常重要的和具有很大实用性。冷冻保存通常是一个过程,其中样品,例如细胞或组织,通过冷却到零度以下的温度,通常为77K(=-196℃,液态氮的沸点)而被保存。在这些低温度下,任何生物活性,包括会引起细胞死亡的生化反应,有效地被阻止了。冷冻保存技术通常用于长期保存含水或水性物质如植物和动物的细胞和组织。已知的是,通过冷冻这些物质,冰晶形成,导致不均匀的溶质浓度和污染物被水分子排除在外,称为“冷冻浓缩”。为了使细胞或组织被保存,冷冻保护剂的溶液通常是用来防止由于在冷却期间的冻结或解冻过程导致的损伤。为了使冷冻保存是有用的,冷冻保存的样品应在采集的时候保留它的完整性和生存力至合理的水平。因此,冷冻保存样品的过程本身优选不严重破坏或毁坏,例如细胞或组织结构。
在传统的冷冻技术,样品被采集,放置在存储溶液,然后冷冻保存。当样品被使用,它被解冻,例如从人类供体来源取得的细胞被恢复到正常的人体温度(即,约37℃)然后被放置在细胞培养基中。冷冻保存方案使细胞在整个细胞采集,冻结,解冻过程中经历多种应力和损伤。这些应力和损伤,可以对细胞造成不可逆的损伤。
葡聚糖已被用来作为人类,动物和植物细胞冷冻保护试剂(Odavic,R.et al.Experientia 36,1122(1980),Ashwood-Smith,M.J.et al.Cryobiology 9,441(1972)and Echlin,P.et al.J.Microsc.(Oxford)110,239(1977))。5%甲基亚砜和9%葡聚糖70的混合物被发现为人骨髓定向干细胞提供了最佳冷冻保存(Dextran,Handbook from Amersham BioSciences,18-1166-12,AA版,35页)。针对单独或组合的葡聚糖,甘油和二甲基亚砜(DMSO)进行了人骨髓细胞冷冻保护的研究(Odavic,R.等人。Experientia 36,1122(1980))。与采用15%的甘油或9%葡聚糖以及1%DMSO相比,通过9%葡聚糖70与3或5%的DMSO的组合,以及单独的5或10%的DMSO,针对冷冻损害得到了显著优选的保护。葡聚糖40是已知(Proc.Nati.Acad.Sci.USA,卷92,10119-10122页,1995年十月,Medical Sciences)用于胎盘/脐带血冷冻保存,其为50%DMSO 5%(w/v)在葡聚糖40中的组合。
Shu Guowei等人在Advanced Materials Research,Trans Tech Publications Ltd.,Vol.328(2012),pp 454-457中描述了,果糖寡糖,异麦芽糖寡糖,菊粉和低聚木糖在冻干过程中对B.bifidium生存力的影响。Kwan Hwa Park等在Database CA,XP 002698458中描述了含有果糖寡糖,异麦芽糖寡糖、半乳糖寡糖的冷冻保护试剂用于鱼糜。在Korean Soc.Food Sci.Nutr.,Vol.30(3)(2001),pp 565-568中介绍了,果糖寡糖,异麦芽糖寡糖和半乳糖寡糖冷冻保护试剂对牛肉蛋白的影响。
传统的冷冻保护剂是二醇(含至少两个羟基的醇),如乙二醇,丙二醇,甘油。乙二醇通常用作汽车冷冻保护剂,丙二醇已被用来减少冰淇淋中冰的形成。二甲基亚砜(DMSO)也被视为一个传统的冷冻保护剂。甘油和DMSO已被低温生物学家使用了几十年以降低保存在液氮中的精子和胚胎中的冰形成(-196℃)。在这些已知的冷冻保护试剂中,DMSO被认为是最有效和最常用的,但它是生理毒性的,并且已知,如果DMSO与细胞一同被输给接受者或处理DMSO的人员,DMSO引起高血压,恶心和呕吐,除非采取预防措施。Cox等人(Cell Tissue Bank(2012)13:203-215)通过公开文献回顾的综述发现,几百不良反应(如恶心,畏寒,心律失常,神经学症状和呼吸停止)与采用二甲基亚砜冷冻保护的干细胞移植相关。此外,DMSO的毒性往往降低细胞生存力和/或功能,包括在解冻的细胞被培养或输入接受者的躯体后基因组改变。DMSO的毒性从而也影响在处理过程中细胞可能暴露于DMSO的时间。
因此,仍然需要在冷冻过程中作为其他冷冻保护剂如DMSO的替代物或作为其他冷冻保护剂的添加物的用于保护样品如生物样品的冷冻保护试剂,以及减少需要的浓度,优选是减少至无毒浓度,同时所述冷冻保护试剂有必要的防护效果和毒性低。
发明目的
本发明实施方案的目的是,提供作为其他冷冻保护剂如DMSO的代替物或作为其他冷冻保护剂的添加物的冷冻保护剂以降低其浓度,优选降低至无毒浓度,所述冷冻保护剂在冷冻保存中针对保存冷冻保存的样品的原功能性具有必要的保护作用。本发明的实施方案的进一步目的是,提供具有对处理冷冻保护剂的人员和对生物样品而言低毒性的冷冻保护剂,由此延长样品可以与冷冻保护剂接触而不被损坏的时间,洗涤样品的必要性被降低,并且优选,如果需要的话,在不将样品从冷冻保护剂分离的情况下,可能将样品返回至所述样品被采集的地方,或将样品返回至接受者。本发明的实施方案进一步的目的是,提供一种冷冻保护剂,所述冷冻保护剂是有效的样品的冷冻保护剂,所述样品选自器官,细胞和组织,如选自哺乳动物器官,哺乳动物细胞和哺乳动物组织。本发明的实施方案进一步的目的是,提供一种冷冻保护剂,所述冷冻保护剂是有效的将被进行移植的样品的冷冻保护剂,所述样品例如器官,细胞或组织。本发明的实施方案进一步的目的是,提供一种冷冻保护剂,所述冷冻保护剂是有效的例如细胞的冷冻保护试剂,和导致所述细胞可接受的生存力。本发明的实施方案进一步的目的是,提供一种冷冻保护剂,所述冷冻保护剂是有效的例如器官的冷冻保护试剂,并且导致所述器官可接受的躯体功能。本发明的实施方案进一步的目的是,提供一种冷冻保护剂,所述冷冻保护剂是有效的例如组织的冷冻保护试剂,和导致所述组织可接受的躯体功能。
技术实现要素:
本发明人发现,如下的冷冻保护试剂作为冷冻保护剂是很有用的:包括一种或多种冷冻保护剂的冷冻保护试剂,所述冷冻保护剂选自糊精、葡聚糖、异麦芽糖寡糖及其衍生物,和a)所述冷冻保护试剂包括基于在所述试剂中糊精、葡聚糖、异麦芽糖寡糖及其衍生物的总重量的至少1%w/w的一种或多种异麦芽糖寡糖及其衍生物,所述异麦芽糖寡糖及其衍生物具有300至1650Da的重量平均分子量(MW),或b)其中所述的冷冻保护剂有300至9500Da如300至7500Da的重量平均分子量(MW),或c)其中所述冷冻保护试剂包括基于在所述试剂中糊精、葡聚糖、异麦芽糖寡糖及其衍生物的总重量的至少1%w/w的一种或多种异麦芽糖寡糖及其衍生物,所述异麦芽糖寡糖及其衍生物具有300至1650Da的重量平均分子量(MW),并且所述冷冻保护剂有300至9500Da的重量平均分子量(MW)。相比于以前使用的较高分子量的葡聚糖物质如葡聚糖40(40000Da)和葡聚糖70(70000Da),由于分子量较低,包括上述的冷冻保护剂的冷冻保护试剂具有较低的粘度,因此可以在高浓度被预先制备,使得可能添加已经在溶液中的样品,并且仍然获得包括在适于冷冻保存浓度的冷冻保护试剂和样品的组合物。此外,低分子量的分子一般比具高分子量分子具有较低免疫原性。葡聚糖1被称为半抗原抑制剂,其减少当给予葡聚糖时的过敏反应的风险,并因此用作在注射高分子量葡聚糖如葡聚糖40(40000Da)和葡聚糖70(70000Da)前的预注射液。葡聚糖1也被记录在Richter等人((Int.Arch.Allergy 43:252-268(1972)和Int.Arch.Allergy 41:826-844(1971))的研究中,在人类有非常低的免疫潜力。此外,实施例中已被证明的是,与采用具有较高分子量的葡聚糖相比,采用本文描述的冷冻保护剂的冷冻保存在冷冻保存后提供了对功能性优选的保护,如采用试验的细胞生存力所测定的。
所以,在第一个方面,本发明涉及,包括的一种或多种冷冻保护剂的冷冻保护试剂,所述冷冻保护剂选自糊精、葡聚糖、异麦芽糖寡糖及其衍生物,和
a)其中所述冷冻保护试剂包括基于糊精、葡聚糖、异麦芽糖寡糖及其衍生物的总重量的至少1%w/w的一种或多种异麦芽糖寡糖及其衍生物,所述异麦芽糖寡糖及其衍生物具有300至1650Da的重量平均分子量(MW),或
b)其中所述的冷冻保护剂有300至9500Da如300至7500Da的重量平均分子量(MW)或,
c)其中所述冷冻保护试剂包括基于在所述冷冻保护试剂中糊精、葡聚糖、异麦芽糖寡糖及其衍生物的总重量的至少1%w/w的一种或多种异麦芽糖寡糖及其衍生物,所述异麦芽糖寡糖及其衍生物具有300至1650Da的重量平均分子量(MW),并且所述冷冻保护剂具有300至9500Da的重量平均分子量(MW)。
在另一方面,本发明涉及包括选自异麦芽糖寡糖及其衍生物的冷冻保护剂的冷冻保护试剂,所述异麦芽糖寡糖及其衍生物具有300至1650Da的,如850至1650Da的重量平均分子量(MW)。
在另一方面,本发明涉及本文中描述的冷冻保护剂在冷冻保存样品中的用途,其中所述样品选自器官,细胞和组织。
在另一方面,本发明涉及包括如本文所述的冷冻保护试剂的冷冻保存组合物,所述冷冻保存组合物进一步包括将被冷冻保存的样品,其中所述样品选自器官,细胞和组织。
在另一方面,本发明涉及包括如本文所述的冷冻保护试剂的冷冻保存组合物,所述冷冻保存组合物还包括已被冷冻保存的样品,其中所述样品选自器官,细胞和组织。
在另一方面,本发明涉及冷冻保存样品的方法,包括如下步骤:使将被冷冻保存的样品与如本文所述冷冻保护试剂接触,以获得冷冻保存组合物,和随后降低冷冻保存组合物温度至冷冻保存温度,其中所述样品选自器官,细胞和组织。
在另一方面,本发明涉及,通过使组合物达到冷冻保存温度而冷冻保存本文所描述的冷冻保存组合物的方法,。
在另一方面,本发明涉及本文所描述的冷冻保护试剂在冷冻保存样品中的用途,其中所述样品选自器官,细胞和组织。
在另一方面,本发明涉及本文所描述的冷冻保护试剂在冷冻保存用于移植的样品中的用途。
在另一方面,本发明涉及本文所描述的组合物在通过降低所述组合物温度至冷冻保存温度而冷冻保存样品中的用途,其中所述样品选自器官,细胞和组织。
附图说明
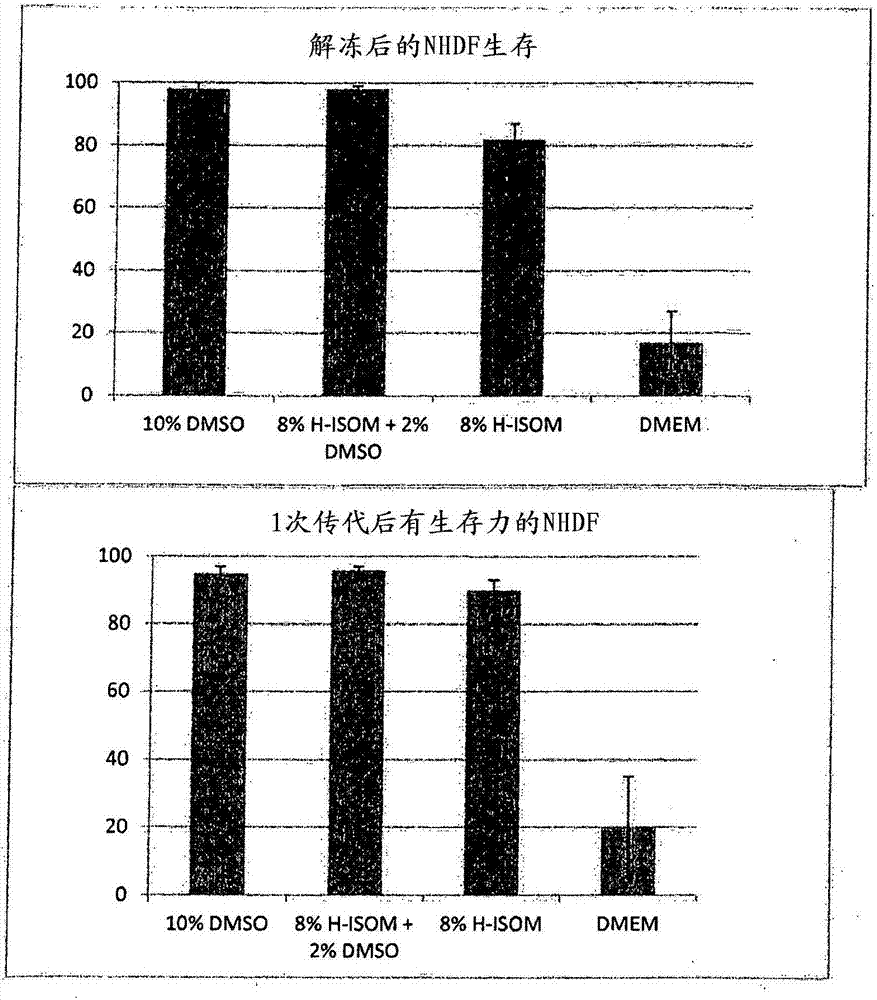
图1显示了,分别在以下中解冻后NHDF的生存和1次传代后NHDF生存力:1)10%的DMSO,2)8%的异麦芽糖寡糖1(ISOM)和2%的DMSO,3)8%的异麦芽糖寡糖1(ISOM)和4)DMEM如实施例2中所描述的。
图2显示了,分别在以下中解冻后NHDFs的生存和1次传代后NHDFs生存力:1)10%的DMSO,2)8%氢化异麦芽糖寡糖1(H-ISOM)和2%的DMSO,3)8%氢化异麦芽糖寡糖1(H-ISOM)和4)的DMEM,如实施例2中所描述的。
图3显示了,分别在以下中解冻后NHEKs的生存和1次传代后NHEKs生存力:1)10%的DMSO,2)8%的异麦芽糖寡糖1(ISOM)和2%的DMSO,3)8%的异麦芽糖寡糖1(ISOM)和4)DMEM,如实施例3中所描述的。
图4显示,分别在以下中解冻后NHEKs的生存:1)10%的DMSO,2)8%氢化异麦芽糖寡糖1(H-ISOM)和2%的DMSO,3)8%氢化异麦芽糖寡糖1(H-ISOM)和4)DMEM,如实施例3中所描述的。
图5显示了,分别在以下中解冻后的MSCs的生存和1次传代后的MSCs的生存:1)10%的DMSO,2)8%的异麦芽糖寡糖1(ISOM)和2%的DMSO,3)8%氢化异麦芽糖寡糖1(H-ISOM)和2%的DMSO,4)8%的异麦芽糖寡糖1(ISOM),5)8%氢化异麦芽糖寡糖1(H-ISOM)和6)DMEM,如实施例4中所描述的。
图6显示,分别在以下中解冻和冷冻保存后,在PluriPro生长培养基中的人类iPS细胞的生存:生长培养基(Growth medium)+10%DMSO,生长培养基+5%的DMSO,生长培养基+10%DMSO+2%的异麦芽糖寡糖1(ISOM),生长培养基+10%DMSO+4%的异麦芽糖寡糖1(ISOM),生长培养基+10%DMSO+8%异麦芽糖寡糖1(ISOM),生长培养基+5%DMSO+2%的异麦芽糖寡糖1(ISOM),生长培养基+5%DMSO+4%的异麦芽糖寡糖1(ISOM),生长培养基+5%DMSO+8%的异麦芽糖寡糖1(ISOM),生长培养基+2%异麦芽糖寡糖1(ISOM),生长培养基+4%异麦芽糖寡糖1(ISOM),生长培养基+8%异麦芽糖寡糖1(ISOM)和不含任何冷冻保护剂的生长培养基,如实施例7中所描述的。
图7显示,分别在以下中解冻后和冷冻保存后PluriPro生长培养基中的人类iPS细胞的生存:生长培养基+10%DMSO,生长培养基+5%的DMSO,生长培养基+10%DMSO+2%氢化异麦芽糖寡糖1(H-ISOM),生长培养基+10%DMSO+4%氢化异麦芽糖寡糖1(H-ISOM),生长培养基+10%DMSO+8%氢化异麦芽糖寡糖1(H-ISOM),生长培养基+5%DMSO+2%氢化异麦芽糖寡糖1(H-ISOM),生长培养基+5%DMSO+4%氢化异麦芽糖寡糖1(H-ISOM),生长培养基+5%DMSO+8%氢化异麦芽糖寡糖1(H-ISOM),生长培养基+2%氢化异麦芽糖寡糖1(H-ISOM),生长培养基+4%氢化异麦芽糖寡糖1(H-ISOM),生长培养基+8%氢化异麦芽糖寡糖1(H-ISOM)和不含任何冷冻保护剂的生长培养基,如实施例8中所述。
图8显示了,分别在以下中解冻和增殖3天后MSCs的生存:1)10%的DMSO,2)”CRYO”分别意指8%异麦芽糖寡糖1,葡聚糖Mw10.000或葡聚糖Mw 40.000,其各自与5%的DMSO组合,3)”CRYO”分别意指8%异麦芽糖寡糖1,葡聚糖Mw10.000或葡聚糖Mw40.000,其各自与1%DMSO组合,4)"CRYO”分别意指8%异麦芽糖寡糖1,葡聚糖Mw10.000或葡聚糖Mw 40.000和5)DMEM培养基,如实施例9中进一步描述的。
图9显示,分别在以下中解冻后MSCs生存:1)10%的DMSO,2)2%的DMSO,3)8%的异麦芽糖寡糖Mw1500(ISOM)和2%的DMSO,4)8%的异麦芽糖寡糖Mw1500(ISOM),和5)DMEM,如实施例10中进一步说明的。
图10显示了,用DMSO,异麦芽糖寡糖1或氢化异麦芽糖寡糖1冷冻保存后CD34+造血干细胞的生存力,如实施例11中进一步描述的。
图11显示,采用DMSO,异麦芽糖寡糖1或氢化异麦芽糖寡糖1冷冻保存后脂肪来源的基质/干细胞(ASC)的生存力,如实施例12中进一步描述的。
发明详述
定义
如本文所使用的,冷冻保存意指一种方法,其中,通过冷却到零度以下的温度而保存样品,包括玻璃化技术,在其中的冷却速度比传统的冷冻保存方法更快。在如此低的温度,活性例如生物活性,包括会导致例如细胞死亡的生化反应被减少,例如蛋白/糖蛋白或脂蛋白的化学结构/功能得以保存。如果不使用冷冻保护剂溶液,被保存的样品可能会被损坏,其原因在于冷却或解冻过程中的冻结。
在一个优选方面,冷冻保存意指如下方法,其中通过冷却到零度以下的温度,通常为77K(=-196℃,液态氮的沸点)而保存样品。在这种低的温度,任何生物活性,包括会引起细胞死亡的生化反应有效地被阻止。
本文所使用的术语“冷冻保存温度”意指如下的温度:从零下到-196℃,如从-50℃至-196℃,如从-80℃至-196℃,例如低于-55℃,例如低于-60℃,例如低于-65℃,例如低于-70℃,例如低于-75℃,例如低于-80℃,例如低于-85℃,例如低于-90℃,例如低于-95℃,例如低于-100℃,例如低于-105℃,例如低于-110℃,例如低于-115℃,例如低于-120℃,例如低于-125℃,例如低于-130℃,例如低于-135℃,例如低于-140℃,例如低于-145℃,例如低于-150℃,例如低于-155℃,例如低于-160℃,例如低于-165℃,例如低于-170℃,例如低于-175℃,例如低于-180℃,例如低于-185℃,例如低于-190℃的温度。
本文所使用的术语“样品”是指将被冷冻保存的任何类型的物质,例如器官,细胞或组织。在一方面,样品选自器官,细胞,组织和血液。在一方面,样品选自器官,细胞和组织,例如选自哺乳动物器官,哺乳动物细胞和哺乳动物组织。在一方面,“样品”不包括在人体形成和发展的各个阶段的人体。在另一方面,本发明涉及本文所描述的冷冻保护试剂在冷冻保存用于移植的样品中的用途。在一方面,所述样品选自用于移植的哺乳动物器官,哺乳动物细胞和哺乳动物组织。
本文所用的术语“细胞”,包括任何类型的细胞,例如体细胞,包括各种组织或器官的细胞,干细胞,包括所有类型的全能干细胞,多潜能干细胞,多能干细胞和祖细胞;卵母细胞;精子(spermatozoa)和生殖细胞。细胞可为分离形式,或在不分离的形式,例如在含有细胞的体液,组织或器官的形式。
本文所使用的术语“含有细胞的体液”包括任何含有细胞的体液,例如,例如下面定义的血液,羊水,精液,脑脊液,骨髓抽出物和月经液。
本文所用的术语“血”包括任何含有血的流体,例如脐带血,外周血,和移动的血(mobilized blood)。
本文所用的术语“组织”或“组织”包括包含任何种类细胞类型的任何组织类型及其组合,包括卵巢组织,睾丸组织,脐带组织,胎盘组织,结缔组织,心脏组织,来自肌肉、软骨和骨的组织,内分泌组织和神经组织。术语“组织”或“组织”也包括脂肪组织或牙髓组织。
本文所使用的术语“器官”包括例如肺,肝,肾,心脏,卵巢和胰腺。“器官”还包括脐带。
本文所使用的术语与样品相关的“冷冻保存后是有功能的”意味着,样品例如器官、细胞或组织在冷冻保存后保留在冷冻保存后可接受的和/或所需的功能。在一方面,样品在冷冻保存后保存其所有功能。在另一方面,样品,例如细胞,至少保留50%的所需的功能,例如至少60%的所需的功能,例如至少70%的所需的功能,例如至少80%的所需的功能,例如至少90%的所需的功能,例如至少95%的所需的功能,例如100%所需的功能,作为关于细胞的例子,将被保存的重要功能是细胞的生存力。作为关于器官的另一个实例,将被保存的重要功能是所述器官的生理功能,如心脏泵功能。作为关于组织的另一个实例,在移植的情况下,将被保存的重要功能是保持这样的组织与周围组织(如皮肤)整合的能力。
可以通过使用核计数器系统(Nucleocounter system)测量冷冻保存后细胞的生存力,其中,通过采用DNA结合染料,碘化丙啶孵育细胞样品而测定死亡细胞,碘化丙啶只导致对死细胞的可检测测量,如实施例所示。生存力是作为被分析的群体中活细胞的百分比而给出。冷冻保存后的细胞样品增殖率可采用比色测定,MTT分析。
本文所用的术语“储存”是指样品的任何存储,其用于以后使用。
本文所用的术语“临床储存方法”是指样品的任何存储,所述样品涉及哺乳动物例如人的临床治疗。
本文所用的术语“骨髓储存方法”意味着骨髓样品例如骨髓抽出物和相关的体液或从骨髓分离出的细胞的存储。
本文所使用的术语“牙髓组织储存方法”是指牙髓组织样品例如从牙髓组织中分离出的细胞的存储。
本文所使用的术语“脂肪组织储存方法”是指脂肪组织样品例如从脂肪组织分离的细胞的存储。在目前的上下文和以下中的术语“脐带储存方法”意味着脐带血,与脐带相关的组织或分离自脐带血或组织的细胞的储存。
在目前的上下文和以下中的术语“移动的外周血(mobilized peripheral blood)储存方法”是指采用例如释放血干细胞进入循环的试剂之后外周血的储存。
本文所用的术语“生殖储存方法”是指与生殖例如精液,卵母细胞,精子,受精卵等有关的任何样品的存储。
原子质量单位道尔顿(符号:Da)是用于指示原子或分子尺度的质量标准单位(原子质量)。它被定义为碳-12在其原子核和电子的基态中未结合的中性原子的剩余质量的十二分之一。
如本文所用的术语“重量平均分子量(MW)被定义为:
其中gi是具有分子量Mi的分子的份数。M的可能的值组成一组数字,其具有离散值标记的Mi,定义p。
如本文使用的术语“数平均分子量”是定义为:
其中Ni是具有分子量Mi的分子的份数,gi是具有分子量Mi的分子的份数。M的可能值组成一组数字,其具有离散值标记的Mi,定义p。
本文所使用的术语多分散性(Pd)通过以下计算
Mw/Mn=Pd。
本文所使用的术语后跟一个数字的“葡聚糖”,例如“葡聚糖1”,“葡聚糖40”和“葡聚糖70”遵循葡聚糖X的药典缩写,葡聚糖X意味着葡聚糖的重量平均分子量约为X kDa。因此,葡聚糖1意味着有850-1150Da重量平均分子量的葡聚糖。异麦芽糖寡糖1和氢化异麦芽糖寡糖1被同样地命名。因此,异麦芽糖寡糖1意味着具有850-1150Da重量平均分子量的异麦芽糖寡糖的混合物,这符合葡聚糖1的EP和USP标准(专著)(Monographs)。异麦芽糖寡糖1在本申请中又称五异麦芽糖(pentaisomaltose)。氢化异麦芽糖寡糖1指氢化异麦芽糖寡糖的混合物,其中所述异麦芽糖寡糖符合葡聚糖1的EP和USP标准。氢化异麦芽糖寡糖1在本申请中又称五异麦芽糖苷。
本文所用的术语“葡聚糖基异麦芽糖寡糖”意味着具有300至1650Da,例如850至1650Da的重量平均分子量(MW)的异麦芽糖寡糖,和得自水解葡聚糖,例如通过水解低分子量葡聚糖。
本文所使用的术语“冷冻保护剂”意味着如下物质,所述物质例如在合适的溶液中,被用于保护样品以免于冷冻损伤。已知的冷冻保护剂的实例是例如DMSO,多元醇等。
本文所使用的术语“无菌”意味着不含活的细菌,微生物和其他能够增殖的生物。
本文所用的术语“基本上不含DMSO”意味着DMSO含量少于0.01w/w%。
本文所用的术语"C1-10烷基"是直链或支链C1-10烷基的烃例如直链或支链C1-6烷基。实例是甲基,乙基,1-丙基,2-丙基,异丙基,1-丁基,2-甲基-1-丙基,2-丁基,1-戊基,3-戊基,2-甲基-2-丁基,和3-甲基-2-丁基。
本文所用的术语"羧基C1-10烷基"意指-C1-10烷基COOH。一个实例是羧甲基(CM)(-CH2COOH)。
本文所用的术语“DEAE”是指二乙基氨基乙基。
冷冻保护试剂
本文所描述的是冷冻保护试剂,其含有冷冻保护剂,所述冷冻保护剂为一种或多种选自糊精、葡聚糖、异麦芽糖寡糖及其衍生物的冷冻保护剂,和
a)其中,基于在所述冷冻保护试剂中糊精、葡聚糖、异麦芽糖寡糖及其衍生物的总重量,所述冷冻保护试剂包括至少1%w/w的一种或多种异麦芽糖寡糖及其衍生物,所述异麦芽糖寡糖及其衍生物具有如下重量平均分子量(MW):300至1650Da的重量平均分子量(MW)例如850至1650Da的重量平均分子量(MW),或
b)其中所述的冷冻保护剂有300至9500Da例如300至7500Da的重量平均分子量(MW),或
c)其中,基于在所述冷冻保护试剂中糊精、葡聚糖、异麦芽糖寡糖及其衍生物的总重量,所述冷冻保护试剂包括至少1%w/w的一种或多种异麦芽糖寡糖及其衍生物,所述异麦芽糖寡糖及其衍生物具有300至1650Da例如850至1650Da的重量平均分子量(MW),所述冷冻保护剂具有300至9500Da的重量平均分子量(MW)。
在一方面,所述冷冻保护剂选自葡聚糖,异麦芽糖寡糖,及其衍生物,
通常通过凝胶渗透色谱(GPC),采用例如类型聚醚的羟基化凝胶GPC柱,而测定葡聚糖和糊精和/或其衍生物的分子量。可以如在欧洲药典第七版中针对葡聚糖所描述的和使用在欧洲药典第七版,卷2,1816-1817页针对葡聚糖描述的迭代数学方法,进行校准。
异麦芽糖寡糖和/或其衍生物例如氢化异麦芽糖寡糖的分子量,通常是采用凝胶渗透色谱(GPC)测定。在柱系统中固定相可以是共价结合至高度交联的多孔琼脂糖珠的葡聚糖,允许在分子质量范围180-3000Da中寡糖的分辨率。按照欧洲药典第七版,卷1,60-61页进行测量。
当所述冷冻保护剂是电中性的,所述冷冻保护试剂的重量平均分子量(MW)优选由GPC测定。当测量携带电荷的冷冻保护试剂的重量平均分子量(MW)时,重量平均分子量(MW)是基于电中性原料分子量与带电的冷冻保护试剂的取代度而计算。在不带电的原料中,每个葡萄糖单元可以被1至3个取代基取代。采用DEAE作为取代基的的例子,技术人员可例如测量氮含量(例如采用基耶达分析法)以计算取代程度,之后计算出最终产物的分子量。如果取代基含有酸性基团,取代度可以例如通过滴定由技术人员确定,然后最终的分子量可以被计算。
糊精,葡聚糖,和异麦芽糖寡糖全部包含重复的D-葡萄糖单元。葡聚糖是中性支链多糖的家族,所述中性支链多糖主要由α-(1→6)连接的D-葡萄糖构成,如下面进一步描述的。糊精是通过α-(1→4)或α-(1→6)糖苷键连接的D-葡萄糖单元的聚合物的混合物,如下面进一步描述的。异麦芽糖寡糖是具有α-D-(1,6)-连接基(通常少于10个D-葡萄糖单元,适合的是3-6个葡萄糖单元)的葡萄糖低聚物的混合物,通常有300至1650Da的平均重量分子量,例如500至1650Da的,例如850至1650Da,或例如850Da至1150Da的平均重量分子量。在一方面,有少于3个葡萄糖单元的异麦芽糖寡糖的重量分数小于15%w/w。在一方面,有超过9个葡萄糖单元的异麦芽糖寡糖的重量分数小于20%w/w例如小于15%w/w,例如少于10%w/w。在另一个方面,有少于3个葡萄糖单元的异麦芽糖寡糖的重量分数小于15%w/w,有超过9个葡萄糖单元的异麦芽糖寡糖的重量分数小于20%w/w例如小于15%w/w,例如小于10%w/w。重量分数可以被确定,例如如本文制备例1、2中所描述的。
在一方面,糊精,葡聚糖,和异麦芽糖寡糖的衍生物选自氢化的异麦芽糖寡糖,氢化的葡聚糖,氢化的糊精,氧化的异麦芽糖寡糖,氧化的葡聚糖,氧化的糊精,糊精的酯,葡聚糖的酯,异麦芽糖寡糖的酯,糊精的醚,葡聚糖的醚,异麦芽糖寡糖的醚,和部分氢化/氧化的糊精,部分氢化/氧化的葡聚糖、和部分氢化/氧化的异麦芽糖寡糖,及其衍生物。在一方面,异麦芽糖寡糖的衍生物选自氢化的异麦芽糖寡糖,氧化的异麦芽糖寡糖、异麦芽糖寡糖的酯,异麦芽糖寡糖的醚,和部分氢化/氧化的异麦芽糖寡糖,及其衍生物。
下面是用于上文描述糊精,葡聚糖,和异麦芽糖寡糖的衍生物的不同合成和原料的实施例的一个示意的概览(表A)。
表A:
*在一个方面,合成可以是部分氧化和氢化方法以获得部分氧化的和氢化的衍生物,例如如在US 6977249中所述
在一个方面,所述糊精的醚,葡聚糖的醚,和异麦芽糖寡糖的醚的类型选自具有官能团R的醚。R选自C1-10烷基例如C1-6烷基例如甲基(-CH3)和乙基(-C2H5),羧基C1-10烷基例如羧基甲基(-CH2COOH),羟基C1-10烷基例如2-羟基乙基(-C2H4OH),2-羟基丙基(-CH2CHOHCH3),2-羟基烷基(-CH2CHOH(CH2)nCH3其中n是1-10),3-氯代-2-羟基丙基(-CH2CHOHCH2Cl),2-二乙基氨基乙基(-C2H4N(C2H5)2),3-氨基-2-羟基丙基(-CH2CHOHCH2NH2),3-二甲基烷基铵-2-羟基丙基(-CH2CHOHCH2N+(CH3)2R其中R是C1-10烷基),聚乙二醇鲸蜡基(-CH2CH2O)10C16H33),和聚乙二醇硬脂酰基(-CH2CH2O)10C18H37)。
在一方面,所述糊精的醚,葡聚糖的醚和异麦芽糖寡糖的醚分别是DEAE-糊精,DEAE-葡聚糖,DEAE-异麦芽糖寡糖。在一方面,所述异麦芽糖寡糖的醚是DEAE-异麦芽糖寡糖。在一方面,所述糊精的醚,葡聚糖的醚和异麦芽糖寡糖的醚分别是羧基C1-10烷基-糊精,羧基C1-10烷基-葡聚糖,羧基C1-10烷基-异麦芽糖寡糖。在一方面,所述异麦芽糖寡糖的醚是羧基C1-10烷基-异麦芽糖寡糖,
在一方面,糊精,葡聚糖,和异麦芽糖寡糖的衍生物选自氢化的异麦芽糖寡糖,氢化的葡聚糖和氢化的糊精。在一方面,异麦芽糖寡糖的衍生物是氢化的异麦芽糖寡糖。
在另一方面,糊精,葡聚糖,和异麦芽糖寡糖的衍生物选自氧化的异麦芽糖寡糖,氧化的葡聚糖,和氧化的糊精。在一方面,异麦芽糖寡糖的衍生物是氧化的异麦芽糖寡糖。在另一方面,糊精,葡聚糖,和异麦芽糖寡糖的衍生物选自氧化/氢化的异麦芽糖寡糖,氧化/氢化的葡聚糖,和氧化/氢化的糊精。在一方面,异麦芽糖寡糖的衍生物是氧化/氢化的异麦芽糖寡糖。
在另一方面,环糊精,葡聚糖和异麦芽糖寡糖的衍生物选自DEAE-葡聚糖,DEAE-葡聚糖,DEAE-异麦芽糖寡糖,羧基C1-10烷基-糊精,羧基C1-10烷基-葡聚糖,羧基C1-10烷基-异麦芽糖寡糖,糊精的酯,葡聚糖的酯和异麦芽糖寡糖的酯。在另一方面,异麦芽糖寡糖的衍生物选自DEAE-异麦芽糖寡糖,羧基C1-10烷基-异麦芽糖寡糖,和异麦芽糖寡糖的酯。
在另一方面,糊精,葡聚糖,和异麦芽糖寡糖的衍生物选自以下的衍生物:氢化的糊精,氢化的葡聚糖,氢化的异麦芽糖寡糖例如选自DEAE-氢化的糊精,DEAE-氢化的葡聚糖,DEAE-氢化的异麦芽糖寡糖,羧基C1-10烷基-氢化的糊精,羧基C1-10烷基-氢化的葡聚糖,羧基C1-10烷基-氢化的异麦芽糖寡糖,氢化的糊精的酯,氢化的葡聚糖的酯和氢化的异麦芽糖寡糖的酯。在另一方面,异麦芽糖寡糖的衍生物选自氢化异麦芽寡糖衍生物例如选自DEAE-氢化的异麦芽糖寡糖,羧基C1-10烷基-氢化的异麦芽糖寡糖和氢化的异麦芽糖寡糖的酯。在另一方面,糊精,葡聚糖,和异麦芽糖寡糖的衍生物选自氧化环糊精,氧化的葡聚糖和氧化的异麦芽糖寡糖的衍生物例如选自DEAE-氧化的葡聚糖,DEAE-氧化的葡聚糖,DEAE-氧化的异麦芽糖寡糖,羧基C1-10烷基-氧化的糊精,羧基C1-10烷基-氧化的葡聚糖,羧基C1-10烷基-氧化的异麦芽糖寡糖,氧化的糊精的酯,氧化的葡聚糖的酯和氧化的异麦芽糖寡糖的酯。在另一方面,异麦芽糖寡糖的衍生物选自氧化的异麦芽糖寡糖的衍生物例如选自DEAE-氧化的异麦芽糖寡糖,羧基C1-10烷基-氧化的异麦芽糖寡糖和氧化的异麦芽糖寡糖的酯。
在另一方面,冷冻保护剂是氢化的异麦芽糖寡糖,氧化的异麦芽糖寡糖,DEAE-异麦芽糖寡糖,羧基C1-10烷基氧化异麦芽糖寡糖,异麦芽糖寡糖的酯,异麦芽糖寡糖的醚、羧基C1-10烷基异麦芽糖寡糖。
在另一方面,冷冻保护剂为羧甲基异麦芽糖寡糖或羧乙基异麦芽糖寡糖。
在一方面,冷冻保护剂是异麦芽糖寡糖例如异麦芽糖寡糖1。在另在一方面,冷冻保护剂是氢化的异麦芽糖寡糖例如氢化的异麦芽糖寡糖1。
通过对衍生变化,不同取代度可被达到。适当地,取代度为在对于每个葡萄糖单元一到三个取代基的范围。例如,在DEAE-葡聚糖的情况下,优选约一个电荷基团对应三个葡萄糖单元。
在一方面,所述冷冻保护试剂包括冷冻保护剂,所述冷冻保护剂是以下的一种或多种:糊精、葡聚糖、异麦芽糖寡糖及其衍生物,并且其中基于在所述试剂中糊精、葡聚糖、异麦芽糖寡糖及其衍生物的总重量,所述冷冻保护试剂包括至少1%w/w的一种或多种异麦芽糖寡糖及其衍生物,所述异麦芽糖寡糖及其衍生物具有300至1650Da的重量平均分子量(MW)例如具有850至1650Da的重量平均分子量(MW)。
在另在一方面,冷冻保护试剂包括冷冻保护剂,所述冷冻保护剂是以下的一种或多种:糊精、葡聚糖、异麦芽糖寡糖,及其衍生物,其中所述冷冻保护剂具有如下的重量平均分子量(Mw):300至9,500Da,例如300至7,500Da,例如500至7,500Da。在一方面,所述冷冻保护剂具有如下的重量平均分子量(MW):最多9500Da,例如最多9000Da,例如最多8000Da,例如最多7000Da,例如最多6000Da,例如最多5000Da,例如最多4000Da,例如最多3000Da,例如最多2000Da,例如最多1900Da,例如最多1800Da,例如最多1700或例如最多1,650Da。
在另在一方面,冷冻保护试剂包括冷冻保护剂,所述冷冻保护剂是以下的一种或多种:糊精、葡聚糖、异麦芽糖寡糖及其衍生物,基于在所述试剂中环糊精,葡聚糖,异麦芽糖寡糖,及其衍生物的总重量,所述冷冻保护试剂包括至少1%w/w的一种或多种异麦芽糖寡糖及其衍生物,所述异麦芽糖寡糖及其衍生物具有如下的重量平均分子量(Mw):300至1,650Da例如具有如下的重量平均分子量(Mw):850至1,650Da,并且其中所述冷冻保护剂具有如下的重量平均分子量(Mw):300至9,500Da,例如300至7,500Da,例如500至7,500Da。
在一方面,带电的衍生物的特征是由不带电的原料例如由上述的葡聚糖,糊精,和异麦芽糖寡糖制备的衍生物的分子量分布。因此,在一方面,所述糊精,葡聚糖和/或异麦芽糖寡糖的衍生物有如下的重量平均分子量(Mw):300至9,500Da,例如300至7,500Da,例如500至7,500Da。在另在一方面,所述衍生物是重量平均分子量(Mw)为850至1,650Da的异麦芽糖寡糖的衍生物。
在一方面,冷冻保护剂选自葡聚糖,糊精,及其衍生物,所述葡聚糖,糊精,及其衍生物具有如下的重量平均分子量(Mw):300至9,500Da,例如300至7,500Da,例如500至7,500Da。
在一方面,冷冻保护剂选自葡聚糖,糊精,及其衍生物,所述葡聚糖,糊精,及其衍生物具有如下的重量平均分子量(Mw):1,650至7,500Da。
在一方面,冷冻保护剂选自葡聚糖,糊精,及其衍生物,所述葡聚糖,糊精,及其衍生物具有如下的重量平均分子量(Mw):1,650至7,500Da,和≥1和≤5的多分散性。
在一方面,冷冻保护剂选自葡聚糖,糊精及其衍生物,所述葡聚糖,糊精及其衍生物具有如下的重量平均分子量(Mw):1,650至3,500Da。
在一方面,冷冻保护剂选自葡聚糖,糊精及其衍生物,所述葡聚糖,糊精及其衍生物具有1,650至3,500Da的重量平均分子量,和≥1和≤5的多分散性。
在一方面,冷冻保护剂选自异麦芽糖寡糖,及其衍生物,所述异麦芽糖寡糖,及其衍生物具有如下的重量平均分子量(Mw):850至1,650Da。
在一方面,冷冻保护试剂选自异麦芽糖寡糖及其衍生物,所述异麦芽糖寡糖及其衍生物具有≥1和≤3的多分散性。
在另在一方面,冷冻保护试剂选自异麦芽糖寡糖,及其衍生物,所述异麦芽糖寡糖及其衍生物具有如下的重量平均分子量(Mw):850至1,150Da。
在另在一方面,有少于3个葡萄糖单元的异麦芽糖寡糖的重量分数小于15%w/w。在一方面,有超过9个葡萄糖单元的的异麦芽糖寡糖的重量分数为少于20%w/w例如少于15%w/w,例如少于10%w/w。在另一方面,有少于3个葡萄糖单元的异麦芽糖寡糖的重量分数小于15%w/w,有超过9个葡萄糖单元的异麦芽糖寡糖的重量分数小于20%w/w例如少于15%w/w,例如少于10%w/w。重量分数例如可以如本文制备实例1和2中所确定。
在一方面,所述冷冻保护试剂包括至少10%例如20%w/w的一种或多种异麦芽糖寡糖及其衍生物,基于在所述试剂中环糊精,葡聚糖,异麦芽糖寡糖及其衍生物的总重量,所述异麦芽糖寡糖及其衍生物具有如下的重量平均分子量(Mw):300至1,650Da例如具有如下的重量平均分子量(Mw):850至1,650Da。在另在一方面,基于在所述试剂中环糊精,葡聚糖,异麦芽糖寡糖及其衍生物的总重量,冷冻保护试剂包括至少30%,例如40%,例如50%,例如60%,例如70%,例如80%,例如90%,例如95%或更多的w/w的一种或多种异麦芽糖寡糖及其衍生物,所述异麦芽糖寡糖及其衍生物具有如下的重量平均分子量(Mw):300至1,650Da例如具有如下的重量平均分子量(Mw):850至1,650Da。
葡聚糖及其衍生物
葡聚糖可以由几个细菌株形成的,所述细菌株主要是革兰氏阳性,兼性厌氧菌球菌(facultative anaerobe cocci),如明串球菌属(Leuconostoc)和链球菌属(Streptococcus)菌株,如“聚合体科学进展”,卷205,多糖II,克列姆编辑,施普林格出版社(“Advances in polymer science”,Volume 205,Polysaccharides II,editor D.Klemm,Springer Verlag)中所描述的。药用葡聚糖通常是由特定的细菌菌株产生的,所述细菌菌株定义在美国或欧洲药典中,例如由肠膜样明串珠菌(Leuconostoc Mesenteroides)NCTC 10817或B512F产生。菌株NCTC 10817和B512F是自1971起从国立类型培养收藏所(中央公共卫生实验室)(National Collection Type Cultures(Central Public Health Laboratory))英国可以公开获得的,
葡聚糖是一个中性支链多糖家族,主要由以下组成:α-(1→6)连接的D-葡萄糖,其具有不同比例的连接基和分支的主链,这取决于发酵中使用的细菌。葡聚糖分子中含有一个自由端醛基,其没有显示于式I中。葡聚糖中所述α(1→6)连接基可以在从总糖苷键的50到97%之间变化。剩下的糖苷键代表α-(1→2),α-(1→3)和α-(1→4)连接基被键结合作为分支。式I显示葡聚糖α(1→6)-连接的葡萄糖主链的部分,所述葡萄糖的分支点在2,3和4位。使用上述B512F菌株,α-(1-6)连接基的比通常是95%或以上。
式I
非常高的数值的分子量被发现于天然葡聚糖。从107到4x108道尔顿的值的范围被报道。为了使葡聚糖用于许多应用,水解天然葡聚糖至低分子量是必要的。存在一些本领域技术人员已知的和可用的方法,但是,水解可在约pH 1.5,通常采用盐酸,并在约95℃温度进行。通过水解,低分子量葡聚糖和葡萄糖被制备。水解产物是典型通过各种方法而纯化和分离,所述方法例如采用纯沉积,过滤和其他各种色谱方法,包括膜过滤。
药用葡聚糖通常是由特定的细菌菌株产生,所述的细菌菌株在美国或欧洲药典中被定义,例如例如由肠膜样明串珠菌NCTC 10817或B512 F产生。如上面提到的菌株B512F NCTC 10817可以从国立类型培养收藏所(中央公共卫生实验室)英国公开地可获得。
在葡聚糖中,特别是葡聚糖40和葡聚糖70已被用于人类的药物用途。其他的分子大小例如如葡聚糖500和葡聚糖5和分子量处于两者之间的葡聚糖是在冷冻保存领域之外被使用作为载体,所述载体用于合成,分离细胞,作为在疫苗中或在其他各种应用例如保存人角膜中的赋形剂。此外,葡聚糖1对人类有一个特殊的使用,因为葡聚糖1的预注射具有半抗原抑制和阻断了人的葡聚糖抗体,从而防止潜在的过敏反应,已知所述过敏反应偶尔会在人类施用高分子量的葡聚糖后发生。葡聚糖1,葡聚糖40和葡聚糖70是被很好描述的药典产品(欧洲药典第七版,卷2,1816-1819页)。
葡聚糖也是优良的原料,所述原料用于合成水溶性高分子。
以下是葡聚糖衍生物的实施例:
1)氢化的葡聚糖可通过葡聚糖与还原剂例如硼氢化物在碱性条件例如在pH8-12反应而合成,所述反应还原醛端基为山梨糖醇。
2)可通过技术人员已知的方法合成葡聚糖的醚。作为一个实施例,可以提到的是,2-(二乙基氨基)乙基葡聚糖(DEAE葡聚糖)(在反应方案1中所示),其可以通过葡聚糖与(2-氯乙基)二乙基氯化铵在碱溶液中反应而合成。
反应方案1:含有2-(二乙基氨基)乙基(A)2-[(2-(二乙基氨基)乙基]二乙基铵]乙基(B)基团的DEAE-葡聚糖
另一个实施例是羧基C1-10烷基葡聚糖例如羧甲基葡聚糖(CMD),如在反应方案2中所示,可在强碱性条件下通过与单氯乙酸(MCA)反应而合成。
反应方案2
3)葡聚糖酯例如乙酸葡聚糖可通过葡聚糖与乙酸酐反应而合成。
反应方案3
4)氧化的葡聚糖可以例如通过在碱性水溶液中的次氯酸钠而合成。
5)部分氧化/氢化的葡聚糖。这种类型衍生物的制备方法,例如公开于US 6977249,通过引用并入本文。作为一个实例,可以提到的是,是由以下方法制备的葡聚糖,在所述方法中,通过水解降低葡聚糖分子量,和通过氢化将其醛端基转化为醇基团;其特征在于,所述氢化仅是部分的,残留最多15%重量还原糖,其是针对碳水化物总量而计算的,所述葡聚糖随后经历氧化,所述氢化和氧化被执行以所获得实质上所有的醛基团都转化成醇和羧基的葡聚糖,所述葡聚糖产物在中间体糖基中没有功能性醛基或功能性羧酸基团;其中所述氢化反应是在水溶液中通过硼氢化钠而进行;并且其中氧化通过在碱性溶液中通过次氯酸钠而进行。
6)进一步DEAE-取代的,羧基C1-10烷基取代的,以上的氢化和/或氧化的葡聚糖的酯类和醚类可通过技术人员已知的方法制备,类似于上文所述。
异麦芽糖寡糖及其衍生物
异麦芽糖寡糖是葡萄糖低聚物,其具有α-D-(1,6)-结合的主链。在一方面,本文所述的异麦芽糖寡糖是基于葡聚糖的,是由水解低分子量葡聚糖而制备的。在另在一方面,描述的异麦芽糖寡糖具有如下重量平均分子量(MW):300至1650Da例如具有850至1650Da的重量平均分子量(MW)。在一方面,本文所述的异麦芽糖寡糖是水解的葡聚糖,其具有850至1650Da的重量平均分子量(MW)。
从异麦芽糖寡糖开始,可以制备衍生物,其特征是将还原醛端基转化为多羟(直链)糖醇/山梨糖醇。从异麦芽糖寡糖至氢化的异麦芽糖寡糖的转换可以如下进行:用还原剂如硼氢化物在碱性条件下处理异麦芽糖寡糖,如以下反应方案4所示的:
反应方案4
反应方案4
采用上述用于制造葡聚糖衍生物的方法,异麦芽糖寡糖衍生物也可以被制备,例如通过采用(2-氯乙基)二乙基氯化铵的反应制备2-(二乙基氨基葡聚糖)乙基(DEAE)异麦芽糖寡糖。另一个选择是通过采用用于合成羧甲基异麦芽糖寡糖的单氯乙酸(MCA)的反应而制备异麦芽糖寡糖衍生物。对技术人员而言,明显的是,可以通过分别与(2-氯乙基)二乙基氯化铵和单氯乙酸的反应制备其他进行氢化的异麦芽糖寡糖衍生物,如上文针对葡聚糖和异麦芽糖寡糖所描述的。
寡聚-异麦芽糖
以葡聚糖为原料,葡聚糖1(异麦芽糖寡糖)作为中介,可以合成寡聚-异麦芽糖,其特征是,完全缺乏分支侧链α-(1→2),α-(1→3)和α-(1→4),其定义葡聚糖分子。在目前的情况下,寡聚异麦芽糖被认为是异麦芽糖寡糖的子集。因此,在一方面,寡聚异麦芽糖具有如下的的重量平均分子量:300至1650Da的重量平均分子量(MW)例如850至1650Da,优选850至1150Da,且完全缺乏分支侧链α-(1→2),α-(1→3)和α-(1→4)。显然,上述对异麦芽糖寡糖描述的衍生物的相同合成可以使用寡聚异麦芽糖进行。
糊精和其衍化物
糊精是一类低分子量的碳水化合物,其由淀粉水解产生。糊精是葡聚糖聚合物,其由分子的混合物组成,所述分子具有不同长度的主链糖链。使用糊精前,它们是典型地被纯化和分离,如采用水解或一种或多种的醇沉积工艺和/或各种色谱方法,包括膜处理,其应用一种或多种特定截止值的膜,以获得所需的分子尺寸和重量分布。
糊精是通过α-(1→4)或α-(1→6)糖苷键连接的D-葡萄糖单元的聚合物混合物,如在式II中所示。
式II
衍生物可通过技术人员已知的方法制备,所述方法类似于上述的针对葡聚糖和异麦芽糖寡糖的方法。
冷冻保存
为了避免将被保存的样品的污染,优选的是,冷冻保护剂是无菌的,和冷冻保存试剂/组合物的其他可选组分也都是无菌的。
在一些应用中,可能有用的是,向选自糊精、葡聚糖、异麦芽糖寡糖及其衍生物的冷冻保护剂补充额外的冷冻保护剂以减少这些额外的冷冻保护剂的浓度,优选是减少至无毒浓度。这对于特定类型的细胞,如肝细胞或多能干细胞可能是特别有用的。在另在一方面,冷冻保护试剂进一步包括至少一种额外的冷冻保护剂,所述额外的冷冻保护剂选自乙酰胺,琼脂,海藻酸盐或酯,1-苯胺(analine),白蛋白,醋酸铵,丁二醇,硫酸软骨素,氯仿,胆碱,二甘醇,二甲基乙酰胺,二甲基甲酰胺,二甲基亚砜(DMSO),赤藓糖醇,乙醇,乙二醇,甲酰胺,葡萄糖,甘油,a-甘油磷酸盐或酯,单乙酸甘油,甘氨酸,羟乙基淀粉,肌醇,乳糖,氯化镁,硫酸镁,麦芽糖,甘露醇,甘露糖,甲醇,甲基乙酰胺,甲基甲酰胺,甲基脲,苯酚,普流尼克(Pluronic)多元醇,聚乙二醇,聚乙烯吡咯烷酮,脯氨酸,丙二醇,吡啶N-氧化物,核糖,丝氨酸,溴化钠,氯化钠,碘化钠,硝酸钠,硫酸钠,山梨糖醇,蔗糖,海藻糖,三甘醇,乙酸三甲基胺,脲,缬氨酸和木糖。在一方面,所述额外的冷冻保护剂是DMSO。添加减少量的DMSO的优势可能是,对于非常脆弱的细胞而言,可以得到额外的保护。在一个优选的方面,冷冻保护试剂不含或基本不含DMSO。因此,在另一个优选方面,所述糊精,葡聚糖,异麦芽糖寡糖,或其衍生物是在冷冻保护试剂中唯一的冷冻保护剂。不含或基本不含DMSO的冷冻保护试剂在解冻样品后可能不需要洗涤。解冻的样品可以直接悬浮在培养基中以立即开始培养过程,而不必清洗样品,或可能直接用于患者,而没有清洗的步骤,所述清洗的步骤可能导致大量的细胞的损失。利用不含或基本不含DMSO的冷冻保护试剂的另一个优点是,样品可能暴露于冷冻保护剂较长时期而无损伤,从而实现更高效的工作过程。
在另在一方面,冷冻保护试剂还包括至少一种防冻蛋白和/或防冻糖蛋白,所述防冻蛋白和/或防冻糖蛋白量例如在0.01至1毫克/毫升的所述冷冻保护试剂。防冻糖蛋白的一个实施例是来自长角杜父鱼的I型AFP,它是一个单一的,长的两亲性的α-螺旋。
冷冻保护剂或组合物可以包括其它物质以提高样品的可行性。这样物质的实施例可以由以下构成,IAPs(凋亡抑制剂),对rho相关蛋白激酶(ROCK)信号通路(signaling pathway)抑制剂,生长因子例如EGF,FGF,PDGF,IGF,EPO,BDNF,TGF,TNF,VEGF。在另在一方面,可以提到的是,人,牛,马,犬来源的任何血清成分。冷冻保护试剂或组合物还可以含有生长培养基。在一方面,可以使用的是包括以下的生长培养基,β-连环蛋白/p300拮抗剂和活化蛋白/TGFβ配体,例如例如与活化蛋白和TGFβ结合的ID-8。这类培养基特别适用于多能干细胞,特别是胚胎干细胞的培养,例如如在WO 2013/054112中所描述的。另一个实施例是标准的剔除培养基(knock out medium),其包括剔除血清取代物(KnockOut Serum Replacement),具有GlutamaxTM补充物的DMEM/F12,FGF,NEAA和BME。另一个实施例是mTSERTM系统。根据要保存的样品的生长培养基的其他的实施例是技术人员众所周知的。
本文所述的冷冻保护试剂可以是粉末例如冻干的或喷雾干燥粉末的形式。
在另在一方面,所述冷冻保护试剂是溶液的形式。试剂可以进一步包括溶剂例如例如无菌水。在一方面,所述剂包括从30%到70%w/w的所述冷冻保护剂,如从40%至65%w/w或从50%到60%w/w的所述冷冻保护剂。
将被冷冻保存的样品例如细胞,组织或器官也可以与冷冻相容的pH缓冲剂接触,所述冷冻相容的pH缓冲剂最典型包括至少一种碱性盐溶液,能量源(例如,葡萄糖),能够在低的温度下维持中性pH值的缓冲剂。众所周知的物质包括,例如,达尔伯克改良伊格尔培养基(DMEM)。这种物质也可以被包括作为冷冻保存组合物和/或试剂的部分。
在本文公开的一方面是,一种包括如本文所述的冷冻保护试剂的冷冻保存组合物,所述冷冻保存组合物进一步包括将被冷冻保存的样品。
在本文公开的另一方面是一种包括冷冻保护试剂和样品的组合物,所述样品已被冷冻保存或是在被冷冻保存的过程中。本文所描述的术语,“冷冻保存的组合物”指“冷冻保存组合物”,其是在被冷冻保存的过程中或已经被冷冻保存。
在本文公开的另一方面是一种冷冻保存的组合物,其包括用于要被冷冻保存的样品的培养基或底物。
在一方面,样品选自器官,细胞和组织例如哺乳动物。在另在一方面,样品是器官,细胞,血液或组织。将被冷冻保存的这样的细胞实施例是体外培养细胞包括原代细胞,细胞系,在体外分选的细胞包括人类血细胞,和动物和人类的来源的受精卵。进一步的实施例是精子细胞,胚胎干细胞,IPS细胞,间充质干细胞,造血干细胞,神经干细胞,脐带血干细胞,肝细胞,神经细胞,心肌细胞,血管内皮细胞,血管平滑肌细胞和血细胞。在另在一方面,样品是选自以下的细胞:间充质干细胞,造血干细胞,胚胎干细胞,IPS细胞,角质形成细胞,优选的造血干细胞例如CD34阳性血干细胞,间充质干细胞,胚胎干细胞和IPS细胞。在另在一方面,样品选自间充质干细胞和造血干细胞。在一方面,细胞是动物或人类来源的。器官的实施例是肺,肝,肾,心脏,卵巢和胰腺。组织实例是如下的组织:骨髓,皮肤,卵巢,睾丸,血管,结缔组织,优选的组织是卵巢和结缔组织。在另在一方面,血液是选自脐带血,和移动的外周血,优选的脐带血。在另在一方面,样品是含有细胞的体液例如血,月经液或羊水。
根据被冷冻保存的特定样品,在将被冷冻保存的组合物中存在的冷冻保护剂的量通常是1至50%w/w如从2至50%w/w,如从4至45%w/w,或从6至20%w/w,或从6至12%w/w,或者优选从6至10%w/w,或者最优选从7至9%w/w。在一个方面,将被冷冻保存的组合物中存在的冷冻保护剂的量是至多60%w/w的量,例如以至多55%w/w的量,例如以至多50%w/w的量,例如以至多45%w/w的量,例如以至多40%w/w的量,例如以至多35%w/w的量。在另一方面,冷冻保护剂通常存在的量是至少2%w/w的量,例如以至少4%w/w的量存在,例如以至少6%w/w的量存在,例如以至少6%w/w的量存在,例如以至少7%w/w的量存在。
如果要被冷冻保存的组合物包括额外的冷冻保护剂例如DMSO,冷额外的冻保护试剂通常存在的量是少于8%w/w的量,如从1-8%w/w,例如例如,在低于5%w/w的量,例如低于4%w/w如从1-4%w/w的量。
在传统的冷冻保存技术中,样品是被采集,悬浮在存储溶液中,然后通过冷冻被保存。当要使用样品例如细胞时,它们被解冻,例如,从人类供体来源取得的细胞被恢复到正常的人体温度(即,约37℃),然后被放入细胞培养基。
在本冷冻保存方法中,样品在如下在冷冻保存期间被保护:在被冷冻至冷冻保存温度之前,使所述样品与如本文所述的冷冻保护试剂接触。通过使其与冷冻保护试剂接触是指,使样品以某种方式与冷冻保护试剂接触,从而在降低温度至冷冻保存温度的过程中,通过在冷冻保存保护组合物中的冷冻保护剂保护所述样品。例如,可通过以下使细胞与冷冻保护试剂接触:填充板适当的孔,所述将被保护的细胞被贴附在是孔中,将细胞悬浮在冷冻保护试剂溶液中或将例如冷冻干燥形式的冷冻保护试剂添加至例如缓冲剂溶液中的细胞,血液或器官,或将离心后的细胞颗粒重新悬浮在冷冻保护试剂中使细胞进入溶液等。
在本文公开的一个方面是一种冷冻保存样品的方法,包括如下步骤:使将被冷冻保存的样品与如本文定义的冷冻保护试剂接触,以获得冷冻保存组合物和随后减少冷冻保存组合物的温度至冷冻保存温度。
在另在一方面,本文公开的是一种通过降低该组合物温度至冷冻保存温度而冷冻保存本文定义的组合物的方法。
如果细胞对热休克敏感,从室温变化至低于溶液凝固点1-2℃的速度可能对最终生存力具有主要影响。
3.5℃和-5℃之间,样品通常通过以下被引起冻结:引入冰晶体,用低温探针接触介质表面,通过机械振动,或通过迅速降低温度至出现冰核。由于冷冻是一个放热过程,热量必须从冷冻液导出。这可以通过以下实现:保持样品浸泡在具有低凝固点的液体中或通过提供大量的散热装置。因为冰在细胞外介质中形成,越来越多的自由水变成在冰相中结合。细胞膜是疏水的,作为胞内冰成核的屏障,因此解冻的细胞暴露于越来越高渗的溶液。细胞外的盐的浓度增加,其原因在于水封存到冰中。解冻的细胞收缩,其原因在于水被运输至细胞外,这是响应于细胞内和细胞外液相之间的渗透压失衡。然后以有限的速度冷却样品,所述速度必须针对每个细胞类型而被优化。
冷却的最佳速度是由以下确定的:细胞膜对水的通透性,细胞表面与体积的比,以及在如本文所述的冷冻保护试剂中冷冻保护添加剂的类型和浓度。对于在甘油或DMSO冷冻的大多数有核细胞,最佳的冷却速度通常是每分钟约0.3到10℃之间。在约4℃至-80℃之间的连续冷却是最常用的。一旦样品达到约-80℃,它可直接被递送入液氮(-196℃)或液态氮的气相以用于储存。另一种用于冷冻保存的方法是玻璃化冷冻技术,其中可以获得1000℃–2000℃/分的非常快的冷却速度。采用这一技术,包含冷冻保存组合物与样品的专业化玻璃化设备被直接放入液氮。在一个方面,冷冻保存温度以如下速度达到:0.05-15,例如0.1-10,例如0.2-8,例如0.3-6,例如0.4-4,例如0.5-2℃每分钟。在另一方面冷冻保存温度是以如下速度达到:500-3000,例如800-2500,例如1000-2000,例如1200-1800℃每分钟。
在液氮温度的活细胞储存的时间是主要依赖于宇宙射线背景引起的自由基生成速度。
例如,存在液氮中的哺乳动物的胚胎保半衰期估计为约30000年。重要的是,不要让冷冻细胞升温高于它们的贮存温度,即使短暂的时间也不行。间歇升温促进快速迁徙的重结晶,它可以破坏细胞结构和降低整体生存力。
在另在一方面,冷冻保存后解冻样品。样品的解冻最佳速度取决于使用的冷冻条件和要保存的特定样品。一般来说,对冻结于悬浮液中的单细胞,和组织例如心脏瓣膜,快速升温速率是可取的。如此迅速的升温限制冰晶在冷冻的样品中生长,并且往往是高生存力的绝对必要条件。对于许多组织这种升温可以通过在37~42℃水浴搅拌样品而完成。快速升温的原理是,它限制了在冷却过程中形成的冰晶生长。
一些组织可能会对迅速升温是敏感的。这是因为短暂的渗透压冲击,因为细胞暴露于细胞外高渗溶液,随着冰的融化而被迫再水合以维持渗透压平衡。对于其他的,更灵敏的,样品,代谢过程可以通过在解冻培养基中使用血清或其他高分子量聚合物的连续稀释,被再活化,或带到正常水平。
在解冻的过程完成后,细胞仍然暴露于多体积克分子浓度的冷冻保护试剂,所述冷冻保护试剂必须逐步被稀释以使细胞返回等渗介质(培养基)。对于哺乳动物细胞,逐步稀释方案通常被使用。样品的稀释通常是优选在37℃被执行,以减少渗透压冲击和冷冻保护剂毒性的影响。在另在一方面,所述冷冻保护剂浓度是从4至45%w/w,如从4至20%w/w,如从5至15%w/w,或从6至12%w/w,或者优选从6至10%w/w,或者更优选从7至9%w/w冷冻保护剂。
在另在一方面,在冷冻保存组合物中样品的温度被降低到低于-50℃,例如-50℃至-196℃,例如-80℃至-196℃的冷冻保存温度。
在一个方面,冷冻保护试剂被用于储存方法。在一个方面,冷冻保护试剂被用于临床的储存方法。在一个方面,冷冻保护试剂被用于移动的外周血储存方法。
在一个方面,冷冻保护试剂被用于临床的储存方法中例如在用于治疗恶性疾病的干细胞移植中或器官移植中。在一个方面,冷冻保护试剂被用于移动的外周血储存方法,骨髓储存方法或脐带储存方法。
在一个方面,冷冻保护试剂被用于骨髓储存方法或脐带储存方法。在一个方面,冷冻保护试剂被用于脂肪组织储存的方法或牙髓组织储存方法。在另在一方面,冷冻保护试剂被用于繁殖储存方法。
在进一步的实施方案中被公开如下:
1.冷冻保护试剂,其包括冷冻保护剂,所述冷冻保护剂是以下的一种或多种:糊精、葡聚糖、异麦芽糖寡糖及其衍生物,例如是一种或多种:葡聚糖,异麦芽糖寡糖,和它们的衍生物,和
a)其中基于在所述试剂中糊精、葡聚糖、异麦芽糖寡糖及其衍生物的总重量,所述冷冻保护试剂包括至少1%w/w的一种或多种异麦芽糖寡糖及其衍生物和/或
b)其中所述的冷冻保护剂有300至9500Da的重量平均分子量(MW)。
2.冷冻保护试剂,包括一种或多种的冷冻保护剂,所述冷冻保护剂选自糊精、葡聚糖、异麦芽糖寡糖及其衍生物,例如选自葡聚糖,异麦芽糖寡糖,和它们的衍生物,和
a)其中基于在所述冷冻保护试剂中的糊精、葡聚糖、异麦芽糖寡糖及其衍生物的总重量,所述冷冻保护试剂包括至少1%w/w的一种或多种异麦芽糖寡糖及其衍生物,所述异麦芽糖寡糖及其衍生物具有如下的重量平均分子量(Mw):300至1,650Da,或
b)其中所述的冷冻保护剂有300至9500Da的重量平均分子量(MW),或
c)其中基于在所述冷冻保护试剂中的糊精、葡聚糖、异麦芽糖寡糖及其衍生物的总重量,所述冷冻保护试剂包括至少1%w/w的一种或多种异麦芽糖寡糖及其衍生物,所述异麦芽糖寡糖及其衍生物具有300至1650Da的重量平均分子量(MW),所述冷冻保护剂具有300至9500Da的重量平均分子量(MW)。
3.根据实施方案1-2任何一项的试剂,其中所述冷冻保护剂具有300至7500Da的重量平均分子量(MW)。
4.根据实施方案1-3任何一项的试剂,其中所述冷冻保护剂是选自异麦芽糖寡糖及其衍生物的一种或多种,所述异麦芽糖寡糖及其衍生物具有300至1650的重量平均分子量(MW)。
5.根据实施方案1-4任何一项的试剂,其中基于在所述冷冻保护试剂中的糊精、葡聚糖、异麦芽糖寡糖及其衍生物的总重量,所述冷冻保护剂包括至少1%w/w的一种或多种异麦芽糖寡糖及其衍生物,所述异麦芽糖寡糖及其衍生物具有300至1650Da的重量平均分子量(MW)。
6.根据实施方案1-5任何一项的试剂,其中所述异麦芽糖寡糖及衍生物具有850至1650Da的重量平均分子量(MW)。
7.根据实施方案1-6任何一项的用于冷冻保存样品的试剂,并且所述样品选自器官,细胞和组织例如选自哺乳动物器官,哺乳动物细胞和哺乳动物组织。
8.根据实施方案1-7任何一项的用于冷冻保存样品的试剂,其中所述样品是用于移植。
9.根据实施方案1-8任何一项的用于冷冻保存样品的试剂,其中所述样品是在冷冻后具有功能。
10.实施方案1-9任何一项的试剂,其中所述样品是器官,所述器官在冷冻保存后具有功能,如通过所述器官的生理功能所测量的,和/或其中所述样品是组织,所述组织具有功能,如由这样的组织与周围组织整合能力所测量的和/或所述样品是细胞,所述细胞具有功能,如由冷冻保存后所述细胞的生存力所测量的。
11.根据实施方案1-10的任何一项的试剂,其中所述冷冻保护剂具有1,650至7,500Da的重量平均分子量(Mw)。
12.根据实施方案1-11任何一项的试剂,其中所述冷冻保护剂具有500至3,500Da的重量平均分子量(Mw)。
13.根据实施方案1-12任何一项的试剂,其中所述冷冻保护剂具有如下的重量平均分子量(Mw):1,650至3,500Da。
14.根据实施方案1-13任何一项的试剂,其中所述冷冻保护剂具有多分散性Pd,其中Pd是≥1和≤5。
15.根据实施方案1-14任何一项的试剂,其中所述冷冻保护剂具有如下的重量平均分子量(Mw):850至1,650Da。
16.根据实施方案1-15任何一项的试剂,其中所述冷冻保护剂具有如下的重量平均分子量(Mw):850至1,150Da。
17.根据实施方案1-16任何一项的试剂,其中所述冷冻保护剂具有多分散性Pd,其中Pd是≥1和≤3。
18.根据实施方案1-17任何一项的试剂,基于在所述试剂中环糊精,葡聚糖,异麦芽糖寡糖及其衍生物的总重量,所述试剂包括至少10%w/w的一种或多种异麦芽糖寡糖及其衍生物。
19.根据实施方案1-18任何一项的试剂,其中所述具有少于3个葡萄糖单元的异麦芽糖寡糖的重量分数是少于15%w/w。
20.根据实施方案1-19任何一项的试剂,其中有超过9个葡萄糖单元的异麦芽糖寡糖的重量分数少于20%w/w。
21.根据实施方案1-20任何一项的试剂,其中有少于3个葡萄糖单元的异麦芽糖寡糖的重量分数为少于15%和有多于9个葡萄糖单元的异麦芽糖寡糖的重量分数少于20%w/w例如少于15%w/w,例如少于10%w/w。
22.根据实施方案1-21的任何一项的试剂,基于在所述试剂中环糊精,葡聚糖,异麦芽糖寡糖及其衍生物的总重量,所述试剂包括至少30%w/w,至少40%w/w,至少50%w/w,至少60%w/w,至少70%w/w,至少80%w/w,至少90%w/w,至少95%w/w或更多的一种或多种异麦芽糖寡糖及其衍生物。
23.根据实施方案1-22任何一项的试剂,其中所述冷冻保护剂是异麦芽糖寡糖,异麦芽糖寡糖具有例如如下的重量平均分子量(Mw):850至1,150Da。
24.根据实施方案1-23任何一项的试剂,其中所述异麦芽糖寡糖及其衍生物是基于葡聚糖的。
25.根据实施方案1-24任何一项的试剂,其中所述衍生物是糊精葡聚糖,和异麦芽糖寡糖的衍生物,和选自氢化的异麦芽糖寡糖,氢化的葡聚糖,氢化的糊精,氧化的异麦芽糖寡糖,氧化的葡聚糖,氧化的糊精,糊精的酯,葡聚糖的酯,异麦芽糖寡糖的酯,糊精的醚,葡聚糖的醚,异麦芽糖寡糖的醚,部分氢化/氧化的糊精,部分氢化/氧化的葡聚糖和部分氢化/氧化的异麦芽糖寡糖,及其衍生物例如选自氢化的异麦芽糖寡糖,氢化的葡聚糖,氢化的糊精,氧化的异麦芽糖寡糖,氧化的葡聚糖,氧化的糊精,DEAE-糊精,DEAE-葡聚糖,DEAE-异麦芽糖寡糖,羧基C1-10烷基-糊精,羧基C1-10烷基-葡聚糖,羧基C1-10烷基-异麦芽糖寡糖,糊精的酯,葡聚糖的酯和异麦芽糖寡糖的酯,及其衍生物。
26.根据实施方案1-25任何一项的试剂,其中所述衍生物是氢化的异麦芽糖寡糖,氧化的异麦芽糖寡糖,DEAE-异麦芽糖寡糖,羧基C1-10烷基氧化的异麦芽糖寡糖或羧基C1-10烷基异麦芽糖寡糖。
27.根据实施方案1-26任何一项的试剂,其中所述衍生物是氢化的异麦芽糖寡糖衍生物,例如具有如下的重量平均分子量(Mw)的氢化的异麦芽糖寡糖:850至1,150Da。
28.根据实施方案25-27任何一项的试剂,其中所述羧基C1-10烷基异麦芽糖寡糖是羧甲基异麦芽糖寡糖或羧乙基异麦芽糖寡糖。
29.根据实施方案1-28任何一项的试剂,选自至少一种额外的冷冻保护剂选自乙酰胺,琼脂,海藻酸盐或酯,1-苯胺(analine),白蛋白,醋酸铵,丁二醇,硫酸软骨素,氯仿,胆碱,二甘醇,二甲基乙酰胺,二甲基甲酰胺,二甲基亚砜(DMSO),赤藓糖醇,乙醇,乙二醇,甲酰胺,葡萄糖,甘油,a-甘油磷酸盐或酯,单乙酸甘油,甘氨酸,羟乙基淀粉,肌醇,乳糖,氯化镁,硫酸镁,麦芽糖,甘露醇,甘露糖,甲醇,甲基乙酰胺,甲基甲酰胺,甲基脲,苯酚,普流尼克(Pluronic)多元醇,聚乙二醇,聚乙烯吡咯烷酮,脯氨酸,丙二醇,吡啶N-氧化物,核糖,丝氨酸,溴化钠,氯化钠,碘化钠,硝酸钠,硫酸钠,山梨糖醇,蔗糖,海藻糖,三甘醇,乙酸三甲基胺,脲,缬氨酸和木糖。
30.根据实施方案1-29任何一项的试剂,其中所述额外的冷冻保护剂是DMSO。
31.根据实施方案1-30任何一项的试剂,其中所述试剂基本不含DMSO。
32.根据实施方案31的试剂,其不含DMSO。
33.根据实施方案1-32任何一项的试剂,包括实施方案1中定义的冷冻保护剂作为唯一的冷冻保护剂。
34.根据实施方案1-33任何一项的试剂,该试剂为粉末形式。
35.根据实施方案1-34任何一项的试剂,该试剂为冻干或喷雾干燥粉末的形式。
36.根据实施方案1-35任何一项的试剂,该试剂是溶液的形式。
37.根据实施方案1-36任何一项的试剂,该试剂包括从30%到70%w/w的所述冷冻保护剂,如40%至65%w/w或50%至60%w/w的所述冷冻保护剂。
38.根据实施方案1-37任何一项的试剂,该试剂包括从30%到70%w/w的所述额外的冷冻保护剂,如从40%到65%w/w或从50%至60%w/w的所述额外的冷冻保护剂。
39.根据实施方案1-38任何一项的试剂,还包括用于将被冷冻保护的样品的生长培养基或底物。
40.根据实施方案1-39任何一项的试剂,还包括属于IAPs(凋亡抑制剂)的任何蛋白,rho相关蛋白激酶(ROCK)信号通路抑制剂,和/或任何生长因子例如EGF,FGF,PDGF,IGF,EPO,BDNF,TGF,TNF和/或VEGF。
41.根据实施方案1-40任何一项的试剂,还包括人类,牛,马或犬来源的任何血清成分。
42.根据实施方案1-41任何一项的试剂,其中所述冷冻保护剂是无菌的。
43.包括在实施方案1-42任何一项中定义的冷冻保护试剂的冷冻保存组合物,其中冷冻保存组合物进一步包括将被冷冻保存的样品。
44.根据实施方案43的冷冻保存组合物,其中所述样品选自器官,细胞例如分离的细胞或含有细胞的体液例如血液和组织。
45.根据实施方案44的冷冻保存组合物,其中样品选自哺乳动物器官,哺乳动物细胞,和哺乳动物的组织,例如样品选自用于移植的哺乳动物器官,哺乳动物细胞,和哺乳动物的组织。
46.根据实施方案43-45任何一项的冷冻保存组合物,其中所述样品是选自以下的细胞:体细胞,包括各种组织来源的细胞例如间充质干细胞,组织特异性祖细胞,角质形成细胞,成纤维细胞,软骨细胞,骨细胞,或心肌细胞,血衍生的细胞例如造血干细胞,巨噬细胞,血小板(plate),红细胞,或干细胞,包括所有类型的多(潜)能细胞,全(潜)能细胞和单(潜)能细胞,和胚层细胞。
47.根据实施方案43-46任何一项的冷冻保存组合物,其中所述样品是选自以下的细胞:角质形成细胞,成纤维细胞,间充质干细胞,巨噬细胞,和造血干细胞,例如CD34阳性造血干细胞。
48.根据实施方案43-45任何一项的冷冻保存组合物,其中所述样品是选自以下的组织:卵巢组织,睾丸组织,脐带组织,胎盘组织,结缔组织,心脏组织,来源于肌肉,骨和软骨组织的组织,内分泌组织和神经组织。
49.根据实施方案43-45任何一项的冷冻保存组合物,其中所述样品是选自以下的含有细胞的体液:血例如脐带血,外周血,和移动的外周血,羊水,精液,脑脊液,月经液血和骨髓穿刺物。
50.根据实施方案43-45任何一项的冷冻保存组合物,其中所述样品是选自以下的器官:肺,心脏,肾脏,肝脏,脐带和卵巢。
51.根据实施方案43-45任何一项的冷冻保存组合物,其包括所述冻保护剂的量为1至50%w/w如从2至50%w/w,或从4至45%w/w,或从6至12%w/w,或者优选从6至10%w/w,或者最优选从7至9%w/w。
52.根据实施方案43-51任何一项的冷冻保存组合物,其中所述组合物包括DMSO,所述DMSO的量少于8%w/w,如1-8%。
53.根据实施方案43-52任何一项的冷冻保存组合物,其中所述样品在冷冻保存后具有功能。
54.根据实施方案43-53中的任何一项的冷冻保存组合物,其中所述组合物包括DMSO,所述DMSO的量少于8%w/w,少于4%w/w如1-4%。
55.冷冻保存样品的方法,包括如下步骤:使将被冷冻保存的样品与在实施方案1-42任何一项中定义的冷冻保护试剂接触,从而获得冷冻保存组合物,和随后降低冷冻保存组合物的温度至冷冻保存温度。
56.根据实施方案55的方法,其中冷冻保存组合物如在实施方案43-54任何一项中所定义。
57.冷冻保存实施方案43-56任何一项定义的组合物的方法,所述方法通过降低所述组合物温度至冷冻保存温度冷冻而保存实施方案43-56任何一项定义的组合物。
58.根据实施方案55-57中任何一项的方法,其中冷冻保存温度通过以下速度达到:0.05-15,例如0.1-10,例如0.2-8,例如0.3-6,例如0.4-4,例如0.5-2℃每分钟。
59.根据实施方案55-58任何一项的方法,其中所述冷冻保护剂的浓度是从4至20%w/w如从5至15%w/w,或从6至12%w/w,或者优选从6至10%w/w,或者更优选从7至9%w/w。
60.根据实施方案55-59任何一项的方法,其中在冷冻保存组合物中样品的温度降低到低于-50℃的温度,例如-50℃至-196℃,例如-80℃至-196℃。
61.根据实施方案55-60任何一项的方法,其中样品在冷冻保存后被解冻。
62.根据实施方案55-61任何一项的方法,其中所述样品在冷冻保存后具有功能。
63.根据实施方案55-62任何一项的方法,其中将被冷冻保存的样品选自器官,细胞和组织。
64.根据实施方案55-63任何一项的方法,其是临床的储存方法。
65.根据实施方案55-64任何一项的方法,其是储存的方法例如移动的(转移的(mobilized))外周血储存方法,骨髓储存方法,脂肪组织储存方法,牙髓组织储存方法,繁殖储存方法或脐带储存方法。
66.包括一种或多种冷冻保护剂的冷冻保护试剂在冷冻保存样品中的用途,其中所述样品选自器官,细胞和组织,所述冷冻保护剂选自糊精、葡聚糖、异麦芽糖寡糖及其衍生物,例如选自葡聚糖,异麦芽糖寡糖,及其衍生物;和a)基于在所述冷冻保护试剂中的糊精、葡聚糖、异麦芽糖寡糖及其衍生物的总重量,所述冷冻保护试剂包括至少1%w/w的一种或多种异麦芽糖寡糖和其衍生物,所述异麦芽糖寡糖和其衍生物具有300至1650Da的重量平均分子量(MW),或b)其中所述的冷冻保护剂有300至9500Da的重量平均分子量(MW),或c)其中基于在所述冷冻保护试剂中的糊精、葡聚糖、异麦芽糖寡糖及其衍生物的总重量,所述冷冻保护试剂包括至少1%w/w的一种或多种异麦芽糖寡糖及其衍生物,所述异麦芽糖寡糖及其衍生物具有300至1650Da的重量平均分子量(MW),所述冷冻保护剂具有300至9500Da的重均摩尔分子量(MW)。
67.根据实施方案66的冷冻保护试剂的用途,其中,所述冷冻保护剂具有300至7500Da的重量平均分子量(MW)。
68.冷冻保护试剂在冷冻保存样品中的用途,所述样品选自器官,细胞和组织,所述冷冻保护试剂选自异麦芽糖寡糖及其衍生物,所述异麦芽糖寡糖及其衍生物具有300至1650Da的重量平均分子量(MW)例如具有850至1650Da的重量平均分子量(MW),。
69.在实施方案1-42任何一项定义的冷冻保护试剂在冷冻保存样品中的用途,所述样品例如选自器官,细胞,和组织的样品。
70.根据实施方案66-69任何一项的用途,包括使所述要被冷冻保存的样品接触所述试剂,以获得冷冻保存组合物,和随后降低冷冻保存组合物的温度至冷冻保存温度。
71.实施方案43-54任何一项定义的冷冻保存组合物在冷冻保存样品中的用途,其中通过降低所述组合物温度至冷冻保存温度而冷冻保存样品。
72.根据实施方案66-71任何一项的用途,其中冷冻保存温度通过以下速度达到:0.05-15,例如0.1-10,例如0.2-8,例如0.3-6,例如0.4-4,例如0.5-2℃每分钟。
73.根据实施方案66-72任何一项的用途,其中所述冷冻保护剂的浓度是从4至20%w/w如从5至15%w/w,或从6至12%w/w,或者优选从6至10%w/w,或者更优选从7至9%w/w的冷冻保护试剂。
74.根据实施方案66-73.任何一项的用途,其中冷冻保存组合物样品的温度降低到低于-50温度℃,例如-50℃至-196℃,例如-80℃至-196℃。
75.根据实施方案66-74任何一项的用途,其中样品在冷冻保存后被解冻。
76.根据实施方案66-75任何一项的用途,其中所述样品在冷冻保存后具有功能,
77.根据实施方案66-76中任何一项的用途,其中将被冷冻保存的样品选自用于移植的器官,细胞,和组织。
78.根据实施方案66-77任何一项的用途,其是在储存的方法中,例如移动的外周血储存方法,骨髓储存方法,脂肪组织储存方法,牙髓组织的储存方法,繁殖储存方法或脐带储存方法。
79.根据实施方案66-78任何一项的用途,其是临床的储存方法。
在上述说明中提到的所有出版物都通过引用并入本文。上述本发明的组合物,方法和系统的各种修改和变化将在不脱离本发明的范围和精神的情况下对于是那些技术人员而言是明显的。虽然本发明已在特定的优选实施方案中被描述,但是,应当理解,本发明所要求保护的不应过分被限制于具体实施方案。
具体实施方式
制备实例1
异麦芽糖寡糖1的制备
低分子量葡聚糖的水解
从膜收集作为渗透物的3345kg水解的葡聚糖,所述膜具有<5000道尔顿的截止值,所述葡聚糖在pH 1.5在95℃的温度被水解。
水解是用凝胶渗透色谱(GPC)通过色谱监测,并当满足以下条件时通过冷却终止水解:被水解的物质的分子量被估计已经达到了预期值,即重量平均分子量850-1150道尔顿。
通过水解低分子量异麦芽糖寡糖是被制备,也形成了葡萄糖。冷却中和后,葡萄糖的含量和非常低分子量的低聚物通过膜过程被减少,所述膜有340-800道尔顿截止值。在这个过程后,异麦芽糖寡糖含量由旋光测定(Dα20~200)为915公斤,并且还原糖的量是用Somogyi试剂确定为22.5%。
表1:来自GPC分析的结果。
AUPW:峰下面积(Mw)
AUPN:峰下面积(Mn)
从上述表1可见,异麦芽糖寡糖有1020Da的MW,Mn为827Da,给出多分散性Pd=1.23。还原糖测定为22.5%。这种异麦芽糖寡糖在本申请中又称为五异麦芽糖。
制备实施例2
氢化异麦芽糖寡糖1的制备
水解分离后得到异麦芽糖寡糖418公斤。还原糖被测定为30.8%。采用10公斤硼氢化钠处理这一数量,结果,在最后的离子交换前产生362公斤异麦芽糖寡糖。此后的溶液被中和到pH<7.0,并随后去离子化,最后喷雾干燥。最终产物的还原糖被测量是0.09%。
表2:从GPC分析的结果。
AUPW:峰下面积(Mw)
AUPN:峰下面积(Mn)
从上面的表2可见,异麦芽糖寡糖具有968Da的Mw,Mn为780Da,给出多分散性Pd=1.24。这种氢化异麦芽糖寡糖在本申请中也被称为五异麦芽糖苷。
实施例1
冷冻保存试剂的制备
在下列实施例中使用的冷冻保存试剂如下制备:通过无菌溶解所述冷冻保护剂(例如DMSO,如在制备实例1中所述而制备的五异麦芽糖(异麦芽糖寡糖1)或如在实施实施例2中所述而制备的五异麦芽糖苷(氢化的异麦芽糖寡糖1))在生长培养基(DMEM/F12培养基+10%FBS+青霉素/链霉素)中,至所需的终浓度(例如,8%异麦芽糖寡糖1冷冻保存组合物,8克至100毫升培养基)和过滤灭菌个别冷冻保存组合物。
实施例2
正常人皮肤成纤维细胞(NHDF)的冷冻保存:
NHDF(传代2)在常规T烧瓶中在标准条件下(37℃,5%CO2和标准生长培养基[DMEM/F12+10%FBS+青霉素/链霉素)])被培养。当达到汇合(70-80%)时,细胞群从烧瓶中释放并且离心(1000rpm/10分)。0,5x106细胞被重新悬浮在六种不同的冷冻保存剂(1毫升);1)生长培养基+10%的DMSO,2)培养基+2%DMSO+8%异麦芽糖寡糖1,3)生长培养基+2%DMSO+8%氢化的异麦芽糖寡糖1,4)生长培养基+8%异麦芽糖寡糖1,5)生长培养基+8%氢化的异麦芽糖寡糖1和6)生长培养基中不含任何添加剂(DMEM/F12无FBS)。然后在使用基于异丙醇的方法的标准控制的冷冻保护条件下将细胞冷冻保存,在恒定的速率1℃/分钟冷冻下降到液氮温度。一周后使用标准解冻方案解冻细胞(直接浸入水浴中的小瓶,37度和将细胞液逐滴转移入新鲜37℃生长培养基中)。解冻后进行跟踪分析;1)生存力,用核计数器设备(NC200),和2)1次传的代生存力使用核计数器设备(NC200)。结果视于图1和2,总结在表3-5。
当使用异麦芽糖寡糖1作为唯一的冷冻保护试剂时,与使用10%的DMSO标准条件相比,解冻后的生存力略有减少。当使用2%的DMSO和异麦芽糖寡糖1时,关于生存力没有观察到差异。采用独自的异麦芽糖寡糖1冷冻保护的细胞在1次传代的生存力类似于使用10%的DMSO的标准条件。这个实验表明,在使用异麦芽糖寡糖1为唯一冷冻保存剂的冷保存溶液中冷冻保存NHDF,导致可以以与标准冷冻保存条件相同的程度使用的培养。
实施例3
正常人表皮角质形成细胞的冷冻保存(NHEKs):
使用与如实施例2中所描述的相同的方案,冷冻保存NHEKs。相同的实验组被包括。结果在图3-4中显示,总结于表3-5。
如也对NHDF示出的,结果清楚地表明,NHEKs可以在使用异麦芽糖寡糖1作为唯一的冷冻保护剂的冷冻保存溶液中被冷冻保存。在培养第1次传代的生存力的水平是与在使用10%的DMSO标准条件冷冻保存的NHEKs的水平相同。
实施例4
正常人间充质干细胞(hMSCs)的冷冻保存:
使用与如实施例2中所述相同的方案,冷冻保存间充质干细胞,有两个实验组被包括,生长培养基+8%异麦芽糖寡糖1+2%海藻糖和生长培养基+2%海藻糖。利用核计数器技术,进行生存力分析,如上面描述的。结果显示在图5和总结在表3-5。
结果清楚地表明,间充质干细胞(hMSCs)可以在使用异麦芽糖寡糖Da作为唯一的冷冻保护剂的冷冻保存溶液中被冷冻保存。解冻后的生存力是与含10%的DMSO标准制剂在在同一水平。
表3-5:
T1:解冻后的生存
T2:1次传代后的生存
表3
表4
表5
实施例5
hMSCs暴露于异麦芽糖寡糖1
hMSCs在常规T烧瓶中生长至汇合。细胞被释放,悬浮在两种不同制剂中1)生长培养基+10%的DMSO和2)8%异麦芽糖寡糖1。每个制剂的细胞终浓度为1x106/毫升细胞。使用的是如实施例2中所描述的相同的基本方案。来自每一小瓶的1毫升被加入冷冻小瓶中,生存力在三个不同的时间点用核计数器分析;1)0分钟(T0),10分钟(T10)和30min(T30)。结果总结在表6。
表6
它清楚地表明,暴露于标准冷冻保存条件严重影响hMSCs生存力。暴露于含有异麦芽糖寡糖1作为唯一的冷冻保护剂成分的冷冻制剂仅仅在暴露60分钟后影响显著生存力。这表明,可能的是,在含异麦芽糖寡糖1的冷冻保存组合物中处理用于冷冻保存的细胞培养,使得更灵活的工作程序成为可能。
实施例6
异麦芽糖寡糖560Da用于冷冻保存hMSCs
使用与如实施例2中所描述的相同的基本方案,冷冻保存人间充质干细胞(hMSCs),采用相同的实验组。结果表明,可以的是,在异麦芽糖寡糖560Da中冷冻保存hMSCs,然而在这个实验中氢化的异麦芽糖寡糖560Da不如异麦芽糖寡糖560Da一样有效。结果总结在表7。
表7
实施例7
在PluriPro生长培养基中的人iPS细胞
在这个实施例中使用的异麦芽糖寡糖1是如制备实例1所描述的所制备的。人类诱导的多潜能干细胞,iPSCs(12次传代),其在常规培养T烧瓶中作为单细胞在标准条件下(37度,5%的二氧化碳和PluriPro生长培养基,细胞诱导系统(Cell Guidance System))被培养。当达到汇合(70-80%)时,细胞群从瓶中释放,离心(1000转/10分钟)。0,5x106细胞重新悬浮于十二种不同的冷冻保存液(1毫升);生长培养基+10%的DMSO,生长培养基+5%的DMSO,生长培养基+10%DMSO+2%异麦芽糖寡糖1,生长培养基+10%DMSO+4%异麦芽糖寡糖1,生长培养基+10%DMSO+8%异麦芽糖寡糖1,生长培养基+5%DMSO+2%异麦芽糖寡糖1,培养基+5%DMSO+4%异麦芽糖寡糖1,生长培养基+5%DMSO+8%异麦芽糖寡糖1,生长培养基+2%异麦芽糖寡糖1,生长培养基+4%异麦芽糖寡糖1,生长培养基+8%异麦芽糖寡糖1,和不含任何冷冻保护剂的生长培养基。然后在标准控制冷冻保存条件(使用基于异丙醇的方法)下将细胞冷冻保存到液态N2。一周后使用标准解冻方案(直接将小瓶浸入水浴,37度和将细胞液逐滴转移入新鲜培养基)而解冻细胞。ROCK抑制剂在第一次接种下被添加。采用核计数器技术,进行在解冻后的生存力分析。结果如图6所示。
结果表明,使用异麦芽糖寡糖1作为唯一的冷冻保护剂,可以冷冻保存iPS细胞,虽然冷冻保存的细胞生存力显著低于加入DMSO的情况。
实施例8
在PluriPro iPS细胞生长培养基
在此实施例中使用的氢化的异麦芽糖寡糖1如所制备实施例2描述而制备。人类诱导的iPS细胞,iPS细胞(12次传代)在常规T烧瓶中作为单细胞在标准条件下(37度,5%的二氧化碳和PluriPro生长培养基,细胞诱导系统)被进行培养。当达到汇合(70-80%)时,细胞群从瓶中释放,离心(1000rpm,10分钟)。0,5x106细胞重新悬浮于十二种不同的冷冻保存溶液(1毫升);生长培养基+10%的DMSO,生长培养基+5%DMSO,生长培养基+10%DMSO+2%氢化的异麦芽糖寡糖1,生长培养基+10%DMSO+4%氢化的异麦芽糖寡糖1,生长培养基+10%DMSO+8%氢化的异麦芽糖寡糖1,生长培养基+5%DMSO+2%氢化的异麦芽糖寡糖1,生长培养基+5%DMSO+4%氢化的异麦芽糖寡糖1,生长培养基+5%DMSO+8%氢化的异麦芽糖寡糖1,生长培养基+2%氢化的异麦芽糖寡糖1,生长培养基+4%氢化的异麦芽糖寡糖1,生长培养基+8%氢化的异麦芽糖寡糖1和不含任何冷冻保护剂的生长培养基。然后在标准控制冷冻保存条件(使用基于异丙醇)下将细胞冷冻保存到液态N2。一周后使用标准解冻方案(直接将小瓶浸入水浴,37度和将细胞液逐滴转移入新鲜培养基)而解冻细胞。ROCK抑制剂在第一次接种被添加。采用核计数器技术,进行解冻后生存力分析。结果如图7所示。
结果表明,可以使用氢化的异麦芽糖寡糖1作为唯一的冷冻保护试,冷冻保存人iPS细胞,虽然冷冻保存的细胞生存力显著低于加入DMSO的情况。在不采用DMSO冷冻保存的样品中,观察到,对改善的生存力的倾向性作为使用的异麦芽糖寡糖1浓度的函数。
实施例9
在具有不同分子量的冷冻保护剂中冷冻保存正常人间充质干细胞(hMSCs):
使用与如实施例2中所述相同的方案,冷冻保存hMSCs,涉及以下的实验组,生长培养基+10%的DMSO,8%异麦芽糖寡糖1,平均Mw为10.000的葡聚糖或平均Mw为40.000的葡聚糖+5%的DMSO,8%异麦芽糖寡糖1,平均Mw为10.000的葡聚糖或平均Mw为40.000的葡聚糖+1%的DMSO,8%异麦芽糖寡糖1,平均Mw为10.000的葡聚糖或平均Mw为40.000的葡聚糖和生长培养基。利用上面描述的核计数器技术,对生存力进行分析。解冻后,在标准条件下,hMSCs被培养3天,采用体外分析比色分析,MTT测定(其测量细胞群体中线粒体活性),对增殖率(速率)进行分析。
结果如图8所示。
结果清楚地表明,可以在使用异麦芽糖寡糖1,平均Mw10.000葡聚糖或平均Mw 40.000葡聚糖作为唯一的冷冻保护剂的冷冻保存溶液中,冷冻保存hMSCs。观察到,分子量对解冻后直接生存力分析无显著差异。然而,3天后增殖率的分析表明,与8%葡聚糖平均Mw10.000和平均Mw为40.000相比,在8%异麦芽糖寡糖1(平均分子量1000)中冷冻保存的hMSCs更积极地增殖。
实施例10
在具有平均Mw1500的异麦芽糖寡糖中冷冻保存正常人间充质干细胞(hMSCs):
使用与如实施例2中所述相同的方案,冷冻保存hMSCs,涉及以下的实验组,生长培养基+10%的DMSO,生长培养基+2%的DMSO,8%具有平均Mw1500Mw的异麦芽糖寡糖+2%的DMSO,8%具有平均Mw1500Mw的异麦芽糖寡糖和生长培养基。利用如上面描述的核计数器技术,进行生存力分析。结果如图9所示。
结果清楚地表明,可以在冷冻保存溶液中冷冻保存hMSCs,所述冷冻保存溶液使用具有平均Mw1500的异麦芽糖寡糖作为唯一的冷冻保护剂。
实施例11
采用DMSO,异麦芽糖寡糖1或氢化的异麦芽糖寡糖1冷冻保存后的CD34+造血干细胞的生存力。
通过白细胞去除术采集移动的外周血细胞,将其冷冻在含有10%的DMSO或不同浓度的异麦芽糖寡糖1(isom)或氢化的异麦芽糖寡糖1(h-isom)的冷冻保护培养基中。使用受控速率冷冻器(Kryo 560-16,平刨机;起始温度4℃,-1℃/分钟降到0℃,-2℃/分钟降到-45℃和-5℃/min降到-100℃),冷冻样品,将其达到-150℃。样品在37℃水浴中解冻。应用流式细胞仪估计CD45+、CD34+造血干细胞生存力。荧光DNA结合的化合物7-氨基放线菌素D(7-AAD)作为活/死标记。细胞能够排除7AAD被认为是有生存力的。结果如图10所示:异麦芽糖寡糖1(浅灰色条),氢化的异麦芽糖寡糖1(深灰色条)和DMSO(黑色条)。本文显示的数据是来自3个不同的实验,每个测量两次。误差线显示标准偏差。
h-isom和isom均使得冷冻保存后CD34+造血细胞生存力与采用标准10%DMSO的情况具有相同的程度。表明的是,明确的趋势是,采用更高浓度的i-som和isom,得到更强的保护作用。与6%,8%,10%和12%的浓度相比,4%浓度有显著的较小保护作用(小于60%)。10%和12%的浓度也有类似于10%的DMSO的保护效果。在这项研究中观察到,h-isom和isom的保护作用无显著性差异。
实施例12
在采用DMSO,异麦芽糖寡糖1或氢化的异麦芽糖寡糖1冷冻保存后脂肪来源的间充质/干细胞(ASC)的生存力。
ASC是从脂肪组织获得,所述脂肪组织经腹部或大腿内侧使用vibrasat装置(医疗有限两合公司,富尔达,德国)((Medical GmbH&Co.KG,Fulda,Germany))使用美容吸脂术采集。来自间质的血管片段的ASC在培养基中进行体外扩增,所述培养基由以下组成:杜尔伯科改良伊格尔培养基,1%青霉素-链霉素,1%GlutaMAX,和10%混合的人血小板裂解液。细胞被冻结在含10%DMSO或不同浓度的异麦芽糖寡糖1(isom)或氢化的异麦芽糖寡糖1(h-isom)的冷冻保护试剂中。使用受控速率冷冻器(Kryo 560-16,平刨机;起始温度。4℃,-1℃/分钟降到0℃,-2℃/分钟降到-45℃和-5℃/min降到-100℃),冷冻样品,使其达到-150℃。在37℃水浴解冻样品。针对表型表征应用流式细胞仪(对于CD73,CD90,CD105阳性,和对于CD14,CD20,CD45和CD34阴性),和以估计ASC的生存力。荧光DNA结合的化合物7-氨基放线菌素D(7-AAD)被用作活/死标记。能够排除7AAD的细胞被认为是有生存力的。结果如图11所示:异麦芽糖寡糖1(浅灰色条),氢化的异麦芽糖寡糖1(深灰色条)和DMSO(黑色条)。本文显示的数据是得自单一的实验,所述实验被测量两次。误差线显示标准偏差。DMSO结果低于预期。
h-isom和isom作为冷冻保护剂使得ASCs生存力达到与10%DMSO相同的程度。除了4%的低浓度,高浓度导致高于70%的生存力。与低浓度相比,12%浓度导致显著更高的生存力(80%-90%)。在本研究中观察到,除了4%组,h-isom和isom的冷冻保护效果无显著差异。
实施例13
小鼠卵巢切除后,它们被转移到添加10毫克/毫升的HAS,青霉素/链球菌素的McCoy培养基中,和保持在37℃,直到它们被转移到下面的冷冻保存溶液:1)标准条件(PBS,1.5mol/L乙二醇,0.1mol/L蔗糖,10毫克/毫升类似于人类卵巢组织的冷冻保存的HSA)或2)采用PBS,10%(w/v)异麦芽糖寡糖1。
卵巢是在冰上被平衡30分钟,然后被转移至可编程的冰冻冷冻器(计划者冷冻10可编程低温冰箱,英国)(Planner Cryo 10programmable freezer,UK),其中,采用以下的程序将样品冷却到-140℃(起始温度:-1℃;-2℃/分钟至-9℃;保温5min;接种;-0.3℃/分钟,直到-40℃,-10℃/分钟,直到-140C,然后直接进入液氮中)。在这之后,它们都被陷入了液氮,保存在液氮罐中变可变的时间期间。解冻:在37℃热水中的室温;含有异麦芽糖寡糖1的培养基(20%(w/v)10分钟,然后直接进入固定培养基。在组织制备物双侧卵巢显示在不同发展阶段的生存的滤泡。
实施例14
在以下冷冻保存溶液中,如上述实施例13中所描述的,处理小鼠卵巢:1)标准条件(PBS,1.5mol/L乙二醇,0.1mol/L蔗糖,10毫克/毫升的HAS,类似于人类卵巢组织的冷冻保存)或2)采用PBS,1.5mol/L乙二醇,10毫克/毫升HSA,10%(w/v)氢化的异麦芽糖寡糖1或3)采用PBS,10毫克/毫升的HSA,10%(w/v)氢化的异麦芽糖寡糖1。在组织制备物中所有卵巢显示生存力在不同发展阶段的滤泡。
- 还没有人留言评论。精彩留言会获得点赞!