一种盆腔炎性疾病的动物模型制备方法与流程
本发明涉及一种盆腔炎性疾病的动物模型制备方法。
背景技术:
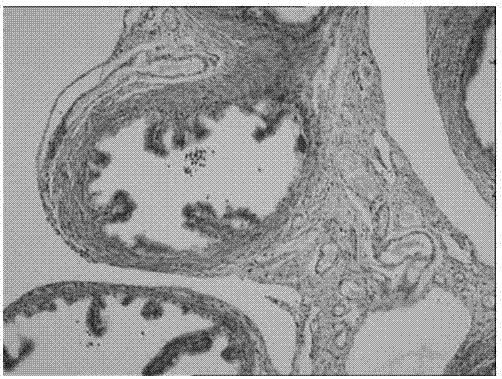
:盆腔炎性疾病后遗症(SPID)是盆腔炎性疾病(PID)未得到及时正确治疗而发生的女性上生殖道及其周围组织破坏、广泛粘连、增生及瘢痕形成等一系列后遗症,即既往称谓的慢性盆腔炎。因PID临床症状轻重的异质性较大,常就诊不及时、治疗不全面,易发展为SPID,其不孕率可达20%-30%,异位妊娠率是正常女性8-10倍,约20%患者遗留慢性盆腔痛,且易反复发作,严重影响女性生活质量。目前,国内的SPID动物造模多采用开腹手术法,即经“腹壁—子宫壁—子宫—输卵管”的途径注入菌液,并配合机械轻微损伤宫腔组织,明显与SPID临床发病过程不符。现阶段国内外尚无符合临床发病过程的明确的SPID动物模型,不能明确区分PID与SPID,仍以PID模型代替SPID研究。故模拟SPID临床发病条件,建立相应动物模型,已是其临床发病机制和疗效机理研究的重要课题。基于此,在前期SPID模型炎症和免疫修复等指标分析及临床证候、疗效评价基础上,本发明以正气不足而感邪,引入大鼠运动性疲劳及饥饿诱因,依SPID临床病原体种类,设立比拟临床的阴道上行感染,结合炎症因子和大鼠局部病理组织形态学的变化,检测成模效果。这对奠定SPID中医药研究平台,将发挥必要的支撑作用。技术实现要素:本发明的目的在于提供一种盆腔炎性疾病的动物模型制备方法。为了实现上述目的,本发明提供的技术方案如下:一种盆腔炎性疾病的动物模型制备方法,包括以下步骤:(1)取雌性动物;(2)对雌性动物建立疲劳诱因和饥饿诱因;(3)在建立疲劳诱因的最后1天,阴道种植感染源,检测。进一步的,建立疲劳诱因的方法如下:在温度为25~35℃的水中,对雌性动物进行适应性游泳训练,随后进行负重游泳训练。进一步的,适应性游泳训练的天数为1~3天,每天1~3次,每次10~50分钟;负重游泳训练的天数为5~20天,每天1~3次,每次10~50分钟;优选的,适应性游泳训练的天数为2天,每天1次,每次20分钟;负重游泳训练的天数为10天,每天1次,每次20分钟。进一步的,负重游泳训练的负重为雌性动物体重的4~10%;优选的,为4~6%。进一步的,建立饥饿诱因的方法如下:与建立疲劳诱因同时开始,采用禁食/再投喂的方式,重复直到实验结束。进一步的,建立饥饿诱因时,每日投喂量为雌性动物体重的8~15%;优选的,为8~12%。进一步的,阴道种植感染源的方法为:暴露雌性动物阴道,注入细菌悬液,待液体被阴道粘膜完全吸收后放回。进一步的,注入细菌悬液的频率为每天1~3次,重复进行5~20天;优选的,每天1次,重复进行10天;优选的,细菌悬液为大肠杆菌悬液,细菌悬液的浓度为5~10×106个/ml、用量为0.3~0.8ml。进一步的,所述动物模型还包括模拟对照组、自然观察组、手术模型组中的任意一种或两种以上。进一步的,所述雌性动物为雌性大鼠。本发明通过开展动物实验研究,提出新的非手术SPID模型方法,根据正气不足、邪毒内侵而搏结气血的基本病机,引入大鼠运动性疲劳诱因以及饥饿诱因,依临床检出的PID常见病原菌,选择单一病原体作为感染源,设立比拟临床的阴道上行感染,严格区分SPID与PID病理异同,结合炎症因子和大鼠局部病理组织形态学的变化,检测成模效果,建立更符合临床发病特征的SPID动物模型,提供与SPID临床发病吻合度高、全面翔实的大鼠建模和评价数据。显然,根据本发明的上述内容,按照本领域的普通技术知识和惯用手段,在不脱离本发明上述基本技术思想前提下,还可以做出其它多种形式的修改、替换或变更。以下通过具体实施方式,对本发明的上述内容再作进一步的详细说明;但不应将此理解为本发明上述主题的范围仅限于以下的实例;凡基于本发明的构思所实现的技术均属于本发明的范围。附图说明图1为感染实验组扩张变薄的输卵管组织。图2为手术模型组扩张变薄的输卵管组织。图3为感染实验组增生的外周结缔组织。图4为手术模型组增生的外周结缔组织。具体实施方式材料与方法:实验动物SPF级雌性已生育Wistar大鼠,体重为220±20g,鼠龄12周,共32只,购自山东济南凯悦动物实验公司。实验在山东中医药大学附属医院实验动物中心进行。所用饲料和垫料均购自山东济南凯悦动物实验公司,动物分笼饲养,自由饮食和饮水,动物房内温度(20±2)℃,相对湿度为40%~60%,所有大鼠均在统一条件下饲养。常规喂养1周后,分组并开始造模。实验试剂及仪器WLA004BCA蛋白浓度测定试剂盒、WLA003ECL发光液、WLA013SDS-PAGE凝胶快速制备试剂盒;菌种:大肠杆菌标准菌株,菌株号:ATCC35218,由山东中医药大学附属医院微生物室提供;营养琼脂:由山东中医药大学附属医院微生物室提供;麻醉剂:1%戊巴比妥钠;0.9%无菌生理盐水;10%中性甲醛:由山东中医药大学附属医院病理科提供;Proline微量移液器(苏州BIOHIT公司);NW10LVF超纯水系统(香港HealForce公司);DYY-7C电泳仪(北京六一公司);DYCZ-40D转移槽(北京六一公司);DYCZ-24DN双垂直蛋白电泳仪(北京六一公司);H-2050R超速冷冻离心机(湖南湘仪公司);ELX-800酶标仪(美国BIOTEK公司);DH36001B电热恒温培养箱(天津泰斯特公司)。实施例11、SPID大鼠非手术建模方法1.1制备感染源将大肠杆菌菌株接种在营养琼脂上置37℃,培养24小时后,进行菌液稀释,用无菌生理盐水2ml,标准麦氏管比浊法,配成浓度为6×106个/ml的细菌悬液。1.2分组将32只大鼠按随机数字表随机分成4组:感染实验组、模拟对照组、手术模型组、自然观察组,每组各8只。1.3建立疲劳诱因在120cm×100cm×160cm铁皮水箱中,静水深90cm,水温30±2℃,对大鼠进行适应性游泳训练2天,每天1次,每次20分钟;随后建立疲劳诱因,对大鼠持续进行负重(体重的5%)游泳,至大鼠出现身体下沉、运动协调性明显下降,水淹没鼻尖,再次浮出水面超过10秒,连续10天。1.4建立饥饿诱因与疲劳诱因同时开始,采用禁食/再投喂的方式,即对实验大鼠采取饥饿一天,再投食一天的方法,重复直到实验结束,共计21天。每日投喂量严格控制为大鼠体重的10%,饮用水不受影响。1.5阴道种植感染源感染实验组大鼠于施加疲劳诱因的第12天(即最后1天),开始阴道上行性感染病原菌,暴露大鼠阴道,用一次性移液枪头注入已配置的细菌悬液0.5ml,待液体被阴道粘膜完全吸收后放回笼内。每天1次,重复进行10天。模拟对照组造模方法同上,但接种液为等量无菌生理盐水;自然观察组正常喂养,不施加各种干预因素。其中,感染实验组和模拟对照组建模周期为21天,造模周期=疲劳诱因及饥饿诱因12天+阴道种植10天-重叠1天。2手术模型组建模方法采用机械损伤加大肠杆菌感染造模法:以1%戊巴比妥钠(剂量按50mg/kg)进行腹腔麻醉。动物取仰卧位,将四肢及牙齿固定,无菌条件下取大鼠下腹正中切口约1cm,开腹后暴露并固定子宫,用1ml注射器机械损伤子宫内膜组织,并于子宫分叉处进针,向两侧宫腔内各注入0.1ml大肠杆菌悬液,将子宫回纳,关腹。3实验取材用1%戊巴比妥钠(剂量按50mg/kg)腹腔注射麻醉大鼠,待麻醉生效后,牵拉大鼠四肢及头部固定于操作台上,剪去下腹部的皮毛,并用碘伏消毒。在无菌条件下,取下腹部正中切口长约1cm,开腹后暴露双侧子宫、输卵管、卵巢及其周围结缔组织,肉眼观察局部病理形态后摘取输卵管、卵巢及部分外周结缔组织,置于10%中性甲醛中保存,便于光镜下病理观察和免疫组织化学检测。手术模型组指标于术后第15天检测,其余三组指标均于造模结束后第14天检测。4评价指标及检测方法4.1外观行为学观察大鼠皮毛颜色、色泽、皮毛状态、双眼状态、精神状态、食量、及肛周清洁度的变化。4.2大体形态学肉眼观察输卵管有无充血、增粗、阻塞、积水,输卵管卵巢有无粘连、肿块或囊肿形成,盆腔结缔组织有无增生、粘连、渗出等情况。4.3病理组织学将各组大鼠输卵管、卵巢和周围结缔组织切片进行常规HE染色,于光镜下计数慢性炎症特征性病理改变的单核巨噬细胞、淋巴细胞,定性描述局部显微结构的改变情况。4.4大鼠输卵管、卵巢及周围结缔组织炎症调控因子IL-6、IL-10表达水平检测采用酶联免疫吸附测定法(ELISA)。加入样本组织量9倍体积的PBS,打碎组织,液氮反复冻融三次,12000rpm离心10min,吸取上清,待测样本蛋白抽提物1μl与19μlPBS缓冲液混匀,BCA法测定蛋白浓度。设标准孔、待测样品孔、空白孔,标准孔内分别加入不同浓度的标准品50μl,待测样品孔内稀释样本为1μg/μl,直接加入稀释后样本50μl,每孔加入酶标试剂50μl,空白孔除外,加入显色剂37℃避光显色15min,450nm波长测定各孔吸光度(OD值),所有的标准品和样品的吸光值减去TMB空白显色孔的吸光值后,以标准品浓度为横坐标,调零后的OD值为纵坐标,绘制标准曲线,计算待测样本的IL-6、IL-10的含量。4.5大鼠输卵管、卵巢及周围结缔组织增生修复指标VEGF表达水平检测采用WesternBlot法。各样本内加入相应体积的裂解样本,冰上静置5min,12000rpm离心10min,分离上清为所得的蛋白质抽提物,BCA法测定蛋白浓度,行SDS-PAGE电泳法,电泳结束后,转印制备“三明治”,浸入含5%脱脂奶粉的TTBS缓冲液中封闭,摇床缓慢摇动1h,孵育一抗VEGF(1:500),取出PVDF膜,浸入TTBS中,孵育二抗羊抗兔IgG-HRP(1:5000),采用ECL底物发光液静置反应5min后转入暗盒中曝光,用凝胶图象处理系统(Gel-Pro-Analyzer软件)分析目标条带的光密度值。5统计方法采用SPSS17.0软件,计量资料采用t检验,用(±s)表示;多组间比较用方差分析,P﹤0.05为差异有显著性,P﹤0.01为差异有极显著性。6结果6.1外观行为学方面感染实验组与手术模型组:大鼠均可见皮毛粗糙、稀疏成缕,色黄,精神不振,双眼黯淡无神,双耳色黯,对外界刺激反应迟钝,食欲下降,体重减轻,阴道分泌物增多,大便质稀,有肛周污染。模拟对照组:大鼠可见皮毛蓬乱,色黄白相兼,双眼有神,双耳色暗红,对外界刺激反应灵活,食欲一般,阴道分泌物量少,大便成形,无肛周污染。自然观察组:大鼠表现正常,皮毛整齐,色白,双眼红亮有神,双耳色粉红,对外界刺激反应灵敏,食欲正常,阴道分泌物量少,大便成形且硬,无肛周污染。6.2大体形态学方面感染实验组与手术模型组:大鼠肉眼可见输卵管颜色暗红、迂曲质硬,或有输卵管积水,粘膜组织瘀点,盆腔内有广泛纤维组织粘连,部分可见透明样卵巢囊肿。模拟对照组与自然观察组:大鼠输卵管结构无明显变化,无液体稽留,卵巢结构无明显变化,未见盆腔纤维组织粘连。6.3病理组织学方面感染实验组(图1和图3)与手术模型组(图2和图4):大鼠输卵管管腔有不同程度扩张,粘膜层皱襞平坦,腔内可见大量粉染液体,部分输卵管壶腹部皱襞增生,融合;见少量炎细胞浸润,以淋巴细胞、浆细胞和单核细胞为主,伴周围结缔组织增生,细胞走形紊乱,腺体、间质结构破坏,部分腺体坏死,外周血管扩张。模拟对照组、自然观察组:病理组织腺体结构基本正常,无外周血管扩张,无结缔组织增生,未见炎细胞浸润。6.4大鼠各组织IL-6含量比较(表1)大鼠输卵管组织中,感染实验组IL-6检测结果与手术模型组比较,明显升高,差异有显著性(P﹤0.05),与其余两组比较差异有极显著性(P﹤0.01),手术模型组与自然观察组比较,明显升高,差异有显著性(P﹤0.05);大鼠卵巢组织中,感染实验组IL-6检测结果较其余三组比较差异无显著性(P﹥0.05),手术模型组与自然观察组比较差异无显著性(P﹥0.05);大鼠周围结缔组织中,感染实验组IL-6检测结果与手术模型组比较差异无显著性(P﹥0.05),与其余两组比较,明显升高,差异有极显著性(P﹤0.01),手术模型组与自然观察组比较差异有极显著性(P﹤0.01);模拟对照组与自然观察组比较差异无显著性(P﹥0.05)。表1、大鼠各组织IL-6含量比较(±s,pg/mgprot)组别例数(n)输卵管组织卵巢组织周围结缔组织感染实验组851.86±6.59※△#50.28±13.0458.91±6.68△#手术模型组846.70±10.36×49.75±10.4456.01±6.40*模拟对照组841.55±3.0947.25±3.0745.30±2.34自然观察组842.05±3.0946.15±2.2043.91±3.68注:与手术模型组比较,※P﹤0.05,与模拟对照组比较,△P﹤0.01;与自然观察组比较,#P﹤0.01,×P﹤0.05,*P﹤0.01。6.5大鼠各组织IL-10含量比较(表2)大鼠输卵管组织中,感染实验组IL-10水平明显降低,与其余三组比较差异有极显著性(P﹤0.01),手术模型组与自然观察组比较,明显降低,差异有极显著性(P﹤0.01);大鼠卵巢组织中,感染实验组IL-10检测结果较其余三组比较差异无显著性(P﹥0.05),手术模型组与自然观察组比较差异无显著性(P﹥0.05);大鼠周围结缔组织中,感染实验组IL-10水平明显降低,与其余三组比较差异有极显著性(P﹤0.01),手术模型组与自然观察组比较,明显降低,差异有极显著性(P﹤0.01);模拟对照组与自然观察组比较差异无显著性(P﹥0.05)。表2、大鼠各组织IL-10含量比较(±s,pg/mgprot)组别例数(n)输卵管组织卵巢组织周围结缔组织感染实验组835.57±2.47•△#46.96±0.9239.42±0.79•△#手术模型组840.22±2.13*47.02±0.8340.94±1.23*模拟对照组845.21±1.7747.41±0.6546.78±0.91自然观察组845.87±1.2447.43±0.8246.99±0.68注:与手术模型组比较,•P﹤0.01,与模拟对照组比较,△P﹤0.01;与自然观察组比较,#P﹤0.01,*P﹤0.01。6.6大鼠各组织VEGF表达比较(表3)大鼠输卵管组织中,感染实验组VEGF水平明显升高,与其余三组比较差异有极显著性(P﹤0.01),手术模型组与自然观察组比较差异有极显著性(P﹤0.01);大鼠卵巢组织中,感染实验组VEGF检测结果与手术模型组比较差异无显著性(P﹥0.05),与其余两组比较,明显升高,差异有极显著性(P﹤0.01),手术模型组与自然观察组比较差异有极显著性(P﹤0.01);大鼠周围结缔组织中,感染实验组VEGF水平明显升高,与其余三组比较差异有极显著性(P﹤0.01),手术模型组与自然观察组比较差异有极显著性(P﹤0.01);模拟对照组与自然观察组比较差异无显著性(P﹥0.05)。表3、大鼠各组织VEGF表达比较(±s,比值)组别例数(n)输卵管组织卵巢组织周围结缔组织感染实验组80.72±0.04•△#0.67±0.05△#0.57±0.03•△#手术模型组80.63±0.03*0.54±0.03*0.47±0.02*模拟对照组80.29±0.030.29±0.020.29±0.02自然观察组80.29±0.020.29±0.010.28±0.01注:与手术模型组比较,•P﹤0.01,与模拟对照组比较,△P﹤0.01;与自然观察组比较,#P﹤0.01,*P﹤0.01。本发明通过开展动物实验研究,提出新的非手术SPID模型方法,根据正气不足、邪毒内侵而搏结气血的基本病机,引入大鼠运动性疲劳诱因以及饥饿诱因,依临床检出的PID常见病原菌,选择单一病原体作为感染源,设立比拟临床的阴道上行感染,严格区分SPID与PID病理异同,结合炎症因子和大鼠局部病理组织形态学的变化,检测成模效果,建立更符合临床发病特征的SPID动物模型,提供与SPID临床发病吻合度高、全面翔实的大鼠建模和评价数据。同时,采用大鼠作为SPID造模动物,具有操作简便、结果稳定和成本低廉等优势。要形成符合临床证候的SPID动物模型,除模拟阴道上行性感染外,还需耗伤正气,使其抗病祛邪能力低下而易感邪毒,提高成模率。免疫病理损伤是慢性炎症阶段的主要病理变化,伴随有炎症细胞的浸润、组织纤维化及胶原蛋白沉积等病理改变,是本病慢性进展的主要原因。IL-6属于gpl30细胞因子家族,是主要由单核细胞、巨噬细胞、系膜细胞、成骨细胞分泌产生的一种前炎症细胞因子,也是一种重要的免疫调节因子。在组织的炎性反应中起到促炎的作用,并参与炎症介导与传递,在慢性炎症的发展过程中起重要作用。IL-6能提高淋巴细胞分化率及血管内皮粘附因子对血管内皮细胞的黏附和激活作用。IL-10是由T细胞(主要是Th2细胞)和巨噬细胞分泌产生的一种抗炎症细胞因子,参与调节机体免疫应答反应。IL-10能减少多种致炎性细胞因子的合成与分泌,通过多种途径减轻炎症反应。此外,IL-10还有促进细胞增生和分化,加强细胞免疫反应,增强B细胞功能等作用。VEGF又名血管内皮生长因子,是一种具有高度生物活性的糖蛋白,能够促进炎症的形成和发展,尤其对慢性炎症的形成具有重要意义,促进内皮细胞的增殖,增加血管的通透性,作用部位主要在毛细血管后静脉和小静脉,且此功能不会被组织胺或其他炎症因子抑制剂阻断。本发明研究中,感染实验组与手术模型组比较,大鼠输卵管组织中IL-6的表达明显升高,差异有显著性(P﹤0.05),大鼠输卵管与周围结缔组织中IL-10的表达明显降低、VEGF的表达明显升高,差异有极显著性(P﹤0.01)。感染实验组大鼠输卵管及结缔组织中IL-6的表达明显升高、IL-10的表达明显降低,与模拟对照组及自然观察组比较差异有极显著性(P﹤0.01)。感染实验组大鼠各组织中VEGF的表达较模拟对照组及自然观察组明显升高,差异有极显著性(P﹤0.01)。肉眼观察及光镜下病理组织形态观察结果都表明,感染实验组与手术模型组大鼠的输卵管、卵巢及周围结缔组织有明显的盆腔炎性疾病后遗症病理改变,提示造模成功。且采用阴道上行感染法的非手术SPID模型更符合临床发病过程。另外,感染实验组大鼠在行为学方面(包括皮毛颜色、皮毛状态、双眼状态、精神状态、食量等)较模拟对照组、自然观察组比较的不同变化,为进一步进行中医证候研究提供了重要参考。当前第1页1 2 3
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1