一种外周血单个核细胞冻存方法与流程
本发明涉及免疫细胞冻存技术领域,尤其涉及一种外周血单个核细胞冻存方法。
背景技术
免疫细胞(ic)泛指所有参加免疫应答和与免疫应答有关的细胞及其前体细胞,包括淋巴细胞、单核/巨噬细胞、粒细胞、树突状细胞等,其中淋巴细胞具有免疫调节和自我复制等特点,针对病毒、细菌、真菌感染的治疗均可起到关键的作用,免疫细胞在癌症治疗中具有很大的临床应用价值。
免疫细胞冻存技术是长期保存免疫细胞最可靠,也是最经济的方法,免疫细胞的冻存技术的优化或进展对于免疫细胞的基础研究及临床应用有着重大的意义。利用冻存技术将细胞置于-196℃液氮中低温保存,可以使细胞暂时脱离生长状态而将其细胞特性保存起来,这样在需要的时候再复苏细胞用于实验。而且适度地保存一定量的细胞,可以防止因正在培养的细胞被污染或其他意外事件而使细胞丢种,起到了细胞保种的作用。
技术实现要素:
本发明针对免疫细胞冻存技术对基础研究及临床应用的重要性,提供一种新的有效冻存人体外周血单个核细胞的方法,可为生物银行提供冻存效果更加优越的冻存技术,从而为细胞储存相关的研发及临床等工作带来有力保障。
为实现上述目的,本发明采用以下技术方案。
一种外周血单个核细胞冻存方法,包括以下步骤:
s1、将羟乙基淀粉注射液与外周血按体积比1:4-6混合并摇匀,得预处理外周血样本。
优选的,将羟乙基淀粉注射液与外周血按体积比1:5混合并摇匀。
优选的,所述预处理外周血样本装在转移袋中,所述转移袋置于摇床上以40-60rmp摇4-8min。
s2、对预处理外周血样本进行离心分离,使预处理外周血样本分层,分别除去红细胞层和血浆层,收集单个核细胞层,即细胞悬液。
优选的,所述对预处理外周血样本进行离心分离的方式是:将预处理外周血样本置于转移袋中,使转移袋管口向下置于离心机中进行一次离心,离心后静置至分层清晰,然后从转移袋的管口除去底层的红细胞层;接着使转移袋管口向上置于离心机中进行二次离心,离心后静置至分层清晰,再接着从转移袋的管口除去顶层的血浆层,余下的为细胞悬液。
优选的,所述一次离心的离心参数是:40×g-100×g,离心时间5-10min;所述二次离心的离心参数是:500×g-800×g,离心时间12-18min。
s3、以体积比1:3-5将防冻剂与细胞悬液混合并摇匀,然后将细胞悬液置于冻存袋中。
优选的,以体积比1:4将防冻剂与细胞悬液混合并摇匀。
优选的,所述防冻剂是以体积比1:1将dmso与4℃的右旋糖酐注射液混合均匀所得。
优选的,将右旋糖酐注射液置于4℃下预冷5-10min,然后将dmso加入到右旋糖酐注射液中且边加边摇匀,混合均匀后得防冻剂,将防冻剂置于4℃下20min以上,备用。
s4、将装有细胞悬液的冻存袋进行程序降温,先将温度逐渐降至-54℃,再将温度升至-21℃,然后将温度降至-80℃;接着将冻存袋置于液氮中以长期保存细胞悬液。
优选的,先以1℃/min的速率将温度降至-5℃,再以21℃/min的速率将温度降至-54℃;然后以17℃/min的速率将温度升至-21℃,接着以2℃/min的速率将温度降至-40℃,再接着以10℃/min的速率将温度降至-80℃。
还包括步骤s5,从液氮中取出冻存袋,将冻存袋浸入37℃的水浴中使冻存袋内的细胞悬液融化,然后用密度梯度离心法对细胞悬液进行离心分离,收集单个核细胞,然后将单个核细胞重悬至生理盐水中并用洗涤液洗涤,离心收集单个核细胞。
优选的,所述洗涤液是含2.5%(wt/vol)人血白蛋白和5%(wt/vol)右旋糖酐的生理盐水混合液。
与现有技术相比,本发明的有益效果是:本发明通过采用向外周血中加入羟乙基淀粉注射液并收集其中富含单个核细胞的细胞悬液,然后向细胞悬液中加入防冻剂按一定的降温方式进行冻存,可对单个核细胞进行有效的冻存,细胞复苏后活率,及对复苏后细胞进行cik培养14天的扩增倍数和体外杀伤率均与现有的冻存方法相当,且通过优化及控制细胞悬液的降温方式,可有效提高对复苏后细胞进行cik培养14天的扩增倍数,优于现有的冻存方法。本发明提供一种新的有效冻存人体外周血单个核细胞的方法,可为生物银行提供冻存效果更加优越的冻存技术,从而为细胞储存相关的研发及临床等工作带来有力保障。
附图说明
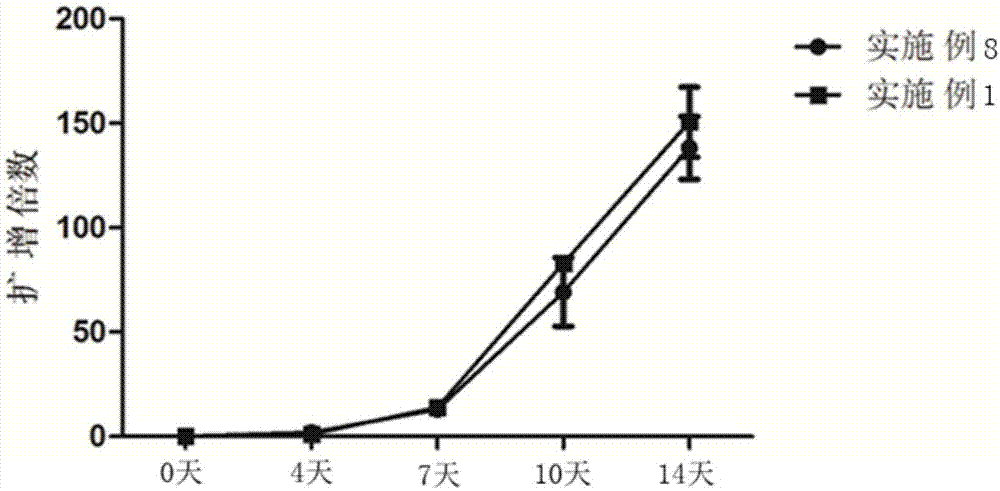
图1为实施例1和实施例8的细胞扩增效率检测对比图;
图2为实施例1与实施例8的细胞表型流式检测对比图;
图3为实施例1与实施例8的细胞体外杀伤检测对比图。
具体实施方式
为了更充分的理解本发明的技术内容,下面结合具体实施例对本发明的技术方案作进一步介绍和说明。
实施例1
本实施例提供一种外周血单个核细胞冻存方法,具体步骤如下:
(1)分别采集3名健康志愿者的外周血各80ml,共240ml,将羟乙基淀粉注射液与外周血按照体积比1:5注入转移袋中,混匀后,置于40-60rpm的摇床上摇匀4-8min,得到预处理外周血样本。
(2)将装有预处理外周血样本的转移袋倒置(管口向下)放入离心机专用转子中固定,放入离心杯,配平离心,离心参数为40×g-100×g,离心时间5-10min,称为一次离心。
(3)离心结束后,从离心机中取出离心杯,轻轻的将转移袋从离心杯中取出,倒挂于生物安全柜挂架上,静置5min,待分层清晰后,通过管口从转移袋中分离出底层的红细胞层,直至分层界面距离管口大约1cm。
(4)将装有剩余预处理外周血样本的转移袋密闭后正置(管口向上)放入离心机专用转子中,放入离心杯,配平离心,离心参数为500×g-800×g,离心时间12-18min,称为二次离心。
(5)离心结束后,从离心机中取出离心杯,然后从离心杯中取出转移袋,用长夹夹在血浆层与细胞悬液层之间,用50ml注射器通过转移袋的管口抽取处于顶层的血浆层,余下的为细胞悬液,富含单个核细胞,细胞悬液将被冻存。
(6)防冻剂的配置:右旋糖酐注射液在4℃下预冷5-10min,吸取相同体积的dmso,缓慢加入到预冷的右旋糖酐中,边加边摇匀,充分混匀后将防冻液放到4℃的冰箱中预冷20min,备用。
(7)用注射器吸取防冻剂,注射至步骤(5)中的转移袋中,防冻剂与被冻存细胞悬液体积比为1:4,边加边摇匀转移袋,防冻剂全部加入后,摇匀转移袋,使得防冻液与细胞充分混匀。
(8)用注射器将转移袋中的细胞悬液平均转移至多个50ml冻存袋中。
(9)将装有细胞悬液的50ml冻存袋置于程序降温仪中,按照以下参数降温:程序降温仪的等待温度为4℃,即降温前冻存袋整体温度为4℃。先以1℃/min的速率将冻存袋的温度降至-5℃,再以21℃/min的速率将程序降温仪的舱室温度降至-54℃;然后以17℃/min的速率将程序降温仪的舱室温度升至-21℃,接着以2℃/min的速率将冻存袋的温度降至-40℃,再接着以10℃/min的速率将冻存袋的温度降至-80℃。
(10)程序降温后,将经步骤(9)降温处理的冻存袋转移至液氮中保存2周。
(11)准备4℃预冷的洗涤液,洗涤液为2.5%(wt/vol)人血白蛋白(humanalbumin)和5%(wt/vol)右旋糖酐(dextran40)的生理盐水混合液。
(12)将冻存在液氮中的冻存袋从气相罐中取出后浸入37℃水浴,保证密封,手持续晃动冻存袋使冻存袋内的细胞悬液快速融化,通常融化时间小于2min。
(13)冻存袋内的细胞悬液融化完毕后,对冻存袋进行消毒,然后剪开冻存袋的塑料管,将冻存袋内的细胞悬液转移至离心管中。
(14)将复苏的细胞用密度梯度离心法进行单个核细胞(pbmc)提纯,收集单个核细胞,然后重悬至生理盐水中并用洗涤液洗涤,离心收集单个核细胞。
(15)对pbmc进行cik培养,接种密度控制在1×107/ml。扩增14天。
实施例2
本实施例提供一种外周血单个核细胞冻存方法,具体步骤与实施例1的基本一致,不同之处在步骤(1)中,将羟乙基淀粉注射液与外周血按照体积比1:4注入转移袋中。
实施例3
本实施例提供一种外周血单个核细胞冻存方法,具体步骤与实施例1的基本一致,不同之处在步骤(1)中,将羟乙基淀粉注射液与外周血按照体积比1:6注入转移袋中。
实施例4
本实施例提供一种外周血单个核细胞冻存方法,具体步骤与实施例1的基本一致,不同之处在步骤(6)中,防冻剂不同,本实施例的防冻剂是步骤(5)分离出的血浆进行灭活后的灭活血浆与dmso按体积比为1:9混合配制而成。
实施例5
本实施例提供一种外周血单个核细胞冻存方法,具体步骤与实施例1的基本一致,不同之处在步骤(9),降温方式不同,本实施例的降温方式是直接将转移袋放到-80℃的冰箱中,放置12h。
实施例6
本实施例提供一种外周血单个核细胞冻存方法,具体步骤与实施例1的基本一致,不同之处在步骤(9)的程序降温方式不同,本实施例的程序降温方式如下:程序降温仪的等待温度为4℃,即降温前冻存袋整体温度为4℃。先以1℃/min的速率将冻存袋的温度降至-5℃,再以21℃/min的速率将程序降温仪的舱室温度降至-54℃;然后以10℃/min的速率将冻存袋的温度降至-80℃。
实施例7
本实施例提供一种外周血单个核细胞冻存方法,具体步骤与实施例1的基本一致,不同之处在步骤(9)的程序降温方式不同,本实施例的程序降温方式如下:程序降温仪的等待温度为4℃,即降温前冻存袋整体温度为4℃。先以10℃/min的速率将程序降温仪的舱室温度降至-54℃;然后以17℃/min的速率将程序降温仪的舱室温度升至-21℃,接着以10℃/min的速率将冻存袋的温度降至-80℃。
实施例8
本实施例提供一种外周血单个核细胞冻存方法,具体步骤如下:
(1)分别采集3名健康志愿者外周血各80ml,共240ml,加入到含有肝素钠抗凝剂的离心管中,将外周血用移液器上下吹打混匀后,取样进行全血计数,离心参数500×g,离心时间7min,离心结束后,用移液器吸取上层淡黄色血浆层,并转移到新的离心管内,于56℃水浴箱内进行灭活30min;血浆灭活完成以后,进行离心,离心参数900×g,离心时间10min,取上清于新的离心管中,即为自体血浆,置于2-8℃保存备用。
(2)用移液器吸取上层淡黄色血浆层后,剩余的液体即为浓缩的血细胞,用生理盐水稀释浓缩的血细胞至原体积,为血液稀释液。
(3)将ficoll分离液加入离心管的底部,将步骤(2)中的血液稀释液缓慢的加到ficoll分离液上层,血液稀释液与ficoll分离液的体积比为2:1,进行离心,离心参数700×g,离心时间20min,吸取离心管内的白膜层(单个核细胞),移到50ml离心管内并补加生理盐水至50ml,洗涤二次离心收集pbmc。
(4)将dmso和步骤(1)的自体血浆按体积比为1:9混合配制冻存液。
(5)用细胞冻存液重悬步骤(3)中收集的pbmc,制成7ml细胞冻存悬液,分7管冻存,每管1ml,冻存密度为:1×107cell/ml~2×107cell/ml。
(6)将冻存管置于-80℃的冰箱中12h,然后转入-196℃液氮罐保存2周。
(7)复苏时,将冻存管从液氮中取出,迅速置于37℃水浴中,不断摇晃,冰块完全融化后取出。
(8)将复苏后的细胞缓慢加入4℃预冷的生理盐水中重悬,洗涤后收集。
(9)对pbmc进行cik培养,接种密度控制在1×107/ml。扩增14天。
采用胎盼蓝拒染法分别对实施例1-7的步骤(14)中的重悬细胞及实施例8的步骤(8)中的重悬细胞进行活率检测,检测结果如下表1所示。实施例1-3和实施例8的细胞复苏后活率无明显差别,实施例1-3的稍优于实施例8。
分别对实施例1-8中cik培养14天细胞进行细胞计数,并计数扩增效率,结果如下表2所示,图1为实施例1和实施例8的细胞扩增效率检测对比图,从图1可见,实施例1与实施例8细胞复苏后进行cik培养,14天实施例1扩增150.5倍优于实施1扩增138.2倍。
分别对实施例1和8中cik培养14天细胞进行流式表型检测,检测内容为cd3+cd4+,cd3+cd8+,cd3+cd56+,cd3-cd56+。图2为实施例1与实施例8的细胞表型流式检测对比图,从图2可见,实施例1与实施例8的细胞复苏后进行cik培养,14天流式表型结果中,实施例1细胞毒t细胞(cd3+cd8+)比例高于实施8,实施例1的nkt细胞(cd3+cd56+)低于实施例8。
分别对实施例1-8中cik培养14天细胞进行体外杀伤检测,靶细胞为k562细胞株,效靶比为20:1。检测结果如下表3所示,图3为实施例1与实施例8的细胞体外杀伤检测对比图,从图3可见,实施例1与实施例8的细胞复苏后进行cik培养,14天体外杀伤检测,实施例1与实施例8无明显差别。
表1实施例1-8细胞复苏后活率检测结果(mean±sd,n=3)(%)
表2实施例1-8中cik培养14天的细胞扩增倍数
表3实施例1-8中cik培养14天的细胞体外杀伤率(%)
以上所述仅以实施例来进一步说明本发明的技术内容,以便于读者更容易理解,但不代表本发明的实施方式仅限于此,任何依本发明所做的技术延伸或再创造,均受本发明的保护。
- 还没有人留言评论。精彩留言会获得点赞!