一种关于长寿花增殖培养及植株生根的研究的制作方法
本发明涉及植物生长技术领域,具体涉及一种关于长寿花增培养及植株生根的研究。
背景技术:
6-ba促进植株非分化组织的分化以及促进其细胞分裂等作用是此类细胞分裂素类所特有的生理作用,是其它植物激素所不可取代的,在植物组织及植物细胞培养中是不可缺少的。在实际应用中,不仅要考虑处理方法,还要兼顾处理部位和使用量。因此,这成为了限制它在农业以及园艺上应用更广泛的一个原因。尽管如此,由于其细胞分裂素的活性很高,故其在从作物发芽到收获的过程中均有广泛应用。naa是一种生长素,不仅可促进植物根系的生长,还可促进细胞的分裂和扩大,诱导植株形成不定根,是一种优良的植物激素。
植物组织培养作为一种新型的繁殖方法,被广泛的应用。长寿花作为一种理想的试验材料,可以在较短的时间内观察到愈伤组织和不定芽分化,还具有吸收甲醛净化空气的功效。现如今,已有不少学者对长寿花进行研究,比如研究不同激素种类、同种激素不同浓度、不同种激素的不同配比以及不同处理的ms培养基对长寿花的茎段、叶片等不同组织部位的影响。虽然目前对长寿花的研究较多,但结果各不相同。当6-ba浓度为1.0mg/l时,有研究得出加入naa0.1mg/l时,最适宜芽增殖培养,有研究指出加入0.2mg/l的naa,最适宜诱导长寿花的芽增殖;当6-ba浓度为1.0mg/l时,有研究指出加入naa0.1mg/l时,最适宜诱导产生愈伤组织,有人研究指出加入0.2mg/l和0.1mg/l的naa,对诱导块根产生愈伤组织均有显著效果,有研究指出加入6-ba2.0mg/l和naa0.3mg/l最有利于愈伤组织的诱导;当naa浓度为0.2mg/l时,有研究指出1/2ms培养基是诱导生根的最佳培养基,有研究指出ms培养基诱导生根效果显著;前人对长寿花的离体繁殖的研究结果不尽相同。
技术实现要素:
本发明的目的在于针对现有技术的缺陷和不足,提供一种结构简单,设计合理、使用方便的关于长寿花增培养及植株生根的研究,明确长寿花在离体快繁各阶段的具体培养基成分,用6-ba、naa不同激素组成研究继代培养和生根培养,研究不同琼脂用量培养,寻找最有利于长寿花繁殖培养的培养基,以期建立长寿花的离体快繁体系。
为实现上述目的,本发明采用的技术方案是:它的操作步骤如下:
1、材料准备
1.1、用无菌瓶苗选择生长健壮的优良枝条,切成约2.0cm的带一个茎节的茎段;
1.2、将培养瓶及盖子等全部放入高压灭菌锅中消毒后烘干备用;
1.3、对步骤1.1中的枝条进行外植体消毒:取上述切好的长寿花枝条,充分清洗表面后,在无菌条件下用无菌水对实验材料反复冲洗2~3次后75%酒精浸泡25~30s,无菌水冲洗2次,0.2%升汞溶液消毒8~9min,无菌水冲洗3~4次,用无菌滤纸吸干枝条表面水分进行接种实验;
1.4、ms培养基的准备:ms培养基为基本培养基,即,蔗糖30g/l、琼脂粉6g/l,ph值5.7~5.8,培养温度25~27℃,光照强度2500lx,光照时间12h/d;
2、试验设计
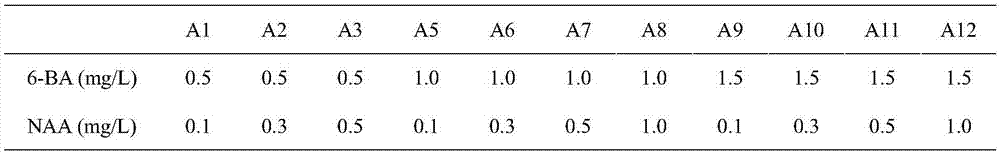
2.1、增殖培养:在ms基本培养基上加入激素naa和6-ba,6-ba设0.5、1.0、1.5mg/l,naa设0.1mg/l、0.3mg/l、0.5mg/l、1.0mg/l,正交组合,共12个处理,每处理30瓶,每瓶接种3个茎段;
2.2、生根培养:在ms培养基中加入激素naa和6-ba,在无菌环境进行茎段接种,每瓶接种2个,每个处理接种20瓶;
2.3、不同琼脂用量设计:ms培养基作为基本培养基,蔗糖30g/l,激素6-ba0.5mg/l和naa1.0mg/l,分别加入琼脂粉3g/l,4.5g/l,6g/l,将茎段接种在培养基上,每瓶接种3个,每个处理接种15瓶;
2.4、试验测定:42d后在每组处理中随机选取5瓶培养基,分别统计每株长寿花的芽增殖数和株高,42d后对统计分析的数据进行差异显著性检验、多因素方差分析和pearson相关性分析;5d后发现有根形成,开始记录根的形状和长度,8d,10d,42d记录一次;株高是指培养基基部到植株顶端的距离;芽增殖系数=芽苗总数/接种芽数;
3、结果分析
3.1、激素对增殖培养的影响
3.1.1、对株高的影响:当naa浓度是1.0mg/l时,6-ba浓度是0.5mg/l株高最高且对株高影响差异显著高于1.0mg/l和1.5mg/l,但6-ba浓度为0.5mg/l和1.0mg/l对株高影响差异均不显著;当naa浓度是0.5mg/l时,6-ba浓度为0.5mg/l对株高影响差异显著高于1.0mg/l和1.5mg/l,6-ba浓度为0.5mg/l和1.0mg/l对株高影响差异不显著;当naa浓度分别是0.1mg/l和0.3mg/l时,6-ba浓度的不同对株高影响差异均不显著;当6-ba浓度分别是0.5mg/l和1.5mg/l时,naa浓度的不同对株高影响差异均不显著,当6-ba浓度是1.0mg/l时,naa浓度为0.1mg/l和0.3mg/l对株高影响差异均不显著,naa浓度为0.5mg/l和1.0mg/l对株高影响差异均不显著,但naa浓度为0.1mg/l和0.3mg/l对株高影响差异显著高于naa浓度是0.5mg/l和1.0mg/l;
3.1.2、对增殖系数的影响:当naa浓度是1.0mg/l时,6-ba浓度为0.5mg/l对增殖系数影响差异显著高于1.0mg/l,但6-ba浓度为1.5mg/l与6-ba浓度为0.5mg/l和1.0mg/l对增殖系数影响差异均不显著;6-ba浓度是0.5mg/l增殖系数最高,但与其他处理株高影响差异均不显著。当naa浓度是0.5mg/l,1.0mg/l,1.5mg/l,6-ba浓度的不同对株高影响差异均不显著。当6-ba浓度是0.5mg/l,1.0mg/l,1.5mg/l,naa浓度的不同对株高影响差异均不显著;
6-ba对株高的影响达到了极显著水平,naa对株高影响不显著,6-ba和naa对增殖系数影响均不显著,而两者的交互作用对增殖系数影响不显著,但对株高的影响达到了显著水平;从影响大小来看,6-ba对株高和增殖系数的影响均大于naa的影响;
3.2、激素对生根培养的影响
5d后,基础培养基为ms、1/2ms、1/4ms,naa均为0的生根培养处理较少有根形成,根量少,约1-3根;8d后,基础培养基为1/2ms、1/2ms、1/2ms(6-ba为0.5)、1/4ms,naa为0.5、1、0、0.5的生根培养处理有根形成,约2-5根;10d后,基础培养基为ms、1/2ms、1/4ms,naa均为0的生根培养处理根细长,约0.8cm-1.5cm,根数一般,较少无根出现;基础培养基为ms、ms、1/2ms(6-ba为0.5)、1/2ms(6-ba为0.5),naa为0.5、1、0.5、1的生根培养处理开始有根形成,根少,约0.2cm-0.3cm;基础培养基为1/2ms,naa为0的生根培养处理根较多,约7-8根,长约0.2cm,较少根长约1.0cm;基础培养基为1/2ms、1/2ms,naa为0.5、1的生根培养处理根量较少,约4-5根,长约0.2cm;基础培养基为1/2ms(6-ba为0.5)、1/4ms、1/4ms,naa为0、0.5、1的生根培养处理根多但短,约0.1cm-0.3cm。
42d后,基础培养基为1/2ms(6-ba为0.5),naa为0和基础培养基为1/2ms(6-ba为0.5),naa为0的生根培养处理的长寿花根短且少,植株矮小,叶片发黄;基础培养基为1/2ms(6-ba为0.5),naa为0.5的生根培养处理的根长但极少,植株矮小;基础培养基为ms、ms、ms、1/2ms,naa为0、0.5、1、0生根培养处理的长寿花根稍长,数量也稍多;处理组基础培养基为1/2ms、1/4ms、1/4ms,naa为1、0、0.5的生根培养对诱导长寿花生根效果显著;结合后期观察,处理组处理组基础培养基为1/2ms,naa为1的根系长,根量多且粗壮,植株较健壮,生根诱导效果显著;
3.3、不同琼脂用量对植株的影响
琼脂粉用量为3g/l和4.5g/l处理植株大多呈倾斜式生长,浸入培养基中的叶片逐渐分化成愈伤组织,处理组6g/l植株生长健壮,叶片形态正常且植株直立生长;
4、结论总结
在增殖培养中,加入激素6-ba和naa的培养基,都能诱导茎段产生不定芽,但效果差异显著,当6-ba浓度为0.5mg/l,naa浓度为1.0mg/l时,株高最高,增殖系数最大;当6-ba浓度为1.5mg/l,naa浓度为0.5mg/l时,株高2.38最低,增殖系数6.80较大;当6-ba浓度为1.0mg/l,naa浓度为0.3mg/l时,增殖系数5.00最小,株高3.36最低,分析其中原因:激素6-ba和naa的浓度配比影响长寿花芽的增殖,与目前研究结果保持一致,细胞分裂素和生长素的比值直接影响了叶片的再生;
当6-ba浓度不变时,随着naa浓度的增加,根的质量并没有呈现一直增加趋势,而出现了下降现象;当naa浓度不变时,随着6-ba浓度的增加,部分处理的根质量降低,究其原因:激素6-ba和naa的浓度影响长寿花根系的生长,与目前研究结果保持一致,植物生长调节剂显著影响组织培养;
较少植株茎段末端或浸入培养基中的叶片膨大成球逐渐形成愈伤组织,分析其中原因:叶片比茎段更适合进行愈伤组织的诱导;6-ba影响毛状根的生长和衰老,部分长寿花在培养过程中根萌发时间较长或根数量少或出根的质量不佳,甚至有的植株直到培养后期都没有实根形成,分析其中原因,可能是长寿花植株个体的差异、实验中激素的使用和培养条件对其的影响;
植株在琼脂粉用量为6g/l处理直立生长且叶片形态正常,较健壮;在琼脂粉用量为3g/l和4.5g/l处理倾斜生长,琼脂浓度大更利于植株的直立生长,与目前研究结果一致,琼脂的凝胶强度值随着琼脂质量分数的增大而增大;
ms+6-ba0.5mg/l+naa1.0mg/l是最适宜于长寿花增殖的培养基,最有利于长寿花生根诱导的培养基为1/2ms+naa1.0mg/l;植株在固态培养基中可以正常生长。
本发明的有益效果:本发明提供了一种关于长寿花增培养及植株生根的研究,明确长寿花在离体快繁各阶段的具体培养基成分,培养基为ms+0.5mg/l6-ba+1.0mg/lnaa时,茎段增殖速度快,增殖系数最高,而且幼苗株高较高,长势好,最适宜诱导长寿花的芽增殖;培养基1/2ms+1.0mg/l6-ba最有利于长寿花根系诱导,其芽苗根量较多,根系发达呈矮圆锥状分布,植株长势较好。
附图说明
为了更清楚地说明本发明实施例或现有技术中的技术方案,下面将对实施例或现有技术描述中所需要使用的附图作简单地介绍,显而易见地,下面描述中的附图仅仅是本发明的一些实施例,对于本领域普通技术人员来讲,在不付出创造性劳动的前提下,还可以根据这些附图获得其他的附图。
图1是本发明中芽增殖培养培养基激素成分图表。
图2是本发明中生根培养设计图表。
图3是本发明中6-ba和naa用量对株高的影响图表。
图4是本发明中6-ba和naa用量对增殖系数的影响图表。
图5是本发明中6-ba、naa及其交互作用对株高和增殖系数的效应图表。
具体实施方式
下面结合附图对本发明作进一步的说明。
参看如图1-图5所示,本具体实施方式采用的技术方案是:它的操作步骤如下:
1、材料准备
1.1、用无菌瓶苗选择生长健壮的优良枝条,切成约2.0cm左右的带一个茎节的茎段;
1.2、将培养瓶及盖子等全部放入高压灭菌锅中消毒后烘干备用;
1.3、对步骤1.1中的枝条进行外植体消毒:取上述切好的长寿花枝条,充分清洗表面后,在无菌条件下用无菌水对实验材料反复冲洗2~3次后75%酒精浸泡25~30s,无菌水冲洗2次,0.2%升汞溶液消毒8~9min,无菌水冲洗3~4次,用无菌滤纸吸干枝条表面水分进行接种实验;
1.4、ms培养基的准备:ms培养基为基本培养基,即,蔗糖30g/l、琼脂粉6g/l,ph值5.7~5.8,培养温度25~27℃,光照强度2500lx,光照时间12h/d;
2、试验设计
2.1、增殖培养:在ms基本培养基上加入激素naa和6-ba,6-ba设0.5、1.0、1.5mg/l,naa设0.1mg/l、0.3mg/l、0.5mg/l、1.0mg/l,正交组合,共12个处理,具体处理见图1。每处理30瓶,每瓶接种3个茎段;
2.2、生根培养:在ms培养基中加入激素naa和6-ba,见图2,在无菌环境进行茎段接种,每瓶接种2个,每个处理接种20瓶;
2.3、不同琼脂用量设计:ms培养基作为基本培养基,蔗糖30g/l,激素6-ba0.5mg/l和naa1.0mg/l,分别加入琼脂粉3g/l,4.5g/l,6g/l,将茎段接种在培养基上,每瓶接种3个,每个处理接种15瓶;
2.4、试验测定:42d后在每组处理中随机选取5瓶培养基,分别统计每株长寿花的芽增殖数和株高,42d后对统计分析的数据进行差异显著性检验、多因素方差分析和pearson相关性分析;5d后发现有根形成,开始记录根的形状和长度,8d,10d,42d记录一次;株高是指培养基基部到植株顶端的距离;芽增殖系数=芽苗总数/接种芽数;
3、结果分析
3.1、激素对增殖培养的影响
3.1.1、对株高的影响:由图3数据可知,当naa浓度是1.0mg/l时,6-ba浓度是0.5mg/l株高最高且对株高影响差异显著高于1.0mg/l和1.5mg/l,但6-ba浓度为0.5mg/l和1.0mg/l对株高影响差异均不显著;当naa浓度是0.5mg/l时,6-ba浓度为0.5mg/l对株高影响差异显著高于1.0mg/l和1.5mg/l,6-ba浓度为0.5mg/l和1.0mg/l对株高影响差异不显著;当naa浓度分别是0.1mg/l和0.3mg/l时,6-ba浓度的不同对株高影响差异均不显著;当6-ba浓度分别是0.5mg/l和1.5mg/l时,naa浓度的不同对株高影响差异均不显著,当6-ba浓度是1.0mg/l时,naa浓度为0.1mg/l和0.3mg/l对株高影响差异均不显著,naa浓度为0.5mg/l和1.0mg/l对株高影响差异均不显著,但naa浓度为0.1mg/l和0.3mg/l对株高影响差异显著高于naa浓度是0.5mg/l和1.0mg/l;
3.1.2、对增殖系数的影响:由图4数据可知,当naa浓度是1.0mg/l时,6-ba浓度为0.5mg/l对增殖系数影响差异显著高于1.0mg/l,但6-ba浓度为1.5mg/l与6-ba浓度为0.5mg/l和1.0mg/l对增殖系数影响差异均不显著;6-ba浓度是0.5mg/l增殖系数最高,但与其他处理株高影响差异均不显著。当naa浓度是0.5mg/l,1.0mg/l,1.5mg/l,6-ba浓度的不同对株高影响差异均不显著。当6-ba浓度是0.5mg/l,1.0mg/l,1.5mg/l,naa浓度的不同对株高影响差异均不显著;
由图5可以看出,6-ba对株高的影响达到了极显著水平,naa对株高影响不显著,6-ba和naa对增殖系数影响均不显著,而两者的交互作用对增殖系数影响不显著,但对株高的影响达到了显著水平;从影响大小来看,6-ba对株高和增殖系数的影响均大于naa的影响;
3.2、激素对生根培养的影响
5d后,r1,r4,r10处理较少有根形成,根量少,约1-3根;8d后,r5,r6,r7,r11处理有根形成,约2-5根;10d后,r1,r4,r10处理根细长,约0.8cm-1.5cm,根数一般,较少无根出现;r2,r3,r8,r9处理开始有根形成,根少,约0.2cm-0.3cm;r4处理根较多,约7-8根,长约0.2cm,较少根长约1.0cm;r5,r6处理根量较少,约4-5根,长约0.2cm;r7,r11,r12处理根多但短,约0.1cm-0.3cm;42d后,r7和r9处理的长寿花根短且少,植株矮小,叶片发黄;r8处理的根长但极少,植株矮小;r1,r2,r3,r4处理的长寿花根稍长,数量也稍多;处理组r6,r10和r11对诱导长寿花生根效果显著;结合后期观察,处理组r6根系长,根量多且粗壮,植株较健壮,生根诱导效果显著;
3.3、不同琼脂用量对植株的影响
琼脂粉用量为3g/l和4.5g/l处理植株大多呈倾斜式生长,浸入培养基中的叶片逐渐分化成愈伤组织,处理组6g/l植株生长健壮,叶片形态正常且植株直立生长;
4、结论总结
在增殖培养中,加入激素6-ba和naa的培养基,都能诱导茎段产生不定芽,但效果差异显著,当6-ba浓度为0.5mg/l,naa浓度为1.0mg/l时,株高最高,增殖系数最大;当6-ba浓度为1.5mg/l,naa浓度为0.5mg/l时,株高2.38最低,增殖系数6.80较大;当6-ba浓度为1.0mg/l,naa浓度为0.3mg/l时,增殖系数5.00最小,株高3.36最低,分析其中原因:激素6-ba和naa的浓度配比影响长寿花芽的增殖,与目前研究结果保持一致,细胞分裂素和生长素的比值直接影响了叶片的再生;
当6-ba浓度不变时,随着naa浓度的增加,根的质量并没有呈现一直增加趋势,而出现了下降现象;当naa浓度不变时,随着6-ba浓度的增加,部分处理的根质量降低,究其原因:激素6-ba和naa的浓度影响长寿花根系的生长,与目前研究结果保持一致,植物生长调节剂显著影响组织培养;
较少植株茎段末端或浸入培养基中的叶片膨大成球逐渐形成愈伤组织,分析其中原因:叶片比茎段更适合进行愈伤组织的诱导;6-ba影响毛状根的生长和衰老,在生根培养中,r7,r8,r9在处理组r4,r5,r6的基础上添加了6-ba0.5mg/l,加入激素6-ba的长寿花根系生长状态不佳,植株矮小,分析原因6-ba影响长寿花根系的生长,与目前研究结果一致。部分长寿花在培养过程中根萌发时间较长或根数量少或出根的质量不佳,甚至有的植株直到培养后期都没有实根形成,分析其中原因,可能是长寿花植株个体的差异、实验中激素的使用和培养条件对其的影响;
植株在a3处理直立生长且叶片形态正常,较健壮;在琼脂粉用量为3g/l和4.5g/l处理倾斜生长,琼脂浓度大更利于植株的直立生长,与目前研究结果一致,琼脂的凝胶强度值随着琼脂质量分数的增大而增大;
ms+6-ba0.5mg/l+naa1.0mg/l是最适宜于长寿花增殖的培养基,最有利于长寿花生根诱导的培养基为1/2ms+naa1.0mg/l;植株在固态培养基中可以正常生长。
本发明的有益效果:本发明提供了一种关于长寿花增培养及植株生根的研究,明确长寿花在离体快繁各阶段的具体培养基成分,培养基为ms+0.5mg/l6-ba+1.0mg/lnaa时,茎段增殖速度快,增殖系数最高,而且幼苗株高较高,长势好,最适宜诱导长寿花的芽增殖;培养基1/2ms+1.0mg/l6-ba最有利于长寿花根系诱导,其芽苗根量较多,根系发达呈矮圆锥状分布,植株长势较好。
以上所述,仅用以说明本发明的技术方案而非限制,本领域普通技术人员对本发明的技术方案所做的其它修改或者等同替换,只要不脱离本发明技术方案的精神和范围,均应涵盖在本发明的权利要求范围当中。
- 还没有人留言评论。精彩留言会获得点赞!