一种植物组织培养方法与流程
本发明属于植物器官培养技术领域,特别涉及一种植物组织培养方法。
背景技术:
植物组织培养又称离体培养,是利用植物细胞具有全能性理论,在无菌和适宜的人工培养基及外部因素下,利用植物的离体器官、组织、细胞以及原生质体,诱导形成愈伤组织、不定芽、不定根,最后发育为完整植株。
近些年来在中药产业迅速发展的大环境下,由于对药用植物的深入研究,使其不断被开发,需求量也不断增长,组织培养再生与种子繁殖方式相比具有周期短、不受四季气候限制、无重金属、农药等有害物质污染、投资少、经济效益高的优点,因此受到人们的广泛关注,被认为是一种有希望缓解土地资源短缺和中药材质量标准不一的重要途径。
技术实现要素:
本发明的目的在于提供一种植物组织培养方法。与传统种植方式相比,本发明重复性好、诱导率高、生长迅速、有效成分含量高、收获方便。
一种植物组织培养方法,使用含有植物激素的滤纸层与固体培养叠加制备的组合培养基,对植物组织进行培养,包括如下步骤:
s1、愈伤组织的诱导:取植物的无菌外植体根、幼嫩茎段2cm左右或幼嫩叶片置于组合培养基的顶层滤纸层上,24~28℃下黑暗无菌培养10~15d,获得新鲜愈伤组织;
其中,所述组合培养基,由滤纸层和固体层由下至上交替叠加而成;所述滤纸层为1片或多片含有植物激素的滤纸,所述固体层为固体培养基,所述组合培养基的底层和顶层均为滤纸层;所述滤纸层在植物组织培养过程中起到了缓释植物激素的作用;
s2、植物组织的诱导:获得愈伤组织后,向组合培养基中加入无菌液体培养基,液体没过顶层滤纸层1mm左右,继续对不定根或不定根和不定芽进行诱导;其中,不定根诱条件为:24~28℃、黑暗无菌培养15~20d,得到带有愈伤组织的不定根;不定根和不定芽诱导条件为:24~28℃、光照12h/d无菌培养15~20d,得到长有不定根和不定芽的完整植株。
优选方式下,步骤s1所述植物激素为2,4-二氯苯氧乙酸(2,4-d)、6-苄氨基腺嘌呤(6-ba)、吲哚丁酸(iba)、萘乙酸(naa)、激动素(kt)中的一种或多种。
优选方式下,步骤s1所述固体培养基的厚度为0.5~1cm。
优选方式下,步骤s1所述固体培养基为ms固体培养基。
优选方式下,步骤s1所述组合培养基由四层滤纸层和三层固体层由下至上交替叠加而成。
优选方式下,步骤s1所述组合培养基由三层滤纸层和两层固体层由下至上交替叠加而成。
优选方式下,步骤s1所述组合培养基由两层滤纸层和一层固体层由下至上交替叠加而成。
优选方式下,步骤s2所述培养基为ms液体培养基。
优选方式下,步骤s1所述组合培养基由下至上分别为第1层滤纸层、第1层固体层、第2层滤纸层、第2层固体层和顶层滤纸层;所述第1层滤纸层含有2.5~5.0mg/liba、0.2~1.0mg/lnaa、0.5~4.0mg/l6-ba、0.5~1.0mg/lkt;所述第2层滤纸层含有1.0~2.0mg/liba、0.5~1.0mg/l2,4-d、0.5~2.0mg/l6-ba和0.2mg/lnaa;所述顶层滤纸层含有0.5~1.0mg/l2,4-d和0.2~1.0mg/l6-ba;所述第1层固体层为厚度为0.5cm的蔗糖的浓度为30~50g/l、琼脂含量为8g/l的ms固体培养基,第2层固体层为厚度为1cm的蔗糖的浓度为30~50g/l、琼脂含量为8g/l的ms固体培养基;
优选方式下,步骤s1所述组合培养基的制备方法为:
s11、剪裁滤纸:取定性滤纸将其裁剪成与无菌组培瓶底部大小一致的直径为8cm的圆形滤纸片,将其放入洁净的培养皿中牛皮纸密封,121℃、0.1mpa高温灭菌25min;
s12、制备滤纸层:
第1层滤纸层的制备:于超净工作台中采用孔径为0.22μm的滤膜对植物激素进行过滤除菌后混合在一无菌小烧杯中,得混合植物激素1,所述混合植物激素1中含2.5~5.0mg/liba、0.2~1.0mg/lnaa、0.5~4.0mg/l6-ba、0.5~1.0mg/lkt,将4~8片步骤s11所得灭菌后的滤纸片叠放在一起,在混合植物激素1中浸泡20s,得第1层滤纸层,用于对不定根进行诱导;第2层滤纸层的制备:于超净工作台中采用孔径为0.22μm的滤膜对植物激素进行过滤除菌后混合在一无菌小烧杯中,得混合植物激素2,所述混合植物激素2中含1.0~2.0mg/liba、0.5~1.0mg/l2,4-d、0.5~2.0mg/l6-ba和0.2mg/lnaa,将3~8片步骤s11所得灭菌后的滤纸片叠放在一起,置于所述混合植物激素2中浸泡20s,得第2层诱导滤纸层,用于对不定根进行诱导;
顶层诱导滤纸层的制备:于超净工作台中采用孔径为0.22μm的滤膜对植物激素进行过滤除菌后混合在一无菌小烧杯中,得混合植物激素3,所述混合植物激素3中含有0.5~1.0mg/l2,4-d和0.2~1.0mg/l6-ba,将3~5片步骤s11灭菌后的滤纸片叠放在一起,在植物激素3中浸泡20s,得顶层诱导滤纸层,用于对愈伤组织进行诱导;
s13、配制培养基:准确称取ms固体粉末溶于水,添加蔗糖和琼脂,调节ph=5.8~6.0,121℃、0.1mpa高温灭菌25min后保温防止凝固,配制成蔗糖的浓度为30~50g/l,琼脂含量为8g/l的ms琼脂培养基;
s14、制备组合培养基:将步骤s12所得第1层滤纸层平铺于步骤s11所述无菌组培瓶底部,在第1层滤纸层上倒入步骤s13制备的培养基,凝固后形成厚度为1cm的第1层固体层,将步骤s12所得第2滤纸层平铺于第1层固体层上,在第2层滤纸层上倒入步骤s13制备的培养基,凝固后形成厚度为0.5的第2层固体层,将步骤s12所得顶层滤纸层平铺于第2层固体层上,得组合培养基;所述组合培养基从下到上分别为:第1层滤纸层、第1层固体层、第2层滤纸层、第2层固体层和顶层滤纸层。
本发明的有益效果是:
本发明可以实现高诱导率,且所需原材料少,染菌率低,愈伤组织无需进行转接,生长周期短,收获方便,无需进行培养基分离,满足市场需求,具有重大的推广价值。
附图说明
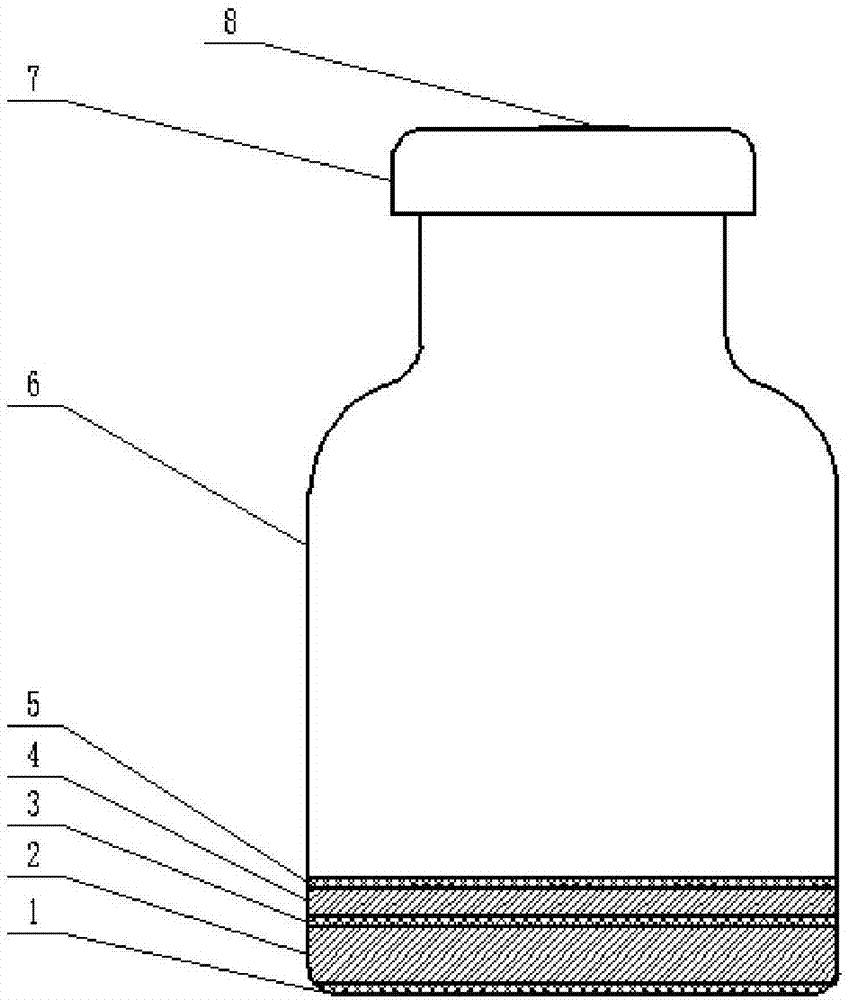
图1为本发明实施例1制备的组合培养基示意图,
其中1.第1层滤纸层;2.第1层固体层;3.第2层滤纸层;4.第2层固体层;5.顶层滤纸层;6.组培瓶;7.瓶盖;8.滤膜。
具体实施方式
下面通过具体实施实例对本发明做进一步说明。
下述实施例中所使用的实验方法,如无特殊说明均为常规方法。
下述实施例中所使用的材料、试剂等,如无特殊说明,均可从商业途径获得。ms固体粉末购自于:chembase,货号:27-11-2016。
实施例1
一种植物组织的培养方法:
s1、人参愈伤组织的诱导:取无菌人参生长活力高的根段2cm左右置于组合培养基的顶层滤纸层上,24℃下黑暗无菌培养10d,获得新鲜人参愈伤组织;
s2、人参不定根的诱导:获得愈伤组织后,向组合培养基中加入无菌ms液体培养基,液体高度没过顶层滤纸层1mm左右,由于愈伤组织吸收底层诱导植物激素,在24℃及黑暗条件下无菌培养15d,不定根开始生长,得到带有愈伤组织的人参不定根,共培养35天,不定根数量6,长度3.2cm,诱导率95.1%。
其中,步骤s1所述组合培养基由三层滤纸层和两层ms固体培养基由下至上交替叠加而成,制备方法为:
s11、剪裁滤纸:取定性滤纸将其裁剪成与无菌组培瓶底部大小一致的直径为8cm的圆形滤纸片,将其放入洁净的培养皿中牛皮纸密封,121℃、0.1mpa高温灭菌25min;
s12、制备滤纸层:
第1层滤纸层的制备:于超净工作台中采用孔径为0.22μm的滤膜对植物激素进行过滤除菌后等体积混合在一无菌小烧杯中,得混合植物激素1,所述混合植物激素1中含有2.5mg/liba、0.2mg/lnaa、0.5mg/l6-ba、0.5mg/lkt,将8片步骤s11所得灭菌后的滤纸片叠放在一起,在混合植物激素1中浸泡20s,得第1层滤纸层,用于对不定根进行诱导;第2层滤纸层的制备:于超净工作台中采用孔径为0.22μm的滤膜对植物激素进行过滤除菌后等体积混合在一无菌小烧杯中,得混合植物激素2,所述混合植物激素2中含1.0mg/liba、0.5mg/l2,4-d、0.5mg/l6-ba和0.2mg/lnaa,将3片步骤s11所得灭菌后的滤纸片叠放在一起,置于所述混合植物激素2中浸泡20s,得第2层诱导滤纸层,用于对不定根进行诱导;
顶层诱导滤纸层的制备:于超净工作台中采用孔径为0.22μm的滤膜对植物激素进行过滤除菌后等体积混合在一无菌小烧杯中,得混合植物激素3,所述混合植物激素3中含有0.5mg/l2,4-d和0.5mg/l6-ba,将5片步骤s11灭菌后的滤纸片叠放在一起,在植物激素3中浸泡20s,得顶层诱导滤纸层,用于对愈伤组织进行诱导;
s13、配制培养基:准确称取ms固体粉末溶于水,添加蔗糖和琼脂,调节ph=5.8,121℃、0.1mpa高温灭菌25min后保温防止凝固,配制成蔗糖的浓度为30g/l,琼脂含量为8g/l的ms琼脂培养基;
s14、制备组合培养基:将步骤s12所得第1层滤纸层平铺于步骤s11所述培养瓶底部,在第1层滤纸层上倒入步骤s13制备的培养基,凝固后形成厚度为1cm的第1层固体层,将步骤s12所得第2滤纸层平铺于第1层固体层上,在第2层滤纸层上倒入步骤s13制备的培养基,凝固后形成厚度为0.5的第2层固体层;将步骤s12所得顶层滤纸层平铺于第2层固体层上,得组合培养基;所述组合培养基从下到上分别为:第1层滤纸层、第1层固体层、第2层滤纸层、第2层固体层和顶层滤纸层。
实施例2
一种植物组织的培养方法:
s1、丹参愈伤组织的诱导:取无菌丹参生长活力高的根段2cm左右置于组合培养基的顶层滤纸层上,28℃下黑暗无菌培养15d后,获得新鲜丹参愈伤组织;
s2、丹参不定根的诱导:获得愈伤组织后,向组合培养基中加入无菌ms液体培养基,液体高度没过顶层滤纸层1mm左右,由于愈伤组织吸收底层诱导植物激素,在28℃及黑暗条件下无菌培养20d,不定根开始生长,得到带有愈伤组织的丹参不定根,共培养35d,不定根数量5,长度2.9cm,诱导率97.3%。
其中,步骤s1所述组合培养基由三层滤纸层和两层ms固体培养基由下至上交替叠加而成,制备方法为:
s11、滤纸层的制备:取定性滤纸将其裁剪成与无菌组培瓶底部大小一致的直径为8cm的圆形滤纸片,将其放入洁净的培养皿中牛皮纸密封,121℃、0.1mpa高温灭菌25min;
s12、制备滤纸层:
第1层滤纸层的制备:于超净工作台中采用孔径为0.22μm的滤膜对植物激素进行过滤除菌后等体积混合在一无菌小烧杯中,得混合植物激素1,所述混合植物激素1中含有5.0mg/liba、0.4mg/lnaa、1.0mg/l6-ba、0.5mg/lkt,将4片步骤s11所得灭菌后的滤纸片叠放在一起,在混合植物激素1中浸泡20s,得第1层滤纸层,用于对不定根进行诱导;第2层滤纸层的制备:于超净工作台中采用孔径为0.22μm的滤膜对植物激素进行过滤除菌后混合在一无菌小烧杯中,得混合植物激素2,所述混合植物激素2中含1.2mg/liba、0.5mg/l2,4-d、0.6mg/l6-ba和0.2mg/lnaa,将3片步骤s11所得灭菌后的滤纸片叠放在一起,置于所述混合植物激素2中浸泡20s,得第2层诱导滤纸层,用于对不定根进行诱导;
顶层诱导滤纸层的制备:于超净工作台中采用孔径为0.22μm的滤膜对植物激素进行过滤除菌后等体积混合在一无菌小烧杯中,得混合植物激素3,所述混合植物激素3中含有0.5mg/l2,4-d和0.5mg/l6-ba,将3片步骤s11灭菌后的滤纸片叠放在一起,在植物激素3中浸泡20s,得顶层诱导滤纸层,用于对愈伤组织进行诱导;
s13、配制培养基:准确称取ms固体粉末溶于水,添加蔗糖和琼脂,调节ph=5.8,121℃、0.1mpa高温灭菌25min后保温防止凝固,配制成蔗糖的浓度为30g/l,琼脂含量为8g/l的m琼脂培养基;
s14、制备组合培养基:将步骤s12所得第1层滤纸层平铺于步骤s11所述培养瓶底部,在第1层滤纸层上倒入步骤s13制备的培养基,凝固后形成厚度为1cm的第1层固体层;将步骤s12所得第2滤纸层平铺于第1层固体层上,在第2层滤纸层上倒入步骤s13制备的培养基,凝固后形成厚度为0.5cm的第2层固体层;将步骤s12所得顶层滤纸层平铺于第2层固体层上,得组合培养基;所述组合培养基从下到上分别为:第1层滤纸层、第1层固体层、第2层滤纸层、第2层固体层和顶层滤纸层。
实施例3
一种植物组织的培养方法:
s1、甘草愈伤组织的诱导:取无菌甘草生长活力高的根段2cm左右置于组合培养基的顶层滤纸层上,26℃下黑暗无菌培养12d后,获得新鲜甘草愈伤组织;
s2、甘草不定根及不定芽的诱导:获得愈伤组织后,向组合培养基中加入少量无菌ms液体培养基,没过顶层滤纸层1mm左右,由于愈伤组织吸收底层诱导植物激素,在26℃、光照12h/d条件下无菌培养18d,不定根及不定芽开始生长,形成完整甘草植株,共培养35天,不定根数量6,不定芽数量11,不定根长度3.0cm,不定芽高度5.5cm,诱导率96.9%。
其中,步骤s1所述组合培养基由三层滤纸层和两层ms固体培养基由下至上交替叠加而成,制备方法为:
s11、剪裁滤纸:取定性滤纸将其裁剪成与无菌组培瓶底部大小一致的直径为8cm的圆形滤纸片,将其放入洁净的培养皿中牛皮纸密封,121℃、0.1mpa高温灭菌25min;
s12、制备滤纸层:
第1层滤纸层的制备:于超净工作台中采用孔径为0.22μm的滤膜对植物激素进行过滤除菌后等体积混合在一无菌小烧杯中,得混合植物激素1,所述混合植物激素1中含有4.0mg/liba、0.5mg/lnaa、4.0mg/l6-ba、0.8mg/lkt,将4片步骤s11所得灭菌后的滤纸片叠放在一起,在混合植物激素1中浸泡20s,得第1层滤纸层,用于对不定根进行诱导;
第2层滤纸层的制备:于超净工作台中采用孔径为0.22μm的滤膜对植物激素进行过滤除菌后等体积混合在一无菌小烧杯中,得混合植物激素2,所述混合植物激素2中含1.5mg/liba、0.8mg/l2,4-d、1.5mg/l6-ba和0.2mg/lnaa,将5片步骤s11所得灭菌后的滤纸片叠放在一起,置于所述混合植物激素2中浸泡20s,得第2层诱导滤纸层,用于对不定根进行诱导;
顶层诱导滤纸层的制备:于超净工作台中采用孔径为0.22μm的滤膜对植物激素进行过滤除菌后等体积混合在一无菌小烧杯中,得混合植物激素3,所述混合植物激素3中含有0.8mg/l2,4-d和0.8mg/l6-ba,将3片步骤s11灭菌后的滤纸片叠放在一起,在植物激素3中浸泡20s,得顶层诱导滤纸层,用于对愈伤组织进行诱导;
s13、配制培养基:准确称取ms固体粉末溶于水,添加蔗糖和琼脂,调节ph=5.9,121℃、0.1mpa高温灭菌25min后保温防止凝固,配制成蔗糖的浓度为50g/l,琼脂含量为8g/l的ms琼脂培养基;
s14、制备组合培养基:将步骤s12所得第1层滤纸层平铺于步骤s11所述培养瓶底部,在第1层滤纸层上倒入步骤s13制备的培养基,凝固后形成厚度为1cm的第1层固体层;将步骤s12所得第2滤纸层平铺于第1层固体层上,在第2层滤纸层上倒入步骤s13制备的培养基,凝固后形成厚度为0.5cm的第2层固体层,所述第2层组合培养基由第2层滤纸层和第2层固体层组成;将步骤s12所得顶层滤纸层平铺于第2层固体层上,得组合培养基;所述组合培养基从下到上分别为:第1层滤纸层、第1层固体层、第2层滤纸层、第2层固体层和顶层滤纸层。
实施例4
s1、黄芪愈伤组织的诱导:取无菌黄芪幼嫩叶片置于组合培养基的顶层滤纸层上,25℃下黑暗无菌培养10d后,获得新鲜黄芪愈伤组织;
s2、黄芪不定根的诱导:获得愈伤组织后,向组合培养基中加入无菌ms液体培养基,没过顶层滤纸层1mm左右,由于愈伤组织吸收底层诱导植物激素,在25℃、黑暗条件下无菌培养16d,不定根开始生长,得到带有愈伤组织的黄芪不定根,共培养35天,不定根数量7,不定根长度3.2cm,诱导率98.3%。
其中,步骤s1所述组合培养基由三层滤纸层和两层ms固体培养基由下至上交替叠加而成,制备方法为:
s11、剪裁滤纸:取定性滤纸将其裁剪成与无菌组培瓶底部大小一致的直径为8cm的圆形滤纸片,将其放入洁净的培养皿中牛皮纸密封,121℃、0.1mpa高温灭菌25min;
s12、制备滤纸层:
第1层滤纸层的制备:于超净工作台中采用孔径为0.22μm的滤膜对植物激素进行过滤除菌后等体积混合在一无菌小烧杯中,得混合植物激素1,所述混合植物激素1中含有3.5mg/liba、0.5mg/lnaa、1.0mg/l6-ba、0.5mg/lkt,将6片步骤s11所得灭菌后的滤纸片叠放在一起,在混合植物激素1中浸泡20s,得第1层滤纸层,用于对不定根进行诱导;
第2层滤纸层的制备:于超净工作台中采用孔径为0.22μm的滤膜对植物激素进行过滤除菌后等体积混合在一无菌小烧杯中,得混合植物激素2,所述混合植物激素2中含2.0mg/liba、0.5mg/l2,4-d、0.8mg/l6-ba和0.2mg/lnaa,将3片步骤s11所得灭菌后的滤纸片叠放在一起,置于所述混合植物激素2中浸泡20s,得第2层诱导滤纸层,用于对不定根进行诱导;
顶层诱导滤纸层的制备:于超净工作台中采用孔径为0.22μm的滤膜对植物激素进行过滤除菌后等体积混合在一无菌小烧杯中,得混合植物激素3,所述混合植物激素3中含有0.8mg/l2,4-d和0.5mg/l6-ba,将4片步骤s11灭菌后的滤纸片叠放在一起,在植物激素3中浸泡20s,得顶层诱导滤纸层,用于对愈伤组织进行诱导;
s13配制培养基:准确称取ms固体粉末溶于水,添加蔗糖和琼脂,调节ph=5.8,121℃、0.1mpa高温灭菌25min后保温防止凝固,配制成蔗糖的浓度为30g/l,琼脂含量为8g/l的ms琼脂培养基;
s14、制备第1层组合培养基层:将步骤s12所得第1层滤纸层平铺于步骤s11所述培养瓶底部,在第1层滤纸层上倒入步骤s13制备的培养基,凝固后形成厚度为1cm左右的第1层固体层;将步骤s12所得第2滤纸层平铺于第1层固体层上,在第2层滤纸层上倒入步骤s13制备的培养基,凝固后形成厚度为0.5cm左右的第2层固体层;将步骤s12所得顶层滤纸层平铺于第2层固体层上,得组合培养基;所述组合培养基从下到上分别为:第1层滤纸层、第1层固体层、第2层滤纸层、第2层固体层和顶层滤纸层。
实施例5
s1、金铁锁愈伤组织的诱导:取无菌金铁锁有嫩叶片置于组合培养基的顶层滤纸层上,27℃下黑暗无菌培养12d后,获得新鲜金铁锁愈伤组织;
s2、金铁锁不定根及不定芽的诱导:获得愈伤组织后,向组合培养基中加入无菌ms液体培养基,没过顶层滤纸层1mm左右,由于愈伤组织吸收底层诱导植物激素,在27℃、光照12h/d条件下无菌培养15d,不定根及不定芽开始生长,形成完整金铁锁植株,共培养35天,不定根数量7,不定芽数量9,不定根长度3.5cm,不定芽高度5.1cm,诱导率95.9%。
其中,步骤s1所述组合培养基由三层滤纸层和两层ms固体培养基由下至上交替叠加而成,制备方法为:
s11、剪裁滤纸:取定性滤纸将其裁剪成与无菌组培瓶底部大小一致的直径为8cm的圆形滤纸片,将其放入洁净的培养皿中牛皮纸密封,121℃、0.1mpa高温灭菌25min;
s12、制备滤纸层:
第1层滤纸层的制备:于超净工作台中采用孔径为0.22μm的滤膜对植物激素进行过滤除菌后等体积混合在一无菌小烧杯中,得混合植物激素1,所述混合植物激素1中含有3.5mg/liba、0.5mg/lnaa、4.0mg/l6-ba、1.0mg/lkt,将7片步骤s11所得灭菌后的滤纸片叠放在一起,在混合植物激素1中浸泡20s,得第1层滤纸层,用于对不定根进行诱导;
第2层滤纸层的制备:于超净工作台中采用孔径为0.22μm的滤膜对植物激素进行过滤除菌后等体积混合在一无菌小烧杯中,得混合植物激素2,所述混合植物激素2中含1.5mg/liba、1.0mg/l2,4-d、2.0mg/l6-ba和0.2mg/lnaa,将4片步骤s11所得灭菌后的滤纸片叠放在一起,置于所述混合植物激素2中浸泡20s,得第2层诱导滤纸层,用于对不定根进行诱导;
顶层诱导滤纸层的制备:于超净工作台中采用孔径为0.22μm的滤膜对植物激素进行过滤除菌后混合在一无菌小烧杯中,得混合植物激素3,所述混合植物激素3中含有1.0mg/l2,4-d和1.0mg/l6-ba,将3片步骤s11灭菌后的滤纸片叠放在一起,在植物激素3中浸泡20s,得顶层诱导滤纸层,用于对愈伤组织进行诱导;
s13、配制培养基:准确称取ms固体粉末溶于水,添加蔗糖和琼脂,调节ph=5.9,121℃、0.1mpa高温灭菌25min后保温防止凝固,配制成蔗糖的浓度为45g/l,琼脂含量为8g/l的ms琼脂培养基;
s14、制备组合培养基层:将步骤s12所得第1层滤纸层平铺于步骤s11所述培养瓶底部,在第1层滤纸层上倒入步骤s13制备的培养基,凝固后形成厚度为1cm左右的第1层固体层;将步骤s12所得第2滤纸层平铺于第1层固体层上,在第2层滤纸层上倒入步骤s13制备的培养基,凝固后形成厚度为0.5cm左右的第2层固体层;将步骤s12所得顶层滤纸层平铺于第2层固体层上,得组合培养基;所述组合培养基从下到上分别为:第1层滤纸层、第1层固体层、第2层滤纸层、第2层固体层和顶层滤纸层。
实施例6
s1、当归愈伤组织的诱导:取无菌当归幼嫩茎段2cm左右置于组合培养基的顶层滤纸层上,25℃下黑暗无菌培养11d后,获得新鲜当归愈伤组织;
s2、当归不定根的诱导:获得愈伤组织后,向组合培养基中加入无菌ms液体培养基,没过顶层滤纸层1mm左右,由于愈伤组织吸收底层诱导植物激素,在25℃黑暗条件下无菌培养18d,不定根开始生长,得到带有愈伤组织的当归不定根,共培养35天,不定根数量5,不定根长度2.7cm,诱导率97.6%。
其中,步骤s1所述组合培养基由三层滤纸层和两层ms固体培养基由下至上交替叠加而成,制备方法为:
s11、剪裁滤纸:取定性滤纸将其裁剪成与无菌组培瓶底部大小一致的直径为8cm的圆形滤纸片,将其放入洁净的培养皿中牛皮纸密封,121℃、0.1mpa高温灭菌25min;
s12、制备滤纸层:
第1层滤纸层的制备:于超净工作台中采用孔径为0.22μm的滤膜对植物激素进行过滤除菌后等体积混合在一无菌小烧杯中,得混合植物激素1,所述混合植物激素1中含有4.0mg/liba、1.0mg/lnaa、0.5mg/l6-ba、1.0mg/lkt,将6片步骤s11所得灭菌后的滤纸片叠放在一起,在混合植物激素1中浸泡20s,得第1层滤纸层,用于对不定根进行诱导;
第2层滤纸层的制备:于超净工作台中采用孔径为0.22μm的滤膜对植物激素进行过滤除菌后等体积混合在一无菌小烧杯中,得混合植物激素2,所述混合植物激素2中含1.5mg/liba、1.0mg/l2,4-d、0.5mg/l6-ba和0.2mg/lnaa,将2片步骤s11所得灭菌后的滤纸片叠放在一起,置于所述混合植物激素2中浸泡20s,得第2层诱导滤纸层,用于对不定根进行诱导;
顶层诱导滤纸层的制备:于超净工作台中采用孔径为0.22μm的滤膜对植物激素进行过滤除菌后等体积混合在一无菌小烧杯中,得混合植物激素3,所述混合植物激素3中含有1.0mg/l2,4-d和0.8mg/l6-ba,将4片步骤s11灭菌后的滤纸片叠放在一起,在植物激素3中浸泡20s,得顶层诱导滤纸层,用于对愈伤组织进行诱导;
s13、配制培养基:准确称取ms固体粉末溶于水,添加蔗糖和琼脂,调节ph=6.0,121℃、0.1mpa高温灭菌25min后保温防止凝固,配制成蔗糖的浓度为30g/l,琼脂含量为8g/l的ms琼脂培养基;
s14、制备组合培养基:将步骤s12所得第1层滤纸层平铺于步骤s11所述培养瓶底部,在第1层滤纸层上倒入步骤s13制备的培养基,凝固后形成厚度为1cm左右的第1层固体层;将步骤s12所得第2滤纸层平铺于第1层固体层上,在第2层滤纸层上倒入步骤s13制备的培养基,凝固后形成厚度为0.5cm左右的第2层固体层;将步骤s12所得顶层滤纸层平铺于第2层固体层上,得组合培养基;所述组合培养基从下到上分别为:第1层滤纸层、第1层固体层、第2层滤纸层、第2层固体层和顶层滤纸层。
实施例7
s1、滇重楼愈伤组织的诱导:取滇重楼幼嫩茎段2cm左右置于组合培养基的顶层滤纸层上,26℃下黑暗无菌培养10d后,获得新滇重楼愈伤组织;
s2、滇重楼不定根的诱导:获得愈伤组织后,向组合培养基中加入无菌ms液体培养基,液体高度没过顶层滤纸层1mm左右,由于愈伤组织吸收底层诱导植物激素,在26℃黑暗条件下无菌培养15d,不定根开始生长,得到带有愈伤组织的滇重楼不定根,共培养35天,不定根数量8,不定根长度3.1cm,诱导率96.9%。
其中,步骤s1所述组合培养基由两层滤纸层和一层ms固体培养基由下至上交替叠加而成,制备方法为:
s11、剪裁滤纸:取定性滤纸将其裁剪成与无菌组培瓶底部大小一致的直径为8cm的圆形滤纸片,将其放入洁净的培养皿中牛皮纸密封,121℃、0.1mpa高温灭菌25min;
s12、制备滤纸层:
第1层滤纸层的制备:于超净工作台中采用孔径为0.22μm的滤膜对植物激素进行过滤除菌后等体积混合在一无菌小烧杯中,得混合植物激素1,所述混合植物激素1中含有3.5mg/liba、1.0mg/l2,4-d、0.5mg/l6-ba和1.0mg/lnaa,将8片步骤s11所得灭菌后的滤纸片叠放在一起,在混合植物激素1中浸泡20s,得第1层滤纸层,用于对不定根进行诱导;
顶层诱导滤纸层的制备:于超净工作台中采用孔径为0.22μm的滤膜对植物激素进行过滤除菌后等体积混合在一无菌小烧杯中,得混合植物激素3,所述混合植物激素3中含有1.0mg/l2,4-d和1.0mg/l6-ba,将4片步骤s11灭菌后的滤纸片叠放在一起,在植物激素3中浸泡20s,得顶层诱导滤纸层,用于对愈伤组织进行诱导;
s13、配制培养基:准确称取ms固体粉末溶于水,添加蔗糖和琼脂,调节ph=5.8,121℃、0.1mpa高温灭菌25min后保温防止凝固,配制成蔗糖的浓度为30g/l,琼脂含量为8g/l的ms琼脂培养基;
s14、制备组合培养基:将步骤s12所得第1层滤纸层平铺于步骤s11所述培养瓶底部,在第1层滤纸层上倒入步骤s13制备的培养基,凝固后形成厚度为1cm左右的第1层固体层;将步骤s12所得顶层滤纸层平铺于第1层固体层上,得组合培养基;所述组合培养基从下到上分别为:第1层滤纸层、第1层固体层和顶层滤纸层。
实施例8
s1、西洋参愈伤组织的诱导:取无菌西洋参生长活力旺盛根段2cm左右置于组合培养基的顶层滤纸层上,25℃下黑暗无菌培养10d后,获得新鲜西洋参愈伤组织;
s2、西洋参不定根的诱导:获得愈伤组织后,向组合培养基中加入少量无菌ms液体培养基,液体没过顶层滤纸层高度为1mm左右,由于愈伤组织吸收底层诱导植物激素,在25℃黑暗条件下无菌培养17d,不定根开始生长,得到带有愈伤组织的西洋参不定根,共培养35天,不定根数量8,不定根长度2.9cm,诱导率98.4%。
其中,步骤s1所述组合培养基由四层滤纸层和三层ms固体培养基由下至上交替叠加而成,制备方法为:
s11、剪裁滤纸:取定性滤纸将其裁剪成与无菌组培瓶底部大小一致的直径为8cm的圆形滤纸片,将其放入洁净的培养皿中牛皮纸密封,121℃、0.1mpa高温灭菌25min;
s12、制备滤纸层:
第1层滤纸层的制备:于超净工作台中采用孔径为0.22μm的滤膜对植物激素进行过滤除菌后等体积混合在一无菌小烧杯中,得混合植物激素1,所述混合植物激素1中含有4.0mg/liba、0.5mg/lnaa、0.5mg/l6-ba、0.5mg/lkt,将4片步骤s11所得灭菌后的滤纸片叠放在一起,在混合植物激素1中浸泡20s,得第1层滤纸层,用于对不定根进行诱导;
第2层滤纸层的制备:于超净工作台中采用孔径为0.22μm的滤膜对植物激素进行过滤除菌后等体积混合在一无菌小烧杯中,得混合植物激素2,所述混合植物激素2中含1.0mg/liba、1.0mg/l2,4-d、1.0mg/l6-ba和0.2mg/lnaa,将3片步骤s11所得灭菌后的滤纸片叠放在一起,置于所述混合植物激素2中浸泡20s,得第2层诱导滤纸层;
第3层滤纸层的制备:于超净工作台中采用孔径为0.22μm的滤膜对植物激素进行过滤除菌后等体积混合在一无菌小烧杯中,得混合植物激素3,所述混合植物激素2中含2.0mg/liba、1.5mg/l2,4-d、4.0mg/l6-ba和0.8mg/lnaa,将3片步骤s11所得灭菌后的滤纸片叠放在一起,置于所述混合植物激素3中浸泡20s,得第2层诱导滤纸层;
顶层诱导滤纸层的制备:于超净工作台中采用孔径为0.22μm的滤膜对植物激素进行过滤除菌后等体积混合在一无菌小烧杯中,得混合植物激素3,所述混合植物激素3中含有0.8mg/l2,4-d和0.5mg/l6-ba,将4片步骤s11灭菌后的滤纸片叠放在一起,在植物激素3中浸泡20s,得顶层诱导滤纸层,用于对愈伤组织进行诱导;
s13、配制培养基:准确称取ms固体粉末溶于水,添加蔗糖和琼脂,调节ph=5.8,121℃、0.1mpa高温灭菌25min后保温防止凝固,配制成蔗糖的浓度为30g/l,琼脂含量为8g/l的ms琼脂培养基;
s14、制备组合培养基:将步骤s12所得第1层滤纸层平铺于步骤s11所述培养瓶底部,在第1层滤纸层上倒入步骤s13制备的培养基,凝固后形成厚度为0.5cm左右的第1层固体层;将步骤s12所得第2滤纸层平铺于第1层固体层上,在第2层滤纸层上倒入步骤s13制备的培养基,凝固后形成厚度为0.5cm左右的第2层固体层;将步骤s12所得第3滤纸层平铺于第2层固体层上,在第3层滤纸层上倒入步骤s13制备的培养基,凝固后形成厚度为0.5cm左右的第3层固体层;将步骤s12所得顶层滤纸层平铺于第3层固体层上,得组合培养基;所述组合培养基从下到上分别为:第1层滤纸层、第1层固体层、第2层滤纸层、第2层固体层、第3层滤纸层、第3层固体层和顶层滤纸层。
以上所述,仅为本发明较佳的具体实施方式,但本发明的保护范围并不局限于此,任何熟悉本技术领域的技术人员在本发明披露的技术范围内,根据本发明的技术方案及其发明构思加以等同替换或改变,都应涵盖在本发明的保护范围之内。
- 还没有人留言评论。精彩留言会获得点赞!