一种糖尿病小鼠结直肠肿瘤模型的构建方法与流程
本发明涉及动物模型构建技术领域,具体而言,涉及一种aom/dss在构建dm状态下的crc动物模型中的应用和dm小鼠crc模型的构建方法。
背景技术:
糖尿病(diabetesmellitus,以下简称dm)是一种多病因引起的慢性代谢紊乱性疾病,其主要特征为高血糖和不同程度的胰岛素缺乏和(或)抵抗,是全世界最主要的慢性非传染性疾病之一。国际糖尿病联盟调查研究显示,2017年世界dm患病人数为约4.249亿,中国dm患病人数为1.144亿,已居于世界首位,18岁及以上成年人dm患病率为11.6%,dm前期的患病率已达50.1%,带来了极大的疾病负担。
结直肠癌(colorectalcancer,以下简称crc)是最常见的消化道肿瘤之一。2015中国癌症统计数据显示,我国crc的发病率和致死率在全部恶性肿瘤中均位居第5位,并呈现逐年上升的趋势。45岁以上crc患者的死亡率为95.18%,整体表现为随着年龄增长而逐渐升高的趋势。癌症基因组图谱研究显示结肠癌和直肠癌从生物特性上是单一类型的癌症,其主要差异表现为解剖位置上的不同。
流行病学研究提示:dm,特别是2型糖尿病(type2diabetesmellitus,以下简称t2dm),是crc和肿瘤特异性死亡率的独立危险因素之一。对比非dm患者,t2dm患者的crc发病率增加约27%。然而,dm是如何促进crc发病的,其深层机制仍亟待探索研究;此外,由于绝大多数crc患者在发现时已属于中晚期,增大了crc发病机制、临床诊断、药物治疗等各方面研究的难度。因此,建立一种可靠性高、重复性好、符合人类dm状态下crc患病趋势的动物模型,具有十分重要的临床价值和理论意义。
目前,为了研究crc和dm,科学家们已建立了仅涉及crc的动物模型和仅涉及dm的动物模型,但是还没有一种dm状态下crc发生发展的动物模型。
因此,提供一种dm状态下crc发生发展的动物模型,成了业界需要解决的问题。
技术实现要素:
本发明的目的是提供一种用于研究dm状态下crc发生发展的动物模型,为研究dm和crc之间相互作用机制、药物治疗、临床诊治靶点等奠定基础。
为了实现上述目的,本发明提供了一种糖尿病小鼠结直肠肿瘤模型的构建方法,其包括如下步骤:
a、分组:将2型糖尿病小鼠分为两组,分别为糖尿病实验组和糖尿病对照组;将同窝野生型小鼠分为两组,分别为野生实验组和野生对照组;
b、建模:第1周至第6周,对实验组小鼠以氧化偶氮甲烷(azoxymethane,以下简称aom)联合葡聚糖硫酸钠(dextransulfatesodium,以下简称dss)建模;
c、处死:每组分别在实验的第7周、第9周随机处死部分小鼠,于第11周处死余下所有小鼠;
d、标本采集。
现有技术中,有使用aom建立ob/ob小鼠结肠癌模型,但是aom/dss联合使用未被使用过。(参考文献doi:10.1136/gut.2010.235754)
结肠癌的主要病理类型为结肠腺癌,人类大部分结肠腺癌呈现“早期癌前病变的异常隐窝灶(aberrantcryptfoci,acf)—腺瘤—腺癌”的发展规律。在结肠癌研究中,使用aom这一致癌剂已成为啮齿类动物结肠癌化学诱导建模的主要方法之一。但不同研究使用aom的药物浓度及药物暴露时间不一,aom对小鼠结肠肿瘤的诱导效果结论不一。而在aom基础上联合使用dss这一促炎剂,在减少建模时间的同时可提高成瘤数量及体积。因此aom/dss这一诱导crc的方法被广泛使用。
现有技术中,仅使用aom的原因可能为:该研究团队的实验中可以通过单独使用aom形成肿瘤,尽管所需时间较长,aom使用剂量较大,成瘤率也较小,但是减少使用dss这一种药,也就是减少一个对实验结果可能的影响因素,便于增加实验的可操控性,所以其研究团队仅使用aom诱导crc形成。
而在本发明的方法中,实验目的是研究crc的发生及发展的机制,故不仅需要稳定成瘤,还需保持一定的、较高的成瘤率,综合考虑建模时长、成瘤稳定性、成瘤效率、肿瘤形成的体积数量大小、实验成本等多方面因素,选择使用aom/dss建模。
根据本发明另一具体实施方式,小鼠年龄为5-8周龄;注射方式为颈背部皮下注射或者腹腔注射。
根据本发明另一具体实施方式,aom的注射浓度为8mg/kg-20mg/kg;aom的注射次数为1-6次,每周1次。
根据本发明另一具体实施方式,dss的溶液浓度为1.5%-5%;dss的循环次数为1-3次,优选为2次。
根据本发明另一具体实施方式,步骤b中,对实验组小鼠以10mg/kgaom联合2循环2%dss建模。绝大多数科学家使用aom/dss建模中,使用3个循环周期的dss。发明人经实验发现,2循环的dss即可满足本发明实验需要。(参考文献doi:10.3969/j.issn.0253-9802.2018.10.006)
根据本发明另一具体实施方式,步骤b中,实验组小鼠于第1周颈背部皮下注射10mg/kgaom,第2周予2%dss自由足量饮用,第3周恢复普通饮水,第5周予第2次2%dss自由足量饮用,第6周恢复普通饮水。
根据本发明另一具体实施方式,步骤b中,对照组小鼠于第1周颈背部皮下注射0.1g/10g生理盐水(normalsaline,以下简称ns)。
根据本发明另一具体实施方式,每周一次,定时称取记录小鼠体重,并采血测量记录小鼠血糖;每日一次,观察并记录所有小鼠的身体机能,所述身体机能包括精神状态、活动度、进食饮水量、粪便性状、有无便血脱肛、死亡情况。
根据本发明另一具体实施方式,步骤c中,处死小鼠的方法为戊巴比妥钠麻醉后颈椎脱臼处死。
根据本发明另一具体实施方式,步骤d具体包括如下步骤:
d1、沿腹中线打开腹腔,分离并剪取自回盲瓣至直肠的肠段;
d2、冰上操作,予预冷的4℃pbs清洗肠腔,沿长轴剪开肠道,仔细观察并触摸肠腔有无肿瘤形成;
d3、观察测量并记录每条肠道的肿瘤数量,每个肿瘤的最长径和垂直短径、肿瘤的形成部位;
d4、分别切去每个肿瘤及其癌旁组织和该肠道的正常组织,4%多聚甲醛固定,石蜡包埋并制备组织切片,h&e染色后于光学显微镜下观察。
与现有技术相比,本发明具备如下有益效果:
1、通过本发明的方法得到的小鼠crc模型具有“先慢后快”的成瘤趋势,亟待进一步研究解释。该结论可能提示:在crc发病过程中,存在某个(些)分子和信号通路的变化,影响肿瘤的形成,并可能在肿瘤形成初期起抑癌作用,肿瘤形成后期起促癌作用。对该分子和信号通路的后续深入研究将会对dm状态下crc的早期预防、早期发现和早期治疗起着重要的作用。
2、通过本发明的方法得到的小鼠crc主要位于直肠、结肠肝曲、结肠脾曲,与人类结直肠癌好发部位有一定的吻合,具有较好的代表性及研究价值。
3、绝大多数crc患者在发现时已属于中晚期,增大了对crc发病机制、临床诊断、药物治疗等各方面研究的难度,也降低了患者的生存质量、增加了家庭、社会、国家的医疗负担。因此,本发明的模型弥补了crc发病早期的研究可能,具有重要的临床价值、科研价值和理论意义。
简言之,本发明提供的方法在成瘤率稳定的情况下,死亡率低。可动态研究dm状态下crc的发生发展,建模简单易行,科研、经济应用价值高。
附图说明
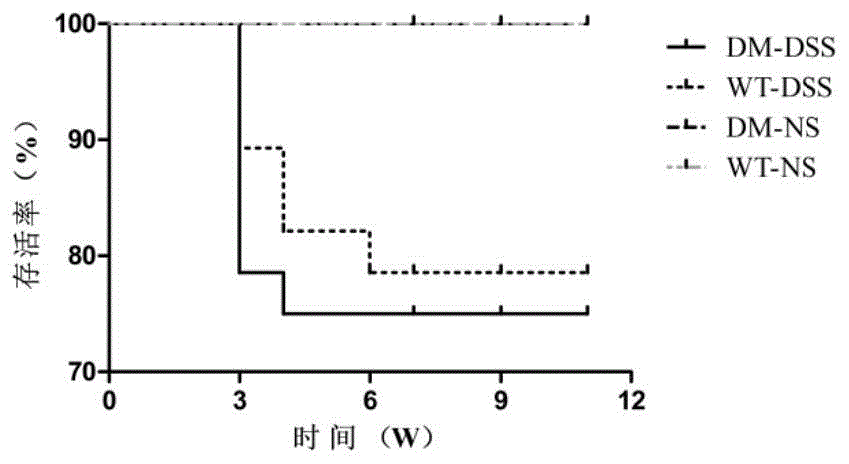
图1是实施例1中,四组小鼠的生存曲线;
图2是实施例1中,正常与成瘤结肠大体图像;
图3是实施例1中,正常结肠组织和肿瘤组织的h&e染色;
图4是实施例1中,肿瘤体积直方图(*:p<0.05);
图5是实施例1中,糖尿病实验组和野生型实验组的成瘤率;
图6是实施例1中,糖尿病实验组和野生型实验组的荷瘤小鼠平均成瘤数量。
具体实施方式
实施例1
一、实验动物
spf级bks-leprem2cd479/nju(db/db)小鼠,雄性,7周龄,48只,重量(35±5)g;spf级同窝野生型c57bl/6(-/-,wt)小鼠,雄性,7周龄,48只,重量(22±2)g。均购买于南京大学-南京生物医药研究院,饲养于中山大学实验动物中心东校园。饲养条件为spf级,环境温度为(23±3)℃,环境相对湿度为(55±10)%,昼夜交替时间为12h/12h。实验过程中予小鼠足量普通饲料,自由饮水进食。db/db小鼠每2-3天更换一次垫料,wt小鼠每5天更换一次垫料。所有动物实验均在中山大学实验动物伦理委员会的监督指导下完成,符合实验动物伦理学要求。
另外,实验动物可以有其它选择,例如2型糖尿病小鼠模型:ob/ob小鼠、kk-ay小鼠,或予普通小鼠高脂饮食诱导等。1型糖尿病小鼠模型:注射化学药物(如链霉素streptozocin、四氧嘧啶alloxan等)诱导。小鼠品系多样化,可用如c57bl/6j、balb/c等不同品系的小鼠建模,或使用基因工程小鼠模型(基因敲除、敲低或敲入、过表达等)。此外还有其他糖尿病动物模型,如zucker大鼠等。
二、实验药物
氧化偶氮甲烷azoxymethane(sigma-aldrich,美国)
葡聚糖硫酸钠dextransulfatesodium(mpbiomedicals,美国)
三、建模方法
a、分组
所有小鼠适应性饲养一周,正常自由饮食。将2型糖尿病(db/db)小鼠随机分为2组,分别为糖尿病实验组(dm-dss组,28只)和糖尿病对照组(dm-ns组,18只);将同窝野生型小鼠(wt小鼠)随机分为2组,分别为野生型实验组(wt-dss组,28只)和野生型对照组(wt-ns组,18只)。
b、建模(小鼠crc模型的诱导方法)
aom联合dss(10mg/kgaom联合2循环2%dss)造模。具体方法为实验组小鼠于第1周颈背部皮下注射10mg/kgaom,第2周予2%dss自由足量饮用,第3周恢复普通饮水。第5周予第2次2%dss自由足量饮用,第6周恢复普通饮水。对照组小鼠于第1周颈背部皮下注射0.1g/10gns。
每周一次定时称取记录小鼠体重,并采血测量记录小鼠血糖。每日一次,观察并记录所有小鼠精神状态、活动度、进食饮水量、粪便性状、有无便血脱肛、死亡情况等。
c、处死
每组分别在实验的第7周、第9周随机处死6只小鼠,于第11周处死余下所有小鼠,处死小鼠的方法为戊巴比妥钠麻醉后颈椎脱臼处死。
d、标本采集,具体包括如下步骤:
d1、沿腹中线打开腹腔,分离并剪取自回盲瓣至直肠的肠段;
d2、冰上操作,予预冷的4℃pbs清洗肠腔,沿长轴剪开肠道,仔细观察并触摸肠腔有无肿瘤形成;
d3、观察测量并记录每条肠道的肿瘤数量,每个肿瘤的最长径和垂直短径、肿瘤的形成部位;
d4、分别切去每个肿瘤及其癌旁组织和该肠道的正常组织,4%多聚甲醛固定,石蜡包埋并制备组织切片,h&e染色后于光学显微镜下观察。依照下列公式计算肿瘤体积、肿瘤发生率、平均成瘤数量和荷瘤小鼠平均成瘤数量:
肿瘤体积=(最长径×垂直短径2)/2
肿瘤发生率(%)=荷瘤小鼠数量/实验小鼠数量×100%
平均成瘤数量=肿瘤数量/实验小鼠数量
荷瘤小鼠平均成瘤数量=肿瘤数量/荷瘤小鼠数量
图1是四组小鼠的生存曲线;由图1可知,dm-dss组共有7只小鼠死亡,分别于第3周、第4周各死亡6只、1只;wt-dss组共有6只小鼠死亡,分别于第3周、第4周、第6周各死亡3只、2只、1只;dm-ns组和wt-ns组均未见小鼠死亡。dm-dss组与wt-dss组的生存率无统计学差异(p=0.716);但dm-dss组与dm-ns组和wt-dss组与wt-ns组的生存率具有统计学差异。(p=0.023和p=0.036)。
图2是正常与成瘤结肠大体图像;其中a:正常结肠大体照片,可见肠道黏膜光滑。b:成瘤结肠大体照片,可见肠道表面凹凸不平,有多个外生性肿物形成,伴出血糜烂。肿物间的肠道粘膜光滑,未见明显异常。
图3是正常结肠组织和肿瘤组织的h&e染色;其中a:正常结肠组织可分为黏膜层、黏膜下层、固有肌层、浆膜层。结肠腺体呈管状,可见大量空泡状的杯状细胞(40×)。b,c,d:结肠肿瘤组织主要为腺瘤和(或)原位癌(高级别上皮内瘤变)。肿瘤腺体拥挤紊乱,部分腺体呈不规则形,腺体细胞大小不一,细胞核大深染,核型不规则,并可见病理性核分裂像。肿瘤边界清,未侵及黏膜肌层(40×,100×,200×)。
图4是肿瘤体积直方图(*:p<0.05);由图4可知,在第9周,dm-dss组与wt-dss组相比,其平均肿瘤体积显著较小(p=0.043),但在第7周和第11周,则无显著性差异(p=0.677和p=0.196)。随着实验时间的增加,dm-dss组的平均肿瘤体积有显著性差异(p=0.043),其中在第11周的平均肿瘤体积较w9显著增加(p=0.013);而wt-dss组的平均肿瘤体积随时间的增加,差异无统计学意义(p=0.615)。这说明,dm状态下crc的形成具有“先慢后快”的特点,表现为肿瘤体积在第9周显著低于wt小鼠,但在第11周已追平,肿瘤体积无统计学差异。
图5是糖尿病实验组和野生实验组的成瘤率;由图5可知,在第9周,所有小鼠均形成或多或少的crc,提示本方法构建的小鼠crc模型有着稳定的成瘤情况,且可缩短实验时间,有着一定的科研实践价值。
图6是糖尿病实验组和野生实验组的荷瘤小鼠平均成瘤数量;由图6可知,dm小鼠的荷瘤小鼠平均成瘤数量随着时间的增加显著增加(p<0.05)。wt小鼠的荷瘤小鼠平均成瘤数量不因时间的变化而变化(p>0.05)。第11周,dm小鼠比wt小鼠的荷瘤小鼠平均成瘤数量显著增加(p<0.05)。
由于dss有诱导结肠炎的左右,在实验中可能导致小鼠腹泻、便血、脱肛,水电解质失衡,甚至死亡,因而dm和wt小鼠实验组和对照组间有显著的生存率差别。由于dm状态下小鼠对实验干预的耐受能力相对较差,既往大多数实验的dm小鼠会比wt小鼠死亡率高15%-20%。但在本实施例中,dm-dss组与wt-dss组间小鼠的生存率无统计学差异,说明本实施例的建模方法可减少实验动物的死亡,更符合动物伦理学的规范要求,同时可减少实验经济成本,具有实践价值。
虽然本发明结合优选实施例进行了公开,但这些实施例并非用以限定本发明实施的范围。任何本领域的普通技术人员,在不脱离本发明的发明范围内,当可作适当改进,即凡是依照本发明所做的任何等同替换,均在本发明的保护范围内。
- 还没有人留言评论。精彩留言会获得点赞!