一种结合透明带削薄的小鼠胚胎抗应激冻存和解冻方法与流程
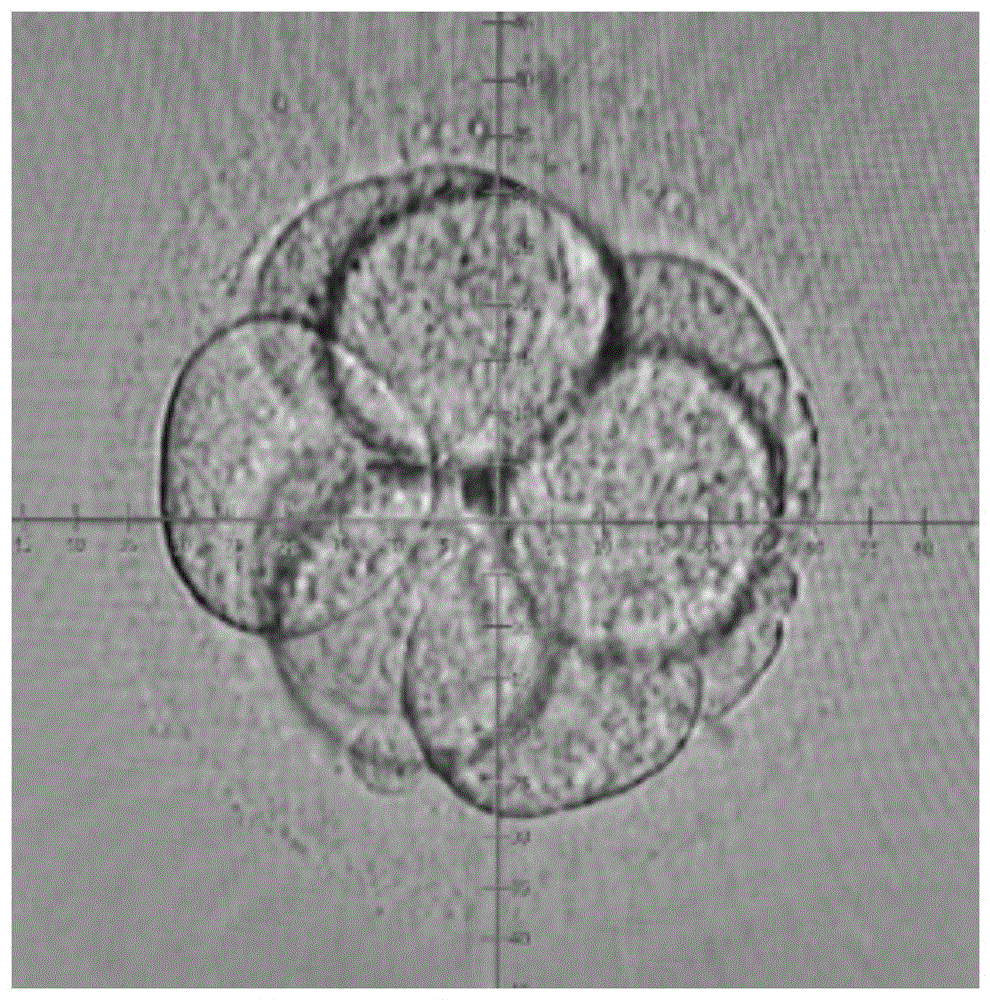
本发明涉及胚胎保存技术领域,具体涉及一种结合透明带削薄的小鼠胚胎抗应激冻存和解冻方法。
背景技术:
胚胎冷冻保存技术是胚胎移植的关键技术之一,它解决了胚胎移植受时间和地点的限制,使胚胎移植的优越性得以最大发挥。目前小鼠胚胎冷冻主要有慢速冷冻和玻璃化冷冻,但以上两种方法均存在一定缺陷。慢速冷冻体需要昂贵的程序化冷冻仪,且胚胎体外平衡操作时间长,冷冻操作复杂,导致胚胎体外停留时间长,对胚胎产生不良的应激,此外这种方法复苏率在70%-80%,复苏率偏低。玻璃化冷冻采用高浓度的冷冻保护剂,胚胎冷冻时间有所缩短,冷冻复苏率也较高,但存在高浓度冷冻保护剂对胚胎体外操作的毒性和应激损伤。因此,需要进一步改变体外胚胎冷冻操作时间及体外操作环境的应激因素对胚胎后续发育的影响,达到既提高冷冻保存效果,又不影响其进一步发育潜能的冷冻方法。
技术实现要素:
本发明的目的是为了解决现有技术存在的上述问题,提供一种结合透明带削薄的小鼠胚胎抗应激冻存和解冻方法,本发明通过对透明带进行削薄,配合自制的抗应激冷冻液的使用,能显著提高胚胎冷冻复苏率,保护冷冻胚胎的发育潜能及降低妊娠后的流产率。
为了达到上述目的,本发明的技术方案如下:
一种结合透明带削薄的小鼠胚胎抗应激冻存方法,包括如下步骤:
(1)抗应激冷冻液的配置:所述抗应激冷冻液包括冷冻平衡液和冷冻液;
所述冷冻平衡液采用htf为基础液,添加体积百分比为7-8%的eg,体积百分比为7-8%的dmso,体积百分比为11-13%的hsa,150-250um/l维生素c和90-100um/l维生素e;
所述冷冻液采用htf为基础液,添加体积百分比为12-16%的eg,体积百分比为13-16%的dmso,0.5m蔗糖,体积百分比为10-15%的hsa,150-250um/l维生素c和90-100um/l维生素e;
(2)胚胎透明带的削薄:小鼠体内受精后第三天卵裂期进行胚胎透明带削薄,取第三天6-10细胞期的胚胎,将胚胎用标尺标注并平均划分为四个区域,将其中一个区域的透明带用激光破膜仪在透明带中部将其削薄,总的削薄区域占胚胎的四分之一,其中激光脉冲宽度0.200ms,孔径2-3um,采用连续激光进行削薄,分三次将透明带削薄四分之一,每次削薄时要调节脉冲轨迹使其与透明带的弧度相吻合,每次连续进行6个脉冲激光削薄,最后在削薄区域的两端将透明带切断;
(3)将削薄的胚胎放入冷冻平衡液中平衡,待胚胎恢复至原体积75-85%,将其转入到冷冻液中在不同液滴间清洗转移,并控制在1分钟之内将胚胎放入到载杆上,迅速浸入到液氮中。
作为优选,步骤(1)中,所述冷冻平衡液采用htf为基础液,添加体积百分比为7.5%的eg,体积百分比为7.5%的dmso,体积百分比为12%的hsa,200um/l维生素c和100um/l维生素e;
所述冷冻液采用htf为基础液,添加体积百分比为15%的eg,体积百分比为15%的dmso,0.5m蔗糖,体积百分比为12%的hsa,200um/l维生素c和100um/l维生素e。
进一步的,步骤(3)的具体操作步骤如下:
s1、将胚胎放入到第一个冷冻平衡液液滴表面,让其自由下落到液滴底部,在第一个冷冻平衡液液滴中总计停留2min;然后将胚胎转移到第二个冷冻平衡液液滴底部并吹洗3次,在第二个冷冻平衡液液滴中停留1min;再将胚胎转移到第三个冷冻平衡液液滴底部并吹洗3次后,观察胚胎卵裂球情况;
s2、待胚胎恢复至原体积80%时,将胚胎转移到冷冻液液滴中,将胚胎吸取到第一个冷冻液液滴底部,让其飘到液面上部,然后迅速将其转移到第二个冷冻液液滴底部吹洗3次,再次转移到第三个冷冻液液滴底部吹洗3次后,将胚胎迅速转移到载杆上,放入液氮中冷冻保存。
进一步的,步骤s2中,所述胚胎在冷冻液中停留时间控制在60s内。
本发明还提供上述冻存后的小鼠胚胎的解冻方法,包括如下步骤:取上述冻存后的小鼠胚胎,将带胚胎的载杆迅速插入到预热37℃的ts1液中平衡1min后,将胚胎转移到ts2液中平衡3min,再将胚胎转移到ts3液中平衡5min,最后在ws液中平衡5min,转移到培养基中放入培养箱,培养2小时后对胚胎存活情况进行评估,然后继续对存活的胚胎培养至囊胚期至囊胚孵化;
所述ts1液、ts2液、ts3液、ws液均以htf为基础液进行配置,其中ts1液添加1m蔗糖,200um/l维生素c和体积百分比为12%的hsa;ts2液添加0.5m蔗糖,200um/l维生素c和体积百分比为12%的hsa;ts3液添加0.25m蔗糖,200um/l维生素c和体积百分比为12%的hsa;ws液添加200um/l维生素c和体积百分比为12%的hsa。
进一步的,所述小鼠胚胎具体的解冻操作步骤如下:
a、将带有胚胎的载杆末端插入到预热37℃的ts1液中,用吸管将胚胎与载杆脱离并在ts1液中停留1min;
b、将带有ts1液的胚胎加入到第一个ts2液滴表面让其自由落下,并停留1min,随后将胚胎转入到第二个ts2液滴底部并吹吸3次停留1min,然后将胚胎转入到第三个ts2液滴底部吹吸3次并停留1min;
c、将带有ts2液的胚胎转移到第一个ts3液滴表面,让胚胎自由落下并在液滴中停留1min,随后将胚胎转入到第二个ts3液滴底部并吹吸3次停留2min,然后再将胚胎转入到第三个ts3液滴底部吹吸3次并停留2min;
d、将胚胎转移到第一个ws液滴底部吹吸3次,再将胚胎转移到第二个ws液滴中停留2min,然后转移到第三个ws液滴底部吹吸3次并停留3min,最后转入囊胚培养基中继续培养。
本发明在冻存和冷冻步骤中均采用了胚胎在不同液滴间清洗转移的方法进行操作,进行液滴之间转移主要为了保持稳定,使平衡和冷冻液的环境更适宜小鼠胚胎的冻存和解冻,确保解冻后的胚胎的发育潜能能保持较好状态。
有益效果:
本发明通过对透明带进行削薄,可以使冷冻保护剂快速的进入胚胎内进行平衡,缩短胚胎冷冻平衡时间,减少环境不利影响,同时削薄的透明带有利于胚胎复苏后的孵化,提高胚胎着床及妊娠率;通过改进冷冻液配方,加入维生素e和维生素c,可有效防止体外操作产生的活性氧的损伤,保护冷冻胚胎的发育潜能及降低妊娠后的流产率。
附图说明
图1为标尺标注及区域划分的胚胎图;
图2为从一个区域透明带中间开始进行激光削薄的胚胎图;
图3为透明带1/4区域削薄的胚胎图;
图4为削薄区域两端透明带切断的胚胎图。
具体实施方式
下面结合附图及具体的实施例对本发明作进一步说明。
实施例1
一种结合透明带削薄的小鼠胚胎抗应激冻存方法,包括如下步骤:
(1)抗应激冷冻液的配置:所述抗应激冷冻液包括冷冻平衡液和冷冻液;
所述冷冻平衡液采用htf为基础液,添加体积百分比为7.5%的eg,体积百分比为7.5%的dmso,体积百分比为12%的hsa,200um/l维生素c和100um/l维生素e;
所述冷冻液采用htf为基础液,添加体积百分比为15%的eg,体积百分比为15%的dmso,0.5m蔗糖,体积百分比为12%的hsa,200um/l维生素c和100um/l维生素e。
(2)胚胎透明带的削薄:
小鼠受精后第三天冷冻胚胎获取:
①实验材料:4-6周icr雌鼠,12周左右的雄鼠;
②小鼠超排卵与合笼:
a、第一天下午23:00给雌鼠注射pmsg10iu(0.1ml);
b、第三天下午23:00给以上雌鼠注射hcg10iu(0.1ml),并与雄鼠合笼交配;
c、第四天上午9:00检测雌鼠阴道栓,以确定是否交配成功。
③细胞期鼠胚收集及冷冻胚胎获得:
注射hcg40小时后取2细胞鼠胚。在鼠腹部皮肤局部用75%酒精喷涂消毒,从腹部下侧呈“v”字型剪开皮肤,剪开腹膜,在腹膜两侧找到子宫和卵巢,剪下子宫角及和卵巢之间的输卵管放入盛有mhtf的培养皿中,用胚胎获取装置插入到输卵管伞部,将2细胞胚胎冲洗出来,然后将胚胎迅速收集入洗涤培养皿中,洗涤后移入培养皿中,置co2培养箱中继续培养至第三天,选择6-10细胞期胚胎进行冷冻操作。
小鼠体内受精后第三天卵裂期进行胚胎透明带削薄:
取第三天6-10细胞期的胚胎,如图1所示,将胚胎用标尺标注并平均划分为四个区域,如图2-3所示,将其中一个区域的透明带用激光破膜仪在透明带中部将其削薄,总的削薄区域占胚胎的四分之一,其中激光脉冲宽度0.200ms,孔径2-3um,采用连续激光进行削薄,分三次将透明带削薄四分之一,每次削薄时要调节脉冲轨迹使其与透明带的弧度相吻合,每次连续进行6个脉冲激光削薄,如图4所示,最后在削薄区域的两端将透明带切断。
(3)将削薄的胚胎放入冷冻平衡液中平衡,待胚胎恢复至原体积80%,将其转入到冷冻液中在不同液滴间清洗转移,并控制在1分钟之内将胚胎放入到载杆上,迅速浸入到液氮中。具体操作步骤如下:
s1、将削薄的胚胎放入到第一个冷冻平衡液液滴表面,让其自由下落到液滴底部,在第一个冷冻平衡液液滴中总计停留2min;然后将胚胎转移到第二个冷冻平衡液液滴底部并吹洗3次,在第二个冷冻平衡液液滴中停留1min;再将胚胎转移到第三个冷冻平衡液液滴底部并吹洗3次后,观察胚胎卵裂球情况;
s2、待胚胎恢复至原体积80%时,将胚胎转移到冷冻液液滴中,将胚胎吸取到第一个冷冻液液滴底部,让其飘到液面上部,然后迅速将其转移到第二个冷冻液液滴底部吹洗3次,再次转移到第三个冷冻液液滴底部吹洗3次后,所述胚胎在冷冻液中停留时间控制在60s内,将胚胎迅速转移到载杆上,放入液氮中冷冻保存。
对上述冻存后的小鼠胚胎进行解冻,包括如下步骤:取上述冻存后的小鼠胚胎,将带胚胎的载杆迅速插入到预热37℃的ts1液中平衡1min后,将胚胎转移到ts2液中平衡3min,再将胚胎转移到ts3液中平衡5min,最后在ws液中平衡5min,转移到培养基中放入培养箱,培养2小时后对胚胎存活情况进行评估,然后继续对存活的胚胎培养至囊胚期至囊胚孵化;具体的解冻操作步骤如下:
a、将带有胚胎的载杆末端插入到预热37℃的ts1液中,用吸管将胚胎与载杆脱离并在ts1液中停留1min;
b、将带有ts1液的胚胎加入到第一个ts2液滴表面让其自由落下,并停留1min,随后将胚胎转入到第二个ts2液滴底部并吹吸3次停留1min,然后将胚胎转入到第三个ts2液滴底部吹吸3次并停留1min;
c、将带有ts2液的胚胎转移到第一个ts3液滴表面,让胚胎自由落下并在液滴中停留1min,随后将胚胎转入到第二个ts3液滴底部并吹吸3次停留2min,然后再将胚胎转入到第三个ts3液滴底部吹吸3次并停留2min;
d、将胚胎转移到第一个ws液滴底部吹吸3次,再将胚胎转移到第二个ws液滴中停留2min,然后转移到第三个ws液滴底部吹吸3次并停留3min,最后转入囊胚培养基中继续培养。
所述ts1液、ts2液、ts3液、ws液均以htf为基础液进行配置,其中ts1液添加1m蔗糖,200um/l维生素c和体积百分比为12%的hsa;ts2液添加0.5m蔗糖,200um/l维生素c和体积百分比为12%的hsa;ts3液添加0.25m蔗糖,200um/l维生素c和体积百分比为12%的hsa;ws液添加200um/l维生素c和体积百分比为12%的hsa。
实施例2
一种结合透明带削薄的小鼠胚胎抗应激冻存方法,包括如下步骤:
(1)抗应激冷冻液的配置:所述抗应激冷冻液包括冷冻平衡液和冷冻液;
所述冷冻平衡液采用htf为基础液,添加体积百分比为8%的eg,体积百分比为7%的dmso,体积百分比为11%的hsa,150um/l维生素c和100um/l维生素e;
所述冷冻液采用htf为基础液,添加体积百分比为16%的eg,体积百分比为13%的dmso,0.5m蔗糖,体积百分比为15%的hsa,150um/l维生素c和100um/l维生素e;
(2)胚胎透明带的削薄:同实施例1;
(3)将削薄的胚胎放入冷冻平衡液中平衡,待胚胎恢复至原体积85%,将其转入到冷冻液中在不同液滴间清洗转移,并控制在1分钟之内将胚胎放入到载杆上,迅速浸入到液氮中;具体操作同实施例1。
对上述冻存后的小鼠胚胎进行解冻,包括如下步骤:取上述冻存后的小鼠胚胎,将带胚胎的载杆迅速插入到预热37℃的ts1液中平衡1min后,将胚胎转移到ts2液中平衡3min,再将胚胎转移到ts3液中平衡5min,最后在ws液中平衡5min,转移到培养基中放入培养箱,培养2小时后对胚胎存活情况进行评估,然后继续对存活的胚胎培养至囊胚期至囊胚孵化;所述ts1液、ts2液、ts3液、ws液同实施例1。
实施例3
一种结合透明带削薄的小鼠胚胎抗应激冻存方法,包括如下步骤:
(1)抗应激冷冻液的配置:所述抗应激冷冻液包括冷冻平衡液和冷冻液;
所述冷冻平衡液采用htf为基础液,添加体积百分比为7%的eg,体积百分比为8%的dmso,体积百分比为13%的hsa,250um/l维生素c和90um/l维生素e;
所述冷冻液采用htf为基础液,添加体积百分比为12%的eg,体积百分比为16%的dmso,0.5m蔗糖,体积百分比为10%的hsa,250um/l维生素c和90um/l维生素e;
(2)胚胎透明带的削薄:同实施例1;
(3)将削薄的胚胎放入冷冻平衡液中平衡,待胚胎恢复至原体积75%,将其转入到冷冻液中在不同液滴间清洗转移,并控制在1分钟之内将胚胎放入到载杆上,迅速浸入到液氮中;具体操作同实施例1。
对上述冻存后的小鼠胚胎进行解冻,方法同实施例1。
为了验证本发明的效果,设置对比例进行对比,具体如下:
对比例1:使用传统的程序化冷冻即慢速冷冻,没有进行透明带削薄,冷冻液中也未添加维生素e和维生素c,解冻按常规方法;
对比例2:使用传统的玻璃化冷冻,没有进行透明带削薄,冷冻液中也未添加维生素e和维生素c,解冻按常规方法;
对比例3:与实施例1基本相同,不同之处在于:没有进行透明带削薄;
对比例4:与实施例1基本相同,不同之处在于:抗应激冷冻液中未添加维生素e和维生素c。
对以上四种冷冻方法以及实施例1的方法分别进行冷冻平衡时间,囊胚形成率,囊胚孵化率,解冻复苏率的统计及比较,具体见表1。
表1
表1中的指标说明:
冷冻平衡时间:体外平衡时间越长,即胚胎体外存放时间越长,冷冻液及环境的潜在有害物质对胚胎体外发育潜能影响越大。
解冻复苏率:是衡量冷冻效果的关键指标,复苏率低表明胚胎在冷冻时损伤退化较多,导致胚胎不能利用,即利用率低。
囊胚形成率:是衡量解冻胚胎继续发育能力的指标,冷冻的方法及冷冻液组成可对囊胚形成有潜在的影响。
囊胚孵化率:也是衡量解冻胚胎继续发育能力的指标,是囊胚进一步发育的结果,比囊胚形成率更能进一步反应冷冻方法,冷冻液及操作环境对胚胎最终发育潜能的影响。
对实施例1的削薄透明带抗应激冷冻方法与对比例1的程序化冷冻方法在解冻复苏率、囊胚形成率、囊胚孵化率上差异采用卡方检验,实施例1的削薄透明带抗应激冷冻方法与对比例1的程序化冷冻方法在解冻复苏率上(χ2=57.8,p<0.01)差异极显著,囊胚形成率上(χ2=59.96,p<0.01)差异极显著,囊胚孵化率上(χ2=9.4,p<0.01)差异极显著。在冷冻平衡时间上采用单因素方差分析(f=27741,p<0.01)差异极显著。本发明的削薄透明带抗应激冷冻方法在冷冻平衡时间、解冻复苏率、囊胚形成率、囊胚孵化率上显著的优于程序化冷冻方法。
对实施例1的削薄透明带抗应激冷冻方法与对比例2的玻璃化冷冻方法在解冻复苏率、囊胚形成率、囊胚孵化率上差异采用卡方检验,削薄透明带抗应激冷冻方法与玻璃化冷冻方法在解冻复苏率上(χ2=4.3,p<0.05)差异显著,囊胚形成率上(χ2=6.61,p<0.05)差异显著,囊胚孵化率上(χ2=5.1,p<0.05)差异显著。在冷冻平衡时间上采用单因素方差分析(f=153.9,p<0.01)差异极显著。本发明的削薄透明带抗应激冷冻方法在冷冻平衡时间、解冻复苏率、囊胚孵化率上优于玻璃化冷冻方法。
对实施例1的削薄透明带抗应激冷冻方法与对比例3在解冻复苏率、囊胚形成率、囊胚孵化率上差异采用卡方检验,削薄透明带抗应激冷冻方法对比例3在解冻复苏率上(χ2=4.02,p<0.05)差异显著,囊胚形成率上(χ2=0.15,p>0.05)差异不显著,囊胚孵化率上(χ2=5.30,p<0.05)差异显著。在冷冻平衡时间上采用单因素方差分析(f=149.36,p<0.01)差异极显著。实施例1的削薄透明带抗应激冷冻方法在冷冻平衡时间、解冻复苏率、囊胚孵化率上优于对比例3,说明本发明对透明带进行削薄,能够较大影响小鼠胚胎的冷冻、解冻效果以及胚胎的发育潜能。
对实施例1的削薄透明带抗应激冷冻方法与对比例4在解冻复苏率、囊胚形成率、囊胚孵化率上差异采用卡方检验,削薄透明带抗应激冷冻方法对比例4在解冻复苏率上(χ2=1.46,p>0.05)差异不显著,囊胚形成率上(χ2=4.08,p<0.05)差异显著,囊胚孵化率上(χ2=6.50,p<0.05)差异显著。在冷冻平衡时间上采用单因素方差分析(f=2.7,p>0.05)差异不显著。实施例1的削薄透明带抗应激冷冻方法在囊胚形成率、囊胚孵化率上优于对比例4,说明本发明对在冷冻液和解冻液中添加一定量的维生素e和维生素c,能够较大影响小鼠胚胎的冷冻、解冻效果以及胚胎的发育潜能。
虽然本发明已以较佳实施例揭示如上,然其并非用以限制本发明,任何本领域技术人员,在不脱离本发明的精神和范围内,当可做些许的修改和完善,因此本发明的保护范围当以权利要求书所界定的为准。
- 还没有人留言评论。精彩留言会获得点赞!