一种形成多花黄精多芽健壮发育根茎的繁育方法与流程
本发明涉及植物组织培养繁育技术,具体地说是指一种形成多花黄精多芽健壮发育根茎的繁育方法。
背景技术:
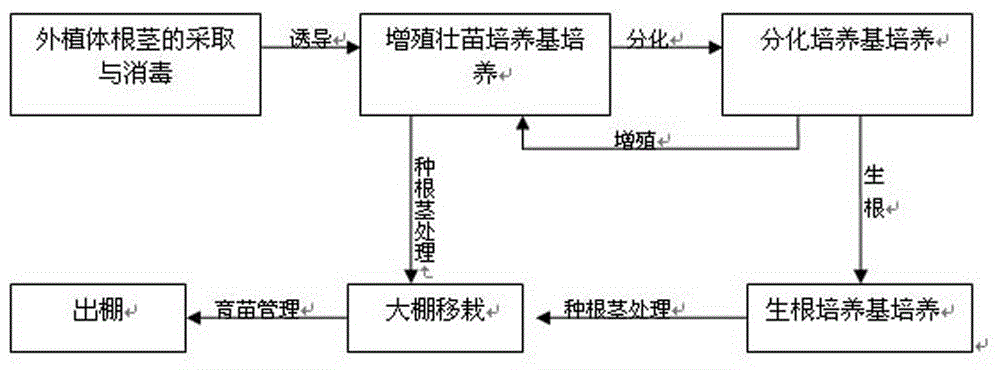
:黄精系百合科黄精属多年生药食兼用植物,药用历史有两千多年。黄精种类很多,中华人民共和国药典2005版规定黄精、滇黄精、多花黄精三个种的块茎为原生药,其中以多花黄精(polygonatumcyrtonemahua)品质最佳,主要含有糖类、甾体皂苷、黄酮及葸醌类化合物、生物碱、强心苷、木脂素、维生素和多种对人体有用的氨基酸及微量元素等,具有延长寿命抗衰老、影响心血管系统、调节免疫能力、抗炎抗病原微生物、抗疲劳、提高学习记忆力、抑制肿瘤细胞等作用,且安全无毒、无致突变性。随着人们对黄精药理、药化研究的逐步深入,黄精在临床应用、保健品、食品、化妆品及观赏方面等方面的应用越来越广泛。近年来,黄精的需求量与日俱增,野生资源已远不能满足生产需要,人工栽培是解决黄精药材短缺的主要渠道。黄精繁殖分无性繁殖(野生根茎)和有性繁殖(种子)进行繁殖,种子繁殖周期长,生产上极少利用,多以野生根茎进行栽培,此法繁殖系数低,易造成种质性状退化,影响着品种的遗传稳定性,加之野生资源有限,优质种苗问题成为黄精大面积栽种的瓶颈。另外多花黄精属于单芽发育优势型,一年只能形成一个根茎,种植3-4年后,栽种产量极低,很难满足市场需求。具体可参考说明书附图2为种植了10年以上多花黄精根茎的生长效果图,其为单芽发育型,栽种产量低。目前,有关多花黄精的组织培养和快速繁殖的很多报道都是基于芽体培养进行的,且都采用传统组培步骤:外植体的选取和消毒→诱导培养基培养→增殖培养基培养→壮苗培养基培养→生根培养基培养,此法组培周期至少半年以上。对于增殖培养基培养,徐忠传等2006是将诱导所得丛芽切成2-3株一丛(即2-3个芽体)后,接种于系列增殖培养基进行增殖的,培养基成分上,徐红梅等2003认为激素组合tdz1.5mg/l+2,4-d1.0mg/l对黄精根茎芽增殖最有利,徐忠传等2006认为激素组合6-ba4.0mg/l+naa0.2mg/l不仅能使芽快速增殖,且不定芽增殖的综合质量好,无畸形叶片产生。对于壮苗生根培养阶段,徐忠传等2006是将分化丛芽接种培养基ms+6-ba1.0mg/l+naa0.2mg/l,30d后将丛芽分开,取健壮单个根茎芽,再接种于ms+naao.5mg/l生根培养基上。总之,现有研究只局限于利用不同激素组合对芽体增殖和单个根茎芽生根的培养,所得到的种根茎小,后期种苗的生长速度慢,育苗周期至少2年,成本高,无法满足优质黄精种苗的规模化生产。试管苗移栽至大棚,多数种根茎当年不抽叶的,处于休眠的状态,要等过冬到次年才可以抽叶,使多花黄精的育苗周期加长。有关打破多花黄精芽体休眠的报道极少,只见张旺凡报道ga3不能打破芽体休眠,打破芽休眠以6-ba200ppm处理12h最佳,出苗率可达90%。6-ba浓度太高,处理时间过长,会导致多花黄精芽体徒长,叶片畸形,很快倒苗,根茎未能得到生长。因此找到适合的6-ba浓度和处理时间至关重要。技术实现要素:本发明提供了一种形成多花黄精多芽健壮发育根茎的繁育方法,其目的在于克服现有多花黄精的繁育方法不够理想,要么多花黄精种根茎小,后期种苗的生长速度慢,成本高,要么多花黄精芽体徒长,叶片畸形,根茎未能得到生长,无法满足优质黄精种苗的规模化生产等缺陷。为了解决上述技术问题,本发明的技术方案如下:一种形成多花黄精多芽健壮发育根茎的繁育方法,它包括以下步骤:a)外植体的选取及预处理:选取多花黄精地下根茎作为外植体;该外植体预处理包括依次对外植体进行清洗、切余料以及消毒,所述切余料为将外植体切去多余的根茎,剥去芽体上的苞片,保留中间的带芽根茎块。b)增殖壮苗培养:将消毒处理过的带芽根茎块用解剖刀削去芽顶,再将其接入增殖壮苗培养基上进行培养,直至块茎膨大、芽体粗壮以及块茎颜色变深得到一号根茎块;该增殖壮苗培养基为:ms+1.0mg/l6-ba+0.5mg/lnaa+糖90g/l,该增殖壮苗培养基的ph值控制在5.5-5.7。c)分化培养:将一号根茎块进行分切成体积均匀的一号单元根茎块(体积约1.0cm×1.0cm×0.5cm)接入分化培养基中培养,直至芽体伸长抽出叶子得到二号根茎块;该分化培养基为:ms+1.0mg/l6-ba+0.5mg/lnaa+0.2mg/liba+糖30g/l,该分化培养基的ph值控制在5.5-5.7;所述二号根茎块用解剖刀削去芽点,切成0.5cm×0.5cm的二号单元根茎块接入上述增殖壮苗培养基进行循环培养数代,即可得到大量的二号根茎块。d)生根培养:将二号根茎块进行分切成体积均匀的三号根茎块(体积约1.5cm×1.5cm),并且确保每块三号根茎块上至少有三个健壮芽以上根茎,将其转接到生根培养基培养直至得到多芽同时带有三个以上发育健壮带根苗的种根茎块,该生根培养基为:ms+1.0mg/l6-ba+0.5mg/lnaa+0.2mg/liba+活性炭0.5g/l+糖60g/l,该生根培养基的ph值控制在5.5-5.7。进一步地说,所述步骤d)之后还需要进行大棚移栽:将种根茎块栽种到装有基质(泥炭土:沙子=2:1)的育苗筛中进行,冬春季采用单层70%的遮阳网遮荫,每隔7天施用1次营养液;夏秋季采用双层70%的遮阳网遮荫,见土层表面发白时就要浇水,夏季一般一周间隔浇一次水和施一次肥。进一步地说,所述大棚移栽之前,还需要进行出苗时种根茎的处理;将种根茎块敞开培养瓶炼苗3天后取出,用自来水冲去琼脂,再用800倍液百菌灵浸泡15分钟后,再用50mg/l6-ba浸泡3小时。进一步地说,所述步骤a)中在当年的9-10月份选取栽种2-3年的多花黄精地下根茎作为外植体;所述带芽根茎块的体积约1.0cm×1.0cm×0.5cm。进一步地说,所述步骤b)中带芽根茎块接入增殖壮苗培养基中培养的时间控制在42-47天;所述步骤c)中一号单元根茎块接入分化培养基中培养的时间也控制在42-47天;所述步骤d)中三号根茎块接入生根培养基中培养的时间也控制在42-47天。一种形成多花黄精多芽健壮发育根茎的繁育方法,它包括以下步骤:a)外植体的选取及预处理:选取多花黄精地下根茎作为外植体;该外植体预处理包括依次对外植体进行清洗、切余料以及消毒,所述切余料为将外植体切去多余的根茎,剥去芽体上的苞片,保留中间的带芽根茎块。b)增殖壮苗培养:将消毒处理过的带芽根茎块用解剖刀削去芽顶,再将其接入增殖壮苗培养基上进行培养,块茎膨大直至长出根系得到一号根茎块;该增殖壮苗培养基为:ms+1.0mg/l6-ba+0.5mg/lnaa+糖90g/l,该增殖壮苗培养基的ph值控制在5.5-5.7;所述培养时间3个月以上得到的一号根茎块。c)出苗时种根茎的处理;将种根茎块敞开培养瓶炼苗3天后取出,用自来水冲去琼脂,再用800倍液百菌灵浸泡15分钟后,再用50mg/l6-ba浸泡3小时。d)大棚移栽:将种根茎块栽种到装有基质(泥炭土:沙子=2:1)的育苗筛中进行,冬春季采用单层70%的遮阳网遮荫,每隔7天施用1次营养液;夏秋季采用双层70%的遮阳网遮荫,见土层表面发白时就要浇水,夏季一般一周间隔浇一次水和施一次肥。由上述对本发明的描述可知,和现有技术相比,本发明的优点在于:本繁育方法设计理想,从种根茎培养和打破根茎芽体休眠上进行研究,培养出多芽同时发育的健壮根茎和芽体种植,品质好,生长速度快,当年就能抽叶的驯化苗,经一年大棚驯化栽培,既能达到生产用的种茎标准,不仅解决了优质种苗短缺的问题,缩短了育苗时间,还降低了成本,能实现成倍地增加其栽种产量。将二号单元根茎块接入上述增殖壮苗培养基进行循环培养数代,操作简单,省去分离单株的麻烦,可以在90天内得到多芽同时健壮发育的种根茎。附图说明图1为本发明繁育流程示意图。图2为种植了10年以上多花黄精根茎的生长效果图,其为单芽发育型,栽种产量低。图3为表1蔗糖浓度为20g/l的生长效果图,该根茎处于生长20天,叶片嫩黄细长。图4为表1蔗糖浓度为20g/l的生长效果图,该根茎处于生长30天,叶片发黄死去,根茎颜色发白,生命力弱。图5为表1蔗糖浓度为30g/l的生长效果图,该根茎处于生长30天,叶片黄绿细长。图6为表1蔗糖浓度为30g/l的生长效果图,该根茎处于生长45天,部分叶片发黄死去,根茎发白,生命力弱。图7为表1蔗糖浓度为30g/l的生长效果图,为增殖苗。图8为表1蔗糖浓度为30g/l的生长效果图,为生根苗。图9为表1蔗糖浓度为60g/l的生长效果图,该根茎处于生长45天增殖苗。图10为表1蔗糖浓度为60g/l的生长效果图,该根茎处于生长45天后多芽同时发育的带根苗,叶片纤细。图11为表1蔗糖浓度为90g/l的生长效果图,该根茎处于生长45天后只长根茎,不抽叶,根茎健壮的状态。图12为表1蔗糖浓度为90g/l的生长效果图,该根茎处于生长3个月以上的带根茎。图13为一号单元根茎块在分化培养基生长30天的生长效果图,多芽苗体健壮。图14为三号根茎块在生根培养基生长45天后的生长效果图,形成多芽同时健壮发育的带根苗,叶色浓绿,根茎大,芽体健壮。图15为本种根茎块(即试管苗)种植5年后的一块根茎。具体实施方式实施例一参考说明书附图1、图11、图12。一种形成多花黄精多芽健壮发育根茎的繁育方法,该繁育方法可快速形成多花黄精块茎多芽发育繁殖,它包括以下步骤:a)外植体的选取及预处理:选取当年的9-10月份选取栽种2-3年的多花黄精地下根茎作为外植体;该外植体预处理包括依次对外植体进行清洗、切余料以及消毒,具体地操作为:将多花黄精地下根茎(即外植体)用水刷洗干净,去掉叶片和根系,切去周围多余的根茎,剥去芽体上能剥掉的苞片,取中间的带芽根茎块,该带芽根茎块的体积约1.0cm×1.0cm×0.5cm;再将带芽根茎块用流动的自来水冲洗1-2小时,将其晾干;再将其置于超净工作台上用75%的酒精浸泡15s,无菌水冲洗2-4次后,再投入0.1%的升汞中,不停摇晃,持续8-10min后取出,再用无菌水冲洗5-8次,最后用无菌滤纸将无菌水吸干备用。b)增殖壮苗培养:将上述带芽根茎块用解剖刀削去芽顶,再将其接入增殖壮苗培养基上进行培养,10天后,根茎周围膨大,长出愈伤,后并陆续冒出芽点,块茎不断膨大直至长出根系得到一号根茎块,所述培养时间3个月以上得到的种根茎,每块种根茎上有3个以上发育健壮的带根苗;该增殖壮苗培养基为:ms+1.0mg/l6-ba+0.5mg/lnaa+糖90g/l,该增殖壮苗培养基的ph值控制在5.5-5.7(最佳ph值5.6);。该增殖壮苗培养基的特点:能有效的抑制带芽根茎块的抽叶,芽体休眠,不会抽叶,而且去除了顶端优势,营养集中供给根茎,因此根茎膨大速度快,块茎侧芽同时健壮膨大显著。c)出苗时种根茎的处理;敞开培养瓶炼苗3天后取出,用自来水冲去琼脂,再用800倍液百菌灵浸泡15分钟后,再用50mg/l6-ba(即细胞分裂素)浸泡3小时即可栽种;采用50mg/l6-ba以及将种根茎浸泡3h处理能有效的打破种根茎芽体休眠,诱导休眠芽生长,打破顶端优势,促进侧芽生长等生理作用。d)大棚移栽:将种根茎块栽种到装有基质(泥炭土:沙子=2:1)的育苗筛中进行,冬春季采用单层70%的遮阳网遮荫,每隔7天施用1次营养液;夏秋季采用双层70%的遮阳网遮荫,见土层表面发白时就要浇水,夏季一般一周间隔浇一次水和施一次肥;大棚移栽的基质和遮荫方式能适应多花黄精试管苗的生长发育。实施例二参考说明书附图1、图2-图11、图13-图15。一种形成多花黄精多芽健壮发育根茎的繁育方法,它包括以下步骤:a)外植体的选取及预处理:选取当年的9-10月份选取栽种2-3年的多花黄精地下根茎作为外植体;该外植体预处理包括依次对外植体进行清洗、切余料以及消毒,具体地操作为:将多花黄精地下根茎(即外植体)用水刷洗干净,去掉叶片和根系,切去周围多余的根茎,剥去芽体上能剥掉的苞片,取中间的带芽根茎块,该带芽根茎块的体积约1.0cm×1.0cm×0.5cm;再将带芽根茎块用流动的自来水冲洗1-2小时,将其晾干;再将其置于超净工作台上用75%的酒精浸泡15s,无菌水冲洗2-4次后,再投入0.1%的升汞中,不停摇晃,持续8-10min后取出,再用无菌水冲洗5-8次,最后用无菌滤纸将无菌水吸干备用;b)带芽根茎块诱导处理:利用匀强电场对带芽根茎块进行处理,具体地说,将带芽根茎块置于诱导容器中,然后通过高压静电发生器发出的100kv-300kv/m匀强电场(最佳200kv/m)对诱导容器内的带芽根茎块进行诱导处理,诱导处理时间控制在2-3分钟;研究表明:带芽根茎块在高压静电场中,诱导处理时间在2-3分钟内,随着处理时间的增加,带芽根茎块的发芽势、发芽率以及脱氢酶的活性提高显著,在处理时间为3分钟时处理效果达到最佳,而超过3分钟之后随着处理时间的继续增加,处理效果逐渐减弱。c)增殖壮苗培养:将诱导处理过的带芽根茎块用解剖刀削去芽顶,再将其接入增殖壮苗培养基上进行培养,10天后,根茎周围膨大,长出愈伤,后并陆续冒出芽点,直至块茎膨大、芽体粗壮以及块茎颜色变深得到一号根茎块;在增殖壮苗培养基上大概培养42-47天(最佳天数为45天);该增殖壮苗培养基为:ms+1.0mg/l6-ba+0.5mg/lnaa+糖90g/l,该增殖壮苗培养基的ph值控制在5.5-5.7(最佳ph值5.6);该增殖壮苗培养基的特点:能有效的抑制带芽根茎块的抽叶,芽体休眠,不会抽叶,而且去除了顶端优势,营养集中供给根茎,因此根茎膨大速度快,块茎侧芽同时健壮膨大显著。d)分化培养:将一号根茎块进行分切成体积均匀的一号单元根茎块(体积约1.0cm×1.0cm×0.5cm),再一号单元根茎块将接入分化培养基中培养,7天后芽块周围膨大,周围冒出许多芽体,直至芽体伸长抽出叶子得到二号根茎块;该分化培养基为:ms+1.0mg/l6-ba+0.5mg/lnaa+0.2mg/liba+糖30g/l,该分化培养基的ph值控制在5.5-5.7(最佳ph值5.6);所述二号根茎块用解剖刀削去芽点,切成0.5cm×0.5cm的二号单元根茎块接入上述增殖壮苗培养基进行循环培养数代,即可在短时间内得到大量的二号根茎块(即优质瓶苗)。该分化培养基的特点:根茎生长速度快,芽体得以伸长抽出叶子。e)生根培养:将二号根茎块进行分切成体积均匀的三号根茎块(体积约1.5cm×1.5cm),并且确保每块三号根茎块上至少有三个健壮芽以上根茎,将其转接到生根培养基培养直至得到多芽同时带有三个以上发育健壮带根苗的种根茎块,该生根培养基为:ms+1.0mg/l6-ba+0.5mg/lnaa+0.2mg/liba+活性炭0.5g/l+糖60g/l,该生根培养基的ph值控制在5.5-5.7(最佳ph值5.6)。该生根培养基的特点:能得到多芽同时健壮发育的带根苗,能实现成倍地增加其栽种产量。f)出苗时种根茎的处理;敞开培养瓶炼苗3天后取出,用自来水冲去琼脂,再用800倍液百菌灵浸泡15分钟后,再用50mg/l6-ba浸泡3小时即可栽种。采用50mg/l6-ba以及将种根茎浸泡3h处理能有效的打破种根茎芽体休眠,诱导休眠芽生长,打破顶端优势,促进侧芽生长等生理作用。g)大棚移栽:将种根茎块栽种到装有基质(泥炭土:沙子=2:1)的育苗筛中进行,冬春季采用单层70%的遮阳网遮荫,每隔7天施用1次营养液;夏秋季采用双层70%的遮阳网遮荫,见土层表面发白时就要浇水,夏季一般一周间隔浇一次水和施一次肥,大棚移栽的基质和遮荫方式能适应多花黄精试管苗的生长发育。上述增殖壮苗培养基、分化培养基和生根培养基中的糖均为蔗糖,并且其他成分均为ms+6-ba1.0mg·l-1+naa0.5mg·l-1+iba+agar5.0g·l-1。本申请人研究发现多花黄精增殖试管苗的根茎大小和质量是后期大田栽培的关键影响因子,试管苗芽体休眠延长了多花黄精的育苗时间,多花黄精的单芽发育是其栽种产量低的直接原因。因此在前人研究基础上,对如何快速大量形成多花黄精块茎多芽发育的繁育方法加以探讨,主要研究了培养基中蔗糖浓度对多花黄精种根茎的影响和6-ba浓度和处理时间对打破芽体休眠的影响。多糖作为组织培养中碳源的重要供应物,在组织培养中充当着提供能源和稳定渗透压的作用,其在培养基中的添加浓度尤为重要。备注:表1表示不同蔗糖浓度对多花黄精种根茎的影响蔗糖浓度(g/l)增殖系数(倍)抽叶率(%)生长情况20.002.3893.237d左右芽体生长,15d形成叶片,叶片嫩黄细长,30d后叶片发黄死去,根茎膨大,颜色发白,生命力弱。30.003.1080.130d左右芽体生长,20d形成叶片,叶片黄绿细长,45d后部分叶片发黄死去,根茎膨大,颜色发白,生命力弱。60.005.6943.78部分根茎15d左右芽体生长,30d形成叶片,叶片大、正常绿色,根茎膨大,45天后根茎颜色深,根茎明显膨大,营养充足,发出根系,植株健壮。部分根茎明显膨大,不长叶片,根茎健壮。90.004.380.00不抽叶片,根茎快速膨大,占满整个培养瓶,30d后根茎颜色深,芽体健壮,营养充足,培养时间久了可发出根系。备注:表2表示6-ba浓度和处理时间对打破芽体休眠的影响6-ba(mg/l)处理时间(h)抽叶率(%)生长情况200121003d后芽体统一伸长,徒长,叶片畸形,7d后倒苗,根茎死去。100121003d后芽体统一伸长,徒长,叶片畸形,7d后倒苗,根茎死去。50121003d后芽体统一伸长,徒长,叶片畸形,7d后倒苗,根茎死去。5061007d后芽体统一伸长,徒长,叶片畸形,15d后倒苗,根茎未生长,次年还可长出。50310010d后芽体统一伸长,植株正常浓绿,正常生长。2036310d后芽体陆续伸长,植株正常浓绿,正常生长。备注:表3表示多芽试管苗种植5年后产量和抽杆数品种观察棵数(棵)平均原始块茎重量(g)5年后平均抽芽数(个)5年后平均块茎重量(g)多芽试管苗301.283.8375.33野生单芽块茎3015.031150.15种子300.15150.23上述仅为本发明的具体实施方式,但本发明的设计构思并不局限于此,凡利用此构思对本发明进行非实质性的改动,均应属于侵犯本发明保护范围的行为。当前第1页12
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1