一种荷花组织培养的初代培养方法与流程
[0001]
本发明涉及农业生物技术中植物组织培养的方法,特别是涉及一种荷花组织 培养的初代培养方法
背景技术:
[0002]
荷花以其优美的姿态、丰富的花色深受我国人民喜爱,属我国的十大名花之 一,具有较高的观赏价值和经济价值。近年来,随着我国经济的持续快速发展, 人民生活水平不断提高,荷花碗莲、鲜切花产业日益兴盛,市场对荷花新品种的 需求量日益旺盛和多元化。
[0003]
传统荷花的育种方式是杂交育种,这种方式具有育种周期长工作量大、容易 发生生殖障碍引起胚胎败育等缺点。通过分子生物学技术结合组织培养技术的育 种方法,可以缩短育种年限,节约时间成本,是未来荷花育种发展的方向和趋势。
[0004]
另外,荷花的常规繁殖方式主要依赖种藕分生进行无性繁殖,这种繁殖方式 带来一系列问题,从淤泥里挖藕耗时耗力,同时长期的无性繁殖导致病毒的积累 和品种的退化。而茎尖组织培养的方法是尝试解决这一问题的有效途径, 不同消毒灭菌方式对莲茎尖诱导率也存在较大影响,不同的培养基类型对莲茎 尖诱导率也存在影响
[0005]
莲组培育苗困难,尤其以腋芽为外植体进行组织培养时,易发生外植体褐化、 污染率高、诱导率低、芽苗不生长、分生困难、生根不稳定等技术瓶颈,严重限 制了荷花分子育种方法的推广及应用,外植体的灭菌方式是困扰其组织培养困 难的技术瓶颈
[0006]
莲的组培再生体系建立极为困难,目前国内外有关莲通过愈伤组织实现再生培 养成功的报道尚鲜少见。利用莲顶芽或腋芽离体培养诱导再生的快繁技术,一直 是各研究机构的研发热点(李良俊,1998)。花莲作为观赏花卉,属莲的一大类, 在这方面的研究才刚刚起步。在花莲芽离体培养的前期研究中,由于莲地下茎长 期在泥土中生长,芽自身多带细菌,因此消毒极其困难,容易褐化,生理活性差, 花莲地下茎段芽离体组培效果不理想,最佳始芽的分化率仅为58.1%(李良俊, 1995)。确定事宜的消毒剂类型和消毒时间对于外植体灭菌尤为重要,在植物组 织培养中,升汞和次氯酸钠是目前比较常见的2种外植体消毒剂。大量的研究证 明,升汞作为一种重金属强消毒剂,在杀死外植体表面细菌的同时,通常也大大 降低了植株细胞的活性(李国树等2014)。次氯酸钠性质温和,但是单纯使用, 消毒效果不佳,污染率高;消毒液的混合使用可以有效的降低外植体的污染率(周 俊辉等2003),
[0007]
莲组培育苗困难,尤其以腋芽为外植体进行组织培养时,易发生外植体褐化、 污染率高、诱导率低、芽苗不生长、分生困难、生根不稳定等技术瓶颈,严重限 制了荷花分子育种方法的推广及应用。
技术实现要素:
[0008]
为了克服上述现有技术的不足,本发明提供了一种一种荷花组织培养的初代 培
养方法。用以解决现有技术中外植体褐化、污染率高、诱导率低、芽苗不生长 等问题。
[0009]
本发明所采用的技术方案是:1、一种荷花组织培养的初代培养方法,包括如下 步骤:
[0010]
s1:挑选顶芽及腋芽完好无损的发育良好的藕根,用解剖刀片沿着顶芽 基部,连根部将顶芽切下,作为外植体;
[0011]
s2:将切取的外植体浸泡在0.09-0.16%洗洁精水里1-2h,之后用小毛刷 在洗洁精水里轻刷干净,然放置在流动的自来水下冲洗1-2h,再置于超净工 作台下,用无菌水冲洗5-8次;
[0012]
s3:对外植体进行浸泡消毒处理:采用75%酒精消毒1-3min后,再用0.1% 次氯酸钠消毒10-20min,最后再在2%ppm中浸泡1-2h,再用无菌水冲洗5~6次, 用无菌滤纸去除表面多余水分;
[0013]
s4:利用解剖刀将顶芽叶鞘剥去,外植体长度约1cm,以直插式插入诱 导培养基上;
[0014]
s5:接种后放置在光照培养箱中进行培养,设置光照强度1000~4000lx, 每天光照12h,温度28℃。
[0015]
优选的,所述诱导培养基的成分为:ms培养基+30.0g/l蔗糖+0.4研究不 同细胞分裂素对顶芽诱导培养的影响,naa浓度0.1mg/l,kt浓度梯度为 3.0mg/l。
[0016]
优选的,所述s3中75%的酒精消毒1min,0.1%次氯酸钠消毒10min,2%ppm 中浸泡2h外植体消毒效果较佳。
[0017]
与现有技术相比,本发明的有益效果是:(1)可以有效降低荷花组织褐变率, 实现更高的成活率、生长速度和出芽数;
[0018]
(2)可以增加组培快繁体系的稳定性,节省人力物力。
附图说明
[0019]
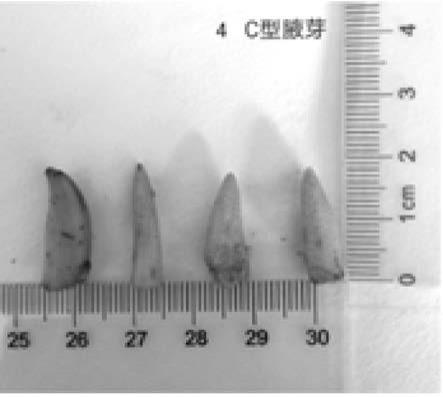
图1为本发明实施例中外植体c型腋芽;
[0020]
图2为本发明实施例中外植体a型顶芽
[0021]
图3为本发明实施例中外植体b型顶芽。
具体实施方式
[0022]
下面结合实施例对本发明进一步说明。
[0023]
实施例:
[0024]
本实施例所述材料均来源于苏州市农科院望亭荷花基地,自育品种“荷 塘情深”。
[0025]
s1:春季4月,荷花地下根状茎开始萌动,在荷花翻盆后,挑选顶芽及腋 芽完好无损的发育良好的藕根,在自来水下将淤泥冲洗干净,带回实验室处 理,用解剖刀片沿着顶芽基部,连根部将顶芽切下,作为外植体。
[0026]
s2:将切取的外植体浸泡在0.09%洗洁精水里1h,之后用小毛刷在洗洁 精水里轻刷干净,然放置在流动的自来水下冲洗1h,再置于超净工作台下, 用无菌水冲洗5次;
[0027]
s3:对外植体进行浸泡消毒处理:采用75%酒精消毒1min后,再用0.1% 次氯酸钠消毒10min,最后再在2%ppm中浸泡2h,再用无菌水冲洗5次,然后 用无菌滤纸去除表面多
余水分;
[0028]
s4:利用解剖刀将顶芽叶鞘剥去,外植体长度约1cm,以直插式插入诱 导培养基上;
[0029]
s5:接种后放置在光照培养箱中进行培养,设置光照强度1000~4000lx, 每天光照12h,温度28℃。
[0030]
优选的,所述诱导培养基的成分为:ms培养基+30.0g/l蔗糖+0.4研究不 同细胞分裂素对顶芽诱导培养的影响,naa浓度0.1mg/l,kt浓度梯度为 3.0mg/l。
[0031]
采用本发明的方案,通过以下对比数据进行如下2组实验
[0032]
表2.1不同灭菌方式的比较
[0033]
表2.1
[0034][0035]
结果分析:
[0036]
按照表1所设定的9种不同灭菌方法进行消毒和灭菌,培养30d后记录外植 体的消毒污染情况。从表中可以看出,不同的处理方法,顶芽污染率的差异显著。 0.1%次氯酸钠消毒5min,污染率最高达到98.9%a。随着次氯酸钠消毒时间的延 长,消毒时间10min的时候,污染率仅仅降低了2.23%,当时间延长至15min时, 污染率下降了15.57%;升汞消毒5min,污染率为93.7a,随着升汞消毒时间的 增加,从5min到15min,污染率仅仅下降了12.6%;当采用传统表面消毒剂结 合生物消毒剂(ppm)的方法时(方法7),对比不用ppm浸泡的方式,污染率下 降了56.67%。当使用浓度更高的ppm浸泡,2%的ppm浸泡1h,污染率是31.3%d, 2%的ppm浸泡2h,污染率下降到27.77%d。因此,莲外植体消毒,效果最好的消 毒方式是先用75%酒精消毒1min后,再用0.1%次氯酸钠处理10min,最后再在 2%ppm中浸泡2h。
[0037]
2、不同外植体的污染、存活死亡对比
[0038]
根据不同的解剖方式,将外植体分为a型、b型及c型,其中:a型顶芽为将顶 芽外面包裹的叶鞘及几层未展开叶芽全部除掉,只剩下顶芽生长锥,外植体长度 约1cm左右,;b型顶芽为只剥去顶芽外层叶鞘,保留顶芽生长锥和未展开叶芽, 长度约1~2cm左右;c型腋芽
为:仅仅除去顶芽外部包裹的一层叶鞘,外植体 约1~2cm左右。之后按照如表2.21-2.23设定的实验方法进行消毒及杀菌,定 期观察外植体污染及存活情况并进行记录,培养30d后外植体消毒实验结果如下 表2.2.1所示。
[0039]
表2.21:不同外植体类型污染情况比较
[0040][0041]
如表2.2.1所示,0.1%次氯酸钠消毒5min时,不同类型外植体污染率差异 不显著,但是随着消毒时间的延长,不同类型的外植体污染情况差异显著,a类 型外植体污染率最低,b类型外植体污染率次之,c类型外植体污染率最高。
[0042]
在成活率的统计中(如下表2.2.2所示),
[0043]
表2.2.2不同外植体类型成活率比较
[0044][0045]
0.1%次氯酸钠消毒5min时,不同类型的外植体存活率均为0;消毒时间10min 时,不同类型的外植体存活率差异不显著;消毒时间15min时,差异显著,a类 型外植体存活率最低,b类型外植体次之,c类型外植体最高。
[0046]
在死亡率的比较中(如下表2.2.3),
[0047]
表2.2.3不同外植体类型死亡情况比较
[0048][0049]
0.1%次氯酸钠消毒5min时,不同类型的外植体死亡率差异不显著;消毒时 间延长至10min、15min、20min时,不同类型外植体差异显著,c类型外植体死 亡率最低,b类型外植体次之,a类型外植体死亡率最高。
[0050]
1.不同诱导培养基配方对比
[0051]
将大小一致的b型外植体芽接种至含有不同细胞分裂素的诱导培养基上进行 初代培养,根据外植体生长的情况,对诱导率、外植体芽生长状况等生长指 标进行统计。
[0052]
结果(表2.3)所示,添加不同浓度的6-ba和kt,外植体的诱导效果差异显 著。对比ck,添加一定浓度的6-ba和kt后,均能在一定程度上缩短芽的萌 发期限,提高诱导率。随着6-ba和kt浓度的增加,芽的萌发天数明显变短, 诱导率提高,芽的长度变短。a1-a4,诱导率差异显著,a4的诱导率达到84.43%, 萌动天数也最短,但是后期芽苗生长势较弱,褐化严重。a3的诱导率同样可 以达到83.33%,但是同时伴随有褐化问题。添加kt的培养基,从b1-b4,诱 导率明显提高,芽的萌发速度也变的更快。b4的诱导率最高,但是芽后期生 长势弱,b3的诱导率对比b4降低8.9%,芽萌发也较早、芽的生长很健壮。 b1、b2的芽诱导率均不高、萌发速度也较慢。在6-ba和kt的对比试验中, 可以发现,kt比6-ba比较不会出现褐化问题。因此,综合考虑诱导率和芽 的生长情况,比较适合芽初代诱导培养的培养基配方是b3,kt浓度为3.0 mg/l。
[0053]
表2.3:不同细胞分裂素浓度对外植体诱导的影响
[0054][0055][0056]
最后应说明的是:以上各实施例仅用以说明本发明的技术方案,而非对其限 制;尽管参照前述各实施例对本发明进行了详细的说明,但本领域的普通技术 人员应当理解:其依然可以对前述各实施例所记载的技术方案进行修改,或者 对其中部分或者全部技术特征进行等同替换;而这些修改或者替换,并不使相 应技术方案的本质脱离本发明各实施例技术方案的范围。
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1