一种连作障碍土壤的微生物修复方法
1.本发明属于生物技术领域,具体涉及一种连作障碍土壤的微生物修复方法。
背景技术:
2.当前,蔬菜连作障碍已成为制约蔬菜产业可持续发展的关键。土壤长时间种植同种蔬菜,作物根系吸收的养分均等且单一,造成营养物质的缺失,导致土壤环境恶化,植株长势不良,抗病能力下降等,加大病虫害发生率,从而导致作物产量降低、品质下降、效益降低。
3.蔬菜作物种类繁多,不同蔬菜作物连作障碍因子不一,需要针对特定的蔬菜作物制定合理的治理技术,才能有效防止蔬菜连作障碍的发生。叶菜类蔬菜种植通常氮肥施用多,氮肥过量,作物的抗逆能力降低,易感病虫害和遭受冻害,还会使土壤酸化、盐碱化加剧,不利于有益微生物生存。
4.随着种植年限的增长,叶菜类种植大棚内的土壤酸化、盐渍化、病害等问题越来越重。个别棚内土壤ph《4.5,呈极强酸性,大部分棚内土壤ph《5.5(强酸性),电导率在500~2100μs/cm,严重的地块电导率在4000μs/cm左右,严重影响叶菜的生产,即使是耐盐性较高的小油菜也不例外。部分种植户为了提高产量,每隔7~10天喷1次药,半个月施一次肥,这既增加了成本,也带来了食品安全隐患,更是一种恶性循环。简单的施用化学药剂和肥料不能消除和减缓土壤连作障碍,只会导致连作障碍的问题越来越重,连作障碍已成为限制叶菜种植业发展的瓶颈,亟待寻求解决途径。
技术实现要素:
5.针对土壤连作障碍的问题,本发明提供了一种连作障碍土壤的微生物修复方法,根据叶菜类产品生长期短,农药残留易超标的特性,利用有益微生物修复连作障碍土壤。
6.一种连作障碍土壤的微生物修复方法,具体包括如下步骤:
7.(1)选择土壤调理剂
8.(2)微生物菌剂的制备
9.选用绿色木霉(trichoderma viride)ltr-2、哈茨木霉(trichoderma harzianum)tw21990、萎缩芽孢杆菌(bacillus atrophaeus)bsr05中的一种并分别制备微生物菌剂;绿色木霉ltr-2保藏于中国微生物菌种保藏管理委员会普通微生物中心,保藏日期是2005年10月20日,保藏编号:cgmcc no.1498,公开于申请号为cn201911122212.6的专利中;哈茨木霉tw21990保藏于中国微生物菌种保藏管理委员会普通微生物中心,保藏日期是2016年09月01日,保藏编号:cgmcc no.12864,公开于申请号为cn202010256670.5的专利中;萎缩芽孢杆菌bsr05保藏于中国微生物菌种保藏管理委员会普通微生物中心,保藏日期是2015年11月16日,保藏编号:cgmcc no.11665,公开于申请号为cn201610056373.x的专利中。
10.(3)对连作障碍土壤的改良
11.对连作障碍土壤撒施土壤调理剂,而后旋耕、喷水保湿,5~10天后,再同时施撒有
机肥和微生物菌剂,旋耕、整地、播种。
12.进一步的,所述步骤(2)中,绿色木霉ltr-2和哈茨木霉tw21990菌剂的制备包括:将绿色木霉ltr-2和哈茨木霉tw21990分别接种于含有高度连作障碍土壤洗脱液的pda平板,置于28℃下培养2~3天;分别转接pda液体培养基,置于摇床上振荡培养,然后将液体种子分别接入麸皮和稻壳组成的固体培养基培养5~7天;自然风干,分别得ltr-2和tw21990固体培养物,过100目筛分别收集分生孢子粉;然后按百分比10%~20%分生孢子粉,50%~69%麦饭石,1%~5%腐殖酸,0.5%~1%叶酸混合,分别制得ltr-2和tw21990菌剂。
13.进一步的,所述绿色木霉ltr-2和哈茨木霉tw21990的振荡培养温度为28℃,培养时间为1~3天。
14.进一步的,所述步骤(2)中,萎缩芽孢杆菌bsr05菌剂的制备包括:将bsr05接种在含有高度连作障碍土壤洗脱液的固体lb培养基上,30℃培养24小时,转接液体lb培养基,置摇床上振荡培养,转接于10升的发酵罐内,接种量为5%wt,30℃培养,培养时间为36~48小时,在芽孢脱落70%时终止发酵;然后将百分比为10%~30%bsr05发酵液与50%~69%麦饭石,1%~3%木屑均匀混合,制得菌剂。
15.进一步的,所述萎缩芽孢杆菌bsr05的振荡培养温度为30℃,培养时间为18小时。
16.进一步的,所述发酵罐内,每分钟通气量与发酵罐容积比为1.2~1.5:1,搅拌速度为400r/min。
17.进一步的,所述步骤(3)中,土壤调理剂的施撒量为150~500千克/亩,有机肥的施撒量为100~400千克/亩,ltr-2菌剂撒施量为5~10千克/亩。
18.进一步的,所述步骤(3)中,土壤调理剂的施撒量为150~500千克/亩,有机肥的施撒量为100~400千克/亩,ltr-2菌剂撒施量为2~5千克/亩,21990菌剂撒施量为2~5千克/亩,bsr05菌剂撒施量为5~10千克/亩。
19.进一步的,所述步骤(3)中,土壤含水量为50%~70%。
20.本发明的有益效果在于:
21.本发明提供了一种连作障碍土壤的微生物修复方法,通过制备微生物菌剂,并结合筛选的土壤调理剂和有机肥来改良修复连作障碍土壤,既可以提高叶菜产量,又可以减少化肥农药的使用,为蔬菜种植业的良性循环发展提供技术支持。
附图说明
22.为了更清楚地说明本发明实施例或现有技术中的技术方案,下面将对实施例或现有技术描述中所需要使用的附图作简单地介绍,显而易见地,对于本领域普通技术人员而言,在不付出创造性劳动的前提下,还可以根据这些附图获得其他的附图。
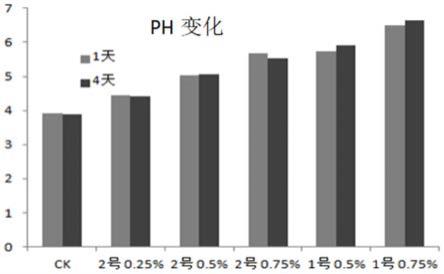
23.图1是实施例1中连作障碍土壤调理剂的室内筛选试验的土壤ph的变化图。
24.图2是实施例1中连作障碍土壤调理剂的室内筛选试验的土壤电导率的变化图。
25.图3是实施例1中连作障碍土壤田间改良试验的土壤ph的变化图。
26.图4是实施例1中连作障碍土壤田间改良试验的土壤电导率的变化图。
27.图5是实施例2中从油菜病株上分离出的病原菌正面形态图。
28.图6是实施例2中从油菜病株上分离出的病原菌反面形态图。
29.图7是实施例2中自制的高度连作障碍土壤洗脱液制备装置。
具体实施方式
30.为了使本技术领域的人员更好地理解本发明中的技术方案,下面将结合本发明实施例中的附图,对本发明实施例中的技术方案进行清楚、完整地描述,显然,所描述的实施例仅仅是本发明一部分实施例,而不是全部的实施例。基于本发明中的实施例,本领域普通技术人员在没有做出创造性劳动前提下所获得的所有其他实施例,都应当属于本发明保护的范围。
31.实施例1改良剂的筛选
32.1.室内筛选试验
33.纸杯装连作障碍土壤150g,按重量比分别添加0.25%、0.5%和0.75%的调理剂。其中,1号为钙镁磷调理剂,2号为硅钙钾镁调理剂,两种调理剂均为济南澳利新型肥料有限公司产品。试验三次重复,设不加调理剂处理为对照ck,分别在混匀后1天和4天测定土壤的ph值和电导率。
34.表1-连作障碍土壤改良剂的室内筛选试验
35.[0036][0037]
通过表1的ph的变化可知,随着调理剂用量的加大,ph随之升高;在用量同为0.5%时,1号调理剂对连作障碍土壤ph的改变比2号调理剂大,但稳定性不如2号;2号调理剂用量为0.25%和0.5%的在混匀后4天内ph较稳定,用量为0.75%的在混匀后第四天ph下降0.15。
[0038]
由电导率的变化可知,调理剂用量在0.5%的浓度以下,电导率低于对照;调理剂用量在0.75%时,电导率均高于对照。
[0039]
综合考虑连作障碍土壤ph和电导率的变化,确定用量为0.5%的2号调理剂为最佳。
[0040]
2.田间土壤改良实验
[0041]
在威海益丰农业科技有限公司16号试验大棚内,撒施土壤调理剂(500千克/亩)、有机肥(400千克/亩)和微生物菌剂(5~10千克/亩),然后旋耕、整地、划分试验小区(面积20m2)。试验设六个处理,每处理三次重复,分别在调理剂使用后(3月9日),菌剂和肥料使用前后(3月20日)及油菜收获后(5月29日)测定土壤ph和电导率。
[0042]
表2-连作障碍土壤田间改良试验
[0043]
[0044][0045]
通过表2的试验结果显示,通过撒施2号调理剂(500千克/亩)处理土壤后,土壤ph由4.43调理至7.15,电导率由660.28μs/cm调理至594.60μs/cm。11天后,土壤ph下降至6.95,电导率下降至519.70μs/cm。3月20日施肥和微生物菌剂后,经2号调理剂处理的区域,ph均下降,电导率均升高。经过一茬种植后,土壤ph均继续下降,但稳定在6.0以上;土壤电导率稳定在1043.40μs/cm以下,不影响下茬油菜生长。
[0046]
实施例2功能菌株的筛选
[0047]
1生防菌株的筛选
[0048]
1.1病原菌的分离及鉴定
[0049]
将采自连作障碍严重大棚内的新鲜带病油菜植株用流水冲洗20min,截取发病部位,用75%酒精棉球擦拭消毒,无菌水冲洗6~8遍后,将其分别转入pda和lb培养基培养,三天后观察病原菌生长情况,在长菌的平皿中将不同形态的菌转接,继续纯化培养,然后用柯克氏法则进一步鉴定病原菌的致病性,最后确定病原菌为镰刀菌。
[0050]
1.2生防真菌的筛选
[0051]
采用平皿对峙培养法筛选油菜根腐病生防菌,不同之处在于在培养基中添加了高度连作障碍土壤洗脱液。
[0052]
高度连作障碍土壤洗脱液制备:将50毫升离心管用刀削去尖底,内置脱脂棉压实,装入高度连作障碍土壤50g,用去离子水按水土重量比1:1洗脱,留取洗脱液(ph3.60,电导率31627.8μs/cm)备用。
[0053]
培养基的制备:称取马铃薯葡萄糖琼脂(海博生物)培养基55.2g,加上述洗脱液200ml,蒸馏水1000ml,于115℃灭菌30min,冷却倾倒至无菌平皿,待凝固后对峙接种病原菌和生防菌(φ=5mm),于25℃培养五天后,分别测量镰刀菌菌落直径大小,按(d
2ck-d
2测
)/d
2ck
计算公试计算抑菌率。以只加镰刀菌,不加生防菌的为对照,每处理设三次重复。
[0054]
表3-油菜根腐病(镰刀菌)生防真菌的筛选试验结果
[0055][0056]
通过表3的试验结果显示,供试的14株木霉中,对油菜根腐病抑菌率在75%以上的菌株有3株,分别是t21-w,ltr-2和tw21990。
[0057]
1.3生防细菌的筛选
[0058]
培养基的制备:12g蛋白胨,6g酵母粉,洗脱液(ph3.6,电导率31627.8μs/cm)800ml,蒸馏水400ml,用1m naoh调ph至7.0,121℃灭菌20min,冷却倾倒至无菌平皿,待凝固后对峙接种镰刀菌(φ=5mm)和生防菌,一周后测定镰刀菌菌落大小,按(d
2ck-d
2测
)/d
2ck
计算公试计算抑菌率。以只加镰刀菌,不加生防菌的为对照,每处理设三次重复。
[0059]
表4-油菜根腐病(镰刀菌)生防细菌的筛选试验结果
[0060][0061]
通过表4的试验结果显示,供试的生防细菌对油菜根腐病抑制率均不理想,表现最好是bsr05,对病原菌的抑制率为43.75%。
[0062]
2生防菌对油菜种子发芽的影响
[0063]
采用滤纸平皿法进行油菜种子发芽试验,不同之处在于培养皿中添加了连作障碍土壤洗脱液(ph4.16,电导率5060μs/cm)。
[0064]
将培养好的生防菌(ltr-2、t21-w、tw21990和bsr05)分别用灭菌蒸馏水稀释,显微计数调整木霉ltr-2、t21-w、tw21990孢子浓度为1
×
105cfu,萎缩芽孢杆菌bsr05菌体浓度为1
×
106cfu,用1ml生防菌液浸种100粒油菜(黑叶五月慢青菜)种子,浸泡30min后,将种子移入置于垫有双层滤纸的灭菌培养皿中,每皿分别加入无菌清水和盐水(土壤洗脱液)溶液10ml。每处理3次重复,每重复供试种子均为30粒。以无菌清水和无菌盐水为对照,试验期间保持培养皿恒温20℃,处理7d后测量根长和芽长。
[0065]
表5-生防菌(ltr-2、t21-w、tw21990和bsr05)对油菜种子的发芽实验结果
[0066]
[0067][0068]
通过表5的生防菌(ltr-2、t21-w、tw21990和bsr05)对油菜种子的发芽实验结果显示,木霉ltr-2、t21-w和tw21990在用1
×
105cfu孢子浸种处理后,与清水对照比,ltr-2和tw21990对油菜的根长有促进作用;与盐水对照比,ltr-2对油菜的根长和芽长均有促进作用,表明ltr-2在含连作障碍土壤洗脱液(ph4.16,电导率5060μs/cm)的环境中,对油菜生长无影响,且能发挥促生长作用。
[0069]
萎缩芽孢杆菌bsr05在用1
×
106cfu菌体浸种处理后,油菜的芽长和根长均高于清水和盐水对照。表明bsr05在含连作障碍土壤洗脱液(ph4.16,电导率5060μs/cm)的环境中对油菜生长无影响,且能发挥促生长作用。
[0070]
实施例3菌剂的制备
[0071]
1.木霉ltr-2和tw21990菌剂制备,按以下步骤进行:
[0072]
(1)斜面菌种:采用含有高度连作障碍土壤洗脱液的固体pda培养基,分别将ltr-2和tw21990接种在试管培养基上,25℃培养2天。
[0073]
(2)茄瓶菌种:采用液体pda培养基,将试管菌种分别接种在液体茄瓶中,置于摇床上25℃振荡培养3天。
[0074]
(3)液体菌种:采用种子培养基,玉米粉2%,葡萄糖0.5%,豆饼粉1%,磷酸氢二钾0.2%,磷酸二氢钾0.3%,碳酸钙1%,ph6.0,121℃灭菌40分钟,将茄瓶的种子用无菌水洗下,分别接种于150立升的种子罐。
[0075]
(4)固体接种:
[0076]
(4.1)固体培养基制备:将麸皮和稻壳按3:1的体积比混合均匀,然后加入55%的水,121℃灭菌40分钟,备用。
[0077]
(4.2)接种:用混合接种器将液体菌种与固体培养基混合均匀,接种量为8%,接种后将其转移到固体培养室内培养。
[0078]
(4.3)培养:培养基厚度为5cm,料温控制在3032℃,室温控制在25~30℃32℃,空气的相对含水量控制在95~100%,培养时间为6天;培养完毕,将固体培养物自然风干,成品含水量控制在5~10%,分别得木霉ltr-2和tw21990固体培养物,过100目筛收集分生孢
子粉。
[0079]
(5)菌剂(有效孢子为2亿/g)组成如下:木霉分生孢子粉15重量份,麦饭石55重量份,腐殖酸3重量份,叶酸0.5重量份。
[0080]
2.萎缩芽孢杆菌bsr05菌剂制备,按以下步骤进行:
[0081]
(1)斜面菌种:采用含有高度连作障碍土壤洗脱液的固体lb培养基,将bsr05接种在试管培养基上,30℃培养24小时。
[0082]
(2)摇瓶菌种:采用液体lb培养基,将试管菌种接种在液体lb培养基中,置摇床上30℃振荡培养18小时。
[0083]
(3)液体发酵:采用培养基,2%玉米粉、1%豆箔粉、0.5%(nh4)2so4、0.2%k2hpo4、0.2%kh2po4、0.035%mgso4·
7h2o,ph7.5,121℃灭菌20分钟,将(2)的种子接种于10升的发酵罐内(接种量为5%wt),30℃培养,每分钟通气量与发酵罐容积比为1.2~1.5:1,搅拌速度为400r/min,培养时间为46小时;在芽孢脱落70%时终止发酵。
[0084]
(4)菌剂(有效菌数为5亿/g)组成如下:萎缩芽孢杆菌bsr05发酵液20重量份,麦饭石55重量份,木屑2重量份。
[0085]
实施例4油菜种植实验
[0086]
分别于2021年3月20日和9月23日在威海益丰农业科技有限公司的16号棚进行了油菜种植试验,油菜品种为黑叶五月慢青菜。16号棚原土壤状况:ph3.91~4.50,电导率660~6813.5μs/cm,有机质含量10.7g/kg,有效磷、速效钾、碱解氮分别为68.2、175、266mg/kg。在种植油菜之前11天(3月9日)用筛选出的2号调理剂按150~500kg/亩的用量处理的土壤,将土壤ph由4.43调理至7.15,电导率由660.28μs/cm调理至594.60μs/cm,3月20日施肥前,土壤ph下降至6.95,电导率下降至519.70μs/cm。施肥后土壤ph和电导率的变化详见表6和表7。肥料和微生物菌剂的使用具体操作为在种植前撒施,用量分别为有机肥(100~400千克/亩)、复合肥(0~30千克/亩)和微生物菌剂(5~10千克/亩)。然后旋耕、整地、划分试验小区(面积20m2)进行种植。试验小区每处理组设三次重复,随机分布。测产时按照长1米、宽2米随机取三方进行测产,并随机挑取10棵油菜进行病害调查。油菜产量以净菜产量为准。
[0087]
表6-连作障碍大棚的油菜种植试验
[0088][0089][0090]
通过表6的连作障碍大棚的油菜种植试验结果可知,与种植户常规处理组相比,本技术试验设计所有处理中油菜发病植株的比率均在30%以下,防病率在65.39%以上,其中防病效果最好的是调理剂+肥星+复合肥+ltr-2处理组,防病率为80.77%;亩增产率在8.4%~33.59%,其中表现最好的是调理剂+肥星+复合肥+ltr-2处理组,亩增产率为33.59%。
[0091]
表7-油菜种植减肥试验
[0092][0093]
通过表7的油菜种植减肥试验结果显示,与空白对照相比,本技术试验设计组增产率在28.58%~41.30%。与常规处理组相比,表现最好的是肥星+ltr-2+1/3复合肥(10kg/亩)处理组,增产率为9.31%,其次是肥星+ltr-2处理组(未加复合肥),增产率为0.4%。表明本技术具有减肥增产的作用。
[0094]
综上所述,本技术可以修复ph《4.5极强酸性、电导率≤6813.5μs/cm、根腐病严重的叶菜类连作障碍土壤,与常规处理相比,亩增产率为8.4%~33.59%,防病率为65.39%~80.77%;肥星+ltr-2+1/3复合肥处理,在每亩减少使用复合肥20kg时,增产率为9.31%。由此可见,本技术既能改良连作障碍土壤,还有减肥增产的作用。
[0095]
尽管通过参考附图并结合优选实施例的方式对本发明进行了详细描述,但本发明并不限于此。在不脱离本发明的精神和实质的前提下,本领域普通技术人员可以对本发明的实施例进行各种等效的修改或替换,而这些修改或替换都应在本发明的涵盖范围内/任何熟悉本技术领域的技术人员在本发明揭露的技术范围内,可轻易想到变化或替换,都应涵盖在本发明的保护范围之内。因此,本发明的保护范围应以权利要求所述的保护范围为准。
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1