一种大鼠颈髓出血性损伤模型的构建方法及其应用
1.本发明属于动物模型构建技术领域,具体涉及一种大鼠颈髓出血性损伤模型的构建方法及其应用。
背景技术:
2.脊髓损伤是指由于外界直接或间接因素导致的脊髓损伤,在损伤的相应节段出现各种感觉、运动和括约肌功能障碍、肌张力异常及病理反射等相应改变。脊髓损伤严重的创伤性中枢神经系统疾病之一,其病理生理机制复杂,临床治疗效果不佳,致残率较高,给家庭和社会带来沉重负担。世界范围内sci的发病率为每年发达国家的发病率为发展中国家为发展中国家为
3.脊髓损伤分为原发性损伤和继发性损伤。原发性损伤由受伤时外力因素所决定,继发性损伤为伤后数小时至数日内发生的一系列自身激活的破坏过程。继发性损伤的机制包括出血、组织缺血、脂质过氧化及自由基改变、炎症、谷氨酸毒性、脱髓鞘和凋亡等。脊髓损伤动物模型的建立为研究继发性损伤提供了基础,因此建立一种可靠性高,重复性好的动物模型,对研究脊髓损伤已势在必行。
4.目前,国内外常用的脊髓损伤建模方式主要有挫伤型脊髓损伤模型、压迫型脊髓损伤模型、缺血损伤型脊髓损伤模型、横断损伤型脊髓损伤模型、牵拉损伤型脊髓损伤模型等。这些动物模型基本上都是通过对背表面造成机械损伤或通过外作用力来达到,难以对sci后出血进行建模。
5.因此,当下需要一种无创伤性的便于sci后出血建模的大鼠颈髓出血性损伤模型的构建方法。
技术实现要素:
6.为了解决上述技术问题,本发明提供了一种大鼠颈髓出血性损伤模型的构建方法;通过对大鼠脊髓中注射胶原酶,诱导脊髓内出血,以此建立脊髓出血性损伤模型。
7.为了达到上述技术效果,本发明是通过以下技术方案实现的:一种大鼠颈髓出血性损伤模型的构建方法,其特征在于,具体包括以下步骤:
8.s1、将大鼠麻醉,于俯卧位固定;
9.s2、切开大鼠皮肤,剥离皮下肌肉,露出其颈椎;
10.s3、在c6水平,切除右侧椎板,并确保没有硬脑膜切口及脊髓损伤;
11.s4、使用立体定向坐标进行胶原酶注射;
12.s5、止血后缝合肌肉和皮肤;
13.s6、采用不同剂量胶原酶重复上述步骤;
14.s7、在伤后于不同周期周进行神经行为和脊髓出血量评估;
15.s8、得出最佳剂量的胶原酶,并重新建模;
16.s9、分别在伤后于不同周期收集脊髓标本进行分子和组织学评价;
17.进一步的,所述s4中胶原酶注射位置为c6脊髓外侧至中线0.4mm处,其深度为1.4mm;
18.进一步的,所述s4中胶原酶剂量包括:0.12u、0.15u、0.3u;
19.进一步的,所述s7中周期分别为24h、72h、1周,且每种剂量每个时间点6只大鼠;
20.进一步的,所述s9中周期分别为,且每个时间点6只大鼠;
21.本发明的有益效果是:
22.本发明通过对大鼠脊髓中注射胶原酶,诱导脊髓内出血,以此建立脊髓出血性损伤模型;与传统的对背表面造成机械损伤或通过外作用力来构建模型的方式相比,本发明提供的模型构建方法不会对大鼠造成组织损伤,且构件模型方法更简单直接,在保证大鼠体质健康的前提下构建模型,避免大鼠其他病症对该模型造成影响。
附图说明
23.为了更清楚地说明本发明实施例的技术方案,下面将对实施例描述所需要使用的附图作简单地介绍,显而易见地,下面描述中的附图仅仅是本发明的一些实施例,对于本领域普通技术人员来讲,在不付出创造性劳动的前提下,还可以根据这些附图获得其他的附图。
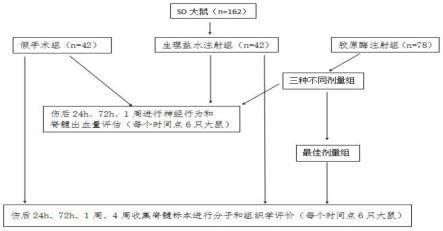
24.图1是一种大鼠颈髓出血性损伤模型的构建方法的验证试验流程图。
具体实施方式
25.为了更清楚地说明本发明实施例的技术方案,下面将对实施例描述所需要使用的附图作简单地介绍,显而易见地,下面描述中的附图仅仅是本发明的一些实施例,对于本领域普通技术人员来讲,在不付出创造性劳动的前提下,还可以根据这些附图获得其他的附图。
26.实施例1
27.一种大鼠颈髓出血性损伤模型的构建方法,其特征在于,具体包括以下步骤:
28.s1、将大鼠麻醉,于俯卧位固定;
29.s2、切开大鼠皮肤,剥离皮下肌肉,露出其颈椎;
30.s3、在c6水平,切除右侧椎板,并确保没有硬脑膜切口及脊髓损伤;
31.s4、使用立体定向坐标进行胶原酶注射;
32.s5、止血后缝合肌肉和皮肤;
33.s6、采用不同剂量胶原酶重复上述步骤;
34.s7、在伤后于不同周期周进行神经行为和脊髓出血量评估;
35.s8、得出最佳剂量的胶原酶,并重新建模;
36.s9、分别在伤后于不同周期收集脊髓标本进行分子和组织学评价;
37.所述s4中胶原酶注射位置为c6脊髓外侧至中线0.4mm处,其深度为1.4mm;
38.所述s4中胶原酶剂量包括:0.12u、0.15u、0.3u;
39.所述s7中周期分别为24h、72h、1周,且每种剂量每个时间点6只大鼠;
40.所述s9中周期分别为,且每个时间点6只大鼠。
41.实施例2
42.本实施例为基于上述实施例1的验证对照试验:
43.试验地点拟定于云南省动物研究所。
44.试验对象采用成年sprague dawley(sd)大鼠,其中雄性81只,雌性81只,共计162只,平均体重250-350g,并经历疼痛类别d后纳入使用。
45.整个试验过程将仔细检查伤口是否有感染的迹象,如果切口处发生感染,伤口将用聚维酮碘治疗,并定期监测。如果感染持续,将使用抗生素软膏。如有需要,将给予支持性护理(如饲喂、软质食物和皮下液体)。止痛药布丙诺啡在麻醉恢复前开始开始第一次给药,并且观察动物是否有疼痛或痛苦的迹象(丁丙诺啡,皮下给药,根据疼痛或痛苦的征兆使用:0.03mg/kgbid
×
2天或更长)。
46.本发明的大鼠模型构建实验
47.胶原酶注射组(共78只大鼠):动物用异氟醚麻醉,俯卧位置于立体定向框架上。切开皮肤,剥离皮下肌肉,露出颈椎。在c6水平,进行右侧椎板切除术。确保没有任何硬脑膜切口及没有脊髓损伤。使用立体定向坐标进行胶原酶注射(c6脊髓外侧至中线0.4mm,深度1.4mm),止血后缝合肌肉和皮肤。测试三种剂量的胶原酶(0.12u、0.15u、0.3u)以确定最佳剂量。分别在伤后24h、72h、1周进行神经行为和脊髓出血量评估(每种剂量每个时间点6只大鼠)。以最佳剂量的胶原酶重新建模,分别在伤后24h、72h、1周、4周收集脊髓标本进行分子和组织学评价(每个时间点6只大鼠)。
48.对照实验1:假手术组
49.假手术组(共42只大鼠):动物用异氟醚麻醉,置于俯卧位立体定向框架内。切开皮肤,剥离皮下肌肉,露出颈椎。在c6水平,进行右侧椎板切除术。手术将只包括椎板切除术,没有任何硬脑膜切口或脊髓损伤。术后止血,确保肌肉和缝隙缝合。分别在伤后24h、72h、1周进行神经行为和脊髓出血量评估(每个时间点6只大鼠)。分别在伤后24h、72h、1周、4周收集脊髓标本进行分子和组织学评价(每个时间点6只大鼠)。
50.对照实验2:
51.生理盐水注射组(共42只大鼠):动物用异氟醚麻醉,俯卧位置于立体定向框架上。切开皮肤,剥离皮下肌肉,露出颈椎。在c6水平,进行右侧椎板切除术。确保没有任何硬脑膜切口及没有脊髓损伤。使用立体定向坐标进行盐水注射(c6脊髓外侧至中线0.4mm,深度1.4mm),止血后缝合肌肉和皮肤。分别在伤后24h、72h、1周进行神经行为和脊髓出血量评估(每个时间点6只大鼠)。分别在伤后24h、72h、1周、4周收集脊髓标本进行分子和组织学评价(每个时间点6只大鼠)。
52.实施例3
53.本实施例基于上述实施例2的实验数据,对实验组以及对照实验组进行包括以下测试类目的分析;
54.神经行为测试:
55.a.改良加西亚评分:评价包括七个测试,每个测试评分0-3分,最高得分为21分,评分越高表明功能越好。这七个测试包括:
56.a.自发活动:将动物放在一个大笼子里,观察动物的活动水平5分钟。
57.b.测试四条腿运动的对称性:抬起动物尾巴,观察肢体对称性。
58.c.前爪伸展性:抬起动物尾巴,使前肢行走,评估前爪运动并比较两侧。
59.d.在倾斜45度的的平台上攀登:将动物放置在斜坡上,并注意选择攀登的方向。
60.e.身体本体感觉:用棉签刺激动物的侧面,观察反应的差异。
61.f.对晶须刺激的反应:用棉签刺激动物的胡须,观察反应的差异。
62.g.侧向转动:检查动物是否直线行走或是否有向一侧转向的趋势。
63.b.横梁平衡试验:该试验将检测动物在横梁(长100cm,直径2cm)上行走的能力,将动物放在平台中间,测60秒内动物行走的距离或到达两端终点的时间。根据时间和距离的变化,评分0到5分,取三次测试的平均数。
64.c.脚部故障测试:将动物放置在水平格栅地板上2分钟。计算动物不正确地放置前肢或后肢的次数即为评分。
65.d.前肢台阶交替试验:将动物两只前肢接触桌面放置,以判定它们是否能交替使用前肢。允许动物被移动,转移他们的重心,试图使它们行走。每只动物重复四次这个测试,如果动物显示出在75%或75%以上的交替能力,则该测试将被认为是有交替能力。如果动物重复使用同一前肢,则被认为无交替能力。
66.e.姿势不稳测试:每个肢体的运动将被测试。动物将被保持并允许在桌面上伸出两个前肢移动。记录动物前肢恢复平衡所需的距离。
67.f.面食处理测试:该测试将确定动物吃面食的时间和爪子偏好。本试验将使用4厘米的干面条,测试应在每一个测试日大致相同的时间进行。
68.出血量检测
69.将脊髓标本冰冻包埋剂包埋,冰冻切片机矢状位连续纵向切片,等间隔的十条脊髓组织切片代表整个脊髓,贴于一张娃化玻片上,玻片保存于低温冰箱。将玻片进行he染色后用光学显微镜观察,用dp controller拍摄软件摄像后存盘,用ipp软件对图像进行分析并计算出血体积。
70.western blot
71.动物将在实施程序后被安乐死。将应用冷磷酸盐缓冲盐水(pbs,ph 7.4)溶液经心脏灌注,然后将脊髓从c2至t2水平脊髓区域移除。脊髓部分将被储存(-80℃),直到分析。将全细胞裂解物在ripa裂解缓冲液(santa cruz bio.,inc,sc-24948)中轻轻均质后在4℃下进一步离心20分钟,即可从全细胞裂解物中提取蛋白质。将使用洗涤剂相容性测定(bio rad,dc蛋白测定)来确定。等量的蛋白质(30-50g)将被加载在sds-page凝胶上。在被电泳并转移到硝酸纤维素膜上之后,该膜将被堵塞,并在4℃下与初级抗体隔夜孵育。初级抗体将是针对目标蛋白的特异性抗体。硝酸纤维素膜将在室温下与二级抗体(抗兔/山羊/小鼠igg辣根过氧化物酶结合抗体;santa cruz bio.)孵育1小时。然后用ecl plus化学发光试剂盒(amersham biosciences,arlington heights,il)对免疫印迹物进行检测,并用成像系统(bio-rad,versa doc,型号4000)进行可视化。收集的数据将利用开源软件j图像进行分析。
72.组织学和免疫组织化学
73.深层麻醉处死动物,经左心室灌注冰冷的pbs和10%多聚甲醛。将去除脊髓样品,并在多聚甲醛中固定过夜,在pbs中30%的蔗糖中固定72小时。固定后,脊髓将嵌入oct化合物,10米厚的冠状切面将被切割。将从所有动物群中获得一系列切片。每只动物的切片将用于几个实验,包括苏木精和伊红染色、尼氏染色、免疫荧光、髓磷脂染色、tunel和荧光翡翠染色。结果将在显微镜下观察。
74.本发明通过对大鼠脊髓中注射胶原酶,诱导脊髓内出血,以此建立脊髓出血性损伤模型;与传统的对背表面造成机械损伤或通过外作用力来构建模型的方式相比,本发明提供的模型构建方法不会对大鼠造成组织损伤,且构件模型方法更简单直接,在保证大鼠体质健康的前提下构建模型,避免大鼠其他病症对该模型造成影响。
75.在本说明书的描述中,参考术语“一个实施例”、“示例”、“具体示例”等的描述意指结合该实施例或示例描述的具体特征、结构、材料或者特点包含于本发明的至少一个实施例或示例中。在本说明书中,对上述术语的示意性表述不一定指的是相同的实施例或示例。而且,描述的具体特征、结构、材料或者特点可以在任何的一个或多个实施例或示例中以合适的方式结合。
76.以上公开的本发明优选实施例只是用于帮助阐述本发明。优选实施例并没有详尽叙述所有的细节,也不限制该发明仅为所述的具体实施方式。显然,根据本说明书的内容,可作很多的修改和变化。本说明书选取并具体描述这些实施例,是为了更好地解释本发明的原理和实际应用,从而使所属技术领域技术人员能很好地理解和利用本发明。本发明仅受权利要求书及其全部范围和等效物的限制。
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1