用于对人乳进行巴氏消毒的设备和方法与流程
本发明涉及用于灭活人乳制品中的生物污染物的方法和设备。
背景技术:
巴氏消毒是指杀死或灭活食品(通常是液体)中存在的微生物以防止食品因食品中微生物的生长而腐败的方法。巴氏消毒通过将食品加热至特定的温度并持续特定的时间段以减少食品中的存活微生物数目来进行。这种方法被称为热巴氏消毒法。
牛乳的热巴氏消毒法已使用了一百多年。两种常见的热巴氏消毒法包括使乳短时间暴露于高温,之后立即冷却。第一种热巴氏消毒法被称为高温短时(High Temperature Short Time,HTST),其中使乳暴露于约72℃的温度15秒至20秒。第二种热巴氏消毒法被称为低温长时(low temperature long time,LTLT)或“保温”(“Holder”)巴氏消毒法,其中将乳加热至62.5℃并保持30分钟。只有这些是得到普遍认可的技术。
目前,热巴氏消毒法是唯一用于人乳的巴氏消毒法,并且目前被应用于建立乳库,在所述乳库中,乳被捐赠、筛选以及当不能从婴儿母亲获得乳时供应给婴儿。人乳极少是无菌的。目前,多个乳库中收集的乳有约15%因其含有病原性细菌而不得不丢弃,所述病原性细菌例如金黄色葡萄球菌(S.aureus)、肠杆菌科(Enterobacteriaceae)和肠球菌(Enterococci)。约6%因细菌总数超过100,000菌落形成单位(CFU/ml)而不得不丢弃。此外,人免疫缺陷病毒(HIV)、巨细胞病毒(CMV)、嗜人T淋巴细胞病毒(HLTV)以及另一些病毒可通过人乳传播并引起感染和疾病。再者,在经历热巴氏消毒后仍存活的耐热性孢子也可介导疾病的传播。
可通过HTST或LTLT方法对人乳进行巴氏消毒。保温巴氏消毒法能够引起人乳中的多种细菌物种减少5-log10,这些细菌物种包括大肠杆菌(Escherichia coli)、表皮葡萄球菌(Staphylococcus epidermidis)、阴沟肠杆菌(Enterobacter cloacae)、蜡样芽胞杆菌(Bacillus cereus)和金黄色葡萄球菌(Staphylococcus aureus)(Czank C,等,Pediatric Research 2009;66:374-379)。因此,热巴氏消毒法使经由人乳传播疾病的风险最小化。
然而,重要的是,当对人乳进行热巴氏消毒时,其中存在的热不稳定性生物活性成分可被改变或者从乳中损失。因此,需要提供改进的人乳的巴氏消毒方法,所述方法足以灭活生物污染物而不改变或灭活重要的生物活性成分。
紫外(UV)光处理已被应用于对饮用水、啤酒、酒和果汁、切开的和完整的果实进行巴氏消毒和去污,并且还被应用于净化空气和包装新鲜食品。物质的UV暴露或UV处理被归类为非热灭菌法。本领域中的某些人将这种方法称为“UV巴氏消毒法”或“低温巴氏消毒法(Cold Pasteurization)”。
紫外光被定义为波长短于可见光但长于X-射线的电磁辐射。对液体而言,有效进行巴氏消毒的UV处理需要足够的剂量,即将生物污染物充分地暴露于UV。UV穿透液体的程度取决于该液体的溶解度、密度和浊度。
此前的研究已证明UV处理可用于降低不透明液体的微生物负荷。然而,乳难以用UV进行处理,因为其在254nm的波长下具有300cm-1的高吸收系数,而相比之下饮用水和啤酒的吸收系数分别为0.1cm-1和20cm-1。
实际上,已开发了多种流通式反应器以确保在需要处理大体积液体时以及当待处理的液体是混浊的并且光穿透受到限制时实现充分的UV暴露。这样的流通式反应器被设计成将液体铺成薄层或膜,或者可替选地,赋予液体湍流从而使其围绕UV源流动,由此使生物污染物暴露于不透明液体与光子源之间界面处的光子。美国专利5,675,153、5,567,616、6,540,967和6,576,201以及WO 01/37675中对这样的设备进行了描述。
然而,仍然存在很多与用于对牛乳或果汁进行巴氏消毒之现有方法和设备有关的缺点,这些缺点导致它们不能应用于对人乳进行巴氏消毒。
首先,现有的方法针对于处理大体积乳,而这需要将其从来源泵送至UV反应器,并随后使其再循环或通过多个反应器。人乳只能以小体积进行收集,而这样的小体积可能在这些大反应器中损失。
其次,与需要泵送乳通过反应器有关的其他问题包括:乳在设备的某些区域中停滞,其允许生物污染物集合和生长;乳固体沉积在反应器的表面上,其可导致UV穿透的阻抗和难以清洁该设备;以及乳被赋予不期望的特性,例如因向乳施加湍流而导致由乳脂肪球的聚结形成黄油。
此外,这些设备难以维护。希望具有可由母乳喂养之母亲、乳库、医院和其他临床环境中方便使用的对小体积人乳制品进行巴氏消毒的方法及用于所述方法的设备。这样的方法和设备提供了放心,因为其表明可方便地对乳进行巴氏消毒。
对人乳进行巴氏消毒之现有方法所面临的另一个问题是人乳中存在的多种重要生物活性成分的活性降低和/或丧失。目前,用于对人乳进行巴氏消毒的方法(例如保温巴氏消毒法)旨在降低人乳中的细菌负荷而不考虑使乳中的重要生物活性成分维持在有效水平。人乳的巴氏消毒法以由乳品工业开发的技术为基础。乳品工业的目标是降低牛乳中的酶活性以增加自身的寿命。而在人乳中,需要酶活性来将人乳的全部益处转移至婴儿。
已显示,人乳抑制大肠杆菌、金黄色葡萄球菌和假丝酵母属(Candida sp)的生长。认为人乳的这种抑菌特性主要是由免疫蛋白引起,所述免疫蛋白包括乳铁蛋白、溶菌酶和slgA。乳铁蛋白是一种铁结合蛋白,其降低铁依赖性病原体(例如大肠杆菌)所需之游离铁的可利用性从而抑制其生长并通过与细菌细胞表面上之脂多糖的脂质A部分结合来破坏细菌细胞膜。溶菌酶通过催化N-乙酰葡糖胺与N-乙酰胞壁酸之间的特定键水解来裂解大多数革兰氏阳性细菌(例如金黄色葡萄球菌)的细胞壁。尽管溶菌酶单独是抑菌的,但是体外研究显示在存在乳铁蛋白的情况下,其也是杀菌的并且可杀死一些革兰氏阴性菌。分泌性IgA(slgA)是一种抗体,其响应母亲和婴儿所暴露于的病原体而特异性地分泌,并由此提高婴儿的免疫防御系统。与其他免疫球蛋白相比,slgA因其对蛋白水解酶具有抗性而更能够存留在肠道中。尽管slgA在人乳中没有已知的抗菌活性,但是其增强乳铁蛋白和溶菌酶的抗菌活性并且其在被消化时在婴儿的免疫防御中发挥重要作用。使用热巴氏消毒法可不利地影响这些生物活性成分的活性和保留。
因此,需要提供克服了当前所采用方法所面临的问题同时保持了生物活性成分的改进的人乳制品的巴氏消毒方法。
对文献、法令、材料、设备、制品等的讨论仅仅是出于提供本发明之背景的目的而包括在本说明书内。并非暗示或表明任何或所有这些内容因为其在本申请各项权利要求的优先权日之前就已存在而构成了现有技术基础的一部分或者是本发明相关领域中的公知常识。
当本说明书(包括权利要求书)中使用术语“包含/包括”时,应将它们解释为说明所述特征、整体、步骤或成分的存在,但不排除一个或更多个其它特征、整体、步骤或成分或其组的存在。
技术实现要素:
需要对人乳进行巴氏消毒以降低疾病从乳传播至接受者的风险。此外,需要足以灭活人乳中的生物污染物并同时保护或保留人乳中存在的重要生物活性成分之活性的能力。
因此,在本发明的一个方面中,提供了灭活人乳制品中存在的生物污染物或降低其量的方法,其包括使乳制品暴露于紫外光(UV)并赋予乳制品旋涡流动(vortical flow)以促进乳制品中的污染物暴露于UV光,其中污染物暴露于UV光灭活乳制品中的污染物或降低其量,并且其中乳制品中存在的生物活性成分的活性不显著降低。
根据本发明的另一方面,提供了用于灭活人乳制品中的生物污染物或降低其量的设备,其包含:用于容纳一定体积人乳制品的容器,其中UV光源与所述容器相结合使得人乳制品暴露于UV光;以及向保留在所述容器中的所述乳制品施加旋涡流动以促进污染物暴露于UV光源的装置。
根据本发明的另一方面,提供了通过以下方法制备的人乳制品,所述方法包括:使乳制品暴露于紫外光(UV)并赋予乳制品旋涡流动以促进乳制品中的污染物暴露于UV光;其中污染物暴露于UV光灭活乳制品中的生物污染物或降低其量,并且其中乳制品中存在的生物活性成分的活性不显著降低。
附图说明
应当结合附图参考下面的详细描述以对本发明的方面和优势进行进一步理解。
图1示出了根据本发明一个方面的设备的一个实施方案。
图2示出了与人乳样品中的总固体相关的十进制减少剂量(decimal reduction dose)。
图3示出了在延长的UV照射后人乳样品中的碱性磷酸酶保留率。
图4示出了未经处理的人乳样品(白色)和经4863J/l剂量UV-C处理的样品(灰色)中脂肪酸分布的浓度。
图5示出了暴露于UV的乳和培养基中存在的CMV的灭活。结果以TCID5o/ml表示。
图6示出了未经处理、经UV-C照射和经保温巴氏消毒的人乳和营养肉汤(nutrient broth,NB)的细菌生长。
图7示出了经UV-C照射的人乳中总固体浓度与溶菌酶保留率之间的关系。
图8示出了未经处理、经UV-C照射和经保温巴氏消毒处理的人乳中的免疫蛋白浓度。
图9示出了细菌增殖速率/小时与slgA浓度、乳铁蛋白浓度和溶菌酶浓度之间的关系。
图10示出了人乳中的免疫蛋白浓度之间的关系。
图11示出了根据本发明一个实施方案之设备的结构布置的示意图。
图12示出了根据本发明一个替代实施方案之设备的结构布置的示意图。
图13示出了UV-C设置(层处理)。
图14示出了人乳在UV--C照射前后的荧光读数。
图15示出了未经处理、经UV-C照射和经保温巴氏消毒之人乳在不另外添加任何物质、添加过氧化氢酶或添加H2O2的情况下的荧光读数。
发明详述
人乳含有不能通过婴儿食品向婴儿提供的营养成分和生物活性成分。因此,如果母亲自身的乳不可获得,则可将捐赠的人乳视为最佳选择,对早产婴儿而言尤其如此(Wight,NE.Donor human milk for preterm infants.J Perinatol 2001;21:249-254)。已证明,捐赠的乳有益于足月婴儿和免疫机能不全的成年人。为了使疾病从捐赠母亲传播至早产婴儿的风险最小化,对捐赠的人乳进行巴氏消毒。而目前,人乳的热巴氏消毒法导致人乳中存在的多种重要生物活性成分的活性降低和/或丧失。这样的降低和/或丧失导致乳质量较差。研究已证明:与喂养原人乳的婴儿相比,喂养经热巴氏消毒之人乳的婴儿的脂肪吸收和生长速率降低。
对人乳进行巴氏消毒而不降低乳的总体组成和关键生物活性物质之活性的能力在诸如对婴儿进行新生儿护理和建立乳库方面具有重要意义。
本文使用的术语“人乳制品”指人乳或者由人乳衍生或包含人乳的制品。其可指全乳、已添加有物质的乳或通过加工或分离技术而获得的人乳级分,所述加工或分离技术包括分离、萃取浓缩、离心或过滤(包括超滤或纳米过滤)。这样的乳制品可包括新鲜乳或已储存于室温下、已经冷藏或冷冻(例如在或低于0℃、-20℃或-80℃)的乳;初乳、强化母乳;低脂乳制品、不含糖/乳糖的乳制品、酪蛋白、乳脂(cream)、乳清或乳固体。
不受本说明书的限制,以下描述将举例说明人乳的用途。然而,本发明的方法同样适用于如上所述的人乳制品。
根据本发明的方法,人乳中生物污染物的灭活使得能够保留人乳中存在之关键生物活性物质的生物活性并且还能够使乳的总体组成得以维持。按此方式,与使用保温巴氏消毒法所获得的相比,该方法能够提供质量更优的人乳制品。
本文使用的术语“生物污染物”指但不局限于微生物,例如病毒、细菌、原生动物、酵母、孢子、霉菌和藻类。此类生物污染物可包括病毒(包括病毒核酸),其选自但不局限于以下:B型(逆转录病毒样颗粒)、柯萨奇病毒B3、巨细胞病毒(Cytomegalovirus,CMV)、埃博拉病毒、艾柯病毒18、埃-巴病毒(Epstein-Barr virus,EBV)、乙型肝炎病毒、丙型肝炎病毒、戊型肝炎病毒、单纯疱疹病毒1型、人疱疹病毒6型、人孢疹病毒7型、人免疫缺陷病毒(HIV)1型(和2型)、嗜人T淋巴细胞病毒(Human T-lymphotropic virus,HTLV)、人乳头状瘤病毒16型(Human papillomavirus 16)、轮状病毒、风疹病毒、无名(没有名称)汉滩病毒RNA(Sin nombre(no name)hantavirus RNA)、输血-传播病毒(Transfusion-transmission virus,TTV)、水痘-带状疱疹病毒、西尼罗病毒;细菌和真菌,包括但不局限于葡萄球菌属(Staphylococcus spp.)、链球菌属(Streptoccoccus spp.)、芽孢杆菌属(Bascillus spp.)、弯曲杆菌属(Campylobacter spp.)、肠球菌属(Enterococcus spp.)和肠杆菌属(Enterobacter spp.)、大肠杆菌(E.coli)、蜡样芽胞杆菌(Bacillus cereus)、伯氏疏螺旋体(Borrelia burgdorferi)、马尔他布鲁氏杆菌(Brucella melitensis)、假鼻疽假单胞菌(Burkholderia pseudomallei)、白色念珠菌(Candida albicans)、弗氏柠檬酸菌(Citrobacter freundii)、贝氏柯克斯体(Coxiella burnetti)、阴沟肠杆菌(Enterbacter aerogenes)、E.cloaca、肺炎克雷伯菌(Klebsiella pneumonia)、格氏乳杆菌(Lactobacillus gasseri)、屎肠球菌(Enterococcus faecium)、澳大利亚钩端螺旋体(Leptospira australis)、单核细胞增多利斯特菌(Listeria monocytogenes)、副结核分支杆菌(Mycobacterium paratuberculosis)、结核分枝杆菌(Mycobacterium tuberculosis)、铜绿假单胞菌(Pseudomonas Aeruginosa)、科特部斯沙门氏菌(Salmonella Kottbus)、巴拿马沙门氏菌(Salmonella panama)、森夫顿堡沙门氏菌(Salmonella senftenberg)、鼠伤寒沙门氏菌(Salmonella typhimurium)、粘质沙雷菌(Serratia marcescens)、金黄色葡萄球菌(Staphylococcus aureus)、表皮葡萄球菌(Staphylococcus epidermis)和无乳链球菌(Streptococcus agalactiiae);寄生虫,包括但不局限于美洲板口线虫(Necator americanus)、旋盘尾丝虫(Onchocerca volvulus)、曼森氏裂体吸虫(Schistosoma mansoni)、富氏粪类园线虫(Strongyloides fulleborni)、刚地弓形体(Toxoplasma gondii)、旋毛虫(Trichinella spiralis)和克氏锥虫(trypanosoma cruzi)。
可使用本领域技术人员已知的标准方法来实现人乳中生物污染物的检测。这些方法包括但不局限于基于培养的测定和基于核酸的检测方法。例如,可如下获得细菌污染物的存在:将人乳制品的样品用合适的培养基(例如血琼脂麦康基琼脂等)在37℃下培养适当的时间,例如48小时。可用革兰氏染色对细菌污染物进行进一步鉴定。或者,可应用基于核酸的检测方法,例如PCR检测方法。同样地,可采用基于培养或核酸的方法来检测病毒或寄生虫污染物。乳样品中污染物的阳性检测将取决于所采用的检测方法。样品污染指检测到样品中存在污染物。
使用非无菌的吸奶泵装置和容器可发生人乳的细菌污染。在一些情况下,例如在乳库中,在进行巴氏消毒之前,通过细菌学培养检测到的总细菌污染上限是100,000CFU/ml。另外,在澳大利亚,巴氏消毒前的样品必须不含产生热稳定性肠毒素的病原性细菌(例如,金黄色葡萄球菌、肠杆菌科和肠球菌等)。发现污染人乳的最常见细菌包括大肠杆菌、金黄色葡萄球菌、表皮葡萄球菌(S.epidermidis)、蜡样芽孢杆菌(B.cereus)和E.cloaca。发现污染人乳的最常见病毒包括CMV、HIV、HTLV。
在一个优选实施方案中,本发明提供了灭活人乳中存在的生物污染物或降低其量的方法,其中所述污染物选自大肠杆菌、葡萄球菌属、链球菌属、芽孢杆菌属、肠球菌属和肠杆菌属。
在另一个优选实施方案中,本发明提供了灭活人乳中存在的生物污染物或降低其量的方法,其中所述污染物选自CMV、HIV和HTLV。
不受任何理论的限制,生物污染物暴露于足够剂量的UV光向核酸链引入损伤,包括断裂和二聚体。这样的损伤可损害或抑制污染物复制其遗传物质的能力并导致污染物死亡或破坏。
本文使用的术语“灭活”(或其他形式)指实际破坏、消灭污染物,或对污染物的直接或间接影响,而这些基本上抑制污染物复制或以其他方式对活接受者产生不利影响的能力。
根据另一个实施方案,本发明的方法降低了乳中存在的生物污染物的量。本文使用的术语“降低”(或其变化形式)当应用于生物污染物时指降低生物污染物的量或者减少具有活性和/或能够复制和/或能够感染个体的污染物的数目。
可使用本领域技术人员已知的检测方法来测量人乳中生物污染物的灭活或生物污染物量的降低。还可使用生物污染物的生物活性测定来确定生物污染物的灭活。可通过比较通过分析暴露于UV前后之样品而产生的数据来断定灭活或降低。污染物之生物活性测定的一个实例是检测病毒在暴露于UV前后感染细胞的能力。在该测定中,病毒感染细胞的能力在暴露于UV后降低将表示灭活。虽然没有降低在样品中检测到的污染物总量,仍发生这样的生物污染物灭活。例如,在UV暴露之后,虽然被病毒感染的细胞数目有所下降,但是样品中的病毒DNA或RNA量可保持不变。
本文使用的术语十进制减少剂量指使存活的污染物群减少1个对数周期所需的UV剂量,即,将污染物群破坏或灭活90%所需的剂量。在一个优选实施方案中,本发明的方法使污染物水平降低至少1个Log10单位。在另一个优选实施方案中,本发明的方法使污染物减少至少2、3、4或5个Log10单位。在又一个优选实施方案中,本发明的方法使污染物减少至少5个Log10单位。
优选地,本发明的方法灭活人乳制品中的污染物或降低其水平,使得乳制品可安全地使用。优选地,污染物的水平被灭活或降低至20000CFU/ml的水平。更优选地,污染物降低至低于选自以下的水平:10000CFU/ml、9000CFU/ml、8000CFU/ml、7000CFU/ml、6000CFU/ml、5000CFU/ml、4000CFU/ml、3000CFU/ml、2000CFU/ml、1000CFU/ml、900CFU/ml、800CFU/ml、700CFU/ml、600CFU/ml、500CFU/ml、400CFU/ml、300CFU/ml、200CFU/ml、100CFU/ml、90CFU/ml、80CFU/ml、70CFU/ml、60CFU/ml、50CFU/ml、40CFU/ml、30CFU/ml、20CFU/ml、10CFU/ml和5CFU/ml。
在一个优选实施方案中,用于灭活生物污染物的UV光形式是UV-C。UV-C被定义为波长为200nm至280nm的UV光。因此,在另一个优选实施方案中,所述方法包括使人乳暴露于250nm至270nm(包括255nm、260nm、265nm的波长)的UV-C。在又一个优选实施方案中,所述方法包括使人乳暴露于波长为约254nm的UV-C。
UV-C的穿透深度取决于液体的溶解度、密度和浊度。对不透明或浑浊液体进行UV处理可导致UV被吸收或反射。乳在254nm的波长下具有300cm-1的高吸收系数,而相比之下诸如饮用水和啤酒的液体的吸收系数分别为0.1cm-1和20cm-1(Shama G.Ultraviolet light.In:Encyclopaedia of food microbiology.Academic Press(Elsevier)1999)。因此,乳由于其具有高吸收系数而难以用UV-C进行处理。
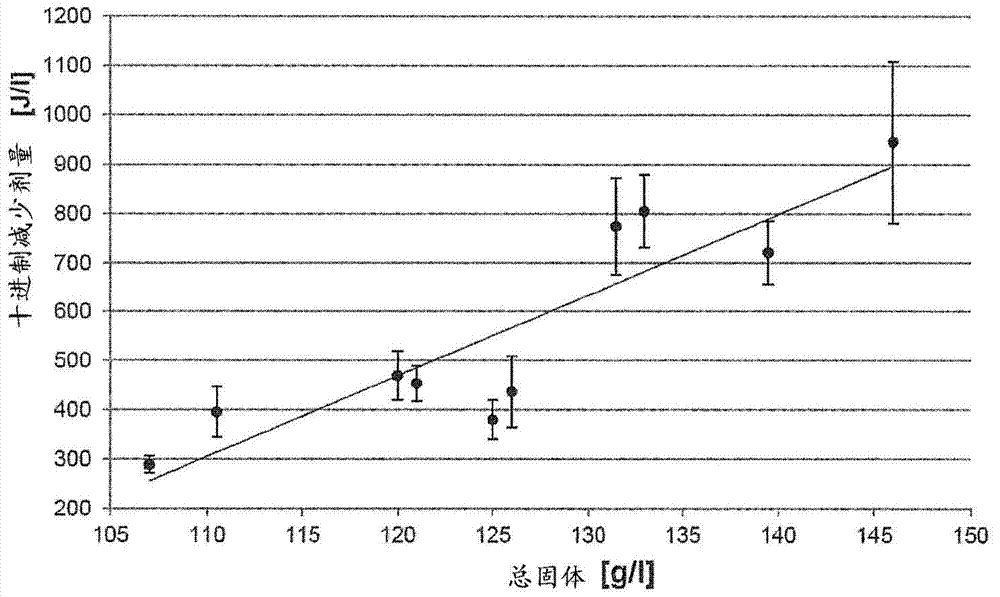
如本文所证明的,十进制减少剂量和人乳中的总固体之间存在强正相关性,R2为0.82(P<0.01)。因此,在本发明的一个方面,所述方法包括测量一定体积的人乳中存在的总固体并调节灭活乳中存在的生物污染物所需的UV(优选UV-C)剂量。
根据用于进行本发明方法的UV源输出和暴露持续时间来计算UV暴露量或UV剂量。因此,UV剂量可根据给定UV源的输出、所采用的UV源数目或暴露持续时间而不同。UV剂量可以以多种方式表示,并且通常将其定义为每处理表面积所传递能量的量(例如毫焦耳/平方厘米,mJ/cm2)。如本文所述,将UV暴露量或UV剂量以焦耳/升(J/l)表示。在一个优选实施方案中,本发明的方法包括使人乳暴露于100J/l至10,000J/l剂量的UV光。更优选地,使人乳制品以选自包括以下之组的剂量暴露于UV光源:100J/l、200J/l、300J/l、400J/l、500J/l、600J/l、700J/l、800J/l、900J/l、1000J/l、1100J/l、1200J/l、1300J/l、1400J/l、1500J/l、1600J/l、1700J/l、1800J/l、1900J/l、2000J/l、2100J/l、2200J/l、2300J/l、2400J/l、2500J/l、2600J/l、2700J/l、2800J/l、2900J/l、3000J/l、3100J/l、3200J/l、3300J/l、3400J/l、3500J/l、3600J/l、3700J/l、3800J/l、3900J/l、4000J/l、4100J/l、4200J/l、4300J/l、4400J/l、4500J/l、4600J/l、4700J/l、4800J/l、4900J/l、5000J/l、5100J/l、5200J/l、5300J/l、5400J/l、5500J/l、5600J/l、5700J/l、5800J/l、5900J/l、6000J/l、6100J/l、6200J/l、6300J/l、6400J/l、6500J/l、6600J/l、6700J/l、6800J/l、6900J/l、7000J/l、7100J/l、7200J/l、7300J/l、7400J/l、7500J/l、7600J/l、7700J/l、7800J/l、7900J/l、8000J/l、8100J/l、8200J/l、8300J/l、8400J/l、8500J/l、8600J/l、8700J/l、8800J/l、8900J/l、9000J/l、9100J/l、9200J/l、9300J/l、9400J/l、9500J/l、9600J/l、9700J/l、9800J/l、9900J/l和10,000J/l。更优选地,所述剂量为至少500J/L。
根据本发明,在暴露于UV之后不显著降低乳中存在的生物活性成分的活性。本文使用的术语“生物活性成分”指具有生物效应的物质(agent)。实例包括但不局限于碳水化合物、脂质、肽、脂肪酸、酶、抗体、生长因子、细胞因子、趋化因子、激素、抗微生物化合物、代谢物、维生素和细胞,所述细胞包括但不局限于干细胞和免疫细胞,例如白细胞。
优选地,所述生物活性成分是肽、蛋白质、酶、抗体、生长因子、激素和类固醇。
本文使用的术语“显著降低”指人乳制品的生物活性成分之活性或浓度或者人乳制品的抑菌性能降低大于50%。即,根据本发明,在通过UV暴露灭活生物污染物后,人乳制品中存在的生物活性成分的活性或浓度或者人乳制品的抑菌性能是UV暴露之前人乳制品的生物活性成分之活性或浓度或者抑菌性能的至少50%。在一个优选实施方案中,人乳制品中生物活性成分的活性或浓度降低或者人乳制品的抑菌性能降低不超过40%、30%或20%。在另一个优选实施方案中,人乳制品中生物活性成分的活性或浓度或者人乳制品的抑菌性能降低不大于10%。‘
本文使用的术语“抑菌的”指阻止、延迟或抑制细菌生长、分裂、增殖或复制。
在热巴氏消毒法中,使用保温巴氏消毒法显著降低了免疫蛋白的保留并可使胆汁盐激活脂肪酶(bite salt stimulated lipoase,BSSL)的活性完全丧失。BSSL将三酰甘油分解成单酰甘油酯和游离脂肪酸,并因此而有助于婴儿消化脂肪。BSSL是一种非常热不稳定的酶,并且根据暴露时间可从45℃下开始灭活。通过人乳来供给BSSL对早产婴儿来说特别重要,因为他们的内源脂肪酶活性低。研究已表明:与喂养原乳的早产婴儿相比,喂养经热巴氏消毒之人乳的早产婴儿具有较低的脂肪吸收和生长速率。可能是热巴氏消毒过程使BSSL失活而导致这些较低的生长速率。
在保温巴氏消毒法的情况下,另一种完全丧失的酶是碱性磷酸酶(ALP)。ALP已被作为生物标志物用于乳品工业中以检测乳的不充分巴氏消毒,这归因于以下事实:当略高于破坏乳中的靶微生物所需要的巴氏消毒条件时,乳中的碱性磷酸酶失活。
因此,在一个优选实施方案中,乳中存在的生物活性成分的活性不显著降低。在另一个优选实施方案中,所述蛋白质是酶。在又一个优选实施方案中,所述生物活性蛋白质选自包括以下的组:胆汁盐激活脂肪酶、碱性磷酸酶、乳铁蛋白、溶菌酶、乳过氧化物酶、髓过氧化物酶、谷胱甘肽过氧化物酶、过氧化氢酶、超氧化物歧化酶,或乳铁蛋白。
在又一个优选实施方案中,所述生物活性蛋白质是抗体、生长因子、细胞因子和趋化因子。
在热巴氏消毒法中,使用保温巴氏消毒可使人乳的抑菌性能完全丧失。
因此,在一个优选实施方案中,人乳的抑菌性能不显著降低。
在另一个优选实施方案中,乳中存在的生物活性蛋白质的浓度不显著降低。在另一个优选实施方案中,乳中存在的酶的浓度不显著降低。
在又一个优选实施方案中,选自包括以下之组的生物活性蛋白质的浓度不显著降低:胆汁盐激活脂肪酶、碱性磷酸酶、分泌性IgA(slgA)、乳铁蛋白和溶菌酶。在又一个优选实施方案中,胆汁盐激活脂肪酶、碱性磷酸酶和/或乳铁蛋白的浓度不显著降低。
在又一个实施方案中,抗氧化成分的活性不显著降低,所述抗氧化剂成分例如但不局限于包含以下的组:乳过氧化物酶、髓过氧化物酶、谷胱甘肽过氧化物酶、过氧化氢酶、超氧化物歧化酶、乳铁蛋白、维生素C和维生素E。因此,在又一个优选实施方案中,乳的抗氧化剂活性不显著降低。
如所讨论的,当涉及混浊液体(例如乳)时UV暴露的效力下降,这是因为UV的吸收或反射增加。已设计了各种不同的流通式UV反应器,其包括使液体流过管道或导管并使液体暴露于UV。这样的反应器已被设计用于处理大体积液体。
在使用层流的流通式反应器中处理不透明液体存在问题,因为位于流通式反应器中心的层将不暴露于UV。
人乳只能以小体积从个体收集。例如,个体在任何给定时间所排出(expressed)的母乳体积具有大量的个体间差异。研究已证明,可排出的母乳平均重量可为约30克至约150克(即约30ml至150ml)。因此,这样的小体积将在大反应器和流通式反应器中损失。另外,如上文所强调的,当需要在流通式反应器中泵送乳时,将出现其他问题。此外,当向乳施加过度的湍流时,可赋予乳不期望的特性,其包括乳脂肪球聚结形成黄油。
根据本发明,赋予乳流动(例如旋涡流动)促进乳中的污染物暴露于UV。本文使用的“旋涡流动”指这样的液体流动,其中液体在层中围绕虚轴以回转或旋转运动的方式流动。所述轴可以是直的或弯曲的。可能存在层间的一些流动的混乱(disruption)或混合以及一些湍流,这可发生在容器内液体流中的不同点,但是大多数液体以旋涡方式流动。
根据本发明的方法,人乳被保留在用于容纳乳的容器中,并赋予乳旋涡流动。向乳施加速度充分降低的旋涡流动促进污染物暴露于UV,同时维持乳的一致性。即,通过向乳施加速度充分降低的旋涡流动,可避免乳的一致性发生不期望的改变,例如因施加于乳而导致乳脂肪球聚结形成黄油。本文使用的速度指旋转速度或旋转强度。因此,速度充分降低的旋涡流动是旋转速度或强度被降低以不赋予乳不期望变化的旋涡流动。流动还必须使得速度被充分降低,但流动是连续的使得乳持续移动从而确保其促进乳中的污染物暴露于UV光而不赋予乳任何不期望的物理损害。
可能存在一些流动的混乱或混合以及一些湍流,这可发生在容器内液体流中的不同点,但是大多数液体以旋涡方式流动。可能发生的混乱或混合以及湍流促进乳中的污染物暴露于UV光。
可通过技术人员已知的任何方式来赋予乳旋涡流动。这使乳能够以平缓的方式流动,从而促进乳中的污染物暴露于UV光而不赋予乳任何不期望的物理损害,例如在乳表面上形成黄油-油层或形成黄油。在一个优选实施方案中,通过涡旋(vortex)来赋予旋涡流动,而涡旋使用磁棒和旋转磁棒的装置来产生。在又一个优选实施方案中,所述旋转磁棒的装置是磁搅拌器。
在实践中,但不局限于该实例,磁棒被放置在用于容纳乳的容器中。通过用磁搅拌器旋转磁棒来获得低速涡旋并由此获得乳的低速旋涡流动。磁棒的尺寸可根据所需处理的乳体积和容器尺寸而不同。例如,当使用较大的容器来容纳乳时,可采用较大的磁棒。或者,当需要对较小体积的乳进行处理时,可使用较小的磁棒。类似地,磁棒的旋转速度也可不同。例如,当使用较大体积的乳或较小的乳容纳容器时,可分别将磁棒的旋转速度增加或降低至维持旋涡流动并促进乳制品中的生物污染物暴露于UV光的速度。
因此,可在产生足够快的流动以获得微生物的最佳UV-C光子暴露和使人乳受到损害的风险最小化之间进行平衡。这可通过调节旋转速度和/或搅拌方法来实现。此外,可对搅拌装置的尺寸和形状进行调整以减小剪切力。还可使用旋转容器。
如本文所例示的,可使用以500rpm速率旋转的8×40mm磁棒或其等效物来向容纳400ml液体之容器中的380ml人乳施加速度充分降低的旋涡流动。
参考图1,本文所例示设备的一个优选实施方案包括:容器(1),其用于容纳一定体积的乳制品(2),其中乳制品中引入有UV光源(3)。向乳制品引入UV光源能够使乳制品中存在的污染物暴露于UV光,继而可在足够量的暴露后将污染物灭活。赋予乳旋涡流动以促进污染物暴露于UV;在此优选实施方案中,使用磁棒(4)并使其以足以产生并维持涡旋的速率旋转来产生旋涡流动。通过使用磁搅拌器(5)来使磁棒旋转。可对磁搅拌器进行控制以指定磁棒的旋转速率,从而向乳施加低速旋涡流动并得以维持。
图11示意性地示出了根据本发明一个实施方案的设备的结构布置。这种设备布置包括具有基座(6)的支架(8),其中基座(6)内并入有磁搅拌器(5)(用于驱动磁棒(4))。优选地,将基座(6)配置成使得当将容器(1)放置在其上时其适当地对容器(1)进行定位并将其托住。容器(1)包括具有孔(12)的盖(10),其中盖(10)可相对地附接至容器(1)从而使容器内乳制品的溢出和污染最小化。支架(8)包括具有电插座(20)的顶部结构(18),而电插座内插入有UV光源(3),UV光源(3)是灯。当将容器(1)放置在基座(6)上时,顶部结构(18)延伸到容器(1)上方,从而支持通过盖(10)中之孔(12)的UV灯(3)并将其定位在容器(1)内的合适深度处。用于驱动搅拌器(5)的电连接和用于UV灯(3)的插座(20)通过电缆(14)和插头(16)来与普通/家用GPO连接。可以预期,可将该设备的独立组件包装,单独包装和销售或者作为单元/单个包装连同该设备的使用说明书一起包装和销售,所述独立组件,即合并基座(6)与磁搅拌器(5)的支架(8)、顶部结构(18)、插座(20)以及电缆和插头(14/16)、UV灯(3)、容器(1)和盖(10)以及磁棒(4)。
在一个优选实施方案中,所述设备包括其中可直接排出、收集或储存一定体积人乳的容器。个体在任何给定时间所排出的母乳体积具有大量的个体间差异。研究已证明,可排出的母乳平均重量可为约30克至约150克(即约30ml至150ml)。在一个优选实施方案中,所述容器用于体积为约30ml至约10000ml的人乳。在一个优选实施方案中,所述容器用于体积为选自以下的人乳:50ml、100ml、200ml、300ml、400ml、500ml、600ml、700ml、800ml、900ml、1000ml、1100ml、1200ml、1300ml、1400ml、1500ml、1600ml、1700ml、1800ml、1900ml、2000ml、2500ml、3000ml、3500ml、4000ml、4500ml、5000ml、5500ml、6000ml、6500ml、6500ml、700ml、7500ml、8000ml、8500ml、9000ml、9500ml和10000ml。
所述容器可以是封闭式或开放式的并且可由任何合适的材料构成,所述材料包括玻璃、不锈钢或食品级材料,包括选自包括以下之组的塑料:聚对苯二甲酸乙二醇酯(Polyethylene Terephthalate,PET)、高密度聚乙烯(High Density Polyethylene,HDPE)、低密度聚乙烯(Low Density Polyethylene,LDPE)、聚氯乙烯(Polyvinyl Chloride,PVC)和聚丙烯(Polypropylene,PP)。
在一个优选实施方案中,所述设备还包括适合与容器接合的盖。或者,所述容器适合接受盖。所述盖例如(盖子(1id))能够防止从容器泄漏或溢出。所述盖还可起防止在容器中保留的乳制品暴露于UV光期间或在暴露后(例如在乳制品储存期间)向容器中引入污染物的作用。在另一优选实施方案中,所述盖适合接受UV光源和/或赋予所述容器内的乳旋涡流动的装置。
例如,所述盖可适合例如通过可打开和关闭的孔接受UV光源和/或赋予所述容器内的乳旋涡流动的装置。
所述UV光源可包括一个或更多个UV灯。所述UV灯可具有任何特定的形状或尺寸。在一个优选实施方案中,所述UV光源发射优选250nm至270nm,最优选254nm的UV-C。可将UV光源布置成使得其位于容器的内部或外部并以足以使容器内的人乳制品暴露于UV光(优选UV-C)的任何特定方式定向。当将UV光源定位在容器的外部时,可将一个或更多个UV灯定位在容器周围的不同点。在一个优选实施方案中,将UV光源引入到容器中以与容器中的人乳制品接触。在某些实施方案中,当UV光源位于容器的外部时,将由允许UV光源充分透射通过容器表面的材料来形成容器,优选地容器吸收最少的UV光。
图12示意性地示出了根据本发明一个实施方案的设备的结构布置,其中UV光源位于容器的外部。这种设备布置包括具有基座(6)的支架(8),其中基座(6)内并入有磁搅拌器(5)(用于驱动磁棒(4))。优选地,将基座(6)配置成使得当将容器(1)放置在其上时其适当地对容器(1)进行定位并将其托住。容器(1)包括盖(10),其中盖(10)可相对地附接至容器(1)从而使容器内乳制品的溢出和污染最小化。支架(8)包括电插座(20),而电插座内插入有UV光源(3),UV光源(3)是灯。当将容器(1)放置在基座(6)上时,支架(8)延伸至紧邻容器(1),从而支持UV灯(3)并将其定位在适当邻近容器(1)的地方。用于驱动搅拌器(5)的电连接和用于UV灯(3)的插座(20)通过电缆(14)和插头(16)来与普通/家用GPO连接。可以预期,可将该设备的独立组件包装,单独包装和销售或者作为单元/单个包装连同该设备的使用说明书一起包装和销售,所述独立组件,即合并基座(6)与磁搅拌器(5)的支架(8)、插座(20)以及电缆和插头(14/16)、UV灯(3)、容器(1)和盖(10)以及磁棒(4)。
赋予乳旋涡流动的装置可包括搅拌装置,其包括顶部搅拌器和磁搅拌器。顶部搅拌器可包括一端设置有叶片的轴,其可被引入到液体中并且在乳中旋转从而产生旋涡流动。或者,可使用磁搅拌器。或者,可移动或旋转容纳乳的容器以赋予旋涡流动。在一个优选实施方案中,适合赋予乳旋涡流动的装置是磁体和磁搅拌器。在操作中,磁搅拌器向磁体施加磁力,所述磁力导致磁体旋转,从而在乳制品中产生涡旋并由此赋予乳旋涡流动。或者,可将容器相对于UV源移动以产生涡旋并由此产生乳的旋涡流动。
所述磁体可具有任何合适的形状或尺寸。优选地,所述磁体是磁搅拌棒。磁棒的尺寸可根据所需处理的乳体积和容器尺寸而不同。例如,当使用较大的容器来容纳乳时,可采用较大的磁棒。或者,当对较小体积的乳进行处理时,可使用较小的磁棒。在一个优选实施方案中,所述容器适合容纳400ml的人乳制品并且所述磁棒是8×40mm。当将8×40mm的磁棒以500rpm旋转时,可产生涡旋以赋予适合容纳400ml之容器中的380ml体积人乳充分地旋涡流动。
根据另一个实施方案,UV光源可作为向乳施加涡旋的装置来运行。例如,可将UV灯引入容器内保留的乳中并使其移动以产生涡旋并由此产生乳的旋涡流动。例如,可将UV灯插入到容器内保留的一定体积乳中,并以搅拌方式旋转以产生涡旋并由此产生乳的旋涡流动。
根据另一方面,本发明提供了根据本说明书中所述的方法制备的人乳制品。可以预期的是与未经巴氏消毒的人乳制品相比,根据本发明方法制备的人乳制品(乳制品中存在的污染物已灭活和/或减少)可储存更长的时间。另外,与已使用热方法进行巴氏消毒的人乳制品相比,根据本发明的乳制品将具有更优的生物活性。
现在,将参考以下非限制性实施例对本发明进行更全面的描述。
实施例
实施例1-乳的UV暴露
10份冷冻的人乳样品由过量乳供应的母亲捐赠。在实验之前,乳储存在-20℃冰箱中。使用中红外分析仪测定人乳样品中的总固体(HMA一人乳分析仪(Human Milk Analyser),Miris AB,Uppsala,Sweden)。然后,将样品离心(Allegra X-12R,Beckman Coulter Inc.,Brea,CA,USA)并通过移除或添加相同人乳样品的乳脂来调节总固体含量。在这10份样品中,最终的样品总固体含量为107g/l至146g/l。总结提供在表1中。
表1:人乳样品中的总固体、总蛋白质、乳糖和脂肪
将各个人乳样品(380ml;n=10)转移到400ml PYREX玻璃烧杯No.1003中。将部分覆盖(211mm弧长中开放57mm)的杀菌UV-C灯(253.7nm的95%UV-输出)(GPH287T5L,Infralight Pty Ltd,Helensburgh,NSW,Australia)放入玻璃烧杯中(图1)。
该打开57mm之灯的UV输出是1.1w。在进行UV--C处理期间,将杀菌UV-C灯(253.7nm的95%UV-输出)(GPH287T5L,Infralight Pty Ltd,Helensburgh,NSW,Australia)沿对角线放入容器中(图1)。在进行UV-C处理期间,将乳用8×40mm磁搅拌器棒(C-MAG HS 7,IKA,Staufen,Germany)以500rpm搅拌以产生低速涡旋。使人乳暴露于UV-C,并在不同时间点采取1ml样品并将其分配到管中以用于进行不同的分析。将用于进行酶和脂肪酸分析(在下文中描述)的等份样品冷冻保存在-80℃直至进行测定。细菌分析立即进行。
实施例2-细菌分析
将表皮葡萄球菌(ATCC 12228)、阴沟肠杆菌(ATCC 27508)、蜡样芽孢杆菌(ATCC 10702)(American Type Culture Collection Inc,Manassas,VA,USA)和大肠杆菌K12(ATCCl498,Southern Biological,Nunawading,Vic,Australia)在33℃下在营养肉汤(Nutrient Broth No.2,Oxoid Australia Pty Ltd,Adelaide,SA,Australia)中培养过夜。将金黄色葡萄球菌(ATCC 6538)(American Type Culture Collection Inc,Manassas,VA,USA)在33℃下在胰胨豆胨培养液(BBLTrypticase Soy Broth,Becton Dickinson&Co,Franklin Lakes,NJ,USA)中培养过夜。然后,使用光密度方法用之前构建的标准曲线对细菌进行计数。将培养物稀释并接种到总固体经调节的人乳样品中直至乳库中具有最大接受浓度105CFU/ml(菌落形成单位/毫升)。
当按照实施例1用紫外光照射时,观察到大肠杆菌、表皮葡萄球菌、阴沟肠杆菌、蜡样芽胞杆菌和金黄色葡萄球菌随时间发生指数减少。这五种不同物种细菌的十进制减少剂量无显著差异,分别为594±265J/l、569±209J/l、565±178J/l、640+189J/l和635±268J/l。
发现在人乳中测量的总固体与十进制减少剂量之间具有高正相关性(P<0.01)。这些样品的总固体浓度为107.0g/l、110.5g/l、120.0g/l、121.0g/l、125.0g/l、126.0g/l、131.5g/l、133.0g/l、139.5g/l和146g/l,而相关的十进制减少剂量分别为289±17g/l、396±52g/l、470±51g/l、454±36g/l、380±39g/l、437±72g/l、774±98g/l、805+74g/l、721±64g/l和945±164J/l(图2)。
实施例3-胆汁盐激活脂肪酶活性
使用脂肪酶测定试剂盒(QuantiChrom Lipase Assay Kit,BioAssay Systems,Hayward,CA,USA)测定了人乳中的胆汁盐激活脂肪酶(BSSL)活性。将实施例1中的冷冻(-80℃)人乳样品(n=10)解冻,并调至37℃、用DDI(1/100,v/v)稀释,之后根据试剂盒说明书以一式两份方式进行测定。用分光光度计(PowerWave,Biotek,Winooski,VT,USA)测定吸光度并根据试剂盒说明书中的公式将其转换成BSSL活性/毫升(U/ml)。在96孔板测定中,试剂盒的线性检测范围为40U/ml至1600U/ml脂肪酶活性。单位定义:1单位酶在测定条件下(pH 8.5)每分钟催化切割1.0μM底物。组内的变异系数<7%。
未经处理的人乳样品具有116.5±36.6U/ml的BSSL活性。按照实施例1中用1389J/l、2084J/l、2779J/l、3474J/l和4863J/l的UV-C剂量处理之后,BSSL活性未显著下降,分别为113.1±34.0U/ml、112.7±33.3U/ml、114.3±34.6U/ml、113.6±33.7U/ml和115.3±34.4U/ml(n=10)。
实施例4-碱性磷酸酶测定
碱性磷酸酶(ALP)引起对硝基苯基磷酸酯被水解并形成黄色络合物,而该黄色络合物之在405nm下测量的强度与样品中的ALP浓度成正比。使用基于Walter和Schütt(23)的酶测定来分析ALP活性。将实施例1中的冷冻(-80℃)人乳样品解冻并调至37℃、用DDI(1/4,v/V)稀释、以一式两份方式向96孔板中的135al底物(1M二乙醇胺,0.5mM MgCl2,pH 10.3)添加5μl样品。然后,向孔中添加10μl显色剂(10mM对硝基苯基磷酸酯)并将板在37℃下孵育30分钟。用分光光度计在405nm下测定吸光度(PowerWave,Biotek,Winooski,VT,USA)并使用标准曲线将其转换成碱性磷酸酶活性/毫升(U/ml)。单位定义:1单位酶在测定条件下每分钟水解1.0mM硝基苯基磷酸酯。回收率测定是94±9%并且测定内差异<6%。
未经处理的人乳样品的ALP活性为0.200±0.050U/ml。在如实施例1中用2084J/l、3474J/l和4863J/l的UV-C剂量处理之后,ALP活性未显著降低,分别为0.199±0.056U/ml、0.199±0.047U/ml和0.204±0.057U/ml(n=10)。
当在过度暴露实验中,与使微生物负荷降低5-log10所需要的相比对人乳进行显著更久的处理时,发现10,400J/l、62,526J/l和239,684J/l的UV-C剂量使ALP活性保留率显著降低,分别为79.8±7.1%、53.4±20.2%和40.6±15.0%(n=3)(图3)。
实施例5-脂肪酸分析
使用基于Mitoulas等(24)的萃取和酯交换方法对脂肪酸(FA)进行分析。用氯仿/甲醇(2/1,v/v)萃取FA并使用丁基化羟基苯甲醚作为抗氧化剂。使用甲醇中的1%H2SO4通过酸转甲基作用由乳脂萃取物制备FA甲酯。然后,将脂肪酸甲酯通过气相色谱法(GC-2010,Shimadzu Co.,Kyoto,Japan)使用涂有0.25μm BPX-70(SGE Pty Ltd.,Ringwood,VIC,Australia)之内径为0.32mm的50m毛细管柱进行分离和量化。然后,将每个样品(3μl)用自动注射器(AOC-20i,Shimadzu Co.,Kyoto,Japan)以20∶1的分流比注射到柱中。将注射器温度设置在250℃并将检测器(火焰电离)温度设置在300℃。炉的初始温度是130℃。将温度初始编程成在5分钟内上升至155℃,然后在1分钟内慢慢上升至165℃,接着在5分钟内上升至230℃,最后在10分钟内上升至250℃,并将其在此保持5分钟。使用速度为4ml/分钟的氦气作为载气。根据相对于真实脂质标准物的保留时间鉴定了脂肪酸(Sigma-Aldrich Co.,St Louis,MO,USA)。将各个FA峰以FA峰之下的总面积进行量化。5次单独萃取之FA峰之下的面积的变异系数<4.2%。
在如实施例1中进行UV-C处理期间,FA浓度在各个未经处理的样品间具有较大差异,但并未显著改变。对实施例1中的10份人乳样品进行分析并在全部10份样品中检测到所有的脂肪酸(FA),除在9个样品中检测到FA 17:0、20:5n3、20:0和22:1n9以及在8个样品中检测到FA18:2tt之外。FA 8:0的浓度最低而c-18:1n9的浓度最高,其中未经处理的中值面积分别为11,270(4233至24,513)和6,819,353(1,157,398至11,613,614)。以4863J/lUV-C处理的那两种FA的中值面积分别为13,304(3612至30,132)和7,285,795(1,067,547至13,459,439)(图4)。
因此,UV-C照射促进所需要的营养型细菌污染物发生的减少并保护热敏感性酶(例如BSSL和ALP)而不改变FA,从而提高捐赠人乳的质量。
实施例6-通过UV暴露来灭活病毒
将鼠或人CMV接种到细胞培养基或经巴氏消毒的母乳中并分配到容器中以提供0.5mm的层。然后,使样品在离UV-C光源1cm、2cm、3cm和4cm的距离处暴露于UV光源,持续10秒、20秒、30秒或60秒的时间。UV光源的距离差异有利于向样品递送不同剂量的UV。随后,使用噬菌斑测定或组织培养感染剂量(Tissue Culture Infective Dose)(TCID)50测定来评价样品中存在的病毒的灭活。
对于噬菌斑测定,使用经连续稀释的鼠CMV(MCMV)病毒储备液或掺有MCMV的母乳来接种鼠胚胎成纤维细胞(Murine Embryonic Fibroblast,MEF)。在于37℃、5%CO2下孵育1小时之后,将接种物吸出并洗涤所有的孔。将洗涤液吸出并用0.5%甲基纤维素/MEM+2%NCS在细胞上铺层。将板在37℃、5%CO2下孵育4天至5天并用每孔1mL亚甲蓝噬菌斑测定染色剂进行染色。在于室温下2天至3天后,将染色剂洗去并将板风干,之后进行噬菌斑计数。根据以下公式计算病毒滴度:噬菌斑形成单位(pfu)/ml=每孔的噬菌斑数目×稀释因子×5。该测定的结果示于下面的表2中:
表2:通过暴露于UV光灭活MCMV
I=噬菌斑形成单位/ml。
T=未检测到噬菌斑。
这些数据证明暴露于UV光能够将人乳中存在的病毒灭活。
对于TCID 50测定,制备掺有人CMV(HCMV)的培养基或母乳。将以不同距离暴露于UV或未经处理的两复制份之培养基或乳连续稀释,之后加入培养的人包皮成纤维细胞(HFF)并孵育3周。随后,以每天为基础评价经处理或未经处理之样品中存在的病毒的致细胞病变效应。基于Reed和Muench(Reed LJ,Muench HA.The American Journal of Hygiene.1938;27:493-497)的方案使用由Brett D.Lindenbach(耶鲁大学,Yale University)建立的计算图表来分析结果。将值以TCID50/ml提供。
该研究的结果证明使含有病毒的人乳暴露于UV光能够将病毒灭活从而导致病毒感染细胞的能力降低。实际上,以1cm、2cm和3cm暴露的乳样品的TCID 50/mL值低于检测水平(图5)。
虽然没有在人乳被容纳在容器中并经受旋涡流动的条件下进行本实施例的实验设计,但是测定结果允许技术人员发表预测,在这样的条件下将发生类似或更大的病毒灭活水平。根据一个预示性实施例,将复制份的人乳样品掺加限定剂量的病毒。然后,按照实施例1中所述使乳样品暴露于UV光。随后,可使用噬菌斑形成测定或TCID50测定评价相比于未暴露于UV的掺加样品,以不同UV暴露量暴露于UV之乳中的病毒灭活程度。基于实施例6中获得的数据,技术人员能预测到增加UV暴露与病毒灭活增加有关。
实施例7-经UV处理之乳和经保温巴氏消毒之乳的抑菌性能
保温巴氏消毒法:
将由母亲捐赠之10份冷冻人乳样品(实施例1)中每一份的一部分(1.6ml;n=10)转移到2ml聚丙烯微小管中。然后,将样品放置在预热的水浴(CC-1,Huber GmbH.Offenburg,Germany)中并调至62.5℃,持续30分钟,随后立即在冰浴中冷却。将样品冷冻保存在-80℃直至进行实验室分析。
抑菌性能分析
将大肠杆菌K12(ATCC1498,Southern Biological,Nunawading,Vic,Australia)和金黄色葡萄球菌(ATCC6538,American Type Culture Collection Inc,Manassas,VA,USA)在37℃下的营养肉汤(Nutrient BrothNo.2,Oxoid Australia Pty Ltd,Adelaide,SA,Australia)中培养过夜。在使用光密度方法用之前构建的标准曲线计数后,将培养物稀释并接种到未经处理、经UV-C照射和经保温巴氏消毒的样品中直至大肠杆菌和金黄色葡萄球菌的细菌负荷为2000CFU/ml(菌落形成单位/毫升)。在接种后立即以及在于37℃下孵育2小时后,将所有的样品以一式两份方式铺到伊红亚甲蓝琼脂和甘露醇盐琼脂上(Oxoid Australia Pty Ltd,Adelaide,SA,Australia/Plain agar,Southern Biological,Nunawading,Vic,Australia)。然后,将平板在37℃下孵育过夜并根据每毫升的菌落形成单位(CFU/ml)计数菌落数目以确定细菌数目。
在37℃下的2小时孵育时间内,大肠杆菌和金黄色葡萄球菌的生长速率没有差异(p=0.69)。因此,将这两个物种分组在一起用于进行其余的统计学分析。
未经处理的人乳的细菌生长速率为2.7±1.1倍/小时。
经UV-C照射的人乳(4683J/1)的细菌生长速率为3.1±0.9倍/小时。该生长速率与未经处理的乳相比无显著差异(p=0.75)。
经保温巴氏消毒的人乳的细菌生长速率为5.1±1.4倍/小时。经保温巴氏消毒之人乳的细菌生长速率显著高于未经处理和经UV-C照射的人乳两者(p<0.001)。
营养肉汤的细菌生长速率为5.9±1.5倍/小时,这与经保温巴氏消毒的人乳相比并无显著差异(p=0.13),但要显著高于未经处理和经UV-C照射的人乳两者(p<0.001)(图6)。
实施例8-UV处理和保温巴氏消毒后人乳中的免疫蛋白浓度
按照实施例1和7中所述,分别对10份人乳样品进行UV处理或保温巴氏消毒。
使用此前所述的标准夹心ELISA方法(Czank C,等Pediatr Res 2009;66:374-379)来量化人乳样品中的slgA和乳铁蛋白含量。所有的抗体和标准物均购买自MP Biomedicals Australasia(New South Wales,Australia)。slgA的回收率测定是85±4%(n=6),而乳铁蛋白的回收率测定是82±9%(n=6)。使用人溶菌酶酶免疫测定(EIA)试剂盒(Biomedical Technologies,Inc.,MA)根据生产商的使用说明来量化人乳样品中的溶菌酶含量。
这些测定的结果示于下面的表3中。
表3:未经处理、经UV-C照射和经保温巴氏消毒的样品中的免疫蛋白浓度(平均值±SD,n=10)。
*p<0.05,**p<0.001
与未经处理的样品相比,经3474J/l剂量UV-C照射的样品具有显著较低的slgA浓度(p=0.036)和溶菌酶浓度(p=0.032)。当用4683J/l进行处理时,两种蛋白质的显著性均上升至p<0.00l。所使用的剂量未显著降低乳铁蛋白的浓度(p=0.28)。
在总固体浓度较高的情况下观察到较大的溶菌酶保留率(p<0.001)(图7)。对于人乳中总固体的每个附加g/l,溶菌酶的保留率增加0.55%百分点。在UV-C照射后,在总固体浓度和slgA(p=0.45)或乳铁蛋白保留率(p=0.23)之间没有发现显著的相关性。
在保温巴氏消毒后观察到slgA、乳铁蛋白和溶菌酶显著减少(p<0.001)(表2)(图8)。在保温巴氏消毒期间,在总固体浓度与免疫蛋白保留率之间没有发现相关性(P=0.76)。
实施例9-人乳的免疫蛋白浓度和抑菌性能
在考虑不同处理(未经处理、UV-C照射、保温巴氏消毒)的可能影响之后,当slgA(p<0.001)、乳铁蛋白(p<0.001)和溶菌酶(p<0.019)单独具有较高的浓度时,每小时的细菌生长速率较低,并且对三者一起的和而言也同样如此(p<0.001)(图9)。人乳样品显示slgA浓度和乳铁蛋白浓度之间具有高相关性(p<0.001),但是在slgA和溶菌酶(p=0.35)之间以及在乳铁蛋白和溶菌酶(p=0.25)之间并未发现显著的相关性(图10)。
实施例10-UV-C处理和保温巴氏消毒后的抗氧化活性
在乳房排出和储存期间,使排出的人乳暴露于氧、光、电离辐射和温度变化。环境应激(例如巴氏消毒)可引起人乳中产生活性氧类别(ROS)。温度升高可导致较高的细胞ROS产生并可超过细胞的抗氧化能力,随后导致ROS浓度增加。
人乳包含抗氧化成分,例如乳过氧化物酶、髓过氧化物酶、谷胱甘肽过氧化物酶、过氧化氢酶、超氧化物歧化酶、乳铁蛋白、维生素C和维生素E。本实施例研究了人乳中的过氧化氢(H2O2)状态并研究了保温巴氏消毒或UV-C照射是否改变人乳中的H2O2水平并由此改变其抗氧化成分的活性。
人乳样品是捐赠而来的并在进行试验之前将其储存于-20℃冰箱中。用紫外线或保温巴氏消毒法处理样品。
(a)紫外线处理
将每份人乳样品的一部分(150μl)放置在UV-C灯(254nm下为4w,40mW/cm2@1米,GPH287T5L,Infralight Technology,Helensburgh,NSW,Australia)之下8mm距离的0.4mm层中并照射3分钟,如图13中所示。在这些条件下,需要10秒的处理时间以使人乳中的巨细胞病毒减少(Marchant,2011)。
(b)保温巴氏消毒法
将每份人乳样品的一部分(1.6ml)转移到2ml聚丙烯微小管中。将样品放置在预热的水浴(CC-1,Huber GmbH.Offenburg,Germany)中,之后调至62.5℃,并保持30分钟,随后立即将样品在冰浴中冷却至4℃,随后进行分析或者使其暴露于进一步的处理。
(c)过氧化氢酶和H2O2处理
将每份未经处理、经UV-C照射和经保温巴氏消毒之人乳样品的等份试样用10U/ml过氧化氢酶(Sigma-Aldrich Co.,St Louis,MO,USA)处理并在室温下孵育15分钟。将每份未经处理、经UV-C照射和经保温巴氏消毒之人乳样品的另一部分用10μN H2O2处理并在室温下孵育15分钟。
(d)测量过氧化氢
使用Amplex red测定(Life Technologies,Carlsbad,CA,USA)来检测过氧化氢活性并在544nm激发和590nm发射下读数,闪光10次。
在UV-C处理前(图14,时间=-1分钟),人乳的荧光读数为803±134。紧接UV-C照射(0分钟)后,荧光读数显著更高,为11,519±8250。UV-C处理3分钟后,荧光读数为1,238±905,而6分钟后荧光读数为628±187,并保持稳定直至45分钟(图14)。
未经处理的人乳(UHM)的荧光读数为UHM、具有10U/ml过氧化氢酶的UHM以及具有10μN H2O2的UHM分别为937±112、958±117和935±129(n=6)。UV-C照射的人乳(UVHM)的荧光读数为UVHM、具有10U/ml过氧化氢酶的UVHM以及具有10μN H2O2的UVHM分别为1,014±12、1,025±137和1,143±109(n=6)。保温巴氏消毒的人乳(HPHM)的荧光读数为HPHM、具有10U/ml过氧化氢酶的HPHM以及具有10μN H2O2的HPHM分别为1,155±1049、363±125和4,381±2657(n=6)(图15)。
总而言之,未经处理和经UV-C照射的人乳具有基线的H2O2,并具有使该基线水平保持不变的调节过程。UV-C照射使人乳中产生H2O2,但是在处理后3分钟内其降回至处理前水平。经保温巴氏消毒的人乳丧失其调节过程并且可通过环境应激来改变H2O2水平。该发现表明UV-C照射不对人乳中的抗氧化成分造成显著损害。
虽然本发明的前述书面描述能够使普通技术人员利用和使用目前被认为是本发明最佳的模式,但是普通技术人员应理解和意识到存在本文之特定实施方案、方法和实施例的变化形式、组合和等同方案。因此,本发明应不限于上述实施方案、方法和实施例,而是本文广泛描述的本发明范围和精神内的所有实施方案和方法。
- 还没有人留言评论。精彩留言会获得点赞!