饲喂动物的方法与流程
题为“饲喂动物的方法”的本国际专利申请要求以下专利申请的优先权,并通过引用将其全部内容并入本文:由M.Hilbertetal.于2015年2月12日提交的并转让给CANTechnologies,Inc.(docketno.N00255USP3)的题为“MethodofFeedinganAnimal”的美国临时专利申请No.62/115,412,由M.Hilbertetal.于2014年8月1日提交的并转让给CANTechnologies,Inc.(docketno.N00255USP2)的题为“MethodOfFeedingAnAvianAnimal”的美国临时专利申请No.62/031,977;以及由M.Hilbertetal.于2014年5月30日提交的并转让给CANTechnologies,Inc.(docketno.N00255USP1)的题为“MethodOfFeedingAnAvianAnimal”的美国临时专利申请No.62/005,084。
技术领域:
本公开一般涉及饲喂动物。本公开的方面特别涉及给单胃动物饲喂包括具有多酚源的维生素E的饮食。
背景技术:
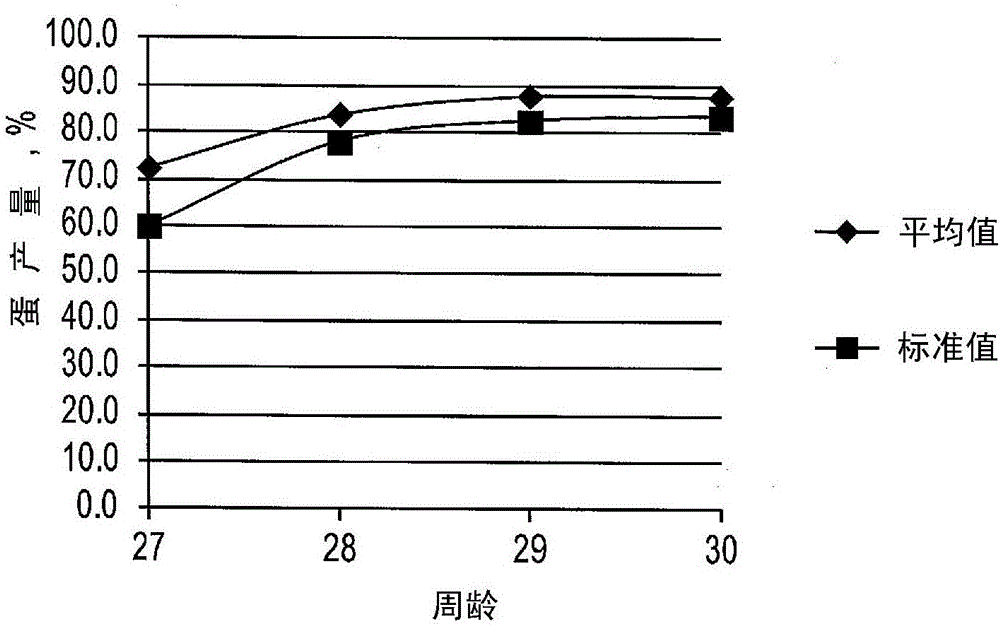
:综合家禽农场主饲养肉鸡种鸡产蛋、在自己的孵化场孵育鸡蛋、喂养后代长成直到宰杀。收入主要来自产出的家禽肉的数量减去饲喂肉鸡种鸡、运营孵化场、饲喂后代产生的费用及其它费用(例如,家禽舍)。胚胎依赖用于正常生长和发育的蛋内所有必需营养物的供应。已知蛋中的营养物质的供应源于母体营养和种鸡母鸡的新陈代谢。如果可以在母体饮食中做出会影响胚胎发育和后代生长的改变,那么这种改变可能要比改变后代饮食来改进表现更有成本效益。例如,转让给DSMIPAssetsB.V.的题为“USEOFCANIHAXANTHINAND/OR25-OHD3FORIMPROVEDHATCHABEJTYINPOULTRY”的欧洲专利申请No.EP2358214涉及使用角黄素来改进家禽的孵化率。一只肉鸡种鸡每年生产约一百只肉鸡。因此,由于种鸡营养的变化引起的后代表现的小的改进可以对由后代造成的产量具有重大影响。同样,饲养牛、猪、羊和许多其它动物的动物饲养者的成功和利润在很大程度上取决于产生大量可存活后代的能力。因此,通过确保较大百分比的受精卵成熟为可存活的后代来增加出生率是可取的。技术实现要素:公开了一种给动物饲喂包含维生素E和多酚源的组合物的方法。动物可以包括单胃动物,例如禽类动物和猪动物。在一些实施方式中,饲喂维生素E和多酚源改进了动物的表现,该表现由其繁殖表现和所得到的后代所测定。在其它实施方式中,动物显示了动物及其后代的抗氧化状态的改进。在一些实施方式中,维生素E可以被多酚源替换。本发明的一个方面公开了一种改进禽类动物的表现的方法,所述方法包括:给禽类动物饲喂组合物作为其饲料配给的部分,所述组合物包含:维生素E;和多酚源;开始给禽类动物饲喂所述组合物后,收集由禽类动物产生的受精卵;孵育受精卵直到其孵化以提供后代;并且使后代生长(growingouttheoffspring);其中与饲喂不含所述组合物的饲料配给的禽类动物相比,表现得到改进。本发明的另一方面公开了一种改进禽类动物的表现的方法,所述方法包括:给禽类动物饲喂组合物作为其饲料配给的部分,所述组合物包含:维生素E;和多酚源;其中饲料配给中存在添加水平为约10ppm至约200ppm的维生素E,并且组合物中维生素E的添加水平与多酚源的添加水平的比例为维生素E比多酚源约1:1,开始给禽类动物饲喂所述组合物后约8周收集由禽类动物产生的受精卵;孵育受精卵直到其孵化以提供后代;并且使后代生长,其中与饲喂不含所述组合物的饲料配给的禽类动物相比,表现得到改进。本发明的另外其它方面公开了一种改进猪动物的生产力的方法,包括:给所述猪动物饲喂组合物作为饲料配给的部分,所述组合物包含:维生素E;和多酚源,其中与饲喂不含所述组合物的饲料配给的动物相比,生产力得到改进。本发明的其它方面包括一种改进猪动物的生产力的方法,包括:给所述猪动物饲喂组合物作为饲料配给的部分,所述组合物包含:维生素E;和多酚源;其中饲料配给中存在添加水平为约1ppm至约300ppm的维生素E,并且所述组合物中维生素E的添加水平与多酚源的添加水平的比例为维生素E比多酚源约1:1。附图说明图1是实施例1的与Cobb500FF的生产标准相比的体重发育的图表。图2是实施例1的与Cobb500FF的生产标准相比的产蛋率的图表。图3是实施例1的与Cobb500FF的生产标准相比的蛋重的图表。图4是实施例5的基于肉鸡种鸡处理的孵化率的总结果的图表。图5是实施例5的基于肉鸡种鸡处理的空蛋百分比、早期、中期、晚期和总胚胎死亡率的图表。图6是显示实施例6的肉鸡种鸡处理对后代的整体饲料增重比的影响并对该影响针对最终体重的饲料增重比做校正的图表。图7是显示实施例7的前实验期(49-56周)和实验期(56-64周)期间提供的饲料量的图表。图8是显示实施例7的实验期(56-64周)期间具有各种饮食的种鸡的平均产蛋百分比的图表。图9是显示实施例9的LPSIgG滴度相对于肉鸡种鸡处理和年龄的反应的图表。图10是显示实施例9的HuSA特异性滴度相对于雏鸡年龄的反应的图表。图11是显示实施例9的LPS滴度相对于肉鸡种鸡处理的反应的图表。具体实施方式本公开的多个实施方式的具体细节在下文中参考动物进行说明。本公开的多个实施方式的其它具体细节在下文中参考改进动物(例如禽类或猪动物)的表现(例如后代表现或动物繁殖表现)的方法进行说明。例如,在一个实施方式中,所公开的方法是一种包括给动物饲喂包含维生素E和多酚源的组合物作为其饲料配给的部分的方法。在一些实施方式中,给动物饲喂其饲料配给的方法包括饲料配给中存在添加水平为约10ppm至约100ppm的维生素E,并且组合物中维生素E的添加水平和多酚源的添加水平的比例为维生素E比多酚源约1:1,,开始给禽类动物饲喂组合物后约5周收集由禽类动物产生的受精卵,孵育受精卵直到其孵化以提供后代,并使后代生长,在这种情况下,与不包含组合物的饲料配给饲喂的禽类动物产生的后代相比,后代表现被改进。本公开中使用的术语“动物”包括单胃动物和反刍动物。如在本公开中所使用的,术语“单胃”是指具有简单单室胃的任何生物体。这种单胃动物包括但不限于猪、马、山羊、绵羊、禽类动物、海产(水产养殖)动物。如在本公开中所使用的,禽类单胃动物包括家禽。本公开中使用的术语“家禽”意指驯养的飞禽,包括用于生产肉或蛋的鸡、火鸡、鹅、鸭、鸵鸟、鹌鹑和雉鸡。鸡包括用于产蛋的“产蛋鸡”和用于产肉的“肉鸡”。鸡还包括“种鸡”,即达到性成熟年龄并且可产蛋的禽类。在一些实施方式中,禽类动物选鸡、火鸡、鸭和鹅。在一些实施方式中,禽类动物是鸡。适用于本公开的实施方式中的鸡可以属于许多可能的鸡品种中的一种,包括例如Ross,Cobb,IsaBrown,Hubbard,Shaver,AtborAcres,IndianRiver,Peterson和Dekalbwhite。在一些实施方式中,鸡可以是Ross鸡。猪单胃动物包括例如待肥育猪和种猪,包括仔猪、母猪、小母猪、阉猪和公猪。如在本公开中所使用的,术语“反刍动物”是指具有多隔室胃的任何哺乳动物并且与通过反刍和重复咀嚼食团(bolus)或反刍的食物的消化相关。这种反刍哺乳动物包括但不限于牛动物,如水牛、野牛和所有家牛,包括小牛、阉牛、小母牛、母牛和公牛。虽然说明书主要涉及禽类和猪动物,但是其并不限于此,并且应当理解,本公开适用于其他单胃动物和反刍动物。已知的是,当抗氧化剂包括在动物饮食中时,其保护细胞免受由自由基和过氧化物引起的损害。有不同类型的可用于饲喂动物(例如禽类和猪)的抗氧化剂,包括天然膳食抗氧化剂。天然膳食抗氧化剂有,例如,维生素(例如E、C)、矿物质(例如Se、Zn)、类胡萝卜素和多酚。已知多酚除了具有自由基清除功能外,还有助于维生素E的再生。本公开的实施方式中有用的多酚是可购买的,并且可以从多种来源获得,包括例如水果、蔬菜、豆类、坚果、种子、茶提取物、药草、香料和树皮。可以提取多酚的水果包括例如苹果(红或绿)、杏子、醋栗果(黑或红)、黑莓、蓝莓、樱桃(甜或酸)、北美沙果、蔓越莓、枣、接骨木、鹅莓、葡萄(红或紫)、猕猴桃、柠檬、越橘、酸橙、芒果、马里恩莓、油桃、橄榄、橙(例如脐橙、橘柚、橘子、血橙)、桃子、梨、李子、石榴、木梨、覆盆子、大黄、草莓、和西红柿。可以提取多酚的蔬菜包括例如洋蓟、西兰花、芹菜、玉米、茄子、茴香、大蒜、绿色蔬菜(例如羽衣甘蓝和芜菁)、球茎甘蓝、韭葱、独活草、洋葱(红和黄)、欧洲萝卜、辣椒、菠菜、红球甘蓝、芜菁甘蓝、大葱、胡葱、甘薯和豆瓣菜。可以提取多酚的豆类、坚果、种子包括例如上述任何水果的种子(例如葡萄籽)、杏仁、腰果、鹰嘴豆、豆(例如黑豆、红芸豆、斑豆、豇豆)、菜豌豆(Englishpea)、蚕豆、亚麻籽、青豌豆、榛子、小扁豆、长山核桃、花生、开心果、南瓜籽、油豆角、葵花籽和核桃。可以提取多酚的茶包括例如绿茶、红茶、乌龙茶、格雷伯爵茶、锡兰茶和大吉岭茶。可以提取多酚的药草和香料包括例如罗勒、香葱、刺山柑(红和绿)、肉桂、咖喱、莳萝叶、辣根、牛至、欧芹、迷迭香、鼠尾草、龙蒿和百里香。在一些实施方式中,多酚源包括洋葱提取物、葡萄籽提取物和迷迭香提取物中的至少一种。可以提取多酚的树皮包括例如阿朱那树皮、白杨树皮、桦树皮、针叶树皮(例如雪松、柏树、冷杉、落叶松、松树、云杉、紫杉)、桉树皮和枫树皮。在一些实施方式中,多酚源可以包括洋葱提取物、葡萄籽提取物和迷迭香提取物。适用于本公开的实施方式中的多酚源可以购买,商品名为PROVIOX50,其可从Cargill,Incorporated,Wayzata,MN,USA购买。PROVIOX50的配制物包括多酚葡萄籽和皮的提取物、洋葱提取物和迷迭香提取物的混合物。PROVIOX50是对其总多酚含量的进行标准化的产品。PROVIOX50含有具有抗氧化性质的化合物来源,且PROVIOX50可以替换或补充维生素E50,这可以节省成本并支持动物抗氧化状态和表现。替代率取决于膳食维生素E水平。在一些实施方式中,高于国家研究委员会(NRC)要求(参见表A和表B中的猪和家禽)的维生素E水平可以被维生素E的等价物(例如多酚)替代或替换。在一些实施方式中,多酚是PROVIOX50。本公开的一个方面涉及给动物饲喂包含维生素E和多酚源(例如PROVIOX50)的组合物作为其饲料配给的一部分。在一些实施方式中,对于禽类动物的饲料,饲料配给中存在维生素E,添加水平为约10ppm至约200ppm、约20ppm至约100ppm、约30ppm至约90ppm、或约35ppm至约85ppm。在一些实施方式中,对于猪动物的饲料,饲料配给中存在维生素E,添加水平为约1ppm至约300ppm、约20ppm至约250ppm、约30ppm至约200ppm、或约35ppm至约150ppm。在一些实施方式中,组合物中维生素E的添加水平与多酚源的添加水平的比例为维生素E比多酚源约1:1。动物饮食中的维生素E通常至少等于国家研究委员会(NRC)的最低要求(参见下面表A和表B中的猪和家禽)。在一些实施方式中,高于最低NRC水平的维生素E水平可以用维生素E等价物(如多酚)替换、替代。在一些实施方式中,多酚是PROVIOX50。尽管以维生素E与维生素E等价物的1:1比例讨论了组合物,但是应当理解,本申请考虑了维生素E与维生素E等价物(例如多酚)的各种其它比例。在一些实施方式中,维生素E与多酚源的比例可以为约1:2至约1:5,如1:2、1:3、1:4或1:5。表A猪(维生素E)最低NRC要求(IU)仔猪3-5kg20IU/KG仔猪5-10KG20IU/KG仔猪10-20KG14IU/KG猪20-50KG14IU/KG猪50-80kg14IU/KG猪80-12kg14IU/KG怀孕母猪55IU/KG哺乳母猪55IU/KG表B家禽(维生素E)最低NRC要求(IU)肉鸡0-7天19肉鸡0-18天18肉鸡19-35天15肉鸡36-42天13产蛋的鸡0-6周15产蛋的鸡7-16周12产蛋的鸡>17周10在全价饲料中多酚源的添加率在1ppm至300ppm(每吨全价饲料中10g至300g多酚源)中变化。例如,10ppm至100ppm、20ppm至95ppm、30ppm至90ppm、35ppm至85ppm。在一些实施方式中,给禽类动物饲喂包含维生素E和多酚源的组合物以改进禽类生产力。禽类生产力包括种禽表现、后代表现和抗氧化状态。在一些实施方式中,在受精卵被收集用于孵育之前,给禽类动物饲喂包含维生素E和多酚源的组合物至少约5周、至少约6周、至少约7周、至少约8周。在一个实施方式中,开始给禽类动物饲喂组合物后约6周至约10周收集受精卵。在其它实施方式中,开始饲喂组合物后约8周收集受精卵。制备用于禽类动物的饲料的方法在本领域是已知的,在例如FeedingPoultry:TheClassicGuidetoPoultryNutritionforChickens,Turkeys,Ducks,Geese,Gamebirds,andPigeons,G.F.Heauser,NortonCreekPress,2003和CommercialPoultryNutrition,3rdEdition,Leesonetal.,UniversityBooks,2005中说明。禽类动物的饲料配给可包括各种成分,例如玉米、小麦、豆粕、脂肪和油(例如豆油)、石灰石、磷酸一钙、碳酸氢钠、氯化钠、L-赖氨酸盐酸、DL-甲硫氨酸、L-苏氨酸和起始预混料或生长预混料,包括例如维生素A(视黄醇乙酸酯)、维生素D3(胆钙化醇)、维生素E(DL-α-生育酚)、维生素K3(甲萘醌)、维生素B1(硫胺素)、维生素B2(核黄素)、维生素B6(吡哆醇盐酸)、维生素B12(氰钴胺素)、烟酸、D-泛酸、氯化胆碱、叶酸、生物素、KI、FeSO4.H2O、CuSO4.5H2O、MnO、ZnSO4.H2O和Na2SeO3。在一些实施方式中,可以从孵化、孵化后1周龄、孵化后2周龄、孵化后3周龄、孵化后4周龄、孵化后5周龄、孵化后6周龄、孵化后7周龄、孵化后8周龄、孵化后9周龄、孵化后10周龄、孵化后11周龄、孵化后12周龄、孵化后13周龄、孵化后14周龄、孵化后15周龄、孵化后16周龄、孵化后17周龄、孵化后18周龄、孵化后19周龄、孵化后20周龄、孵化后21周龄、孵化后22周龄、孵化后23周龄、孵化后24周龄、孵化后25周龄、孵化后26周龄、孵化后27周龄、孵化后28周龄、孵化后29周龄、孵化后30周龄开始给禽类动物饲喂包含维生素E和多酚源的组合物。在一些实施方式中,可以在其整个生命周期中给禽类动物饲喂包含维生素E和多酚源的组合物。与来自由不含所述组合物的饲料配给饲喂的禽类动物的后代相比,由饲喂包含维生素E和多酚源的组合物的禽类动物产生的受精卵的后代可以展示出改进的表现,其可以根据相关领域的普通技术人员已知的方法进行测量。在一些实施方式中,改进的后代表现是在孵化时改进的后代体重、改进的后代最终体重、改进的后代平均日增重、改进的后代饲料转化率、改进的后代饲料摄取和抗氧化状态中的至少一种。抗氧化状态可以通过任何已知的方法测定,包括测量超氧化物歧化酶或谷胱甘肽过氧化物酶水平及维生素A和维生素E水平。在一些实施方式中,改进的禽类后代表现是比饲喂不含组合物的饲料配给的禽类动物的后代表现高出至少1%、高出至少1.5%、高出至少2%、高出至少2.5%、高出至少3%、高出至少3.5%、高出至少4%、高出至少4.5%、高出至少5%、高出至少5.5%、高出至少6%、高出至少6.5%、高出至少7%、高出至少7.5%、高出至少8%、高出至少8.5%、高出至少9%、高出至少9.5%,或高出至少10%。在其它实施方式中,饲喂包含多酚源的所公开组合物的禽类后代表现与饲喂维生素E的禽类动物相似。在一些实施方式中,与饲喂不含维生素E饮食的种禽相比,种禽的表现得到改进。在一些实施方式中,与仅饲喂含维生素E的种禽相比,饲喂包含维生素E和多酚源的组合物可产生类似或更好的种禽表现。种禽表现包括例如,受精卵的孵化率和蛋壳的破裂。在一些实施方式中,孵化率改进。在其它实施方式中,蛋壳的破裂减少。在其它实施方式中,抗氧化状态得到改进。如在实施例中所进一步说明的,类似的方法可以涉及饲喂猪动物。在一些实施方式中,给猪动物饲喂包含维生素E和多酚源的组合物以改进猪的生产力。猪的生产力包括繁殖表现、窝产表现(litterperformance)和抗氧化状态。繁殖表现包括例如如表44中测量的产仔率、实际产次、配种、产仔和断奶以及其它参数。窝产表现包括例如如表45所示的出生时活的、虚弱的或干尸的猪的数量,猪仔的体重(例如断奶时或哺乳后)和其它参数。抗氧化状态包括测定超氧化物歧化酶、谷胱甘肽过氧化物酶的活性,并测定维生素A和E的含量。与饲喂不含维生素E的饮食的猪相比,饲喂包含维生素E和多酚源的组合物可导致猪的生产力的提高。在一些实施方式中,与仅饲喂维生素E的猪相比,饲喂包含维生素E和多酚源的组合物可导致类似或更好的猪的生产力。饲喂组合物可以从初始妊娠期直到哺乳和产仔每天施用。在一些实施方式中,饲喂可以在繁殖的第一天开始,甚至在繁殖前的120天的时期期间(前繁殖)开始。在前繁殖期期间和在繁殖期间饲喂的饲料在本领域是熟知的。在前繁殖期间饲喂的包含维生素E和多酚的组合物的浓度可与在妊娠期期间饲喂的包含维生素E和多酚的组合物的浓度大致相同。基础饮食可以是本领域已知的任何典型的猪饮食,包括特别配制用于妊娠或哺乳猪的饮食。例如,饮食包括选自(aselectionof)本申请表42中所述的成分。在“NutrientRequirementsofSwine”,NutrientRequirementsofDomesticAnimals,Number3,9threv.ed.(NationalAcademyofScience,Washington,D.C.:1988)中可以找到配制用于饲喂猪的饮食的广泛指导。所使用的饲喂计划和饲喂速率(feedrate)可以是本领域中使用的任何标准计划和速率。通常,妊娠猪每天饲喂约4至约6磅的饮食,及每天约4至约5磅的饮食。哺乳猪通常每天饲喂约9至约15磅的饮食,及每天约13至约14磅的饮食。通常,对于妊娠猪每天饲喂饲料1至2次,对于哺乳猪每天饲喂饲料1至2次、至多4次。在用于猪动物的饲料的一些实施方式中,饲料配给中存在维生素E,添加水平为约1ppm至约300ppm、约20ppm至约250ppm、约30ppm至约200ppm或约35ppm至约150ppm于。实施例根据本发明的方面的某些方法的方面在以下实施例中进行说明。实施例1-9涉及饲喂禽类动物,实施例10涉及饲喂猪动物。实施例1-由PROVIOX50部分替换肉鸡种鸡饮食中的维生素E两种不同的种鸡饮食(表1)在随机区组设计中进行测试。种鸡接受标准对照饮食或其中50%的维生素E被PROVIOX50替换的饮食。这两种饮食被随机分配到6个笼子中,导致每次处理中3次重复实验,其中每次重复实验中具有28、29或30个雌性和3或4个雄性。表1、肉鸡种鸡的饮食实验期持续4周;根据实验设计种鸡在整个实验期间接受了产蛋开始饮食。饲料和水都受到限制。饲料量取决于体重的发展。实施例1的饲喂计划在表2中给出。每天提供两小时的水,定期检查嗉囊以确保提供正确的水量。表2、饲喂计划总共购买了24只雄性和173只雌性Cobb500FF20周龄的种鸡。雄性和雌性被随机分配到6个地面围栏(pen)(每个围栏4个雄性,围栏1-3中29个雌性,围栏4中30个雌性,及围栏5和6中28个雌性)。在前试验期间,所有种鸡都接受对照饮食。在整个试验中,种鸡被放置在()肉鸡种鸡地面围栏(2.60×2.40米)中在褥草(亚麻)上。每个围栏配有两个可调节高度的饮水器。通过在升高的板条地面上的两个饲料碗供应雌性饲料。通过在围栏另一侧的饲料槽供应雄性饲料。将日长度设定为每天14小时,直到达到峰值生产(70%;第15天)。在达到峰值生产后,将日长度设定为每天15小时。温度和通风由计算机控制。在整个实验期间将温度设定在20℃。饮食由ResearchDietServices,WijkbijDuurstede,荷兰生产。所有饮食分别生产,使用一个基础饮食批次的雌性饮食和一个基础饮食批次的雄性饮食。饮食生产为糊状饲料。在饮食配制之前,储备多批豆粕和粗粉碎的玉米和小麦,并对其粗蛋白质、钙、和磷进行湿化学分析。此外,分析豆粕的钾。使用BrukerOptikGmbH,Ettlingen,Germany的BrukerMPA,ISO12099光谱仪,用近红外光谱(“NIRS”)来预测粗灰分、粗脂肪、粗纤维、水分,并交叉检查粗蛋白。饮食的配方基于所保留成分的营养物含量分析。基于ProvimiB.V.对肉鸡种鸡的营养物建议配制基础饮食(玉米-豆粕-小麦和麦麸)。使用未添加维生素E和特定抗氧化剂产品的肉鸡种鸡预混物。虽然使用相同的实验设计,但是产生不同的雄性和雌性饮食。这样做是为了能够根据其营养需要(更少的粗蛋白质、能量、和钙,以及不同的预混物要求)饲喂雄性,而不损害实验设计。实验饮食的组成在表3中给出。实验饮食的分析显示在表4中。表3、实验饮食的成分和营养组成1每kg饮食提供:核黄素,9.0mg;烟酰胺,40mg;D-泛酸,12mg;氯化胆碱,600mg;DL-α-生育酚,-IU;甲萘醌,2.5mg;视黄醇乙酸酯,12500IU;胆钙化醇,2500IU;生物素,150μg;叶酸,1.5mg;硫胺素,2.0mg;盐酸吡哆醇,4.5mg;氰基钴胺,30μg;FeSO4.H2O,147mg;MnO2,135mg;CuSO4.5H2O,40mg;ZnSO4.H2O,275mg;Se(org),0.88mg;KI,2.6mg;抗氧化剂(OxytrapPXN),-mg。2每kg饮食供应:核黄素,7.5mg;烟酰胺,30mg;D-泛酸,9mg;氯化胆碱,500mg;DL-α-生育酚,-IU;甲萘醌,3.5mg;视黄醇乙酸酯,10000IU;胆钙化醇,2000IU;生物素,100μg;叶酸,1.0mg;硫胺素,2.0mg;吡哆醇盐酸,3.0mg;氰基钴胺,25μg;FeSO4.H2O,147mg;MnO2,106mg;CuSO4.5H2O,40mg;ZnSO4.H2O,206mg;Se(org),0.88mg;KI,1.9mg;抗氧化剂(OxytrapPXN),-mg。表4、实验饮食的营养组成分析从实验开始每周记录单只鸡的重量。每天记录提供的饲料量。每天记录产蛋量和蛋质量的数据。产蛋%计算为每个围栏产生的蛋数量除以鸡的只数和实验期的天数。每周每个围栏的产蛋的质量(eggmassproduction)计算为产蛋%(包括次等蛋)乘以围栏的平均蛋重量。每周测定一次平均蛋重。次等蛋分为脏蛋、碎蛋、无壳蛋、双黄蛋、窝外蛋和其余的次等蛋。每天检查死亡率;在实验期间不替换死亡动物。为了比较不同的处理,根据以下统计模型使用SASVersion9.2,2008(SASInstituteInc.,Cary,NC,USA)对所有参数使用MIXEDMODEL程序:Yij=μ+αi+εij其中:Yij=每个实验单元(围栏)的特定性状μ=特定性状的总体平均值αi=处理的固定效应(i=1或2)εij=误差项除非另有概率值,否则根据P<0.05的概率(平均分离的Studentt检验)假设平均值之间的差异是显著的。除了雄性对照饮食中的钙水平和雄性PROVIOX50饮食中的磷水平(基于重复分析)之外,饮食的营养组成合理地符合期望值(表4)。然而,由于使用一个饮食批次来生产两种饮食,并且使用与用于雌性饮食的相同的储备及分析成分,预期这些发现涉及分析或采样中的错误,因为饮食作为糊状饲料被饲喂。在整个实验中观察到的鸡的健康状况良好。死亡率(包括剔除率)达到1.5%(表5),这符合实际水平(从26至30周龄,1.6%)。鸡的技术表现符合Cobb500FF的种鸡标准(图1-3和表6)。表5、在试验开始时计算动物的死亡率和剔除率(总计195)时期死亡率剔除率总计26-30周0.511.5表6、饲喂对照饮食或PROVIOX50饮食的种鸡的技术结果,其中一半的维生素E水平被PROVIOX50替换(26至30周龄)参考图1-3和表6,在两个处理组之间没有发现肉鸡种鸡产蛋表现的显著差异。这可能与每次处理的重复实验相关。预期有一些变化,因为种鸡处于产蛋的起始阶段。两种处理之间没有显著差异,表明当用PROVIOX50替换50%的维生素E水平时,种鸡的表现没有受到影响。实施例2-实施例1的蛋产的鸡在9天的时期内,收集产自实施例1的肉鸡种鸡群的蛋。蛋按照种鸡围栏和储存日进行储存。蛋被分配到12个托盘和9个区域,每个区域代表一个储存日。在E17,所有的蛋都被对光检查,且在E18,蛋从孵育器孵蛋盘(setter)转移到孵化篮。收集产自实施例1的28-29周肉鸡种鸡的总共540个蛋(在9天期间产生的所有蛋)并储存在18℃(64.4°F)和75%相对湿度的孵育器中。在孵育期开始时,将鸡蛋称重并分配到区域中,每个区域代表一个储存日。每个区域由12个实验单元组成,每个实验单元为一组10个蛋。只包括完整的鸡蛋;碎蛋、脏蛋或变形壳的蛋被排除在实验外。将蛋放置在具有自动控制温度和相对湿度的NatureFormNMC2340孵育器中。从E0到E18,将蛋放置在孵蛋盘推车中,该推车包括两个搁板,每个搁板可容纳13个托盘。每个托盘具有3层30个蛋。在此期间,孵育器起始温度设定为37.5℃,且相对湿度设定为54%。基于在E037.5℃的起始温度且从E12至E18逐渐从37.5℃降低至36.7℃的温度谱设定温度。在孵蛋盘期(E0-E18)之后,基于孵蛋盘中的区域结构将蛋转移到孵化器中的篮子里。每次重复实验,按照每个区域的托盘顺序,将蛋放置在孵化箱的子区中。每个孵化器台车具有12个篮子,每个篮子可容纳180个蛋。在此期间,孵育器温度设定为36.7℃,相对湿度设定为70%。在E0记录每个实验单元的蛋重量。在孵化(E21)时,记录死鸡、死胚胎和鸡破壳而出的蛋(内部和外部)的数量。打开其余的未孵化蛋以确定蛋龄和死亡原因。每次重复实验都要记录孵出的鸡的数量,以及平均的鸡重量。性别通过泄殖腔确定,由专业的鸡性别鉴定员执行。孵化率计算为总的蛋和受精卵(E17后含有活胚胎的蛋)的百分比。基于肉鸡种鸡围栏,每次处理的总共102只雄性鸡被随机选择用于实施例3。仅选择具有平均体重、完全干燥、显示主动运动和具有良好中央评分(navelscore)的鸡。选择来自每个实验单元的2只雄性鸡(每次处理总共108只)用于解剖。单独称重样品鸡并通过颈脱位法杀死,以测量剩余的卵黄囊重量、不含卵黄的体重(“YFBM”)、雏鸡的长度和两条胫的胫长度。根据下式计算相对不对称性:RA=(|L-R|/[(L+R)/2])×100其中:L=左胫长度R=右胫长度为了比较不同的处理,根据以下统计模型,使用SASVersion9.2,2008(SASInstituteInc.,Cary,NC,USA)对所有参数使用MIXEDMODEL程序:Yijkl=μ+αi+bj+ck+acik+εijkl其中:Yijkl=特定性状μ=特定性状的总体平均值αi=肉鸡种鸡处理的固定效应(i=1或2)bj=区域/存储日的随机效应(j=1-9)ck=整个积块的随机效应(k=1,2或3)acjk=整个积块和处理的随机相互作用εijkl=误差项处理和整个积块的相互作用系数被包括在模型中以校正所使用的肉鸡种鸡处理的实验单元的数量。由于试验的设计,储存日效应与区域(孵育器中的位置)效应完全混杂。生育力、总孵化率和受精卵的孵化率等参数被认为是二项数据。除非另有概率值,否则基于P<0.05的概率(平均分离的Studentt检验)假设平均值之间的差异是显著的。试验开始时的平均蛋重为57.9克/蛋。总生育力(94%)符合Cobb育种指南,根据育种指南,孵化率(91%)高于平均水平(对于28-29周龄的种鸡,总生育力和孵化率分别为95%和85%)。与指南相比,更高的孵化率结果可能来自使用的孵育器比实际使用的孵育器更小,导致优化的孵蛋过程,因此导致更小的胚胎死亡率。生育力和孵化率不显著受肉鸡种鸡处理影响(表7)。然而,从数字上看,由饲喂PROVIOX50处理的肉鸡种鸡生产的蛋具有高出总孵化率4.6%的孵化率,这主要与生育力增加了3.6%有关。表7、肉鸡种鸡处理对孵化率、生育力、雏鸡体重和相对雏鸡体重的影响肉鸡种鸡处理对所评估的任何雏鸡表现和质量参数没有显著影响(表8),表明PROVIOX50对肉鸡种鸡饮食中的50%维生素E水平的替换不影响孵化的鸡的表现。表8、肉鸡种鸡处理对解剖鸡的雏鸡重量、卵黄囊重量、相对卵黄囊重量、无卵黄体重、雏鸡的长度和胫的相对不对称性(“RA”)的影响维生素E50%PROVIOXSEMp-值n33--雏鸡重量,g41.340.50.62390.558卵黄囊重量,g4.924.360.17780.248相对雏鸡重量1,%70.770.70.43320.973相对雏鸡重量2,%11.810.70.29550.180YFBM3,g36.236.00.45540.808雏鸡的长度,cm17.917.80.07720.760相对不对称性1.591.520.18940.8281表示为平均蛋重的百分比2表示为雏鸡重量的百分比3无卵黄体重结果表明,由PROVIOX50对肉鸡种鸡饮食中50%维生素E的替换对孵化的鸡的表现(例如,生育力、孵化率和孵化的鸡的特性)没有显著影响。实施例3-使实施例2的鸡生长在此实施例中,孵化的鸡生长直到屠宰年龄并评价表现。目前的实验的目的是相比由PROVIOX50替换50%的维生素E,评估具有维生素E的肉鸡种鸡饮食对后代表现的影响。如实施例1所示,测试了两种不同的肉鸡种鸡处理。在此实施例中,实施例2的孵化的鸡生长自实施例1的蛋,其中种鸡接受对照饮食或其中50%的维生素E水平由PROVIOX50替换的饮食。将实验期分为初始阶段(0-14天)和生长阶段(14-35天)。随意提供饲料和水。从实施例2的所有孵化的雄性鸡选择总共204只来自28-29周肉鸡种鸡(实施例1)的雄性Cobb500快速羽化的日龄雏鸡。在选择期间,鸡从孵化场中的不同实验单元随机选择,确保肉鸡种鸡设施的实验单元保持完好,将来自肉鸡种鸡设施的一个实验单元的鸡放置在成长设施中的两个围栏中。每笼饲养17只鸡。为了每笼分配17只鸡,将具有实施例2的选定实验单元的日龄鸡的桶放置成直线;从每个桶中随机选择鸡并将其放置在选定的笼中。该过程持续直到完成该实施例的所有笼。将鸡放入笼中后,记录每笼中的所有鸡的个体重量,以确定鸡的起始重量。不同处理之间的起始重量存在可测量的差异,对于处理1(仅维生素E)和处理2(用PROVIOX50替代50%的维生素E)分别为40.9g(±1.6)和39.9g(±0.9)。在整个实验中,将鸡饲养()单个肉鸡生长笼(100×110cm)中在褥草(刨花)上。每个笼配备两个可调高度的乳头饮水器。在前14天内,饲喂器在笼内,并且从第14天开始,饲料通过笼前面穿过的饲喂器供给。前3天设定日长度为23小时每天,第4天至第7天日长度为20小时每天,实验的剩余时间设定日长度为18小时每天。温度、湿度和通风由计算机控制。温度从到达当天的35℃逐渐降低到实验结束时(第35天)的最终温度20.5℃,每周降低2.5℃。研究设施的相对湿度设定为50%。在14日龄时,针对新城疫给鸡喷雾接种疫苗(PoulvacNDW疫苗,可从Intervet,Boxmeer,荷兰获得)。在饮食配制之前,储备及分析多批小麦、玉米和豆粕。这些饮食由ResearchDietServices,WijkbijDuurstede,荷兰生产。使用一个基础饮食批次(每个时期)生产起始饮食和生长饮食。加入蒸汽(约80℃),将起始饮食制成2.5mm的颗粒,并将生长饮食制成3mm的颗粒。饮食的配方基于成分的营养物含量的分析。配制饮食以满足肉鸡的营养需求(CVB,2006)。起始饮食和生长饮食分别含有2,750和2,850kcalAME·kg-1及10.20和9.70g·kg-1明显粪便可消化(AFD)赖氨酸。实验饮食的组成在表9中给出,分析在表10中给出。表9、起始饮食和生长饮食的成分和营养组成1每kg饮食提供:维生素A(视黄醇乙酸酯),12,000IU;维生素D3(胆钙化醇),5,000IU;维生素E(DL-α-生育酚),-mg;维生素K3(甲萘醌),2.3mg;维生素B1(硫胺素),1.0mg;维生素B2(核黄素),4.5mg;维生素B6(吡哆醇盐酸),2.7mg;维生素B12(氰钴胺),20μg;烟酸,40mg;D-泛酸,9mg;氯化胆碱,500mg;叶酸,0.5mg;生物素,100μg;FeSO4.H2O,150mg;CuSO4.5H2O,40mg;MnO,100mg;ZnSo4.H2O,145mg;KI,2.0mg;Na2SeO3,0.56mg;抗氧化剂(oxytrapPXN),-mg。2每kg饮食提供:维生素A(视黄醇乙酸酯),10,000IU;维生素D3(胆钙化醇),2,000IU;维生素E(DL-α-生育酚),-mg;维生素K3(甲萘醌),2.3mg;维生素B1(硫胺素),0.8mg;维生素B2(核黄素),4.5mg;维生素B6(吡哆醇盐酸),1.9mg;维生素B12(氰钴胺),20μg;烟酸,30mg;D-泛酸,8mg;氯化胆碱,400mg;叶酸,0.5mg;生物素,50μg;FeSO4.H2O,150mg;CuSO4.5H2O,40mg;MnO,100mg;ZnSo4.H2O,145mg;KI,1.9mg;Na2SeO3,145mg;抗氧化剂(oxytrapPXN),-mg。3根据CVB(2006)计算。4AFD=表面粪便消化率,CVB(2006)计算。5TFD=真实粪便消化率。表10、起始饮食和生长饮食的营养组成分析在实验开始时(第0天)及在3、14、28和35日龄时记录个体鸡的重量。此外,在鸡称重的同一天记录每个围栏的饲料消耗。基于计算的体重增益和饲料消耗,饲料增重比(F:G)计算为kg消耗的饲料/kg体重增加。每个围栏的总饲料消耗针对死亡率、剔除率和异常值进行校正。使用以下公式计算欧洲家禽指数:欧洲家禽指数=(最终体重(g)×(100%-死亡率%))/((10×周期天数)×总体FCR)使用以下公式计算不包括死亡率的欧洲家禽指数:欧洲家禽指数=(最终体重(g)×100)/((10×周期天数)×总体FCR)在实验的第35天,随机选择每笼5只鸡(不包括明显的异常值)。第二天,鸡被屠宰。在第36天的上午,这些选择的鸡被CO2/O2杀死,并收集血液样品,之后它们被放血。根据用于假设检验和均值分离的Provimi标准,使用ANOVA(修订版1.3)进行统计。为了比较不同的处理,根据以下统计模型,使用SAS(Version9.3,2008,SASInstituteInc.,Cary,NC)对所有参数使用MIXEDMODEL程序:Yijkl=μ+αj+bj+ck+αcik+dl+eijkl;其中:Yijk1=针对每个实验单元测量的特定性状μ=特定性状的总体平均值αi=固定肉鸡种鸡处理效应(i=1或2)bj=随机存储效应(j=短或长)ck=随机整个积块效应(k=1,2或3)αcik=由整个积块相互作用进行的随机处理dl=随机房间效应(1=A或B)eijkl=误差项整个积块是肉鸡种鸡设施中两个实验单元的区域。模型中包括了整个积块和处理之间的相互作用,以校正肉鸡种鸡单元中实际重复实验的次数。死亡率被视为二项数据。除非另有其它概率值,基于P<0.05的概率假设效应是显著的。饮食的营养组合物与预期值一致(在计算值之上或之下的5%极限;表10)。尽管与实际水平(3至4%)和之前的肉鸡生长研究(2012平均值:4.4%)相比,死亡率(包括剔除率,)达到6.9%)高,但是观察到的鸡的健康状况在整个实验中是良好的。然而,在两种肉鸡种鸡处理之间没有发现死亡率的统计学差异。表11显示了肉鸡种鸡饮食(80ppm维生素E或40ppm维生素E+40ppmPROVIOX50)对Cobb500FF肉鸡的死亡率、欧洲家禽指数、平均日增重、平均日采食量和饲料:增重的影响。表11、肉鸡种鸡饮食的影响1EPI=欧洲家禽指数((最终体重(g)×(100%-死亡率%))/((10×周期天数)×总体FCR);EPIexclmortality=不包括死亡率的欧洲家禽指数((最终体重Wt(g)×100%)/((10×周期天数)×总体FCR));ADG=平均日增重;ADFI=平均日采食量;F:G=饲料增重比(kg采食量:kg增重);127-30只母鸡和3-4只公鸡的种鸡围栏2F:G校正为在35日龄时2,181克体重。每100克额外体重的校正-0.02。参考表11,后代的表现结果、平均日增重(“ADG”)、平均日采食量(“ADFI”)和饲料增重比(F:G)不受肉鸡种鸡饮食的显著影响。肉鸡种鸡实验结果表明,当用PROVIOX50替换50%的维生素E水平时,种鸡的表现没有显著影响。实施例4-在肉鸡种鸡饮食中用PROVIOX50部分替换维生素E所有种鸡在前实验期(19-30周龄)期间接受相同的标准对照饮食。在实验期间,种鸡接受对照饮食,高维生素E饮食、或50%的维生素E水平被PROVIOX50替换的饮食(表12)。表12、肉鸡种鸡处理的实验设计总共有24个地面围栏,各有30只雌性种鸡和3只雄性种鸡(分配后)。实验期持续9周;种鸡在整个实验期间接受产蛋饮食。饲料和水都受到限制。饲料量取决于体重的发展。每天提供两小时的水,定期检查嗉囊以确保提供正确的水量。在饮食配制之前,储备几批豆粕、麦麸、粗粉碎的玉米和小麦,并对其粗蛋白质含量、干物质(“DM”)、钙和磷进行湿化学分析。此外,分析豆粕的钾含量,并对麦麸的粗纤维、钾和淀粉进行湿法化学分析。NIRS用于预测粗灰分、粗脂肪、粗纤维和水分,并用于交叉检查粗蛋白。饮食的配方基于保留成分的营养物含量分析。在整个实验期间使用一批饲料。基于Provimi营养建议为肉鸡种鸡制定基础饮食(玉米-豆粕-小麦和麦麸)。根据Provimi营养码(“PNC”)系统优化饮食配方。使用没有维生素E且没有添加其他抗氧化剂的肉鸡种鸡预混物。尽管使用相同的实验设计和使用一个预混物,但是生产不同的雄性和雌性饮食。这样做是为了能够根据其营养需要(更低的粗蛋白质、能量和钙要求)喂养雄性。实验饮食的组成和分析分别示于表13和表14中。饮食由ResearchDietServices,WijkbijDuurstede,荷兰生产。两种饮食分别生产,使用一个基础饮食批次用于雌性饮食和一个基础饮食批次用于雄性饮食。饮食生产为糊状饲料。表13、实验饮食的成分和营养组成1每kg产蛋前饮食提供:核黄素,7.5mg;烟酰胺,30mg;D-泛酸,9mg;氯化胆碱,500mg;DL-α-生育酚,-IU;甲萘醌,3.5mg;视黄醇乙酸酯,10000IU;胆钙化醇,2000IU;生物素,100μg;叶酸,1.0mg;硫胺素,2.0mg;吡哆醇盐酸,3.0mg;氰基钴胺,25μg;FeSO4.H2O,147mg;MnO2,106mg;CuSO4.5H2O,40mg;ZnSO4.H2O,206mg;Na2SeO3,0.88mg;KI,1.9mg;抗氧化剂(OxytrapPXN),-mg。每kg产蛋开始饮食提供:核黄素,9.0mg;烟酰胺,40mg;D-泛酸,12mg;氯化胆碱,600mg;DL-α-生育酚,-IU;甲萘醌,2.5mg;视黄醇乙酸酯,12500IU;胆钙化醇,2500IU;生物素,150μg;叶酸,1.5mg;硫胺素,2.0mg;吡哆醇盐酸,4.5mg;氰基钴胺,30μg;FeSO4.H2O,147mg;MnO2,130mg;CuSO4.5H2O,40mg;ZnSO4.H2O,206mg;Na2SeO3,0.88mg;KI,2.6mg;抗氧化剂(OxytrapPXN),-mg。每kg产蛋阶段饮食提供:核黄素,6.0mg;烟酰胺,30mg;D-泛酸,9mg;氯化胆碱,350mg;DL-α-生育酚,-IU;甲萘醌,2.5mg;视黄醇乙酸酯,12500IU;胆钙化醇,2500IU;生物素,100μg;叶酸,1.0mg;硫胺素,1.0mg;吡哆醇盐酸,2.5mg;氰基钴胺,25μg;FeSO4.H2O,147mg;MnO2,114mg;CuSO4.5H2O,40mg;ZnSO4.H2O,206mg;Na2SeO3,0.88mg;KI,2.6mg;抗氧化剂(OxytrapPXN),-mg。表14、实验饮食的营养组成分析1用于产蛋期的雌性饮食的量对一个批次来说太多,因此用相同的成分生产两个批次。共采购了730只雌性Ross30819周龄种鸡和92只雄性Ross30819周龄种鸡。在到达时(在前实验期开始时),将雄性和雌性随机分配到地面围栏(每个围栏3-4只雄性和30-31只雌性)。在实验开始时,将种鸡重新分配(每圈30只雌性和3只雄性,其余的健康雄性被放置在备用圈中,其余的雌性被剔除)。在整个实验中,将种鸡安置在()单个肉鸡种鸡地面围栏(2.60×2.40m)中在褥草(亚麻)上。每个围栏配有一个钟形饮水器,高度可调。用于雌性的饲料通过在升高的板条地板上的两个饲料碗供应;雄性的饲料通过围栏另一侧的饲料槽供给。根据种鸡标准,在前实验期间对种鸡进行光刺激。在实验期间,日长度设定为每天15小时。温度和通风由计算机控制。在整个期间内将温度设定为20℃。从前实验期开始每周记录个体鸡重量。在31、33和36周龄时,50%的雌性已称重,在35、37和38周龄时,只对前4个围栏称重以确定适当的体重发育。每天记录所提供的饲料量。每天记录蛋产量和蛋质量数据。产蛋%计算为每个围栏产生的蛋数量除以只数和实验期的天数。每周每圈产蛋的质量计算为产蛋%(包括次等蛋)乘以该圈的平均蛋重。每个围栏每周测定一次平均蛋重。次等蛋分为脏蛋、破蛋、无壳蛋、双黄卵、窝外蛋和其余的次等蛋。每天检查死亡率;在实验期间不替换死亡鸡。蛋被运到比利时根特大学,用于卵黄的ORAC和维生素E分析。用于测定多酚的方法是Folin-Ciocalteu方法,其在欧洲药典中描述,使用分光光度法UV可见。对于ORAC分析,使用如在Ouetal“Developmentandvalidationofanimprovedoxygenradicalabsorptioncapacityassayusingfluoresceinasthefluorescentprobe”,JournalofAgriculturalandFoodChemistry49:4619-4626,(2001)和Huangetal“High-throughputassayofoxygenradicalabsorptioncapacity(ORAC)usingamultichannelliquidhandlingsystemwithamicroplatefluorescencereaderin96-wellformat”,JournalofAgriculturalandFoodChemistiy50:4437-4444,(2002)中所描述的方法。根据用于假设检验和均值分离的Provimi标准,使用ANOVA(修订版1.3)进行统计。为了比较不同的处理,根据以下统计模型,使用SAS(Version9.2,2008,SASInstituteInc.,Cary,NC,USA)对所有参数使用MIXEDMODEL程序:Yij=μ+αi+bj+εij其中:Yij=每个实验单元(围栏)的特定性状μ=特定性状的总体平均值αi=固定处理效应(i=1,2,3或4)bj=随机区域效应(j=1,2,...,6)εij=误差项对比用于比较处理效果。下面给出对比说明,并且用于回答每个问题的对比指标在表15中示出。1)是否有线性维生素E效应?2)是否有PROVIOX50替换效应?3)PROVIOX50的替换效应是否取决于剂量?4)在维生素E之外添加PROVIOX50是否有添加效果?表15、用于统计分析的对比报表饮食的营养组成合理地符合预期值(表14)。在整个实验中观察到的鸡的健康状况良好。死亡率,包括剔除率,达到6.1%,这低于种鸡标准(产蛋期间总的死亡率和剔除率为8%)。这主要是由于约30周龄时腿部问题造成的相对高的剔除率,这在Ross种鸡中更常见。技术表现符合Ross308的种鸡标准(数据未示出)。在整个实验期(30-39周龄)期间,当PROVIOX50部分替换维生素E(50%)时,碎蛋的百分比显著降低47%(表16)。这提示蛋壳强度有所改进,这是重要的,因为可孵化的蛋的数量将增加,导致农民的更高的每个肉鸡种鸡的收入。饲喂实验饮食(30至39周龄)的种鸡的技术结果显示在表16中。表16饲喂实验饮食的种鸡的技术结果(30至39周龄)表17显示了ORAC和维生素E水平的蛋黄含量分析结果。参考表17,蛋黄ORAC和维生素E含量的评估显示处理组之间在ORAC、维生素E含量没有显著差异,然而,由于饮食中维生素E水平的增加,评估显示线性增加。已发现维生素E从饮食中转移到蛋中的比例指数约为50%,这与以前的研究一致(Hossainetal.,1998)。表17、蛋黄含量中ORAC和维生素E水平的分析结果该实施例的结果显示对于在种鸡饮食中使用PROVIOX50的任何评估参数没有有益效果。实施例5-从实施例4的蛋生产鸡在6天的时间内,从上述实施例4的肉鸡种鸡群收集鸡蛋。在孵卵期开始之前,按照种鸡围栏和存储日将蛋再储存3天。孵育所有蛋,直到孵化。所有蛋分布在24个托盘和6个区域,每个区域代表一个储存日。种鸡接受4种实验饮食之一,如表12所示。收集实施例4的源自37-38周肉鸡种鸡(Ross308)的总共2160个蛋,并储存在肉鸡种鸡设施的蛋存储单元中。在孵育期开始时,将蛋称重并分配到区域中,每个区域代表一个储存日。每个区域由24个实验单元组成,每个实验单元为一组15个蛋。只包括完整的蛋,碎蛋、脏蛋或壳变形的蛋被排除在试验之外。将蛋放置在具有自动控制温度和相对湿度的NatureFormNMC2340孵育器中。从E0到E18,蛋被放置在孵蛋盘推车中,其包括两个搁板,每个搁板可容纳13个托盘。每个托盘有3层30个蛋。在此期间,孵育器起始温度设定为37.5℃,相对湿度设定为54%。在E0,起始温度为37.5℃,在E12至E18从37.5℃逐渐降至36.7℃。在孵蛋期(E0-E18)之后,按照孵蛋盘中的区域和托盘结构将蛋转移到孵化器中的篮子里。将蛋放入孵化箱(每个实验单元15个鸡蛋)的子分区中,并按照每个区域的托盘顺序(以1AO开始,以2CI结束)。每个孵化车有12个篮子,每个篮子可容纳180个蛋。将托盘1-12的蛋放置在孵育机1中,将托盘13-24的蛋放置在孵育机2中。在此期间,孵育器温度设定为36.7℃,相对湿度设定为70%。在E0,记录蛋的组重量(groupeggweight)。在E7和E18,所有的蛋被对光检查,并去除空蛋或含有死胚胎的蛋(早期死亡E0-E7,中期死亡E8-E18)。在E18,对光检查后,蛋被转移到孵化篮。在孵化(E21)时,记录死鸡、晚死胚胎(E19-E21)和鸡破壳而出的蛋的数量。每次重复实验,记录孵出的鸡的数量,以及平均雏鸡重量。孵化率计算为总蛋数的百分比。性别通过羽毛性别鉴定法确定,雌性鸡被CO2安乐死并根据当地规定处置。每个实验单元,选择5只雄性鸡用于生长期(grow-outperiod),并分配给肉鸡生长围栏。仅选择具有平均体重、完全干燥、显示主动运动和具有良好中央评分的鸡。在此选择之后,选择每个实验单元的1只雄性鸡用于解剖。单独称重样品鸡并通过颈脱位法杀死,以测量剩余卵黄囊重量、无卵黄体重(“YFBM”)、肝重量、雏鸡长度和两条胫的胫长度。立即将肝脏置于冰上并在解剖后储存于-20℃用于进一步分析(“SOD和GSSG”)。根据下式计算相对不对称性:RA=(|L-R|/[(L+R)/2))×100其中:L=左胫长度R=右胫长度。为了评估不同肉鸡种鸡处理之间是否存在显著差异,使用SAS(Version9.3,SASInstituteInc.,Gary,NC,2008)根据以下统计模型对所有参数使用MixedModel分析:Yijk=μ+αi+bj+α(c)ik+εijk其中:Yijk=每个实验单元的特定性状(重复为15个鸡蛋)μ=特定性状的总体平均值αi=处理的固定效应(i=1-4)bj=区域/存储日的随机效应(j=1-6)α(c)ik=处理内种鸡围栏的随机巢式效应(k=1-24)εijk=误差项在模型中包括处理内的种鸡围栏的巢式效应,以针对所使用的肉鸡种鸡处理的实验单元的数量做校正。由于实验的设计,储存日效应完全与区域(在孵育器中的位置)效应混杂。对比用于比较处理效果。下面给出对比说明,并且回答每个问题的对比指标示于表18中。1)是否有线性的维生素E效应?2)是否是二次的维生素E效应?3)是否有PPROVIOX50替换效应?4)PROVIOX50替换效果是否取决于剂量?5)在维生素E之外添加PROVIOX50有添加效应吗?表18、用于统计分析的对比报表试验开始时的平均蛋重为每只蛋63.1克。与38周Ross种鸡(总产量的87.2%)的育种标准相比,平均孵化率(总产量的90.4%)高于平均水平。这些结果表明,在当前的实验中,平均生育力和孵化率和孵卵过程是良好的。对光检查结果表明相对高的早期胚胎死亡率和非常低的空蛋数(分别为总孵蛋的5.5%和0.5%;表19),表明雄性的精子生产力良好。在孵化率、空蛋,早期、中期或晚期胚胎死亡率方面没有观察到显著差异(图4和图5,表19)。表19、肉鸡种鸡处理对Ross308胚胎的胚胎死亡率和孵化率数据的影响孵化的鸡显示在平均和相对雏鸡重量方面没有显著差异(表20)。此外,在几个雏鸡的质量参数(YFBM,雏鸡的长度和相对不对称性)方面没有发现处理影响。使用购自CellBiolabs,Inc.,SanDiego,CA,USA的OXISELECT超氧化物歧化酶活性测定(“SOD”)和OXISELECT总谷胱甘肽(GSSG/GSH)测定(“GSSG”)试剂盒来分析雏鸡的肝脏。在肝脏的SOD和GSSG分析中没有发现显著的影响。然而,当比较数值差异时,发现在低水平(80ppm维生素E)用PROVIOX50部分替换维生素E增加了胚胎的抗氧化状态。表20、肉鸡种鸡对Ross308胚胎孵化时胚胎发育和雏鸡质量参数的影响1表示为在E0蛋重的百分比2表示为雏鸡体重的百分比3无卵黄体重在所评价的任何参数方面没有发现显著的处理影响。此外,在孵化鸡参数方面没有发现显著的影响。在SOD和GSSG的肝酶分析方面没有发现显著的影响。然而,在低维生素E水平,替换似乎对增加胚胎的抗氧化能力是有效的。可以得出结论,至少在30-38周的实验期期间,由PROVIOX50替换高达50%的膳食维生素E可以用于降低这些饮食中的复合饲料总成本,而不影响孵化率和生育率或孵化鸡的质量。实施例6-使实施例5的鸡生长在本实施例中,孵化的鸡生长直到屠宰年龄并评价表现。目前的实验目的是评价与由PROVIOX50替换50%的维生素E的饮食对后代表现的影响相比,具有维生素E的肉鸡种鸡饮食对后代表现的影响。评价了4种肉鸡种鸡处理(表12)。来自实施例5的孵化的鸡生长自实施例4的肉鸡种鸡实验,其中种鸡接受对照饮食、高维生素E饮食、或由PROVIOX50替换50%维生素E水平(两种水平)的饮食。在本实验中,将相同的基础饮食饲喂给所有肉鸡。将实验期分为起始阶段(0-14天)和生长阶段(14-35天)。在14日龄时,所有的鸡改变为其生长饮食直到35日龄。在饮食配制之前,储备成分(玉米和豆粕)并在ProvimiB.V.实验室,Rotterdam,荷兰分析粗蛋白(“CP”)(ISO16634)和钙(ISO27085:2009;induplicate)含量。此外,分析玉米的磷含量(ISO27085:2009;induplicate)和豆粕的钾含量(ISO27085:2009)。应用近红外反射光谱分析(ISO12099)来评估干物质(“DM”)、粗脂肪、粗纤维和粗灰分含量。起始饮食和生长饮食由ResearchDietServices(RDS,WijkbijDuurstede,荷兰)生产。加入蒸汽(约80℃),将起始饮食制成2.5mm的颗粒,将起始饮食制成3mm的颗粒。基于分析的成分值和满足肉鸡的营养要求配制饮食(Cargill,IncorporatedCPNEMEAguidelines)。起始饮食和生长饮食分别含有为2,750和2,850kcalAME肉鸡g·kg-1和10.20和9.70g·kg-1表面粪便可消化(AFD)赖氨酸。实验起始饮食和生长饮食的组成在表21中提供。饮食分析示于表22。表21、起始饮食和生长饮食的成分和营养组成表22、起始饮食和生长饮食的营养组成计算和分析实验在由两个房间组成的肉鸡生长单元中进行,每个房间有36个围栏。从实施例5的孵化的雄性鸡的总数中随机选择来自38周龄肉鸡种鸡(实施例4)的总共720只Ross308雄性1日龄鸡。在选择期间,从孵化场不同的实验单元中随机选择鸡,确保肉鸡种鸡设施的实验单元保持完好,将来自肉鸡种鸡设施的一个实验单元的鸡放入生长设施中的一个围栏中。每个围栏由30只雏鸡组成,单元A和单元B的初始个体体重分别为43.3±0.81和43.3±0.68g。围栏(90×225cm)具有升高的地板,其由覆盖有2厘米刨花层的塑料线材组成。每个围栏配有两套设备,每套设备具有两个可调节乳头饮水器和在前13天置于围栏内喂食器。从第14天开始,通过围栏前面的喂食槽供给饲料。在整个研究过程中随意提供饲料和水。连续人工照明在实验的前3天每天维持23小时,在4至7天每天维持20小时,在实验的其余时间中每天维持18小时。温度、相对湿度和通风由计算机控制,在前13天温度每天逐渐降低0.5℃,从第14天直到第35天温度每天逐渐降低约0.4℃,从鸡孵化当天的34.0℃(1日龄鸡)逐渐降低至实验结束时(第35天)的最终温度20.4℃。在15日龄时,针对新城疫给鸡喷雾接种疫苗(PoulvacNDW疫苗,Intervet,Boxmeier,荷兰)。在实验开始时(第0天)和在第14、21、28和35日龄时记录个体鸡重量。此外,在称重鸡的同一天记录每个围栏的饲料消耗。基于计算的体重增加和饲料消耗,饲料增重比(F:G)计算为kg消耗的饲料/kg体重增加。每个围栏的总饲料消耗针对死亡率、剔除率和异常值做校正。使用以下公式计算欧洲家禽指数:欧洲家禽指数=(最终体重(g)×(100%-死亡率%))/((10×周期天数)×总体FCR)使用以下公式计算不包括死亡率的欧洲家禽指数:欧洲家禽指数=(最终体重(g)×100)/((10×周期天数)×总体FCR)根据以下统计模型,对所有的数据使用SAS(Version9.3,SASInstituteInc.,Gary,NC,USA)的MIXEDMODEL程序:Yij=μ+αi+bj+εij其中:Yij=每个实验单元测量的特定性状μ=特定性状的总体平均值αi=肉鸡种鸡处理的固定效应(i=1-4)bj=随机区域效应(j=1-6)εij=残余误差项使用对比比较处理效果。下面给出对比说明,并且用于回答每个问题的对比指标在表23中示出。1)是否有线性维生素E效应?2)是否有PROVIOX50替换效应?3)PROVIOX50的替换效应是否取决于剂量?4)除维生素E之外添加PROVIOX50是否有添加效应?表23、用于统计分析的对比报表饮食的营养组成与预期值一致(表22)。在整个实验中观察到鸡的健康状况良好。死亡率,包括剔除率,达到1.4%,与实际水平(3至4%)和与以前的肉鸡生长研究(2012年平均:4.5%)相比较低。令人惊讶的是,当肉鸡种鸡饲料中维生素E被PPROVIOX50部分替换时,后代的最终体重、平均日增重、和采食量显著更高(分别为4.2%、4.8%和3.8%),这不依赖于添加水平,如表24所示。表24、肉鸡种鸡处理对后代死亡率、体重、欧洲家禽指数(EPI)、平均日增重(ADG)、平均日采食量(ADFI)和饲料增重比(F:G)的影响死亡率=相对于第0天的鸡数量的总死亡率和剔除率的百分比;EPI=((最终体重Wt(g)×100%-死亡率%))/((10×周期天数)×总体FCR);不包括死亡率的EPI=((最终体重Wt(g)×100%)/((10×周期天数)×总体FCR);F:G=g饲料进食量:g增重。1每个围栏有30只鸡。2对于维生素E剂量1和Proviox剂量2,n=5。3对于维生素E剂量1,n=5,且对于Proviox剂量2,n=4。4对于Proviox剂量2,n=5。5对于维生素E剂量1,n=5。7对BW校正F:G=F:G对在35日龄2,176克体重校正。每100克额外重量校正-0.02。NS=P>0.10;*=P<0.10;**=P<0.01。参考表24,在高添加水平替换,饲料增重比改进显著更好,其中替换导致饲料的有效使用率高1.9%。当针对最终体重做校正时,效果甚至更明显(后代的有效率高3.9%;图6)。与低维生素E处理相比,高维生素E处理的总饲料增重比显著更差(1.4%)。此外,当针对最终体重校正时,这种效果更加明显(2.6%)。目前尚不清楚为什么肉鸡种鸡饮食中较高的维生素E水平会导致较低效率的后代。在后代表现之后,发表的关于肉鸡种鸡饮食的研究主要报告使用的维生素E水平在0和100ppm之间,本研究中的高添加水平为160ppm。实际上,有时使用甚至更高的水平,然而,重点仍然是每个种鸡孵出的鸡的数量,更少,甚或不关注后代的表现。对较低后代表现的可能解释可以是,在种鸡饮食中维生素E过量,由此安排后代在维生素E吸收方面效率较低,或在抗氧化防御方面效率较低。通过在肉鸡种鸡饮食中提供PROVIOX50,其它抗氧化剂源可用于后代(水溶性源)。这可能增加后代的抗氧化状态,从而使它们能够生长得越来越高效。目前研究的结果表明,将肉鸡种鸡饮食中的维生素E从80ppm提高到160ppm导致低效率的后代。令人惊讶地发现,用PROVIOX50替换50%的维生素E导致显著更高的总体生长和进食量(与剂量无关),并且在高添加水平下产生更有效的后代。实施例7-部分替换肉鸡种鸡饮食中维生素E在前实验期期间(49-56周龄),所有种鸡接受相同的饮食。在实验期间,种鸡接受对照饮食或其中50%的维生素E被PROVIOX50替换的饮食(参见表25)。表25、肉鸡种鸡处理的实验设计*维生素E50等价物总共有12个地面围栏,所用的每个围栏有大约30只雌性种鸡和3只雄性种鸡。实验期持续8周;种鸡在整个实验期间接受产蛋阶段饮食。饲料和水都受到限制。饲料量取决于平均体重的发展。在前实验期期间和实验期间的饲喂水平示于图7。每天提供两小时水,定期检查嗉囊以确保提供正确的水量。在饮食配制之前,储备几批豆粕、麦麸、粗粉碎的玉米和小麦,并对其粗蛋白质含量、干物质、钙和磷进行化学分析。此外,对豆粕分析钾含量,并对麦麸的粗纤维,钾和淀粉进行湿法化学分析。近红外反射光谱(“NIRS”)分析用于预测粗灰分、粗脂肪、粗纤维、水分和交叉检查粗蛋白。饮食的配方基于保留成分的营养物含量分析。在整个实验期间使用一批饲料。基于对肉鸡种鸡的Provimi营养建议配制基础饮食(玉米-豆粕-小麦和麦麸)。根据Provimi营养代码(“PNC”)系统优化饮食配方。尽管使用相同的实验设计和预混物组成,但生产不同的雄性和雌性饮食。这是为了能够根据其营养需要(较低的粗蛋白、能量和钙要求)饲喂雄性。实验饮食和分析的组成分别示于表26和表27中。饮食由ResearchDietServices(RDS,WijkbijDuurstede,荷兰)生产。使用一个用于雌性饮食的基础饮食批次和一个用于雄性饮食的基础饮食批次,分别生产饮食。饮食生产为糊状饲料。表26实验饮食的成分和营养组成表27、实验饮食的营养组成分析通过商业育种组织(PluvitaB.V.,Apeldorn,荷兰)购买总共730只雌性和92只雄性Ross30819周龄种鸡。在到达时(在前实验期的开始),将雄性和雌性随机分配到地面围栏(每个围栏3-4只雄性和30-31只雌性)。在产蛋阶段开始,种鸡被重新分配(每个围栏30只雌性和3只雄性)。将其余的健康雄性放置在备用围栏中,而其余的雌性被剔除。在以下(前)实验期开始时,动物不重新分配。在整个实验中,将种鸡饲养在()肉鸡种鸡地面围栏(2.60×2.40m)中在褥草(亚麻)上。每个围栏配有一个自动饮水器,高度可调。用于雌性的饲料通过在升高的板条地板上的两个饲料碗供应;雄性的饲料通过在围栏的另一侧的喂料槽供给。根据育种标准,在第一个前实验期间种鸡被光刺激。在实验期间,将日长度设定为每天15小时。温度和通风由计算机控制。在整个期间,将温度设定为20℃。在整个实验中使用放置在设施内的数据记录器连续记录室温。在49、55、60和64周龄记录个体鸡重量。在51、53、58和62周龄时,50%的雌性和所有雄性被称重,并且在剩余的星期,仅称重前4个围栏以确定适当的体重发育。每天记录提供的饲料量。每天记录蛋产量和蛋质量数据。产蛋%计算为每个围栏产生的蛋数除以实验期的鸡日数。每周每个围栏的产蛋的质量计算为产蛋%(包括次等蛋)乘以该围栏的平均蛋重。每周测定一次平均蛋重。次等蛋分为脏蛋、碎蛋、无壳蛋、双蛋黄蛋、窝外蛋和其余的次等蛋。每天检查死亡率;在实验期间不替换死亡动物。统计根据用于假设检验和均值分离的Provimi标准,使用ANOVA(修订版1.3)进行统计。为了比较不同的处理,根据以下统计模型,使用SAS(Version9.2,SASInstituteInc.,Cary,NC,2008)对所有参数使用MIXEDMODEL程序:Yij=μ+αi+bj+εij其中:Yij=每个实验单元的特定性状(围栏)μ=特定性状的总体平均值αi=固定处理效应(i=1或2)bj=随机区域效应(j=1、2、...、6)εij=误差项对比用于比较处理效果。以下给出对比说明,并且用于回答该问题的对比指标在表28中示出。1)是否有PROVIOX50效应?表28用于统计分析的对比报表对照PROVIOX1)-11饮食的营养组成与表27中所示的预期值一致。在整个实验中观察到的鸡的健康状况良好。包括剔除率在内的死亡率达到6.7%,其与育种标准(在40周产蛋期间总死亡率和剔除率为8%)相比是平均水平。技术表现符合Ross308的种鸡标准。在整个实验期间,处理内的变化(LSD)(表示为平均鸡表现的百分比)对于产蛋率和蛋重分别为13.0%和1.6%。在前实验期期间,任何表现数据(数据未显示)中没有发现显著的处理或遗留效应。与对照处理相比,在产蛋百分比方面,没有发现任何处理的影响,如表29所示。表29、饲喂实验饮食的种鸡的技术结果然而,如图8所示,当在种鸡饮食中使用PROVIOX50时,与对照饮食相比,产蛋率数值增加8.8%。在整个实验期,没有发现对蛋重量的显著影响,这与以前的研究一致。参考表30,当由PROVIOX50部分替换(50%)维生素E时,相对蛋壳重量显著增加3.8%。这还涉及蛋破碎强度的数值改进(7.9%)。数值上,在实验期间,当维生素E由PROVIOX50部分替换时,碎蛋的数量也减少了50%。表30、饲喂实验饮食的种鸡的蛋参数结果当维生素E被PROVIOX50部分替换(50%)时,产蛋百分比数值增加了8.8%。对于整体平均蛋重没有发现显著影响。当维生素E被PROVIOX50部分替换时,相对蛋壳重量增加了3.8%;这也涉及到蛋破碎强度的数值提高(7.9%)。实施例8-实施例7的蛋生产的鸡在11天的时间里,从实施例7的肉鸡种鸡群中收集鸡蛋。按照种鸡围栏和储存日存储蛋。孵育所有蛋,直到孵化。蛋分布在12个托盘和6个区域,每个区域表示储存日。种鸡接受两种实验饮食中的一种,如表31所示。表31、肉鸡种鸡处理的实验设计收集来自实施例7的63周龄肉鸡种鸡的总共1,080个蛋并储存在InnovationCenterVelddriel的肉鸡种鸡设施的蛋储存单元中。在孵育期开始时,将蛋称重并分配到区域中,每个区域代表储存日组合。每个区域由12个实验单元组成,每个实验单元指示一组15个蛋。仅包括完整的蛋;碎蛋、脏蛋或变形壳的蛋从试验中排除。将蛋放置在具有自动控制温度和相对湿度的NatureFormNMC2340孵育器中。从E0到E18,蛋被放置在孵蛋盘台车中,其由两个搁板组成,每个搁板可容纳13个托盘。每个托盘可容纳3层30个蛋。在此期间,孵化器起始温度设定为37.5℃,相对湿度设定为54%。基于在E037.5℃的起始温度且从E12至E18逐渐从37.5℃降低至36.7℃的温度谱设定温度。在孵蛋期(E0-E18)之后,基于孵蛋盘中的区域和托盘结构将蛋转移到孵化器中的篮子里。孵育器温度设定为36.7℃,相对湿度设定为70%。在整个实验中使用放置在孵育器内不同位置的数据记录器连续记录孵育器温度。在E0、E7和E18,记录蛋组的重量。在E7和E18,所有的蛋被对光检查,并去除空蛋或含有死胚胎的蛋(早期死亡E0-E7,中期死亡E8-E18)。对光检查后,在E18,蛋被转移到孵化篮。在孵化(E21)时,记录死鸡、晚死胚胎(E19-E21)和鸡破壳而出的蛋的数量。每次重复实验,记录孵出的鸡的数量,以及平均雏鸡重量。孵化率计算为总孵蛋的百分比。性别通过羽毛性别鉴定法确定,雌性鸡被用于解剖。所有雄性鸡被选择进入生长期并分配给肉鸡生长围栏。仅选择完全干燥、显示主动运动和具有良好中央评分的鸡。选择每个实验单元的1只雌性鸡用于解剖。剩余的鸡用CO2安乐死并根据当地规定进行处理。单独称用于解剖的鸡并通过颈脱位法杀死,以测量剩余卵黄囊重量、无卵黄体重(“YFBM”)、雏鸡长度和两条胫的胫长度。根据下式计算相对不对称性:RA=(|L-R|/[(L+R)/2))×100其中:L=左胫长度R=右胫长度。为了比较不同的处理,使用SAS(Version9.3,SASInstituteInc.,Gary,NC,2008)根据以下统计模型对表现参数(正态分布)、孵化率和胚胎死亡率(二项分布)使用MixedModel分析:Yijk=μ+αi+bj+α(c)ik+εijk其中:Yijk=每个实验单元的特定性状(15个鸡蛋的重复)μ=特定性状的总体平均值αi=种鸡处理的固定效应(i=1-2)bj=区域/存储日的随机效应(j=1-6)α(c)ik=处理内种鸡围栏的随机巢式效应(k=1-12)εijk=误差项在模型中包括处理内的种鸡围栏的巢式效应,以针对所使用的肉鸡种鸡处理的实验单元的数量做校正。由于实验的设计,储存日效应完全与区域(在孵育器中的位置)效应混杂。对比用于比较处理效果。下面给出对比说明,并且回答每个问题的对比指标示于表32中。1)是否有PPROVIOX50效应?表32、用于统计分析的对比报表试验开始时的平均蛋重为每只蛋71.2克,略高于每只蛋70.3克的63周龄Ross肉鸡种鸡的育种标准。与63周龄的Ross种禽的育种标准(占总数的73%)相比,平均孵化率(占总数的72.0%)略低于平均值。基于每次处理的9次重复实验,对于雏鸡体重和无卵黄体重,与以前试验(分别为3.5%和3.7%)相比,处理内的变化(LSD)(表示为平均鸡的表现的百分比)(分别为6.7和6.4%)高。参考表33,对于总孵化率或受精卵的孵化率,没有发现显著的肉鸡种鸡处理影响。与对照饮食相比,PROVIOX50处理的晚期胚胎死亡率(E18-E21)显著较低。然而,与对照饮食相比,PROVIOX50处理的早期孵育(E0-E7)死亡率略高;因此,在孵化率方面没有发现显著的影响。表33、肉鸡种鸡处理和孵育器对胚胎死亡率和孵化率的影响*参考表34,与对照处理相比,在孵化时,PROVIOX50处理的平均雏鸡重量显著更高。当针对初始蛋重做校正时,与对照处理相比,PROVIOX50处理仍然显著更高。与对照处理相比,在孵化时,PROVIOX50处理的相对剩余卵黄囊重量显著更低,表明增加的卵黄使用率。表34、肉鸡种鸡处理对胚胎发育和Ross308胚胎孵化时雏鸡质量参数的影响在总孵化率或受精卵的孵化率上没有发现显著的影响。用PROVIOX50补充种鸡饮食导致显著更重的后代和增加的卵黄使用率。实施例9-实施例8的鸡的生长评价了两种肉鸡种鸡的饲料处理(表35)。表35、肉鸡种鸡处理的实验设计*维生素E50等价物使实施例8的孵化的雏鸡生长,其源自实施例7的肉鸡种鸡实验,其中种鸡接受对照饮食或其中50%的维生素E被PROVIOX50替换的饮食。在此实施例中,用相同的基础饮食饲喂所有的肉鸡。实验期分为起始阶段(0-14天)和生长阶段(14-34天)。在14日龄时,所有的鸡的饮食变为其生长饮食。在饮食配制之前,储备成分(玉米和豆粕),并在ProvimiB.V.laboratory,Rotterdam,荷兰,对粗蛋白(“CP”)(ISO16634)和钙(ISO27085:2009)含量进行分析。分析玉米的磷含量(ISO27085:2009)和豆粕的钾(ISO27085:2009);应用近红外反射光谱分析(ISO12099)估算干物质、粗脂肪、粗纤维和粗灰分含量。起始饮食和生长饮食在新的Cargill营养系统(“CNS”)和家禽阴影饲料(TD20141)内并基于其进行优化。起始饮食和生长饮食配方分别源自阴影饲料P_BRHIGH51和P_BRHIGH52。根据CNS矩阵,AME上升归因于所用的NSP酶(HostazymeX,100g/MT;+40kcal/kg)。在PHYIDX9的两种饮食中包括植酸酶(Phzyme10000TPT)。实验起始饮食和生长饮食的组成在表36中提供。饮食的分析显示在表37中。起始饮食和生长饮食由ResearchDietServices(RDS,WijkbijDuurstede,荷兰)生产。加入蒸汽(约80℃),将起始饮食制成2.5mm的颗粒,将生长饮食制成3mm的颗粒。表36、饮食的成分和营养组成表37、起始饮食和生长饮食的营养组成计算和分析从实施例8的孵化的雄性鸡的总数中选择总共252只Ross308雄性1日龄鸡,其来自实施例7的63周龄肉鸡种鸡。鸡随机选自孵化场中不同的实验单元,确保肉鸡种鸡设施的实验单元保持完好,将来自肉鸡种鸡设施的一个实验单元的鸡放入成长设施中的一个围栏中。每个围栏由21只雏鸡组成,单元A和B初始个体体重分别为49.1g±1.0g和48.5g±1.0g。围栏(90cm×225cm)具有升高的地板,其由覆盖有2cm的刨花层的不锈钢构成。每个围栏配备两套设备,每套设备具有两个可调节乳头饮水器和在前13天位于围栏内的喂食器。从第14天开始,通过围栏前面的饲料槽供给饲料。在整个研究过程中随意提供饲料和水。连续人工照明在实验的前3天维持23小时/天,在第4天至7天之间维持20小时/天,在实验的其余时间维持18小时/天。温度、相对湿度和通风是计算机控制的,前13天温度每天降低0.5℃,从第14天至第35天每天降低0.4℃,从到达当天(1日龄鸡)的34.0℃逐渐降低至19.6℃,并保持恒定在19.6℃直至实验结束(第35天)。使用数据记录器连续记录室温,并且在整个实验过程中将相对湿度设定为50%。在14日龄时针对新城疫用PoulvacNDW疫苗(PoulvacNDW疫苗,Intervet,Boxmeer,荷兰)对鸡喷洒接种。在整个实验中使用放置在设施内的数据记录器连续记录室温,每个房间放置一个数据记录器。在实验开始时(第0天)和7、14、21、28和34天时记录个体体重。另外,在鸡称重的同一天记录每个围栏的饲料消耗。基于计算的体重增加和饲料消耗,饲料增重比(F:G)计算为kg消耗的饲料/kg体重增加。每个围栏的总饲料消耗针对死亡率、剔除率和异常值进行校正。使用以下公式用(1)计算欧洲家禽指数,使用以下公式用(2)计算不包含死亡率的欧洲家禽指数(DeHerdtetal.,1999):1.欧洲家禽指数=(最终体重(g)×(100%-死亡率%))/((10×周期天数)×总体FCR)2.欧洲家禽指数=(最终体重(g)×100)/((10×周期天数)×总体FCR)为了确定雏鸡的免疫状态发展,根据Parmentieretal(2008)说明的方法,在14日龄时在气管中用HuSA单独接种所有雏鸡,并且在14、21、28和34天收集血样(每个围栏6只雏鸡,颜色编码)。储存血浆用于进一步分析IgT、IgA、IgY和IgM含量(WageningenUniversitylaboratory,Wageningen,荷兰)。从21日龄开始,每周由多个观察者给褥草质量评出1至5之间的分数。在实验的第34天,每圈随机选择5只鸡(不包括明显的异常值)。收集排泄物过夜并在早晨取样(第35天)。在收集后,将排泄物充分混合,并填充10ml塑料试管(肝素血管)以进行游离水分析,并填充NIR袋用于NIR分析(Provimilaboratory,Rotterdam,荷兰)。通过将填充的试管在3,000rpm离心12分钟来分析游离水。除固体物之外的水(g)表示为离心过滤前排泄物重量(g)的百分比。在35日龄时,将鸡饥饿过夜(约8小时),并在第二天宰杀。在第36天的上午,这些所选择的鸡接连进行称重、用CO2/O2杀死、放血、并除去羽毛。确定屠体(不含羽毛、血、脏器(organ)、肠、头部和飞节以下的腿的整只鸡)的重量,并将屠体产率计算为不计饲料的鸡重量(屠宰前的整体鸟重量)的百分比。此外,确定胸部(胸大肌、胸小肌、胸骨和锁骨)和腹部脂肪垫重量,并将它们的产率计算为屠体重量的百分比。还确定脾脏和肝脏重量,并且也相对地表示为个体体重的百分比。根据以下统计模型,对所有正态分布的表现数据使用SASVersion9.3(SASInstituteInc.,Cary,NC)中的PROCMIXED语句程序:Yij=μ+αi+bj+εij其中:Yij=对于每个实验单元测量的特定性状μ=特定性状的总体平均值αi=肉鸡育种处理的固定效应(i=1-2)bj=随机区域效应(j=1-6)εij=残余误差项使用相同模型,使用SASVersion9.3(SASInstituteInc.,Cary,NC)中的PROCGLMMIX语句程序对死亡率作二项分析,将评分作为序数数据。为了说明重复的褥草评分的日效应,对于这些分析,在统计模型中将日作为协变量考虑。为了针对褥草评分中的人的效应做校正,变量人在统计模型中被认为是随机效应。使用重复测量值分析血液结果,以单个鸡为对象。对比用于比较处理效果。下面给出对比说明,并且回答问题的对比指标在表38中示出。1)是否有PROVIOX50效应?表38用于统计分析的对比报表对照PROVIOX1)-11饮食的营养组成与预期值一致(表37)。在整个实验中观察到的鸡的健康状况良好。虽然死亡率,包括剔除率,达到5.7%,与实际水平(3至4%)和以前的肉鸡生长研究(平均3.9%)相比有点高,但与在InnovationCenterVelddriel的肉鸡设施进行的其它实验(平均BW:2,383g)相比,平均技术表现(第34天的平均体重:2,516g)高。区域中的变化(LSD)(表示为平均鸡表现的百分比)是体重增加和FCR的平均值,分别为4.2和1.7%(每个围栏最多21只鸡和6个重复实验-数据未显示),与之相比的是之前的数据为平均LSDBW和FCR分别为4.0和1.8%。后代生长表现没有受到任何肉鸡种鸡饮食的显著影响。在之前的研究中,评价PROVIOX50在种鸡饮食中对后代生长表现的影响,在也使用在本试验中的添加水平上发现2.4%的ADG改进。现在数值增加仅为1.3%(见表39)。在以前的研究中,替换的影响在高维生素E水平(160ppm;改进的ADG和F:G)下更显著。目前的和以前的结果表明,在肉鸡种鸡饮食中抗氧化剂的组合有利于后代生长表现,并且对于饲喂80ppm的基础维生素E水平的较年轻的肉鸡种鸡的后代的影响似乎最显著。表39、肉鸡种鸡处理对Ross308雄性肉鸡的后代死亡率、体重、欧洲家禽指数(“EPI”)、平均日增重(ADG)、平均日采食量(“ADFI”)和饲料增重比(F:G)当评估解剖参数和排泄物结果(表40)时,没有发现显著差异。表40、肉鸡种鸡处理对Ross308雄性肉鸡的解剖参数、褥草评分和排泄物含量的影响HuSAIgA滴度据报告非常低,因此不可靠,因此没有讨论这些结果。在种鸡处理和HuSA特异性血浆滴度日之间没有发现显著的相互作用(参见表41)。表41肉鸡种鸡处理和收集日对血浆HuSA和LPS滴度的影响的相互作用对于LPSIgG滴度,发现显著的相互作用,这是由于接受对照饮食的种鸡后代的LPSIgG滴度在34日龄时的相对较高的增加(图9)。HuSA特异性滴度显著受到日期的影响,表明在HuSA接种之前值较低,并且在接种后增加,当雏鸡较大时再次减少(参见图10)。这是与预期一致的。当雏鸡较大时,LPS滴度增加,这也是与预期一致的。参考图11,接受PROVIOX50部分替换维生素E的种鸡的后代的LPS滴度(IgG,IgM和IgT)显著更高。这些结果表明,接受PROVIOX50的肉鸡种鸡的后代的免疫活性更高。本发明和先前生长研究的结果表明,当饲喂肉鸡种鸡饮食中的抗氧化剂的组合时,后代的生长表现得到改进。这种影响似乎对年轻的肉鸡种鸡且饲喂80ppm基础维生素E水平的后代最显著。免疫血浆参数分析显示,当肉鸡种鸡饮食中维生素E被PROVIOX50部分(50%)替换时,非特异性滴度增加。实施例10-饲喂猪动物的方法本实施例的目的是证明PROVIOX50对猪的功效。通过将PROVIOX50补充组(根据母猪反应标准、窝反应标准、抗氧化和维生素E状态)与阴性对照组及具有不同维生素E含量的组进行比较来评价产品的功效。在波兰的一个农场进行了实验。一般来说,所选定的工作场所的动物居所和管理条件被认为是地区的代表。农场的育种、孕育和分娩设施是完全封闭的建筑物,有通风和加热的房间,以保持母猪的最低舒适区温度。妊娠母猪住处和分娩室的环境温度保持在恒定的温度18-20℃和相对湿度60%。一般来说,所有工作场所都符合组别比较试验的要求和有关动物保护的有效规则的要求。在相同杂交(PIC)类型的母猪(初产和经产)上进行测试。试验包括连续分娩系统中的52头母猪。每组由13头组成。试验从怀孕的第1天开始到下一周期的再次配种。有两种饮食组成:LP0-90d、LK-怀孕90d-断奶。在整个研究中饲喂的饲料在农场的饲料厂中制造。所生产的饲料是根据参与农场的标准饲喂管理程序的全价饲料。饲料稠度是糊状。分析所有饮食的营养物和维生素E含量(AOAC,2000)。饲料示于表42中。表42测试产品名称:PROVIOX50每组给怀孕母猪(0-90d)饲喂具有不同添加水平的维生素E和测试产品(参见表43A)的全价饮食,给哺乳母猪(怀孕90d-断奶)饲喂哺乳饮食,即具有不同添加水平的维生素E和测试产品(参见表43B)的全价饮食。表43A、怀孕饮食(怀孕0-90天)-LP饮食维生素E和PROVIOX50的添加组1维生素E-0mg/kg组2维生素E-50mg/kg组3维生素E-100mg/kg组4维生素E50mg/kg+PROVIOX50mg/kg表43B、哺乳饮食(怀孕90天-哺乳28天)-LK饮食维生素E和PROVIOX50的添加组1维生素E-0mg/kg组2维生素E-75mg/kg组3维生素E-150mg/kg组4维生素E75mg/kg+PROVIOX5075mg/kg在试验期间监测以下表现标准:(i)母猪反应标准(实际产次、分娩率、剔除的母猪-数量和原因、断奶-交配间隔、下一周期的分娩率);(ii)窝反应标准(仔猪数,总数、活的、死产的、干尸的仔猪数;仔猪重量和窝重;存活)。在试验期间监测母猪(交配、分娩和断奶)、第21天仔猪的以下生化(血液)标准:(i)谷胱甘肽过氧化物酶(GPx)活性;(ii)超氧化物歧化酶(SOD)活性;(iii)总抗氧化状态(TAS);(iv)维生素E含量;(v)维生素A含量。为了确定氧化状态,收集母猪和仔猪血样到具有锂抗凝剂的管中-接收的全血用于分析。同时,采集血样用于得到血凝块。将它们离心过滤(1500rpm,15’,温度4℃),将获得的血清移液到单独的管中。在母猪和仔猪的氧化状态的研究中,使用适合于每种指标的来自Sigma-Aldrich的试剂盒。根据制造商规定的规则和程序的说明进行测定。使用抗氧化剂测定试剂盒(CatNoCS0790)测定TAS的含量(总抗氧化剂状态),使用SOD测定试剂盒19160测定SOD(超氧化物歧化酶)的活性,用谷胱甘肽过氧化物测定细胞活性试剂盒(Cat.NoCGP1)测定GPx的活性。根据McMurray和Blanchflower1979(JournalofChromatography178,525-531.)测定维生素A和E的含量。将一式两份的血清样品(10μl)与ABTS(2,2-叠氮基-双(3-乙基苯并噻唑啉-6-磺酸)的工作溶液(150pl)和具有肌红蛋白的溶液(20pl)在室温下孵育5分钟。同时,基于在0.015至0.42mM(mmol)范围内的Trolox等价物的系列稀释液进行校准曲线。由肌红蛋白和过氧化氢形成的高铁离子自由基引起ABTS的氧化和自由基阳离子ABTS*的产生。所得色原体具有蓝绿色。在抗氧化剂存在的情况下,自由基阳离子被抑制,抑制的程度取决于抗氧化剂的活性,并且颜色强度成比例地降低。用分光光度计在405nm的波长下测量颜色。将一式两份的血清样品(20μl)与工作溶液WST(四唑钠盐,2-(4-碘代苯基)-3-(4-硝基苯基)-5-(2,4-二磺基苯基)2H-四唑单钠盐)(200pl)和酶工作溶液(20pl)在37℃培养20分钟。同时进行样品空白(两种试剂,对每个样品为空白)并且得到基于在200至0,001U/ml范围内的SOD系列稀释的校准曲线。用分光光度计上在450nm的波长下读取空白、标准品和测试样品的吸光度。WST在用超氧化物阴离子还原时产生水溶性甲瓒染料。还原O2的速率与黄嘌呤氧化酶(XO)活性线性相关。SOD活性被测量为阻断甲瓒染料形成的程度。将全血样品(收集动物血液到具有锂抗凝剂的试管)一式两份(10pl)加入到930ml缓冲液(pH8)中,混合(涡旋-10’),然后加入10pl70%叔丁基过氧化氢水性溶液,混合(通过倒转),并立即用分光光度计在340nm的波长测量吸光度。1分钟后重复测量。同时进行空白样品(试剂),并得到基于在20至50U/ml范围内的GPx系列稀释液的校准曲线。在NADPH氧化为NADP+的过程中,在340nm处测量的NADPH吸光度(在1分钟内)的降低指示GPx活性。将血清样品(1ml)用无水乙醇(1ml)脱蛋白,用5ml正己烷(Vortex5)萃取,然后离心(3000rpm,10’,温度4℃)。将所得的4ml上清液在氮气下蒸发至干,然后溶解在1ml的96%乙醇中,并通过高效液相色谱(HPLC)进行分析。视黄醇和生育酚的含量通过具有色谱SHMADZU的反相高效液相色谱(HPLC)测定。使用NucleosilC18色谱柱,载体相为甲醇-水(95:5,v:v)。使用UV检测器在326nm的波长下进行测量,以确定视黄醇的量和使用荧光检测器(激发波长-295nm,发射波长-330nM)确定生育酚含量。基于峰值外标(Sigma-Aldrich(□)-α-生育酚、视黄醇维生素A-醇),计算视黄醇和生育酚的浓度。使用单向方差分析和Duncan's检验统计地处理实验结果。获得的结果用算术平均值(x)、平均值的标准误差(SEM)和显著性水平(P)表征。使用STATISTICA10软件进行所有计算。母猪繁殖表现的结果示于表44和表45中。表44表45a,b-P<0,05如表44和45所示,处理和对照母猪的平均产次分别为3.85、3.46、3.50和3.23。与阴性对照组母猪(在第一次和第二次交配后母猪没有怀孕,产仔率)相比,接受维生素E饮食或维生素E和PROVIOX50添加饮食的母猪表征为更好的生育力和交配效率。然而,观察到的差异不具有统计学显著性。在这个实验中,多酚产品(PROVIOX50)补充对被剔除的母猪的数量没有显著影响,但是表现出较短的断奶再交配间隔的趋势。添加不同水平的维生素E和PROVIOX50到母猪饮食中改进了下个周期的产仔率,但组别间差异无统计学意义。考虑到结果,可以得出结论,与用饲喂维生素E饮食的母猪组相比,接受具有PROVIOX50补充的饮食的母猪表征为类似的生育力和交配效率。在出生时活的、虚弱的或出生时干尸的猪的总数之间没有差异(P<0.05)(表45)。根据处理,分析的母猪的出生时活的仔猪的平均数量在11.50和13.18之间变化,虚弱猪的平均数量为0.36至0.8。实验组的每窝出生时活的仔猪数(12.82、13.18、13.00)高于对照组(11.50)。观察到的差异无统计学意义(P<0.05)。干尸的平均数量在0和0.2之间变化。在饲喂维生素E和PROVIOX50补充的母猪中,每窝的断奶仔猪数量倾向于较高(P=0.06)(11.73、11.82、11.55vs.9.80)。实验组的窝重(18.50、19.07、19.34kg)显著(P<0.05)高于比对照组(15.59kg)。实验组出生时的仔猪体重分别达到1.44(组2)、1.45(组3)和1.49(组4),而对照动物(组1)的平均体重为1.46kg。观察到的差异无统计学意义(P<0.05)。在断奶时,含有维生素E和PROVIOX50添加的组的窝重(85.05、84.33、85.98kg)显著(P<0.05)高于比对照组(67,85kg)。在哺乳期后,来自处理2、3和4的仔猪的最终体重分别达到7.16、7.31和7.48kg,而来自对照组(1)的动物平均重量为6.94kg。组别间的断奶重量的差异在统计学上不显著。维生素E和PROVIOX50在母猪饮食中的应用降低了实验仔猪的死亡率,但组间的差异在统计学上不显著。死亡的3个主要原因是:虚弱、母猪碾压和脱水。考虑到结果,可以得出结论,接受PROVIOX50补充的饮食的母猪由与饲喂添加维生素E的饲料的母猪组相比类似的生育力、交配效率和仔猪表现表征。在妊娠期和哺乳期的每个测量期间,当向母猪饮食中加入维生素E时,血清α-生育酚(维生素E)浓度更高(P<0.001)。随着维生素E补充水平的增加,血清α-生育酚浓度增加(表46)。尽管在两个时期(分娩和断奶)中证实了血清维生素E的增加,但是结果显示分娩时的增加比以后的增加更多。(在组IV(维生素E50/75mg/kg+PROVIOX50)中,分娩和断奶时的血清α-生育酚浓度与组III(维生素E100/150mg/kg)相似。从育种到分娩血清α-生育酚减少,但仅在组1和2中出现这种情况。当饲喂基础饮食时,从育种到分娩血清维生素A(视黄醇)浓度下降。当提供维生素E补充时,分娩时血清维生素A浓度呈线性(P<0.001)增加。与饲喂50/75mg维生素E/kg饮食的猪(组2)相比,饲喂饮食3(100/150mg维生素E/kg)和饮食4(维生素E+PROVIOX50)的猪具有较高的维生素A的血清浓度。具有维生素E和PROVIOX50补充的饮食对母猪血清中维生素A的水平具有积极作用(P<0.05)。维生素E对断奶时血清维生素A浓度没有影响。进行各种分析以评价膳食维生素E和PROVIOX50的抗氧化效果,如表46所示。表46a,b-P<0.05A,B-P<0.01血清总抗氧化状态(TAS)已被用作动物抗氧化状态的指征。添加不同水平的维生素E和PROVIOX50改变TAS。对于TAS,对照组(0维生素E)和实验组之间存在差异。在饲喂维生素E和PROVIOX50的母猪中,血清TAS比在仅饲喂维生素E的母猪中增加更多。在育种时,血清SOD(超氧化物歧化酶)值范围为70.99至73.28个酶单位(U/ml)。血清SOD活性受分娩和断奶时膳食维生素E水平的影响(P<0.001)。特别是在断奶时(P<0.001),在饲喂维生素E和PROVIOX50的母猪中观察到SOD的最高活性。在对照组中,来自母猪的血液中的GPx(谷胱甘肽过氧化物酶)活性显著低于接受维生素E的母猪的血液中的GPx(P<0.001)。在两个时期(分娩和断奶)中都观察到饲喂维生素E和PROVIOX50的母猪的GPx的最高活性(P<0.001)。在21日龄的仔猪血清α-生育酚浓度受到供应给繁殖雌性的抗氧化源(维生素E和PROVIOX50)和维生素E的水平的影响(参见表47和表48)。表47表47、母猪血清和血液中的总抗氧化状态(TASmmol/L血清)、超氧化物歧化酶活性(SODU/ml血清)和谷胱甘肽过氧化物酶活性(GPxU/ml血液)表48、在21天的仔猪血清和血液中的维生素E和A(mg/ml血清)、总抗氧化状态(TASmmol/L血清)、超氧化物歧化酶活性(SODU/ml血清)和谷胱甘肽过氧化物酶活性(GPxU/ml血液)a,b-P≤0.05;A,B-P≤0.01向母猪的饮食中添加维生素E导致血清α-生育酚浓度增加(P<0.001)。当给哺乳母猪饲喂150mg/kg维生素E时,与饲喂75mg/kg维生素E的母猪的仔猪相比,其仔猪具有更高的(P<0.001)血清α-生育酚浓度(P<0.001)。与饲喂75mg/kg维生素E母猪的仔猪相比,饲喂PROVIOX50的母猪的仔猪在21日龄时具有更高的血清α-生育酚浓度(P<0.001)。由于母猪饮食中维生素E的膳食水平增加,血清视黄醇(维生素A)浓度增加(P<0.001)。在饲喂维生素E和PROVIOX50的母猪的仔猪中观察到最高浓度的血清维生素A(P<0.001)。加入不同水平的维生素E和PROVIOX50改变TAS。对于TAS,对照组和实验组之间存在差异(P<0.001)。与未补充组相比,维生素E补充组中平均血清TAS浓度较高。与仅补充维生素E的母猪的仔猪相比,补充维生素E和PROVIOX50的母猪的仔猪血清SOD活性最高。对照组的仔猪血液中的GPx(谷胱甘肽过氧化物酶)活性显著低于接受维生素E的母猪的仔猪(P<0.001)。当饲喂哺乳母猪75mg/kg的维生素E和PROVIOX50时,与饲喂75或150mg维生素E/kg饮食的母猪的仔猪相比,其仔猪具有更高的(P<0.001)血液GPx活性。考虑结果,可以得出结论,与饲喂仅补充维生素E饮食的母猪组相比,接受PROVIOX50补充的母猪由类似或更好的维生素E状态和更好的抗氧化状态表征。结论是PROVIOX50可以替换50%的维生素E得到相同(表现)或更好(抗氧化状态)的效果。除非上下文明确要求,否则在整个说明书和权利要求书中,词语“包括”和类似词应以包括,而不是排除或穷尽的意义来理解;也就是说,“包括但不限于”的意义。使用单数或复数的词也分别包括复数或单数。当权利要求在引用两个或更多个项目的列表时使用词语“或”时,该词语涵盖所有的以下对该词的解释:列表中的任何项目、列表中的所有项目、以及列表中的项目的任何组合。本发明的实施方式的上述详细说明不旨在是穷尽的或将本发明限于上面公开的精确形式。尽管上文出于说明的目的说明了本发明的具体实施方式和实施例,但是如相关领域的技术人员将认识到的,在本发明的范围内的各种等效修改是可能的。例如,虽然以给定的顺序给出了步骤,但是其它实施方式可以以不同的顺序执行步骤。本文所述的各种实施方式也可以组合以提供其它的实施方式。一般来说,除非上述详细说明明确定义了这些术语,否则在权利要求中使用的术语不应被解释为将本发明限制为说明书中公开的具体实施方式。虽然下面以某些权利要求形式呈现了本发明的某些方面,但是发明人在任何数量的权利要求形式中考虑了本发明的各个方面。因此,发明人保留在提交申请之后添加额外权利要求以追求针对本发明的其它方面的这种额外权利要求形式的权利。当前第1页1 2 3
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1