用于提高免疫机能的经酵素处理的人参源多糖组分及制备的制作方法
本申请要求了2014年7月29日申请的大韩民国专利申请第10-2014-0096693号(申请号)的优先权,其说明书的所有内容可作为本申请的参考文献。
本发明涉及一种加强提高免疫功效的酵素处理人参源多糖组分的制造方法及按照所述制造方法制造的多糖组分,具体来说有关于一种提高免疫活性人参源多糖组分的制造方法及按照所述制造方法制造的多糖组分,包括在人参中添加淀粉酶和纤维素酶等2种以上酵素进行酵素处理的步骤;以及从经过所述酵素处理的人参水解产物中获取10kda以上分子量的多糖组分的步骤。
背景技术:
免疫是指人体内,当微生物同类组织等异物从外部侵入,尤其是产生细胞时,免疫类立即介入,识别这些抗原并做出特殊反应,发挥产生抗体的作用,以此维持个体稳定状态的现象。有关免疫反应的细胞有淋巴球、巨噬细胞、nk细胞、树状细胞等。近来,促进活体免疫细胞中细胞因子的释放,使癌细胞坏死的免疫方法备受瞩目。免疫方法就是通过免疫反应的增强及抑制诱导,调节活体的防御能力,杀灭癌细胞,因而比以往依靠药物进行抗癌治疗的方法具有更大的效果。所以,有很多人试图从已通过安全性报告的天然物中寻找具有加强免疫活化功效的天然物。
人参(panaxginsengc.a.meyer)是属于五加科植物的多年生草本,是多生长于韩国、中国、西伯利亚东部的植物。人参的主要生理活性成分有皂苷、聚乙炔、苯酚、炼油成分、肽、多糖体成分等,人们所了解的药理活性如下:皂苷具有抑制中枢神经、抗糖尿、抗压力、抗疲劳的功效;聚乙炔具抗癌活性;苯酚具抗酸化、抗癌、美白、降血糖功效用。人们已经了解,植物体源多糖体是可提高免疫的物质,其中,从人参中分离出来的多糖体能抗糖尿、降血糖、促进胰岛素分泌,同时还能刺激淋巴系统的细胞繁衍、激活抗补体等,提高免疫的活性。
人们已经了解红参源所含有的酸性多糖体具有提高免疫作用,但对红参含有的人参源多糖体的生产技术的研究并不十分活跃,目前的生产是按照一般的植物源多糖体的分离工序。因此我们有必要在运用酵素工学技术、糖锁结构的变形等附加技术大量生产功能性多糖体的同时,去寻找改善食品加工工序品质的方法
技术实现要素:
本发明的发明者们一直在研究能更经济实惠地制造加强免疫增强活性的多糖组分的方法,在此过程中发现了可以用淀粉酶和纤维素酶并行处理人参提取物来制造多糖组分,即使不通过高价的分离锭剂工程,也能制造免疫增强活性加强的多糖组分,由此实现了本发明。
因此,本发明的目的就是提供一种方法,能制备具有免疫机能增强活性的人参源多糖组分,包括对人参先后加入纤维素酶和淀粉酶处理的步骤和从所述经过酵素处理的人参水解产物中获得10kda以上分子量的多糖组分的步骤。
本发明的另一目的是,根据所述方法制备的产品的特征是具有免疫机能增强活性的人参源多糖组分。
本发明的另一目的是,提供一种含有上述多糖组分这一有效成分的用于免疫机能增强的食品组合物。
本分明的另一目的是,提供一种含有上述多糖组分这一有效成分的用于免疫机能增强的药物组合物。
为达到上述目的,本发明提供一种能制造具有免疫机能增强活性的人参源多糖组分的方法,包括对人参先后加入纤维素酶和淀粉酶处理的步骤和从所述经过酵素处理的人参水解产物中获得10kda以上分子量的多糖组分的步骤。
为了达到本发明的另一目的,本发明提供的按照所述方法制造的产品的特征是具有免疫机能增强活性的人参源多糖组分。
为了达到本发明的另一目的,本发明提供一种含有上述多糖组分这一有效成分的用于免疫机能增强的食品组合物。
为了达到本分明的另一目的,本发明提供一种含有上述多糖组分这一有效成分的用于免疫机能增强的药物组合物。
以下是对本发明的详细说明。
本发明提供一种具有免疫功能增强活性的人参源多糖组分的制备方法,包括(a)对人参先后加入纤维素酶和淀粉酶处理处理的步骤;(b)从所述经酵素处理的人参水解产物中获取10kda以上分子量的多糖组分的步骤。
以下是对本发明的制备方法的每一个步骤的说明。
(a)对人参先后加入纤维素酶和淀粉酶处理处理的步骤;
(a)步骤是对人参进行酵素处理。本发明进行酵素处理的过程的特征是先后加入纤维素酶和淀粉酶处理处理。
人参(panaxginsengc.a.meyer)是属于五加科的多年生草本植物,多长于韩国、中国、西伯利亚东部。人参的主要生理活性成分有皂苷、聚乙炔、苯酚、炼油成分、肽、多糖体成分等,人们所了解的人参的药理活性如下:皂苷具有抑制中枢神经、抗糖尿、抗压力、抗疲劳的功效;聚乙炔具有抗癌活性;苯酚具有抗酸化、抗癌、美白、降血糖功效。根据加工形态,人参的名称有很多种。刚收获的人参叫水参,把根连皮一块用水蒸气蒸干的叫红参。干参是晒干的生鲜参,去皮后晒干的白参和不去皮晒干的白干参都属于干参。本发明的人参与其之前的加工形态无关,包括所有人参(panaxginseng),本发明的优选人参可以是水参或白参,更合适的可以是加工而成的水参粉末或白参粉末。
淀粉酶(amylase)是指将淀粉(starch)进行加水分解的酵素。淀粉酶的种类有α-amylase(α-1,4-glucan-4-glucanohydrolase),β-amylase(α-1,4-glucanmaltohydrolase),γ-amylase(amyloglucosidase),本发明并没有限定淀粉酶的种类,但优选的是α-amylase。
纤维素酶(cellulase)是指将纤维素进行加水分解的酵素。
淀粉酶和纤维素酶广泛分布于高等植物、动物及微生物等自然界,虽然本发明未对淀粉酶和纤维素酶的起源有特别的限定,但是来自微生物的淀粉酶和纤维素酶最为理想。本发明的加水分解酵素可直接从高等植物、动物或微生物进行分离或从商业销售点采购后使用。本发明优选的淀粉酶来自于bacilluslicheniformis的spezymextra,而纤维素酶则来自于trichodermareesei的rohamentcl。
本发明中的酵素处理可以是两种酵素并行处理,也可以是先后进行处理。由于纤维素酶和淀粉酶显现出活性的温度相异,因此最好是先后进行处理。酵素投入量及处理温度、时间、ph值等反应条件可能根据作为处理对象的人参提取物的量、投入的纤维素酶或淀粉酶的种类、纯度的不同而不同,未对显现加水分解的目的和效果的限度并作特别限定。本发明的酵素处理可依据的优选方法是先加入纤维素酶进行12至24小时的酵素处理,之后加入淀粉酶进行6至24小时的酵素处理。
此外,本发明中,为了提高酵素反应的效率,可将人参切细或者研成粉末后使用,加入蒸馏水等合适的溶剂后进行酵素处理。
(b)从经过上述酵素处理的人参水解产物中获取10kda以上分子量多糖组分的步骤;
在(b)步骤中,从经过酵素处理的人参水解产物中获取10kda以上分子量的组分。
优选的上述(b)步骤还可以包括:
(b1)从上述经酵素处理的人参水解产物中去除残渣的步骤;
(b2)去除了残渣的人参水解产物中加入有机溶剂沉淀后,获取粗多糖的步骤;以及
(b3)从上述粗多糖中分离获取10kda以上分子量的多糖组分的步骤。
(b1)步骤中,从经过酵素处理的人参水解产物中去除残渣。去除残渣的方法可以采用离心原理、过滤等广为人知的如何从混合物中去除固体粉末的方法。采用过滤的方法最为理想。
最为理想的是,本发明的(b1)步骤中,将经上述酵素处理的人参水解产物中所含有的酵素进行钝性处理,采用离心原理方法去除残渣,分离并获取优等液体。上述钝性处理的优选方法可以是运用热处理的方法,即将水解产物维持在100℃至120℃的温度下10至30分钟。
(b2)步骤中,在去除了残渣的人参水解物中加入有机溶剂后沉淀获得粗多糖。上述有机溶剂可以是乙醇。乙醇的沉淀可以使用最常用的乙醇沉淀法,上述乙醇沉淀中使用的乙醇的浓度最好是与水混合后60%至95%(v/v)的乙醇,优选的是70%至95%(v/v)。
(b3)步骤中,从上述(b2)中提取的粗多糖中提取10kda以上分子量的多糖组分。
上述组分的提取方法可以采用根据分子量分离物质这一熟知的方法,例如透析、电泳及各种柱层析法等。去除时采用的上述色谱法可单独或交叉采用离子交换色谱法、凝胶渗透色谱法、hplc、逆相-hplc、亲和性柱层析法及超滤等技法。本发明中提取组分的优选方法是采用利用透析膜的透析方法,从粗多糖中去除目标分子量以下的物质。
上述提取的组分是拥有10kda分子量的组分,拥有10kda以上和500kda以下分子量的组分比较理想。最理想的可能是分子量为50kda以上和400kda以下的组分。
此外,与上述所有提取的组分相比,中性多糖(neutralsugar)占比70至80重量%,糖醛酸(uronicacid)占20至30重量%。上述糖醛酸可由半乳糖醛酸(galacturonicacid)及葡萄糖醛酸(glucuronicacid)组成,上述多糖组分的中性多糖可由鼠李糖、岩藻糖、阿拉伯糖、木糖、甘露糖、半乳糖及葡萄糖组成。
上述多糖组分中的中性多糖在上述人参源多糖组分中,鼠李糖占2至10mole%、阿拉伯糖占10至25mole%、半乳糖占15至45mole%、葡萄糖占40至70mole%,岩藻糖、木糖及甘露糖等残量的中性多糖仅含微量。
按照本发明的制备方法可以制得免疫机能增强效果优异的多糖组分。
因此,本发明的一个特征是,是按照所述本发明的方法制备的,可提供具有免疫机能增强活性的人参源多糖组分。
本发明的一个特征是,多糖组分根据本发明的方法而制造,其免疫机能增强效能比按照故有的单纯热水抽取方法或酵素单独处理方法制造的人参源多糖组分更加优秀。
所谓免疫机能是指在生物体内探知并杀死病原体和肿瘤细胞等,从而保护生命体远离疾病的机能。
免疫机能分天然免疫(innateimmune)机能和特异性免疫(adaptiveimmune)机能,天然免疫是指作为一项当微生物和毒素成功进入体内时立即启动的免疫机能,采用的方式可以是先由模式识别受体去识别微生物之间广泛保存的部分,探知外部微生物或是发出排放受损细胞等警示信号,然后同类受体进行识别,探知微生物的存在。
特异性免疫是指免疫记忆(immunologicalmemory)等,具有记住抗原标示的机能,是一种很强的免疫反应,其抗原比较特别,需要通过抗原提示(antigenpresentation)来识别非自身抗原。
本发明的多糖组分能促进巨噬细胞no、tnf-α及il-16、il-12的产生,能同时提高天然免疫(innateimmune)和特异性免疫(adaptiveimmune)。
另外,本发明的多糖组分不具细胞毒性,易用于食品或医药品。
同时,本发明的效果在本发明的实施例中得到了很好的体现。
本发明的一实施例中,热水抽取人参后,对未进行酵素处理的多糖组分和人参粉末分别用淀粉酶、纤维素酶、果胶酶及蛋白酶处理,然后测定所制造的多糖组分的免疫机能增强活性。通过其结果确认,对照组单纯的热水提取物与蛋白酶或制造多糖组分时普遍使用的果胶酶处理组进行比较时,经淀粉酶或纤维素酶处理的实验组的免疫机能增强活性更加优秀。
本发明的另一实施例中,同时处理淀粉酶和纤维素酶制造多糖组分,将经过淀粉酶或纤维素酶处理的多糖组分与淀粉酶和纤维素酶并行处理的多糖组分的免疫机能增强活性进行比较。通过其结果确认,与经过淀粉酶或纤维素酶处理的多糖组分相比,淀粉酶和纤维素酶并行处理的多糖组分的免疫机能增强活性特别优秀。
本发明的一实施例中,将本发明的多糖组分放在巨噬细胞中处理,用测定细胞存活率的方法测试,以判断是否具有细胞毒性。通过其结果确认,本发明的多糖组分不具有细胞毒性。
本发明的另一实施例中,将本发明的多糖组分放在巨噬细胞中处理,来测试其对氧化氮产生的影响。实验结果确认,本发明所述多糖组分处理的情况下,巨噬细胞的氧化氮的产生量增加。
本发明的另一实施例中,将本发明的多糖组分放在巨噬细胞中进行处理,来测试其对与免疫有关的细胞因子(cytokine)的释放所产生的影响。结果确认,本发明所述多糖组分处理的情况下,tnf-α、il-6及il-12的细胞因子的产生增加很多。
由此可以确定本发明的多糖组分的免疫机能增强活性十分突出。
因此,本发明提供含有本发明中多糖组分这一有效成分,用于免疫机能增强的食品组合物。
本发明的食品组合物包括功能性食品(functionalfood)、营养补充剂(nutritionalsupplement)、健康食品(healthfood)及食品添加剂(foodadditives)等所有形态。上述各类食品组合物可用业内均知晓的普遍的方法制造成各种形态。
以健康食品举例,本发明的人参源多糖组分自体可做成茶、果汁及饮料等饮用,或者制成果粒、胶囊及粉末等摄食。另外,本发明的人参源多糖组分也可以和已知的具有免疫机能增强效果的水质或活性成分混合在一起,做成组合物。
再以功能性食品举例,生产饮料(包括含酒精饮料)、果实及其加工食品(例如:罐装水果、瓶装水果、果子酱、果酱等)、鱼类、肉类及其加工食品(例如:火腿、腌咸牛肉等)、面包类及面类(例如:乌冬面、荞麦面、方便面、意大利面、通心粉等)、果汁、各种饮料、饼干、羊羹、乳制品(例如:黄油、奶酪等)、食用植物乳脂、人造黄油、植物性蛋白质、软罐头食品、冷冻食品、各种调料(例如:大酱、酱油、调料汁等)等时,可添加本发明的人参源多糖组分。
本发明不对食品组合物中上述本发明的人参源多糖组分的优选的含油量有所限制,但理想的是在最终生产的食品中所占的量为0.01-50%。
另外,为了将本发明的人参源多糖组分用作食品添加剂,可做成粉末或浓缩液在生产中加以使用。
本发明的组合物具有预防和改善因免疫机能低下而引起疾患的功效,因上述免疫机能低下引起的疾患并不限定于感冒等感染性疾病、炎症疾病、过敏性皮肤等过敏疾病、慢性疲劳及癌症等其中任何一个,而是包括业内从业者所知道的因免疫机能低下所引起的所有疾病。
本发明可用于上述人参源多糖组分的免疫机能增强用制剂的制造。
本发明提供一种免疫机能增强法,包括对需要上述人参源多糖组分的个体投入有效用量的步骤。
上述内容中提到的在个体中投入的‘有效用量’是能显现免疫机能增进功效以及癌或免疫力低下所引起的疾病的治疗和预防等效果的量,上述‘个体(subject)’指动物,优选的可以是哺乳动物,尤其是包括人类在内的动物,也可以是来自动物的细胞、组织、器官等。上述个体也可以是需要接受治疗的患者(patient)。
另外,本发明提供含有本发明的多糖组分这一有效成分的用于增强免疫机能的药学组合物。
本发明所说的药学组合物是含有本发明的多糖组分或仅含有从药学角度上可使用的一个或多个多糖组分,也可能含有从药学上可以使用的载体、成型添加剂或稀释剂。
药学上可用的载体举例来说可包括口服载体或非口服载体。口服的载体可以包括乳糖、淀粉、纤维素衍生物、硬脂酸镁、硬脂酸等。另外,非口服载体可以包括水、适当的油、生理盐水、水溶性葡萄糖及二羟基醇等。还可以包括的是稳定剂及保鲜剂。合适的稳定剂有亚硫酸氢钠、亚硫酸钠或抗坏血酸类抗酸化剂。合适的保鲜剂有苯扎氯铵、甲基或丙对苯及氯丁烷。此外,作为药学上可用的载体可参考如下文献的记载(remington’spharmaceuticalsciences,19thed.,mackpublishingcompany,easton,pa,1995)。
本发明中用于免疫机能增强的药学组合物可以任意的方式用于以人类为代表的哺乳动物。例如,通过口服或非口服的方式投药。非口服投药的方式不被限定,可投药到静脉、肌肉、动脉、骨髓、硬脑膜、肾脏、经皮、皮下、腹腔、肠管、身体局部、舌下或直肠内。优选的是本发明的药学组合物可通过经皮投药。上述内容中提到的通过经皮投药是指本发明的药学组合物通过细胞或皮肤投药,将本发明组合物中含有的活性成分输送到皮肤内。例如,将本发明的药学组合物做成注射剂,用注射器轻轻戳破皮肤注入30ga剂量的方式或是直接涂抹在皮肤上的方式投药。
本发明的药学组合物可以根据如上所述的投药途径制成口服型或非口服型的药剂。
如果是口服型药剂,本发明的组合物可用业内普遍所知的方法做成粉末、果粒、片剂、丸剂、糖衣片剂、胶囊、液体药剂、凝胶剂、糖浆、浆状药剂、悬浮液等药剂。例如,口服型制剂是将活性成分与固体赋形剂混合之后粉碎,添加合适的保鲜剂,加工成果粒混合物后可得到片剂或糖衣片剂。合适的赋形剂可以是包括乳糖、右旋糖、蔗糖、山梨糖醇、甘露醇、木糖醇、赤藓糖醇及麦芽糖醇的糖类,包括玉米淀粉、小麦淀粉、大米淀粉及土豆淀粉等的淀粉类,包括纤维素、甲基纤维素、羧甲基纤维素、及羟丙基甲基纤维素等纤维素类,还可以包括纤维素类、明胶、聚乙烯吡咯烷酮等填充剂。另外,不同情况下也可以添加架桥聚乙烯吡咯烷酮、石花胶、褐藻酸或褐藻酸盐等分解剂。并且,本发明的药学组合物还可能包括抗凝剂、润滑剂、湿润剂、香料、乳化剂及防腐剂等。
非口服型投药用制剂可用业内普遍使用的方法制成注射剂、霜剂、乳液制剂、外用软膏剂、油性剂、保湿剂、胶状剂、喷雾剂及鼻腔吸入剂等剂型。这些剂型记载于所有制药化学领域都知道的处方文献(remington’spharmaceuticalscience,15thedition,1975.mackpublishingcompany,easton,pennsylvania18042,chapter87:blaug,seymour)。
本发明的多糖组分的总有效剂量可以是根据每天给患者服用的方式决定投药量(singledose),也可以是根据成倍的剂量(multipledose)给患者长期分批服用进行治疗的方式(fractionatedtreatmentprotocol)决定。根据疾病的轻重,本发明的药学组合物有效成分的含有量也可能不同。优选的是本发明的糖蛋白组分的优选总量为每日患者体重每1kg药量约0.01ug-1,000mg,最优选的剂量是0.1ug-100mg。但是,上述本发明的多糖组分的用量不仅根据药学组合物的投药途径及治疗次数决定,同时还要考虑患者的年龄、体重、健康状态、性别、疾病的轻重、饮食及排泄率等各种原因决定能对患者起效的药量。在考虑这些要素时,具备业内一般知识的人可以按照上述本发明的多糖组分作为免疫机能增强剂的特定用途来决定适当的有效的用药剂量。本发明并不特别限定药学组合物能发挥本发明功效的剂型投药途径及投药方法。
本发明的组合物具有预防和改善因免疫机能低下而引起疾患的功效,因上述免疫机能低下引起的疾患并不限定于感冒等感染性疾病、炎症疾病、过敏性皮肤等过敏疾病、慢性疲劳及癌症等其中任何一个,而是包括业内从业者所知道的因免疫机能低下引起的所有疾病。
与现有技术相比,本发明具有如下有益效果:
本发明提供制备具有免疫机能增强活性的人参源多糖组分的方法及按照上述制备方法制造的多糖组分,包括在人参中加入包含淀粉酶和纤维素酶等2种以上酵素进行酵素处理的步骤和从经过上述酵素处理的人参水解产物中获取10kda以上分子量的多糖组分的步骤。本发明的制备方法是通过包括淀粉酶和纤维素酶的复合酵素处理工序,可经济实惠地制成免疫活性增强效果优异的多糖组分,本发明的多糖组分与故有的人参源多糖相比,免疫增强效果更加显著,在免疫增强食品生产上十分有用。
附图说明
图1是用人参热水浸提法制造粗多糖的工序图;
图2是本发明用酵素并行处理法制造人参源多糖组分的工序图;
图3是根据酵素单独处理的人参源多糖样品测定小鼠腹腔巨噬细胞(mouseperitonealmacrophage)繁殖率变化的细胞毒性实验结果的图表(con:不处理组;lps:内毒素脂多糖处理组;fgwo:酵素不处理多糖提取物处理组;fgez1:果胶酶处理多糖组分处理组;fgez2:纤维素酶处理多糖组分处理组;fgez3:淀粉酶处理多糖组分处理组;fgez4:内切蛋白酶(endoprotease)处理多糖组分处理组;
图4是根据酵素单独处理人参源多糖样品测定小鼠腹腔巨噬细胞il-6的细胞因子白细胞介素的产生能力变化结果的图表(con:不处理组;lps:内毒素脂多糖处理组;fgwo:酵素不处理多糖提取物处理组;fgez1:果胶酶处理多糖组分处理组;fgez2:纤维素酶处理多糖组分处理组;fgez3:淀粉酶处理多糖组分处理组;fgez4:内切蛋白酶处理多糖组分处理组;a,b,c,d,ab,bc:显示出重要的文字在结果中没有相同的文字,在统计学上具有重要性);
图5是根据酵素单独处理人参源多糖样品测定小鼠腹腔巨噬细胞il-12的细胞因子白细胞介素的产生能力变化结果的图表(con:不处理组;lps:内毒素脂多糖处理组;ogwo:酵素不处理多糖提取物处理组;fgez1:果胶酶处理多糖组分处理组;fgez2:纤维素酶处理多糖组分处理组;fgez3:淀粉酶处理多糖组分处理组;fgez4:内切蛋白酶处理多糖组分处理组;a,b,c,ab:显示出重要性的文字在结果中没有相同的文字,在统计学上具有重要性);
图6是根据酵素单独处理人参源多糖样品测定raw264.7细胞的细胞因子il-6白细胞介素的产生能力变化结果的图表(con:不处理组;lps:内毒素脂多糖处理组;fgwo:酵素不处理多糖提取物处理组;fgez1:果胶酶处理多糖组分处理组;fgez2:纤维素酶处理多糖组分处理组;fgez3:淀粉酶处理多糖组分处理组;fgez4:内切蛋白酶处理多糖组分处理组;a,b,c,ab:显示出重要性的文字在结果中没有相同的文字,在统计学上具有重要性);
图7是根据酵素单独处理人参源多糖样品测定raw264.7细胞的细胞因子il-12白细胞介素的产生能力变化结果的图表(con:不处理组;lps:内毒素脂多糖处理组;fgwo:酵素不处理多糖提取物处理组;fgez1:果胶酶处理多糖组分处理组;fgez2:纤维素酶处理多糖组分处理组;fgez3:淀粉酶处理多糖组分处理组;fgez4:内切蛋白酶处理多糖组分处理组;a,b,c,d,ab:显示出重要性的文字在结果中没有相同的文字,在统计学上具有重要性);
图8是根据hplc实验测定酵素单独处理人参多糖样品的分子量分布的结果(std:实验中使用的标准物质的测定结果;a:fgwo(酵素不处理多糖提取物处理组)的测定结果;b:fgez2(纤维素酶处理多糖组分处理组)的测定结果;c:fgez3(淀粉酶处理多糖组分处理组)的测定结果);
图9是根据酵素单独处理及并行处理人参源多糖样品测定小鼠腹腔巨噬细胞的细胞因子白细胞介素il-6的产生能力变化结果的图表(con:不处理组;lps:内毒素脂多糖处理组;fgez2:纤维素酶处理多糖组分处理组;fgez3:淀粉酶处理多糖组分处理组;fgez2+3:同时处理纤维素酶和淀粉酶的多糖组分处理组;a,b,c,d:显示出重要性的文字在结果中没有相同的文字,在统计学上具有重要性);
图10是根据酵素单独处理及并行处理人参源多糖样品测定小鼠腹腔巨噬细胞的细胞因子白细胞介素il-12的产生能力变化结果的图表(con:不处理组;lps:内毒素脂多糖处理组;fgez2:纤维素酶处理多糖组分处理组;fgez3:淀粉酶处理多糖组分处理组;fgez2+3:同时处理纤维素酶和淀粉酶的多糖组分处理组;a,b,c:显示出重要性的文字在结果中没有相同的文字,在统计学上具有重要性);
图11是根据酵素单独处理及并行处理人参源多糖样品测定raw264.7细胞的细胞因子il-6的产生能力变化结果的图表(con:不处理组;lps:内毒素脂多糖处理组;fgez2:纤维素酶处理多糖组分处理组;fgez3:淀粉酶处理多糖组分处理组;fgez2+3:同时处理纤维素酶和淀粉酶的多糖组分处理组;a,b,c,ab:显示出重要性的文字在结果中没有相同的文字,在统计学上具有重要性);
图12是根据酵素单独处理及并行处理人参源多糖样品测定raw264.7细胞的细胞因子il-12的产生能力变化结果的图表(con:不处理组;lps:内毒素脂多糖处理组;fgez2:纤维素酶处理多糖组分处理组;fgez3:淀粉酶处理多糖组分处理组;fgez2+3:同时处理纤维素酶和淀粉酶的多糖组分处理组;a,b,c,ab:显示出重要性的文字在结果中没有相同的文字,在统计学上具有重要性);
图13是根据酵素单独处理及并行处理人参源多糖样品测定raw264.7细胞的细胞因子il-10的产生能力变化结果的图表(con:不处理组;lps:内毒素脂多糖处理组;fgez2:纤维素酶处理多糖组分处理组;fgez3:淀粉酶处理多糖组分处理组;fgez2+3:同时处理纤维素酶和淀粉酶的多糖组分处理组;a,b,c,ab:显示出重要性的文字在结果中没有相同的文字,在统计学上具有重要性);
图14是根据酵素单独处理及并行处理人参源多糖样品测定raw264.7细胞的细胞因子tnf-α的产生能力变化结果的图表(con:不处理组;lps:内毒素脂多糖处理组;fgez2:纤维素酶处理多糖组分处理组;fgez3:淀粉酶处理多糖组分处理组;fgez2+3:同时处理纤维素酶和淀粉酶的多糖组分处理组;a,b,c,ab,bc:显示出重要性的文字在结果中没有相同的文字,在统计学上具有重要性);
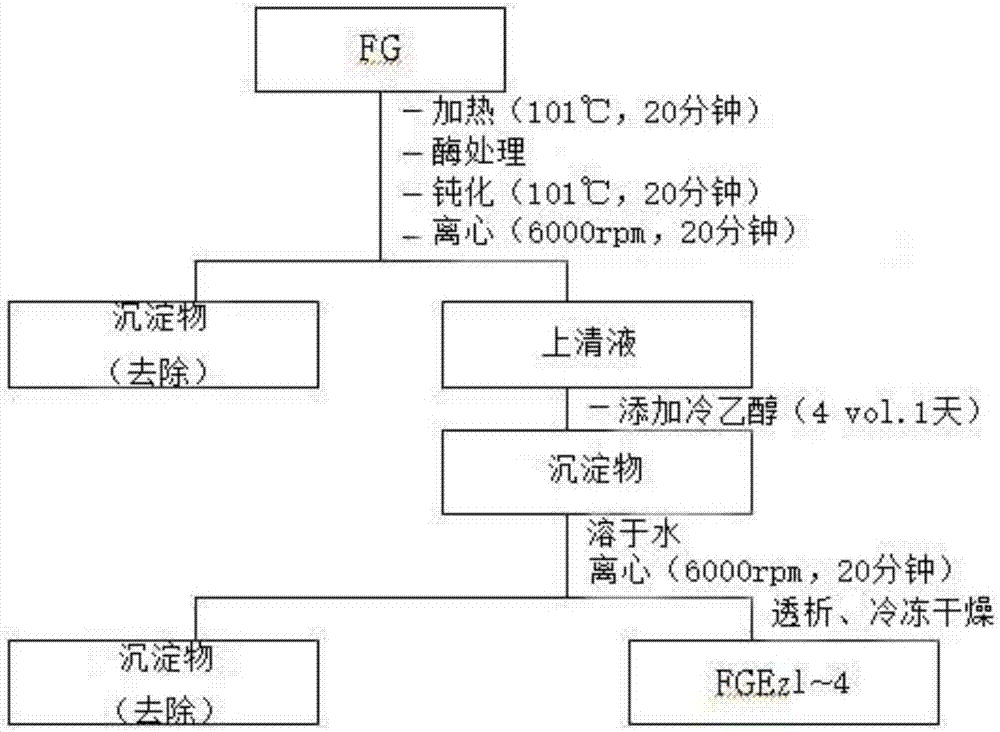
图15是按照本发明酵素并行处理法制备人参源多糖组分的工序图;
图16是根据hplc实验测定酵素并行处理法人参源多糖样品的分子量分布比较的结果(std:测定实验中使用的标准物质的结果;a:fgwo(酵素不处理多糖提取物处理组)的测定结果;b:fgez0(纤维素酶和淀粉酶并行处理的多糖组分处理组)的测定结果);
图17是根据酵素并行处理法人参源多糖样品测定raw264.7细胞的繁殖率变化的细胞毒性实验结果的图表(con:不处理组;lps:内毒素脂多糖处理组;fgwo:酵素不处理多糖提取物处理组;fgez0:纤维素酶和淀粉酶并行处理的多糖组分处理组);
图18是根据酵素并行处理法人参源多糖样品测定raw264.7细胞的细胞因子il-6的产生能力变化结果的图表(con:不处理组;lps:内毒素脂多糖处理组;fgwo:酵素不处理多糖提取物处理组;fgez0:纤维素酶和淀粉酶并行处理的多糖组分处理组);
图19是根据酵素并行处理法人参源多糖样品测定raw264.7细胞的细胞因子tnf-α的产生能力变化结果的图表(con:不处理组;lps:内毒素脂多糖处理组;fgwo:酵素不处理多糖提取物处理组;fgez0:纤维素酶和淀粉酶并行处理的多糖组分处理组)。
具体实施方式
以下是对本发明的详细说明。
但,以下实施例只是对本发明的列举,本发明的内容并不止限于以下实施例。
实施例1、粗多糖提取物的制造
1-1用热水浸提法制造粗多糖提取物
本实验中使用的人参购买的2013年产的4年根水参。
为分离多糖而采用的单纯热水浸提法如下:在100g水参中加入3倍的蒸馏水(w/v)并粉碎,在100℃的温度下提取后,用调节为4℃的离心分离机(mega17r,hanilscienceindustrialco.ltd.,inchun,korea)在6,500×g进行20分钟的离心分离。为了使分离出的精华液的最终浓度达到80%,添加冷乙醇后放置一晚,回收生成的沉淀物,将其放在少量的蒸馏水中溶解,然后用透析膜(membranefilterationproducts,inc.,seguintexas,usa;mwco6,000~8,000)进行透析,时间大约为2~3天,冻结干燥(tokoyorikakikaico.ltd.,fd-1000,tokyo,japan)后即制成热水提取粗多糖提取物(fgwo,产出率3.2%)(图1)。
1-2用酵素处理法制造多糖组分
用于酵素处理的加水分解酵素共有4种:rapidasec80max(果胶酶,源自黑曲霉,ez1);rohamentcl(纤维素,源自里氏木霉,ez2);spezymextra(α-淀粉酶,源自地衣形芽孢杆菌,ez3);protex6l(蛋白酶,源自地衣形芽孢杆菌;ez4),购自bisionbiochem(bisioncorporation,京畿道)并投入使用。
用酵素处理的多糖组分的制造过程如下:将100g水参加入3倍(w/v)的蒸馏水后粉碎,在101℃的温度下加热20分钟,之后将4种(ez1,ez2,ez3,ez4)加水分解酵素[表1]按照条件逐一进行处理或同时用2种以上进行处理。之后在90~100℃的温度下再进行20分钟的加热处理,使残存的加水分解酵素钝化后,在6,500×g进行20分钟的离心分离去除残渣,为了使分离所得的精华液的最终浓度达到80%,添加冷乙醇放置一晚,使多糖沉淀。产生的沉淀物放入少量的蒸馏水进行溶解,用透析膜(membranefilterationproducts,inc.,seguintexas,usa;mwco6,000~8,000)去除低分子物质,冻结干燥后即得到酵素处理多糖组分(图2)。此时,各加水分解酵素(4种;ez1~4)各自处理并制成的酵素处理多糖组分fgez1,fgez2,fgez3,fgez4的产出率依次是1.5,2.7,1.5,3.8%。
表1、酵素处理条件
实施例2、免疫活性的评价
用于本研究实验的动物是出生5~6周的雄性动物,小白鼠在经过了3天的适应期后进行实验。每一组饲养组有2只小白鼠,在保持一定温度和湿度的饲养场内饲养,水和饲料自由供给。
用于本实验的小鼠腹腔巨噬细胞是在小白鼠的腹腔内注入1ml的5%巯基乙酸培养基,72~96小时内诱导的巨噬细胞用pbs缓冲回收。之后,用rpmi1640medium清洗2~3次,将细胞数调整至2.5×106cells/ml,在96孔板(nuncco.,roskilde,denmark)上培养。培养基是将rpmi1640与10%(v/v)fbs和1%(v/v)penicillin-streptomycin混合后使用。之后,加入稀释成各种浓度的样品,在37℃,5%co2恒温箱这一特定条件下进行培养。
2-1小鼠腹腔巨噬细胞的毒性检测
对各细胞样品是否存在毒性的检测用了mttassay(hansenmb,nielsense,bergk.re-examinationandfurtherdevelopmentofapreciseandrapiddyemethodformeasuringcellgrowthcellkill.journalofimmunologicalmethods,1989,119:203-210.)方法。去除96孔板上的液体后,添加0.5mg/mlmtt溶液进行4小时的培养,形成甲臜。然后,去除板面液体后在各孔中添加dmso,等甲臜融化后用elisa试剂盒在540nm中测定吸光度。
将细胞数调整到一定个数后,在培养细胞中将多糖提取物样品fgwo和fgez1~4各自处理至1、10、100ug/ml的浓度进行培养,确认细胞生存与否的结果如图3所示。小鼠腹腔巨噬细胞的情况下,除了处理了fgez4100ug/ml的实验组以外,其他的存活率都在80%以上,在1~100ug/ml的浓度范围内,可知其对细胞毒性不产生大的影响。在fgez4100ug/ml中的存活率为78%,在误差范围之内,所以被认为对细胞的生存不产生大的影响。
2-2小鼠腹腔巨噬细胞细胞因子产生能力的测定
培养基被稀释后,将样品按各种浓度在细胞中处理,在37℃、5%co2的恒温箱中培养24小时后,从巨噬细胞诱导分泌出的液体中细胞因子的量用elisa试剂盒并按照制造公司的要求测定。即,将逆细胞因子捕捉抗体在包被液(0.2msodiumphosphate,ph6.5)中稀释后放入96孔盘,在4℃温度下放置一晚。为了使tween20在pbs达到0.05%(v/v),用pbs/tween溶液洗涤孔盘3遍。将检测稀释液((pbswith10%fbs)放入盘内,在常温下放置1小时。用pbs/tween洗涤3次后,将培养液放入各孔,2小时之后放置于常温下。用pbs/tween洗涤5次后,将检测抗体生物素基化抗体和酶制剂stretavidin-horseradishperoxidaseconjugate放入检测稀释液进行稀释,放入孔盘后在常温下放置1小时。用pbs/tween洗涤7次后,加入基质溶液,在阴暗处放置30分钟。加入终止液2n硫酸溶液终止反应,用elasa试剂盒测试450nm的吸光度。
巨噬细胞分布于体内几乎所有组织,负责识别和去除体内异物和废物。大家知道,在此过程中分泌出各种细胞因子,调节免疫反应。细胞因子作为在免疫细胞中生成的蛋白质中介物,使免疫细胞间对外部抗原起到共同作用,其生成和分泌对免疫反应调节来说十分重要。巨噬细胞所分泌的最典型的免疫反应诱导细胞因子已知的有studyusiil-1,il-6,il-10,il-12,tnf-α等(wangh,actorjk,indrigoj,olsenm,dasguptaa.2003.asianandsiberianginsengasapotentialmodulatorofimmunefunction:aninvitro细胞因子ngmousemacrophage.clinchimacta327:123-128)。在水参源多糖的刺激下,用elisa法测定小鼠腹腔巨噬细胞的细胞因子的产生,结果显示能促进il-6、il-12的产生,显示依赖所有浓度的活性都有所增加。il-6的所有样品与对照组比较都提高了,酵素处理样品组((fgez1~4))与fgwo相比显示出更高的活性(图4)。其中,在100ug/ml的浓度下,可以确认fgez2和fgez3所显示的活性比fgwo高了2.2倍。尤其是fgez2的情况,确认了在10ug/ml的浓度下显示出很大的差异,具有有意义的价值,从较低的浓度中大大地体现了il-6的活性。
il-12的情况下,可以确认的是和对照组(con)和fgwo相比,酵素处理样品组(fgez1~4)的活性相对更高(图5)。酵素之间并未显示重大的差异,浓度相对较低的10ug/ml中,fgwo的数值是87pg/ml,与其相比,fgez2的数值是434pg/ml,fgez3是180pg/ml,fgez4是177pg/ml,显示出较高的数值。尤其是我们可以推测fgez2从低浓度开始显示出很大的活性,即使是很少的量也能体现出较高的免疫机能。
2-3raw264.7在细胞刺激下测定细胞因子产生量
raw264.7细胞株(ktccno.40071)是从韩国细胞株银行(ktcc,seoul)购买并使用的。将细胞数调整至2.0×105cells/ml并加以培养,培养基是在dmem培基中加入10%(v/v)fbs和1%(v/v)双抗混合使用。然后,加入被稀释成各种浓度的样品在37℃,5%co2恒温箱中培养。
raw264.7细胞中也用同样的样品,在10~150ug/ml的浓度范围内,可以确定测定细胞因子的结果是,如图6所示,il-6中可以确认,与fgwo相比,酵素处理样品组(fgez1~4)显示出更高的活性。其中,与fgwo相比时,fgez2和fgez3在il-6中显出重大差异。fgez2的情况下,100、150ug/ml浓度中,il-6增加约达5~10倍以上;fgez3的情况下,100、150ug/ml浓度中增加约9~11倍以上。
il-12则显示出与il-6同状态,fgez4在150ug/ml中多多少少显示出高活性,此外fgez2和fgez3在所有浓度中都显示出比fgwo重要的活性差异(图7).
通过以上测定细胞因子产生能力的结果,可以确定与fgwo相比,酵素处理样品组(fgez1~4)的活性变高,尤其是可以确定fgez2和fgez3的活性大体较高。因此,我们认为需要确认由两个酵素并行处理法获取的样品与单一酵素处理获取的样品的活性差异是否显现。
实施例3、分子量分布的测定
根据用经过酵素处理的4种多糖组分样品(fgez1~4)所做的免疫实验的结果,可以判定与热水提取物(fgwo)相比,用纤维素(ez2)和α-amylase(ez3处理时的水参的免疫活性提升最有效果。因此,用hplc对热水提取多糖提取物(fgwo)和酵素处理多糖组分(fgez2,fgez3)等的分子量分布进行比较并分析。
为了测定分子量,取标准物质和热水及用加水分解酵素处理的多糖的样品各20mg放在0.2mnacl1ml中溶解,然后用膜过滤纸过滤,用于hplc(jascoco.,japan)分析。使用的column用了gs520(7.5mm×300mml,showadenkoco.,toyko,japan)+gs320(8.0mm×300mml,showadenkoco.,toyko,japan),过渡阶段则使用0.2mnacl作为溶剂,样品注入量为20ul,流速为0.4ml/min,用折光率检测器(jascoco.,toyko,japan)检出。片剂多糖的分子量是将普鲁兰多糖标准将fluka产品(molecularsize;10k,48.8k,366k)作为标准物质,获取标准曲线后进行比较。
其结果如图8所示,热水提取多糖提取物(fgwo)时,分子量是10k以上的3个高分子组分;纤维素(ez2)进行酵素处理时,分子量是10k以上的2个高分子组分和1个以上的低分子组分,其分布与fgwo相似。反之,用α-amylase(ez3)进行酵素处理时,分为10k以上的2个高分子组分和10k以下的3~4个以上的低分子组分。
实施例4、根据酵素并行处理法,水参源新型免疫增强多糖组分制剂
在100g水参粉末中加入5~20倍(w/v)的蒸馏水使其悬浮后,先后进行2种(ez2,ez3)加水分解酵素处理。即,初期的悬浮液的温度和ph值调整为50~60℃,4.5~6.0,然后添加ez2的酵素,产生了一天的反应后,反应物的温度调整至85~90℃,调整之后添加ez3的酵素,发生了9~12小时的反应之后,将最终反应物在101℃的温度下处理20分钟,诱导酵素钝性化之后,在6,500×g进行20分钟的离心分离后去除残渣,分离后的精华液的最终浓度达到80%,然后再添加冷乙醇,放置一晚,使多糖沉淀。由此生成的沉淀物放入少量的蒸馏水中溶解,用透析膜(membranefilterationproducts,inc.,seguintexas,usa;mwc06,000~8,000)去除低分子物质,冻结干燥后获取酵素处理多糖组分。
实施例5、酵素并行处理法样品在巨噬细胞刺激下的细胞因子的产生活性
用实施例2中,2-2和2-3中相同的方法测定酵素处理样品的细胞因子的生成活性。
5-1在小鼠腹腔巨噬细胞刺激下的细胞因子的产生能力
在经酵素并行处理法的水参源多糖的刺激下,小鼠腹腔巨噬细胞的细胞因子的生成用elisa方法测定的结果,确认了il-6、il-12的分泌是依赖于浓度而增加的。图9中,所有样品的il-6的量都比对照组更高,与fgwo相比较,酵素处理样品组fgez2、fgez3、fgez2+3显示出更好地活性。尤其是,酵素并行处理法样品fgez2+3在100ug/ml的浓度下的数值是2033pg/ml,该数值是fgez2的1.8倍,fgez3的1.1倍,显示出十分重要的活性,可以确认酵素并行处理法(fgez2+3)比单一酵素处理(fgez2,fgez3)的活性更高。il-12的情况如图10所示,与fgwo相比,酵素处理样品组fgez2、fgez3、fgez2+3显示出更高的活性。尤其是酵素并行处理法样品fgez2+3在100ug/ml的浓度下的数值是683pg/ml,该数值是fgez2的1.5倍、fgez3的1.2倍,显示出十分重要的活性,从而确认了酵素并行处理法样品il-12比单一酵素处理样品更能提高活性。
5-2raw264.7细胞刺激下的细胞因子产生能力
在经并行酵素处理的水参源多糖的刺激下,用elisa法测定raw264.7细胞的细胞因子生成的结果确认了il-6,il-12的分泌是依赖于浓度而增加的。
il-6的情况如图11所示,所有样品都比对照组高,与fgwo相比,酵素处理样品组fgez2、fgez3、fgez2+3显示出更高的活性。尤其是并行酵素处理样品fgez2+3在150ug/ml的浓度下的数值是646pg/ml,该数值是fgez2的1.3倍和fgez3的1.2倍,显示出十分重要的活性,从而确认了酵素并行处理法样品的il-12活性比单一酵素处理样品更高。
il-12的情况如图12所示,与fgwo相比,酵素处理样品组fgez2、fgez3、fgez2+3显示出更高的活性。尤其是并行酵素处理的样品fgez2+3在浓度100ug/ml下的数值是563pg/ml,该高数值分别是fgez2(389pg/ml)和fgez3(483pg/ml)的1.45倍(45%)和1.16(16%)倍左右,在150ug/ml的浓度下,fgez2+3显示出的数值是659pg/ml,该数值是fgez2(412pg/ml)的1.6倍,同时也比fgez3(644pg/ml)要高一些。从以上结果可以看出,fgez2+3显示出了最重要最大的活性,并行酵素处理比单一酵素处理更能提高活性。
il-10的情况如图13所示,除了fgwo以外,均出现了浓度依赖性增加的现象,在100ug/ml以上的浓度下,与fgwo相比,fgez2、fgez3、fgez2+3显现了高活性。尤其是,虽然fgez2和fgez2+3显现了有意义的数值变化,但fgez2+3的数值则高了些许,所以可以确认在并行酵素处理时,细胞因子的活性可以有一定水平的提升。
tnf-α的情况如图14所示,fgwo和fgez2、fgez3各自进行酵素处理的结果之间虽然没有差异,但可以确认用fgez2+3并行酵素处理时,活性增加。这一结果反映了通过单一的酵素处理不能达到的免疫活性增加却可以通过并行酵素处理达到这一事实。
因此,通过并行酵素处理获取的样品fgez2+3的活性的变化体现在大部分的细胞因子中,远远高于单纯的热水提取物fgwo以及通过单一酵素处理获取的fgez2、fgez3的活性,其对消灭细胞不产生影响,可考虑作为有效的免疫活性材料加以开发。
实施例6、进行酵素并行处理法的水参源免疫增强多糖材料的制造和分析
6-1进行酵素并行处理法的水参源免疫增强多糖材料的制造
综合以上所有的研究结果,免疫活性较高的酵素并行处理法水参源免疫增强多糖材料(fgez0)的制造工序如图15所示,据此,用酵素并行处理法制造了水参源免疫增强多糖材料(fgez0)。
在100g水参粉末中加入5~20倍(w/v)的蒸馏水使其悬浮后,先后进行2种(ez2,ez3)加水分解酵素处理。即,初期的悬浮液的温度和ph值调整为50~60℃,4.5~6.0,然后添加ez2的酵素,产生一天反应后,反应物的温度调整至85~90℃,之后再添加ez3的酵素,发生了9~12小时的反应之后,将最终反应物在101℃的温度下处理20分钟,诱导酵素钝性化之后,在6,500×g进行20分钟的离心分离后去除残渣,分离后的液体进行uf处理,获取分子量10k以上的多糖组分,将其用冻结干燥或喷雾干燥等方法进行干燥,获取免疫力增强活性加强的水参多糖组分(fgez0)。
6-2从理化上进行分析
根据前面提出的工序,通过所制造的酵素并行处理法多糖组分(fgez0)的理化成分特性和hplc比较分子量分布等和热水浸取物(fgwo)。
分析上述理化成分特性所得出的结果如表2所示。fgwo的结构中含中性糖67.7%、糖醛酸30.4%、蛋白质1.4%以及kdo0.5%,酵素并行处理法组分(fgez0)中的中性糖是73.8%,比fgwo的含量高,而24.9%的糖醛酸和0.8%的蛋白质含量相对较低,而高碳糖含量仍然是0.5%,没有变化。
表2、用酵素并行处理法生产的样品成分的分析结果
6-3分子量分析
根据最恰当的工序,对所制造的酵素并行处理法多糖组分的分子量分布的分析采用了与实施例3相同的方法。
结果如图16所示,在热水浸取物多糖提取物(fgwo)的情况下,分子量10kda以上的是高分子组分有3个,400kda以上的多糖体具有较广范围的分子量,而酵素并行处理法后利用mwco50kcassette进行uf处理的情况下(b),10kda以上高分子组分有2个,10kda以下的低分子组分稍微被去除了一点。
6-4raw264.7细胞的细胞毒性及nitricoxide(一氧化氮)的产生能力
为了确认用酵素并行处理法制造的新型多糖材料raw264.7细胞是否存在毒性,实施mttassay时采用了与实施例2中2-1相同的办法。
结果如图17所示,水参多糖样品fgwo和fgez0在50、100、150ug/ml的浓度下进行细胞处理时,不同的浓度中都出现了80%以上的存活率,说明在50~150ug/ml的浓度范围内,对细胞毒性未产生大的影响。反而,从所有浓度中显示出100%以上的存活率可以推测,可能存在有助于细胞发育的因子。
6-5raw264.7细胞刺激下细胞因子的产生能力
对用酵素并行处理法制造的新型多糖材料的raw264.7细胞的细胞因子的产生能力的测定采用了与实施例2~3相同的elisa法。
从这一结果可以确认il-6、tnf-α的分泌依赖于浓度而增加。如图18所示,il-6的情况下,所有样品的都比对照组更高,与fgwo相比,新型多糖材料fgez0在所有浓度下都显示出了很高的活性。尤其是,新型多糖材料fgez0在50、100、150ug/ml的浓度下的数值分别是169、363、1051pg/ml,与fgwo相比,在所有浓度范围内的活性增加都是2倍以上。另外,统计处理结果表明,存在着有意义的差异,可以确认通过酵素并行处理获取的新型多糖材料的免疫活性比单纯的热水浸取法更具效果。
如图19所示,tnf-α的情况也是如此,与fgwo相比,新型多糖材料fgez0在所有浓度下都显示出了很高的活性。尤其是,新型多糖材料fgez0在50、100、150ug/ml的浓度下的数值分别是3340、3674、4332pg/ml,与fgwo相比,在所有浓度范围内的活性增加都是2倍以上。尤其是在低浓度下的活性增加达到了4倍以上,而高浓度150ug/ml下数值的增加之所以稍显微弱,是因为样品的活性的检测是以阳性对照组lps所定的为标准,是最大限度的标准,同时认为在低浓度下活性增加反而更多则是因为用了少量的样品才取得了更大的效果。我们十分期待在产业化之后,能很好地利用这一材料,即使投入得经济实惠也能得到肯定的评价。
得出的结论是,水参源多糖被认为是对人体有益的,具有激发免疫机能的效果。与单纯的热水浸取法相比,对水参采用酵素并行处理法分离多糖,能获取更为优质的免疫活性多糖。
综上所述,本发明提供一种制造具有免疫机能增强活性的经酵素处理的人参源多糖组分的方法及根据上述制造方法制造的多糖组分,包括在人参中先后加入淀粉酶和纤维素酶等2种以上酵素进行酵素处理的步骤和从经过上述酵素处理的人参水解产物中获取10kda以上分子量的多糖组分的步骤。本发明的制造方法是通过包括淀粉酶和纤维素酶的复合酵素处理工序,可经济实惠地制造免疫活性增强效果优异的多糖组分,本发明的多糖组分与故有的人参源多糖相比,免疫增强效果更加显著,在免疫增强食品生产上十分有用。
- 还没有人留言评论。精彩留言会获得点赞!