一种发酵大豆饼粕制备猪饲料的方法与流程
本发明涉及饲料的制备领域,特别是涉及一种以豆粕为原料,通过复合菌株固态发酵制备营养型猪饲料的方法。
背景技术:
我国是世界上最大的畜禽养殖生产国之一,同时也是世界上饲料原料特别是蛋白质原料的需求大国。我国饲料工业生产中蛋白质饲料资源严重不足,鱼粉等高品质动物蛋白原料主要依赖国际进口,而目前全球性鱼类资源的日趋减少直接导致鱼粉价格直接上涨。尽管鱼粉被行业内人士认为是最优质的蛋白原料,但受其价格影响,鱼粉在饲料中的使用比例还是趋于下降,动物蛋白价格高涨使得人们将视线逐渐转向了植物蛋白。
大豆饼粕作为一种来源丰富、质量定的植物蛋白原料,一直是构成动物性饲料蛋白来源的主体,加之鱼粉等动物性蛋白资源日益短缺且价格居高不下,使其使用量受限,促使了大豆饼粕的市场需求不断扩大。但由于大豆饼粕中含有多种天然抗营养因子,主要包括:脲酶、胰蛋白酶抑制因子、大豆抗原、红细胞凝集素、胀气因子等,有些抗营养因子对热不稳定,对大豆饼粕进行充分加热后可以使大部分抗营养因子失活。当前,大豆饼粕的热处理温度一般较低(60~80℃),并不能够有效钝化或者清除大豆饼粕中的抗营养因子,从而限制了大豆饼粕在动物饲料中的直接应用。
技术实现要素:
(一)要解决的技术问题
为了解决现有技术的上述问题,本发明提供一种以大豆饼粕为底物,复合菌株发酵制备营养素含量高的猪饲料的方法。
(二)技术方案
为了达到上述目的,本发明采用的主要技术方案包括:
一种发酵大豆饼粕制备猪饲料的方法,其包括以下步骤:将大豆饼粕中加入复合菌发酵后得到猪饲料,所述复合菌包括原核微生物和真核微生物。
本方案大豆饼粕中含有43.5%~47%粗蛋白质和5%~7%粗纤维。经微生物发酵,蛋白质在菌体胞外蛋白酶的水解作用下,分解为小分子多肽、寡肽以及氨基酸,更利于吸收与利用,并且,大量的菌体蛋白能够提高大豆饼粕中的蛋白含量。部分纤维素可以被纤维素酶水解成单糖,从而提高大豆饼粕的利用价值。大豆饼粕在发酵过程中,还能够产生乳酸、丁酸、乙酸、琥珀酸等有机酸,具有增强饲养动物食欲,抑制有害菌在胃肠道中增殖等生理功能。并且,由于部分碳水化合物被降解,大豆饼粕致密结构变得疏松,适口性显著提高。本方案利用原核微生物和真核微生物发酵速度的不同,其中,原核微生物的发酵速度比真核微生物快。在原核微生物发酵开始生成有害物之前停止发酵,此时,真核微生物的发酵不完全,使大豆饼粕中的抗营养因子被降解到较低的含量,生成高利用率的蛋白质等营养素,且大豆饼粕致密结构变得疏松而无过度发酵,其适口性显著提高。
本发明制备猪饲料的方法优选的技术方案中,所述原核微生物包括纳豆芽孢杆菌和乳酸杆菌;且所述真核微生物包括酿酒酵母菌和黑曲霉。
上述纳豆芽孢杆菌(bacillusnatto)简称纳豆菌,属细菌科、芽孢杆菌属,是枯草芽孢杆菌的一个亚种。生长繁殖的过程中可产生多种优质活性抗菌物质,如聚谷氨酸(γ-pga)β-糖苷酶、杆菌肽、细菌素、干扰素以及微生物等。聚谷氨酸(γ-pga),又称纳豆菌胶、多聚谷氨酸,它是一种水溶性,生物降解,不含毒性,使用微生物发酵法制得的生物高分子。
黑曲霉:半知菌亚门,丝孢纲,丝孢目,丛梗孢科,曲霉属真菌中的一个常见种。广泛分布于世界各地的粮食、植物性产品和土壤中。
上述复合菌中:纳豆芽孢杆菌(bacillusnatto),中国工业微生物菌种保藏管理中心(cicc),菌种编号cicc23413;乳酸杆菌(lactobacillussp.),中国工业微生物菌种保藏管理中心(cicc),菌种编号cicc21007;酿酒酵母(saccharomycescerevisiae),中国工业微生物菌种保藏管理中心(cicc),菌种编号cicc1882;黑曲霉(aspergillus)中国普通微生物菌种保藏管理中心(cgmcc),菌种编号为cgmcc3.3928。
本方案通过纳豆芽孢杆菌、乳酸杆菌、酿酒酵母菌和黑曲霉组成的复合菌来发酵低价值的大豆饼粕,利用这四种微生物在生长过程的自身代谢过程,以及分泌的胞外蛋白酶、淀粉酶、纤维素酶等,生成纳豆富含氨基酸、有机酸、寡聚糖等多种易被机体吸收的营养成分。同时还含有多种生理活性物质,如纳豆激酶、超氧化物歧化酶、异黄酮、皂苷素、γ-多聚谷氨酸、生育酚、维生素等。芽孢杆菌与乳酸菌等益生菌可随饲料采食进入动物胃肠道,能够有效调节胃肠道内菌落的微生态平衡,抑制有害菌增殖,改善胃肠道功能,提高机体免疫能力与抗病能力。另外能有效以去除抗营养因子,提高大豆饼粕的生物利用率,可直接应用于猪饲料中,且发酵后产生的蛋白质和氨基酸、维生素及其他物质,丰富了大豆饼粕中的营养成分,最终改善大豆饼粕的营养品质,提高大豆饼粕应用于猪饲料在猪体内的生物利用率。因此,采用原核细菌与真核真菌进行复合菌株生产猪饲料可为改善豆粕品质、降低抗营养因子含量提供有效可行的途径。
本发明制备猪饲料的方法优选的技术方案中,所述复合菌中纳豆芽孢杆菌、乳酸杆菌、酿酒酵母菌和黑曲霉有效菌种数比为1~3:1~3:1~3:1~3。
在上述比例的范围内,所制备得到的猪饲料,在胰蛋白等抑制因子含量最低的情况下,其游离氨基酸含量和脲酶活性最佳。
本发明制备猪饲料的方法优选的技术方案中,所述复合菌由浓度为1×107~1×108cfu/ml的纳豆芽孢杆菌、乳酸杆菌、酿酒酵母菌和黑曲霉浓度混合而成。
其中,复合菌中的各菌种的制备具体为:
将纳豆芽孢杆菌通过平板划线方式接种于mnb琼脂固态培养基中培养以活化,从中挑3选纳豆芽孢杆菌挑单菌落接种于mnb液体培养基中,置于180r/min摇床,37℃培养12h,并进一步扩大培养至有效活菌数为1×107~1×108cfu/ml;将酿酒酵母菌划线于ypd固体培养基中培养以活化,从中挑选酿酒酵母菌单菌落接种于ypd液体培养基中,置于180r/min摇床,25℃培养24h,并进一步扩大培养至有效活菌数为1×107~1×108cfu/ml;将乳酸菌划线于mrs固体培养基上培养以活化,从中挑选乳酸菌单菌落接种于mrs液体培养基中,控温42℃,静置厌氧培养48h,并进一步扩大培养至有效活菌数为1×107~1×108cfu/ml;将黑曲霉划线于pda固体培养基上培养以活化,从中挑选黑曲霉接种于pda液体培养基中,置于180r/min摇床,25℃培养48h,并进一步扩大培养至黑曲霉孢子数为1×107~1×108cfu/ml。
本发明制备猪饲料的方法优选的技术方案中,所述加入的复合菌为豆粕重量的8~12%。
本发明制备猪饲料的方法优选的技术方案中,所述大豆饼粕依次经粉碎、按料液比为1~3:1加水稀释、灭菌后再加入复合菌发酵。
本发明制备猪饲料的方法优选的技术方案中,将大豆饼粕粉碎后经高压灭菌15~25min后,加入复合菌发酵,所述高压为103.4kpa。
本发明制备猪饲料的方法优选的技术方案中,所述发酵为固态发酵,发酵的温度为30~35℃,发酵的时间为40~80h。
本发明制备猪饲料的方法优选的技术方案中,所述豆粕经发酵后得到的发酵产物经过40~80℃热风气流干燥烘干后粉碎得到猪饲料。
(三)有益效果
本发明的有益效果是:
本发明选择生长速度快的原核微生物纳豆芽孢杆菌与乳酸菌,和生长速度较慢的真核微生物酿酒酵母与黑曲霉,组合作为复合菌株对大豆饼粕进行发酵,从而去除大豆饼粕中的天然抗营养因子;同时将大豆饼粕中的蛋白质、纤维素、木质素、淀粉等分解为小分子的生物多肽、氨基酸、单糖等,有利于饲养动物对发酵后大豆饼粕的吸收利用,并且,发酵大豆饼粕中残留的酵母蛋白,提供了一种优质的蛋白质来源。
附图说明
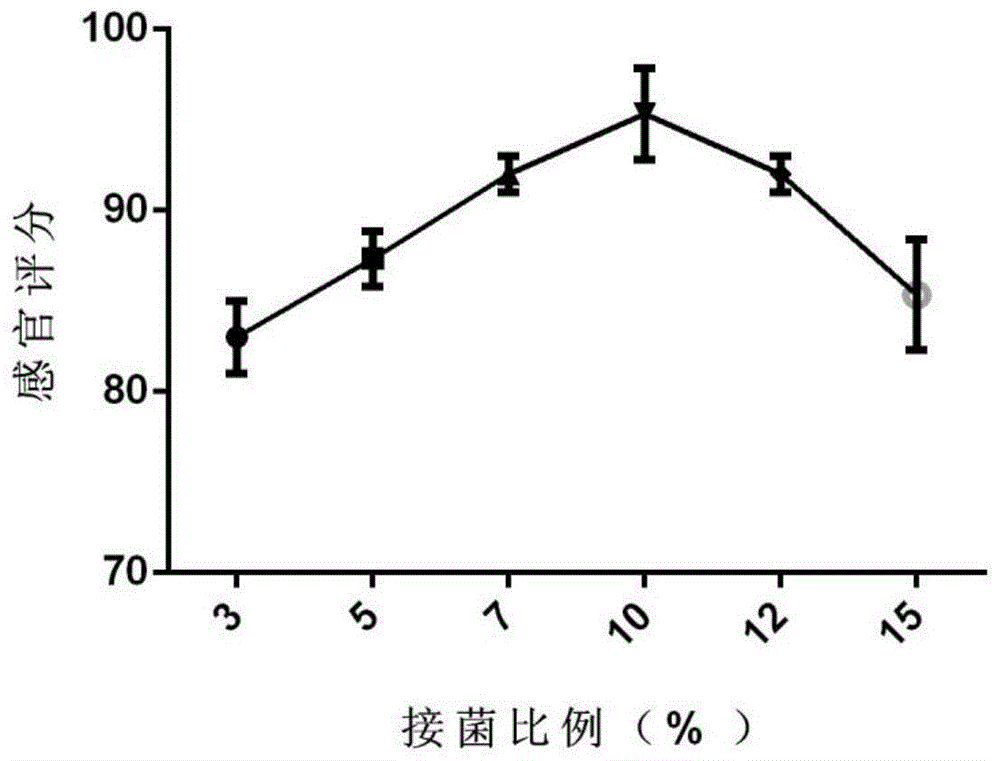
图1:实施例1中复合菌不同接种比例所得的猪饲料感官评分;
图2:实施例2中不同料液比所得的猪饲料感官评分;
图3:实施例3中不同发酵温度所得的猪饲料感官评分;
图4:实施例4中不同发酵时间所得的猪饲料感官评分;
图5:实施例5中不同菌株发酵制得的猪饲料中游离氨基酸总量;
图6:实施例5中不同菌株发酵制得的猪饲料中脲酶活性;
图7:实施例5中不同菌株发酵制得的猪饲料中胰蛋白酶抑制因子含量。
具体实施方式
为了更好的解释本发明,以便于理解,下面结合附图,通过具体实施方式,对本发明作详细描述。
实施例1
发酵大豆饼粕制备猪饲料的方法,具体为:
s1:大豆饼粕的预处理,大豆饼粕先经粉碎成粉末,再按照3:1的料液比加无菌水后,在103.4kpa高压下,温度为121℃,灭菌25min后得到灭菌豆粕。
s2:复合菌的准备:将纳豆芽孢杆菌、乳酸杆菌、酿酒酵母菌和黑曲霉分别活化和扩大培养后得到浓度均为1×107cfu/ml的菌液;将纳豆芽孢杆菌液、乳酸杆菌液、酿酒酵母菌液和黑曲霉液按一定体积比混合均匀后得到有效菌种数比为3:2:1:3复合菌。
其中,复合菌中的各菌种的活化和扩大培养具体为:
将纳豆芽孢杆菌通过平板划线方式接种于mnb琼脂固态培养基中培养以活化,从中挑选纳豆芽孢杆菌挑单菌落接种于mnb液体培养基中,置于180r/min摇床,37℃培养12h,并进一步扩大培养至有效活菌数为1×107cfu/ml;将酿酒酵母菌划线于ypd固体培养基中培养以活化,从中挑选酿酒酵母菌单菌落接种于ypd液体培养基中,置于180r/min摇床,25℃培养24h,并进一步扩大培养至有效活菌数为1×107cfu/mll;将乳酸菌划线于mrs固体培养基上培养以活化,从中挑选乳酸菌单菌落接种于mrs液体培养基中,控温42℃,静置厌氧培养48h,并进一步扩大培养至有效活菌数为1×107cfu/ml;将黑曲霉划线于pda固体培养基上培养以活化,从中挑选黑曲霉接种于pda液体培养基中,置于180r/min摇床,25℃培养48h,并进一步扩大培养至黑曲霉孢子数为1×107cfu/ml。
s3:发酵:将s1得到的灭菌豆粕加入其重量的相应百分比的s2得到的复合菌液进行固态发酵,发酵的温度为32℃,发酵的时间为50h,发酵后得到发酵液;
s4:将s3得到的发酵液经过60℃热风气流干燥烘干后粉碎得到猪饲料。
为验证本实施例中复合菌接种量的不同对所制备得到猪饲料的影响,做如下实验:
将本实施例步骤s3中所加入的复合菌液为豆粕的重量百分比分别设为3%、5%、7%、10%、12%、15%,其他条件按照本实施例所述的方法制备得到六组相应的猪饲料,并依据《gb/t14698-2017饲料显微镜检查方法》并结合猪饲料的实际情况从颜色、气味、触觉三个方面参照表1对猪饲料进行感官评分。
表1感官评价标准表
结果如图1所示,猪饲料的感官品质随接菌比例的增加亦呈现出逐步改善的趋势,当接种量为10%时,猪饲料的感官品质最佳。随着接菌比例的进一步增加,猪饲料的感官品质则呈现出下降的趋势,因此选择复合菌株的接种量为10%。
实施例2
发酵大豆饼粕制备猪饲料的方法,具体为:
s1:大豆饼粕的预处理,大豆饼粕先经粉碎成粉末,再按照一定的料液比加入无菌水稀释后,在103.4kpa高压下,温度为121℃,灭菌20min后得到灭菌豆粕。
s2:复合菌的准备:将纳豆芽孢杆菌、乳酸杆菌、酿酒酵母菌和黑曲霉分别活化和扩大培养后得到浓度均为1×108cfu/ml的菌液;将纳豆芽孢杆菌液、乳酸杆菌液、酿酒酵母菌液和黑曲霉液按一定体积比混合均匀后得到有效菌种数比为2:1:3:2的复合菌。
其中,复合菌中的各菌种的活化和扩大培养具体为:
将纳豆芽孢杆菌通过平板划线方式接种于mnb琼脂固态培养基中培养以活化,从中挑选纳豆芽孢杆菌挑单菌落接种于mnb液体培养基中,置于180r/min摇床,37℃培养12h,并进一步扩大培养至有效活菌数为1×108cfu/ml;将酿酒酵母菌划线于ypd固体培养基中培养以活化,从中挑选酿酒酵母菌单菌落接种于ypd液体培养基中,置于180r/min摇床,25℃培养24h,并进一步扩大培养至有效活菌数为1×108cfu/ml;将乳酸菌划线于mrs固体培养基上培养以活化,从中挑选乳酸菌单菌落接种于mrs液体培养基中,控温42℃,静置厌氧培养48h,并进一步扩大培养至有效活菌数为1×108cfu/ml;将黑曲霉划线于pda固体培养基上培养以活化,从中挑选黑曲霉接种于pda液体培养基中,置于180r/min摇床,25℃培养48h,并进一步扩大培养至黑曲霉孢子数为1×108cfu/ml。
s3:发酵:将s1得到的灭菌豆粕中加入其重量的10%的s2得到的复合菌液,进行固态发酵,发酵的温度为30℃,发酵的时间为80h,发酵后得到发酵液;
s4:将s3得到的发酵液经过50℃热风气流干燥烘干后粉碎得到猪饲料。
将本实施例步骤s1中大豆饼粕粉末按照料液比为1:0.5、1:0.8、1:1、1:1.2、1:1.5加入无菌水,其他条件按照本实施例所述的方法制备得到五组相应的猪饲料,并依据《gb/t14698-2017饲料显微镜检查方法》并结合猪饲料的实际情况从颜色、气味、触觉三个方面参照表1对猪饲料进行感官评分。
感官评分结果由图2所示,当豆粕与水的比例为1:1时,猪饲料的感官品质最优。加水量不足或过多均会影响最终产品的感官品质。可能是由于,豆粕中的可溶性单糖、蛋白质、氨基酸等营养素需要处于水溶液状态才能够被微生物有效利用,如果水量不足,营养素溶出量少,不足以为微生物前期的快速增长提供足够的营养物质。加水量过多会导致营养素与菌体生物量被稀释,且会导致豆粕发酵后质地稀软,为后续干燥工序带来负担。因此,选择最佳的料液比为1:1。
实施例3
发酵大豆饼粕制备猪饲料的方法,具体为:
s1:大豆饼粕的预处理,大豆饼粕先经粉碎成粉末,再按照2:1的料液比加无菌水稀释后,在103.4kpa高压下,温度为121℃,灭菌15min后得到灭菌豆粕。
s2:复合菌的准备:将纳豆芽孢杆菌、乳酸杆菌、酿酒酵母菌和黑曲霉分别活化和扩大培养后得到浓度均为5×107cfu/ml的菌液;将纳豆芽孢杆菌液、乳酸杆菌液、酿酒酵母菌液和黑曲霉液按一定体积比混合均匀后得到有效菌种数比为1:3:2:1的复合菌。
其中,复合菌中的各菌种的活化和扩大培养具体为:
将纳豆芽孢杆菌通过平板划线方式接种于mnb琼脂固态培养基中培养以活化,从中挑选纳豆芽孢杆菌挑单菌落接种于mnb液体培养基中,置于180r/min摇床,37℃培养12h,并进一步扩大培养至有效活菌数为5×107cfu/ml;将酿酒酵母菌划线于ypd固体培养基中培养以活化,从中挑选酿酒酵母菌单菌落接种于ypd液体培养基中,置于180r/min摇床,25℃培养24h,并进一步扩大培养至有效活菌数为5×107cfu/ml;将乳酸菌划线于mrs固体培养基上培养以活化,从中挑选乳酸菌单菌落接种于mrs液体培养基中,控温42℃,静置厌氧培养48h,并进一步扩大培养至有效活菌数为5×107cfu/ml;将黑曲霉划线于pda固体培养基上培养以活化,从中挑选黑曲霉接种于pda液体培养基中,置于180r/min摇床,25℃培养48h,并进一步扩大培养至黑曲霉孢子数为5×107cfu/ml。
s3:发酵:将s1得到的灭菌豆粕中加入其重量的8%的s2得到的复合菌液进行固态发酵,发酵的温度为30℃,发酵的时间为40h,发酵后得到发酵液;
s4:将s3得到的发酵液经过40℃热风气流干燥烘干后粉碎得到猪饲料。
将本实施例步骤s3中的发酵的温度分别设置为于28℃、30℃、33℃、35℃、37℃,其他方法和条件按照本实施例所述的方法和条件制备得到五组相应的猪饲料,并依据《gb/t14698-2017饲料显微镜检查方法》并结合猪饲料的实际情况从颜色、气味、触觉三个方面参照表1对猪饲料进行感官评分。
结果由图3所示,当发酵温度偏低时猪饲料的感官评分随温度增加呈现递增趋势,并且在33℃时达到最高点。此后猪饲料的感官品质呈现显著的下降趋势。分析其原因,可能是由于发酵温度偏低时,微生物生长缓慢,尤其不利于纳豆芽孢杆菌与乳酸菌的生长繁殖,导致这两种菌株的生物量过少,影响猪饲料的感官品质。在温度偏高时,黑曲霉与酿酒酵母的生长受到抑制,同样会不利于豆粕的发酵过程。因此,豆粕的最适发酵温度为33℃。
实施例4
发酵大豆饼粕制备猪饲料的方法,具体为:
s1:大豆饼粕的预处理,大豆饼粕先经粉碎成粉末,再按照1:1的料液比加无菌水稀释后,在103.4kpa高压下,温度为121℃,灭菌15~25min后得到灭菌豆粕。
s2:复合菌的准备:将纳豆芽孢杆菌、乳酸杆菌、酿酒酵母菌和黑曲霉分别活化和扩大培养后得到浓度均为3×107cfu/ml的菌液;将纳豆芽孢杆菌液、乳酸杆菌液、酿酒酵母菌液和黑曲霉液按一定体积比混合均匀后得到有效菌种数比为1:3:1:3的复合菌。
其中,复合菌中的各菌种的活化和扩大培养具体为:
将纳豆芽孢杆菌通过平板划线方式接种于mnb琼脂固态培养基中培养以活化,从中挑选纳豆芽孢杆菌挑单菌落接种于mnb液体培养基中,置于180r/min摇床,37℃培养12h,并进一步扩大培养至有效活菌数为3×107cfu/ml;将酿酒酵母菌划线于ypd固体培养基中培养以活化,从中挑选酿酒酵母菌单菌落接种于ypd液体培养基中,置于180r/min摇床,25℃培养24h,并进一步扩大培养至有效活菌数为3×107cfu/ml;将乳酸菌划线于mrs固体培养基上培养以活化,从中挑选乳酸菌单菌落接种于mrs液体培养基中,控温42℃,静置厌氧培养48h,并进一步扩大培养至有效活菌数为3×107cfu/ml;将黑曲霉划线于pda固体培养基上培养以活化,从中挑选黑曲霉接种于pda液体培养基中,置于180r/min摇床,25℃培养48h,并进一步扩大培养至黑曲霉孢子数为3×107cfu/ml。
s3:发酵:将s1得到的灭菌豆粕中加入其重量的10%的s2得到的复合菌液进行固态发酵,发酵的温度为33℃,发酵到一定的时间后得到发酵液;
s4:将s3得到的发酵液经过80℃热风气流干燥烘干后粉碎得到猪饲料。
将本实施例步骤s3中的发酵的时间分别设置为于40h、45h、50h、55h、60h、65h、70h,其他方法和条件按照本实施例所述的方法和条件制备得到七组相应的猪饲料,并依据《gb/t14698-2017饲料显微镜检查方法》并结合猪饲料的实际情况从颜色、气味、触觉三个方面参照表1对猪饲料进行感官评分。
结果由图4所示,从发酵时间为40h开始,随着发酵时间的延长,猪饲料的感官品质也逐步随之改善。当发酵时间为60h时,猪饲料的品质最佳。但随着发酵时间的进一步延长,猪饲料的感官品质则逐步下降。在发酵过程中,纳豆芽孢杆菌与乳酸菌为原核微生物,其生长速度快于真核微生物酿酒酵母与黑曲霉。发酵时间过短,酿酒酵母与黑曲霉无法有效发挥其生物学功能;发酵时间过长,纳豆芽孢杆菌与乳酸菌逐步转变为劣势菌,生物量逐渐减少,并且一些低分子醛、酮、有机酸、胺类等微生物发酵代谢废物开始在产品中积累,导致猪饲料感官品质下降。因此,最佳发酵时间为60h。
实施例5
发酵大豆饼粕制备猪饲料的方法,具体为:
s1:大豆饼粕的预处理,大豆饼粕先经粉碎成粉末,再按照3:1的料液比加无菌水稀释后,在103.4kpa高压下,温度为121℃,灭菌20min后得到灭菌豆粕。
s2:复合菌的准备:将纳豆芽孢杆菌、乳酸杆菌、酿酒酵母菌和黑曲霉分别活化和扩大培养后得到浓度均为1×107cfu/ml的菌液;将纳豆芽孢杆菌液、乳酸杆菌液、酿酒酵母菌液和黑曲霉液按一定体积比混合均匀后得到有效菌种数比为1:1:1:1的复合菌。
其中,复合菌中的各菌种的活化和扩大培养具体为:
将纳豆芽孢杆菌通过平板划线方式接种于mnb琼脂固态培养基中培养以活化,从中挑选纳豆芽孢杆菌挑单菌落接种于mnb液体培养基中,置于180r/min摇床,37℃培养12h,并进一步扩大培养至有效活菌数为1×107cfu/ml;将酿酒酵母菌划线于ypd固体培养基中培养以活化,从中挑选酿酒酵母菌单菌落接种于ypd液体培养基中,置于180r/min摇床,25℃培养24h,并进一步扩大培养至有效活菌数为1×107cfu/ml;将乳酸菌划线于mrs固体培养基上培养以活化,从中挑选乳酸菌单菌落接种于mrs液体培养基中,控温42℃,静置厌氧培养48h,并进一步扩大培养至有效活菌数为1×107cfu/ml;将黑曲霉划线于pda固体培养基上培养以活化,从中挑选黑曲霉接种于pda液体培养基中,置于180r/min摇床,25℃培养48h,并进一步扩大培养至黑曲霉孢子数为1×107cfu/ml。
s3:发酵:将s1得到的灭菌豆粕中加入其重量的10%的s2得到的复合菌液进行固态发酵,发酵的温度为33℃,发酵的时间为60h,发酵后得到发酵液;
s4:将s3得到的发酵液经过60℃热风气流干燥烘干后粉碎得到猪饲料。
将按照本实施方法制备的猪饲料,与将本实施例s3中的复合菌替换为相同浓度的纳豆芽孢杆菌、乳酸杆菌、酿酒酵母菌或黑曲霉,分别制备得到相应的猪饲料,与本实施例方法制备得到的猪饲料做对照,并将复合菌液替换为相同重量的无菌蒸馏水,制备得到的猪饲料做空白对照。将上述六组的猪肉饲料,分别粉碎后密封保藏于-20℃冰柜中用于检测指标的测定,各指标的测定具体如下:
(1)氨基酸含量的测定:参考《饲料中氨基酸的测定gb/t18246—2000》,采用氨基酸自动分析仪测定。称取适量发酵后豆粕,溶于10ml超纯水,经超声波清洗器超声震荡30min后,12000rpm条件下离心10min,取上清经0.22μm过滤膜过滤后,通过氨基酸分析仪测定游离氨基酸组成及总含量。
(2)胰蛋白酶抑制因子活性的测定:采用苯甲酰-dl-精氨酸-b-硝基替苯氨(bapa)检测法测定猪饲料中的胰蛋白酶抑制因子活性。胰蛋白酶抑制因子能够和胰蛋白酶结合,通过测定底物bapa在胰蛋白酶酶解作用下生成的产物—对硝基苯胺溶液的吸光度,然后与未加酶抑制因子的标准溶液吸光度之差来表示被抑制的胰蛋白酶活性,从而对胰蛋白酶抑制因子的活性进行评价。在385nm(或410nm)下测定溶液吸光度值,规定吸光值减少0.01为1个胰蛋白酶抑制因子单位(tiu)。
胰蛋白酶抑制因子含量(mg/g)=[(样品od385nm—样品空白od385nm)/0.19×1000]×稀释倍数×50/样品质量(g);
(3)尿素酶活性的测定:参照gb/t8622-2006饲料用大豆制品中尿素酶活性的测定方法。
测定结果如图5、6、7所示,复合菌株表现出比单一菌株发酵更大的优势,经复合菌株发酵后得到的猪饲料中的游离氨基酸含量与对照组显著地增加,由5.4%增加至8.3%;且脲酶活性与胰蛋白酶抑制因子含量亦均显著下降,脲酶活性由0.64u/g下降至0.075u/g,胰蛋白酶抑制因子由3.64mg/g下降至0.59mg/g。
- 还没有人留言评论。精彩留言会获得点赞!