包含6′SL和LNT的组合以改善胃肠屏障功能的营养组合物的制作方法
本发明涉及用于改善胃肠屏障的包含6′-唾液酸乳糖(6′sl)和乳糖-n-四糖(lnt)的营养组合物。具体地讲,本发明涉及改善婴儿、幼儿或3岁以上至8岁的儿童的肠屏障功能。
背景技术:
建议所有婴儿采用母乳喂养。然而,在一些情况下,由于某些医学原因,母乳喂养并不足够或不成功,或者母亲不选择母乳喂养。已针对这些情况研发了婴儿配方食品。还研发了用特殊成分丰富母乳或婴儿配方食品的强化剂。在此类情况下,甚至更优选的是提供通过营养干预来改善婴儿和幼儿的肠屏障功能的手段。
在产后发育期间,新生儿肠经历成熟过程,该成熟过程通过建立对大分子和病原菌的结构完整且功能有效的屏障而结束。这种现象被称为肠道闭合,并且似乎受饮食的影响。因此,对婴儿(jpgn,1995,21:383-6)和动物模型(pediatrres,1990,28:31-7)的不同研究表明,母乳喂养中的屏障成熟比配方食品喂养的新生儿更快。这可解释与用母乳喂养的婴儿相比,用配方食品喂养的婴儿的变态反应和感染患病率更高。
婴儿和幼儿的一些特定人群特别需要能够改善肠屏障功能的组合物。此类婴儿和幼儿为例如早产婴儿、低出生体重婴儿、和/或生长迟缓的婴儿或幼儿。实际上,与健康足月婴儿相比,肠屏障在此类婴儿中更易渗透并且更易受伤,并且其结构和功能更不成熟。这继而可导致其他问题,诸如感染或变态反应。对于此类婴儿,用能够改善肠屏障功能的营养组合物来补充药理学管理是特别有利的。
先前已研究了营养成分诸如人乳低聚糖改善肠屏障功能的效果。
wo2013/032674描述了人乳低聚糖可能有利于肠屏障功能。6′sl和lnt在合适的hmo的示例的长列表中被提及。
除了其他hmo,在wo2017/46711(治疗受损粘膜屏障)、wo2017/71716(治疗受损粘膜屏障)、wo2016/91265(降低肠道通透性)和wo2016/66174(保持粘膜完整性)中也描述了lnt的有利效果。在wo2015/091789中,已描述了n-乙酰化低聚糖诸如例如lnt与唾液酸化低聚糖和低聚半乳糖组合降低肠道通透性的有益效果。同样在wo2015/071403中,lnt被描述为促进肠道功能成熟。
增加的肠细胞迁移是粘膜损伤后的重要机制,用于快速恢复致密化的绒毛表面区域上的上皮连续性。tsukahara等人已发现gpr35的激活促进了结肠中的粘膜修复(pharmacologicalresearch123(2017)27–39)。此类机制与改善的胃肠屏障功能、结构、保护和成熟相关,并且具体地与改善的胃肠屏障功能、结构和保护相关。
进一步优化营养组合物对所有婴儿和儿童的肠屏障功能的效果将是有用的。
为了改善婴儿和幼儿的肠屏障功能,显然需要开发合适的方法。
此外,由于这类婴儿或幼儿特别娇弱,因此还需要递送此类健康有益效果的方式应当是特别适合年幼个体(婴儿和幼儿)的方式,该方式不涉及传统的药物干预。
需要以下列方式向这些婴儿或幼儿递送此类健康有益效果:不引发副作用的方式和/或不仅容易递送还能获得父母或健康护理人员广泛认可的方式。
还需要以保持此类递送价格合理且大多数人可负担的方式递送此类有益效果。
因此,至少由于副作用的相关风险,显然需要开发替代方法,而不是传统的药物干预诸如使用药物。
技术实现要素:
如上所述,先前已发现gpr35的激活促进了结肠中的粘膜修复(tsukahara等人,pharmacologicalresearch123(2017)27–39)。本发明基于6′sl和lnt的组合对gpr35受体激活的协同效应的实现,其中该组合的效应大于单独的6′sl和lnt之和(参见实施例2)。因此,已发现6′sl和lnt的组合协同改善肠屏障。
因此,本发明的目的涉及用于改善肠屏障,诸如改善屏障修复、改善屏障成熟、改善屏障结构和/或改善屏障保护的营养组合物。
因此,本发明的一个方面涉及包含6′-唾液酸乳糖(6′sl)和乳糖-n-四糖(lnt)的营养组合物,其用于改善婴儿(年龄在12个月以下的儿童)或幼儿(1岁至不到3岁之间)的胃肠屏障;或包含6′-唾液酸乳糖(6′sl)和乳糖-n-四糖(lnt)的成长乳形式的营养组合物,其用于改善儿童(3岁至不到8岁)的胃肠屏障。
在本发明的一个优选的实施方案中,对胃肠屏障的所述改善为改善的屏障修复,诸如结肠中的粘膜修复,其与gpr35的激活相关。继而,改善屏障修复对于恢复屏障结构和功能是重要的。因此,改善的修复与改善的屏障结构和功能以及屏障保护相关联。
胃肠屏障的成熟、结构、功能和修复均是相关的。适当的胃肠成熟导致适当的胃肠结构和功能,这继而通过适当的屏障保护来维持,并通过适当的屏障修复来恢复。因此,一起考虑或单独考虑的这些方面中的任一个有助于持续降低疾病易感性。
附图说明
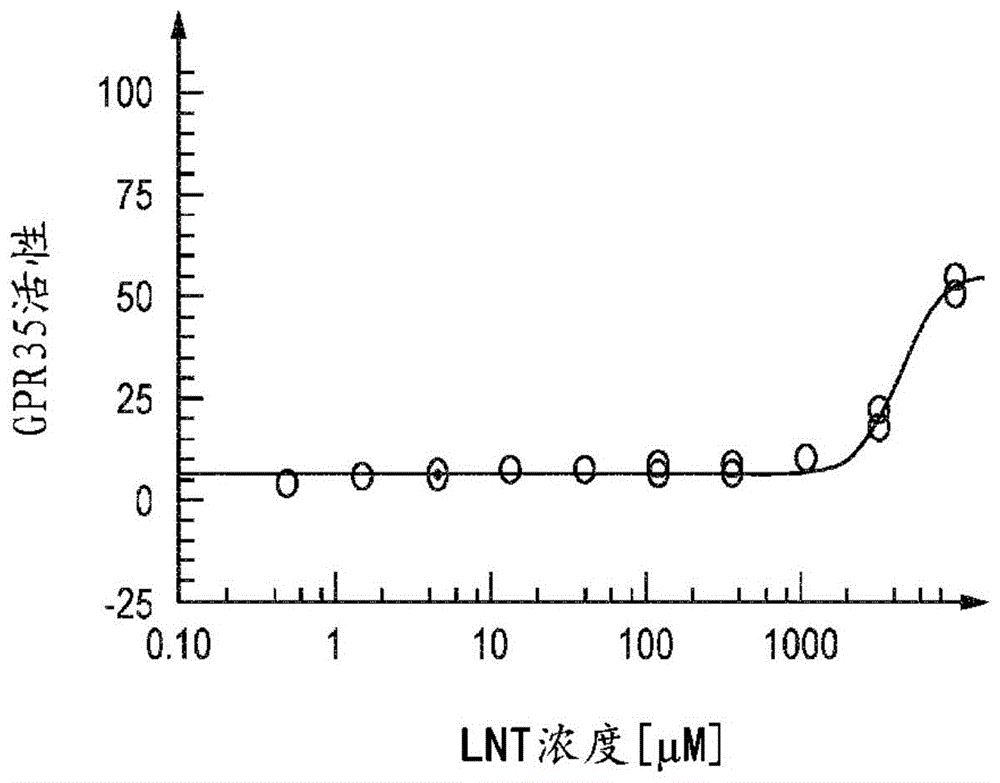
图1:实施例2的基于细胞的测定中gpr35对lnt的体外响应。ec50值为4.5mm。
图2:实施例2的基于细胞的测定中gpr35对6′sl的体外响应。ec50值为6.5mm。
图3:实施例2的基于细胞的测定中gpr35对由6′sl和lnt的混合物组成的hmo混合物的体外响应。ec50值为2.2mm。
图4:用神经氨酸苷酶处理(6′sl)或者用β-半乳糖苷酶处理(lnt)之前和之后6′sl(a)和lnt(b)的hpaec/pad分析,其示出了两种hmo的完全消化。
图5:实施例2的基于细胞的测定中gpr35对由6′sl和lnt的混合物组成的hmo混合物的体外响应(以水平线散列的柱条)相较于经消化的6′sl和lnt的混合物的体外响应(以垂直线散列的柱条)。该图示出了当6′sl和lnt被消化时,受体活性丧失。
现将在下文中更详细地描述本发明。
具体实施方式
定义
在进一步详细讨论本发明之前,首先定义下列术语和惯例。
术语“婴儿”是指年龄在12个月以下的儿童(<12个月)。表述“幼儿”是指年龄介于一岁和小于三岁(≥1岁至<3岁)之间的儿童,也称为学步儿童。表述“儿童”是指年龄介于三岁和小于八岁(≥3岁至<8岁)之间的儿童。
“剖腹产出生的婴儿或幼儿”是指通过剖腹产术分娩的婴儿或幼儿。这意味着婴儿或幼儿不是经阴道分娩的。
“阴道娩出婴儿或幼儿”是指经阴道分娩而不是通过剖腹产术分娩的婴儿或幼儿。
“早产儿”是指不足月出生的婴儿或幼儿。通常是指在妊娠满37周之前出生的婴儿或幼儿。
“低出生体重婴儿”是指由于早产或胎儿生长受限,体重低于2500g(5.5磅)的新生婴儿。因此其涵盖:
-出生时体重为1500g至2500g的婴儿或幼儿(通常称为“低出生体重”或lbw)
-出生时体重为1000g至1500g的婴儿或幼儿(称为“极低出生体重”或vlbw)
-出生时体重不足1000g的婴儿或幼儿(称为“超低出生体重”或elbw)。
“小于胎龄出生的婴儿(sga)”是指出生体重低于相同胎龄婴儿的第10个百分位数的婴孩。
表述“营养组合物”是指供给个体养分的组合物。这种营养组合物通常为口服,并且其通常包括脂质或脂肪源以及蛋白质源。
在一个具体实施方案中,本发明的组合物是低变应原营养组合物。表述“低变应原营养组合物”是指不大可能引起过敏反应的营养组合物。
在一个具体实施方案中,本发明的组合物是“合成营养组合物”。表述“合成的营养组合物”是指通过化学和/或生物方法所获得的混合物,该混合物的化学性质可能与哺乳动物乳汁中天然存在的混合物相同(也就是说,合成的组合物不是母乳)。
如本文所用,表述“婴儿配方食品”是指旨在专用于供给在生命的头几个月期间的婴儿营养,而且本身满足这类人的多种营养需求的食料(符合欧盟委员会2006年12月22日颁发的针对婴儿配方食品和较大婴儿配方食品的第91/321/eec2006/141/ec号指令中第2(c)条的规定)。也是指旨在用于婴儿的营养组合物,并且如在食品法典委员会(法典stan72-1981)和婴儿特殊品(包括针对特殊医学目的的食物)中所定义。表述“婴儿配方食品”既涵盖“1段婴儿配方食品(starterinfantformula)”,也涵盖“2段婴儿配方食品(follow-upformula)”或“较大婴儿配方食品(follow-onformula)”。
“二段婴儿配方食品”或“较大婴儿配方食品”从第6个月开始给予。婴儿配方食品构成了这类人逐渐多样化饮食中的主要液体元素。
表述“婴孩食物”是指旨在专用于供给在生命的头一年期间的婴儿或幼儿营养的食料。
表述“婴儿谷物组合物”是指旨在专用于供给在生命的头一年期间的婴儿或幼儿营养的食料。
表述“成长乳”(或gum)是指通常添加有维生素和矿物质的乳基饮料,其旨在用于幼儿或儿童。
术语“强化剂”是指适于与母乳或婴儿配方食品混合的液体或固体营养组合物。
表述“离乳期”是指在婴儿或幼儿的饮食中逐步用其它食物替代母乳期间的时期。
表述“天龄/周龄/月龄/年龄”和“出生天数/周数/月数/年数”可互换使用。
表述“改善的胃肠屏障”可涵盖下列中的一者或多者:
-改善的屏障修复,诸如(但不限于)胃肠屏障的完整性恢复,诸如被破坏屏障的修复、胃肠粘膜炎性激发时的通透性降低以及粘膜修复。
-改善的屏障成熟,诸如(但不限于)婴儿、优选为早产婴儿的屏障成熟和/或发育。
-改善的屏障结构,诸如(但不限于)胃肠屏障强化、胃肠屏障完整性、紧密连接结构和肠上皮内层完整性。
-改善的屏障功能,诸如改善胃肠屏障抗性、降低胃肠屏障通透性,诸如减少病原体通过肠屏障迁移出肠道,诸如减少共生细菌通过肠屏障迁移出肠道、减少过敏原通过肠屏障迁移出肠道、减少毒性化合物通过肠屏障迁移出肠道以及降低疾病易感性。
-改善的屏障保护,诸如(但不限于)屏障功能障碍的预防、屏障渗漏的预防、紧密连接结构的保护、肠上皮内层完整性的保护。
“母乳”应理解为母亲的乳汁或初乳。
“低聚糖”为含有少量(通常三份至十份)普通糖(单糖)的糖类聚合物。
术语“hmo”或“hmos”或“hmo’s是指人乳低聚糖。这些碳水化合物高度耐受酶促水解,这表明其表现的重要功能可能不与其热值直接相关。本领域已特别指出,这些碳水化合物在婴儿和幼儿的早期发育(诸如,免疫系统的成熟)过程中发挥关键作用。在人乳中发现了许多不同种类的hmo。每种单独的低聚糖都基于葡萄糖、半乳糖、唾液酸(n-乙酰神经氨酸)、岩藻糖和/或n-乙酰基葡糖胺与这些分子间各式各样的键的组合,因此人乳含有大量种类各不相同的低聚糖,迄今已鉴定出逾130种此类结构。几乎所有低聚糖的还原端都有乳糖分子,且非还原端的末端位置都由唾液酸和/或岩藻糖(如果有的话)占据。hmo可以呈酸性(例如,含带电唾液酸的低聚糖)或呈中性(例如,岩藻糖基化低聚糖)。
“岩藻糖基化低聚糖”是具有岩藻糖残基的低聚糖。这种低聚糖呈中性。一些示例为2’fl(2′-岩藻糖基乳糖)、3’fl(3-岩藻糖基乳糖)、二岩藻糖基乳糖、乳糖-n-岩藻五糖(例如,乳糖-n-岩藻五糖i、乳糖-n-岩藻五糖ii、乳糖-n-岩藻五糖iii、乳糖-n-岩藻五糖v)、乳糖-n-岩藻六糖、乳糖-n-二岩藻六糖i、岩藻糖基乳糖-n-六糖、岩藻糖基乳糖-n-新六糖、二岩藻糖基乳糖-n-六糖i、二岩藻糖基乳糖-n-新六糖ii以及这些物质的任意组合。尽管不希望受理论约束,但据信,岩藻糖基化低聚糖的岩藻糖基表位可在粘膜表面处充当“诱饵(decoy)”。该表位可利用竞争效应来防止并/或限制致感染的病原体(病毒或细菌来源)或病原体所分泌物质(如毒素)发挥作用,尤其是避免病原体或病原体所分泌物质与天然配体结合,并且不希望受理论约束,但据信这将因此降低感染/炎症风险,特别是lrt/耳部感染和/或炎症风险。另外,岩藻糖基化低聚糖被认为可促进特定共生微生物的生长和代谢活动,从而降低炎症反应并形成不利于病原体的环境,因此产生定植抗力。
表述“包含2′-岩藻糖基表位的岩藻糖基化低聚糖”和“2-岩藻糖基化低聚糖”涵盖了具有一定同源形式的岩藻糖基化低聚糖,这些同源形式的岩藻糖基化低聚糖都含有2’-岩藻糖基表位,因而可推测它们具有一定同源功能。不希望受理论约束,但据信,这些岩藻糖基化低聚糖的2’-岩藻糖基表位特别针对与lrt和/或耳部感染相关的病原体(或病原体所分泌物质)。
表述“n-乙酰化低聚糖”涵盖“n-乙酰基-乳糖胺”和“含n-乙酰基-乳糖胺的低聚糖”两者。这种低聚糖是具有n-乙酰基-氨基乳糖苷残基的中性低聚糖。合适的示例为lnt(乳糖-n-四糖)、对-乳糖-n-新六糖(对-lnnh)、lnnt(乳糖-n-新四糖)以及它们的任意组合。其它示例为乳糖-n-六糖、乳糖-n-新六糖、对-乳糖-n-六糖、对-乳糖-n-新六糖、乳糖-n-八糖、乳糖-n-新八糖、异-乳糖-n-八糖、对-乳糖-n-八糖和乳糖-n-十糖。
表述“至少一种岩藻糖基化低聚糖”和“至少一种n-乙酰化低聚糖”是指“至少一种类型的岩藻糖基化低聚糖”和“至少一种类型的n-乙酰化低聚糖”。
“hmo前体”是干涉制造hmo的关键化合物,诸如唾液酸和/或岩藻糖。
“唾液酸化低聚糖”是含带电唾液酸的低聚糖,即具有唾液酸残基的低聚糖。这种低聚糖呈酸性。一些示例为3’sl(3′唾液酸乳糖)和6′sl(6′唾液酸乳糖)。
本发明的营养组合物可为固体形式(例如,粉末)或液体形式。各种成分(例如低聚糖)的量在组合物为固体形式(例如粉末)时可按照基于干重的g/100g组合物来表示,或者在组合物是指液体形式时表示为g/l组合物的浓度(后者还涵盖可由粉末在液体(诸如乳、水…)中重构之后获得的液体组合物,例如重构的婴儿配方食品或较大/二段婴儿配方食品或成长乳或婴儿谷物产品或任何其他被设计用于为婴儿提供营养的配制物)。
术语“益生元”是指通过选择地刺激健康细菌(诸如,人类结肠中的双歧杆菌)的生长和/或其活性,而对宿主产生有利作用的非消化性碳水化合物(gibsongr,roberfroidmb.dietarymodulationofthehumancolonicmicrobiota:introducingtheconceptofprebiotics.jnutr.1995;125:1401-12)。
术语“益生菌”是指对宿主的健康或良好状态具有有益效果的微生物细胞制剂或微生物细胞组分。(salminens,ouwehanda.bennoy.等人,“probiotics:howshouldtheybedefined”trendsfoodsci.technol.1999:10107-10)。微生物细胞一般为细菌或酵母。
术语“cfu”应理解为菌落形成单位。
除非另外指明,否则所有百分比均按重量计。
另外,在本发明的上下文中,术语“包含”或“包括”不排除其它可能的要素。本发明的组合物(包括本文所述的多个实施方案)可包含下列要素、由或基本上由下列要素组成:本文所述的本发明的基本要素和必要限制,以及本文所述的或视需求而定的任何另外的或任选的成分、组分或限制。
不能将本说明书中对现有技术文献中的任何参考视为承认此类现有技术为众所周知的技术或形成本领域普遍常识的一部分。
现在开始更详细描述本发明。应当注意,本申请中描述的各个方面、特征、实施例和实施方案可以相容和/或可以组合在一起。
营养组合物
本发明基于6′sl和lnt的组合对gpr35受体激活的协同效应的鉴定。6′sl和lnt对gpr35受体激活的此类协同效应与肠屏障的改善相关。
因此,本发明的一个方面涉及包含6′-唾液酸乳糖(6′sl)和乳糖-n-四糖(lnt)的营养组合物,其用于改善婴儿(年龄在12个月以下的儿童)或幼儿(1岁至不到3岁之间)的胃肠屏障;或
包含6′-唾液酸乳糖(6′sl)和乳糖-n-四糖(lnt)的成长乳形式的营养组合物,其用于改善儿童(3岁至不到8岁)的胃肠屏障。如实施例2所示,已鉴定出6′sl和lnt的组合对gpr35受体激活的协同效应。
还如上所述,改善的屏障修复与gpr35的激活有关(tsukahara等人,pharmacologicalresearch123(2017)27–39)。因此,gpr35受体的激活改善了屏障修复,这被认为对于屏障成熟是重要的。改善的修复/成熟促成改善的屏障结构,这促成改善的屏障保护。因此,在一个实施方案中,对胃肠屏障的所述改善为改善的屏障修复、改善的屏障功能、改善的屏障结构和/或改善的屏障保护。
在另一个实施方案中,对胃肠屏障的所述改善为改善的屏障修复、改善的屏障结构和/或改善的屏障功能。
在一个优选的实施方案中,对胃肠屏障的所述改善为改善的屏障修复。
在另一个实施方案中,所述用途用于改善胃肠屏障的完整性恢复,诸如被破坏屏障的修复、胃肠粘膜炎性激发时的通透性降低以及粘膜修复。
在另一个实施方案中,所述用途用于改善胃肠屏障的强度、改善胃肠屏障抗性、降低疾病易感性、降低胃肠粘膜炎性激发时症状的严重程度和/或降低胃肠屏障通透性。
在另一个实施方案中,所述胃肠屏障通透性的减少是减少病原体、过敏原和/或毒性化合物从肠道穿过肠屏障迁移到身体中。
上述效果/有益效果优选地在小肠中获得。
在一个实施方案中,营养组合物被配制用于施用给婴儿。在一个相关实施方案中,所述婴儿选自早产婴儿、小于胎龄婴儿和低出生体重婴儿,优选地婴儿为早产婴儿。根据本发明的营养组合物被认为对这些类型的婴儿特别有用,因为所述有益效果对于这些婴儿而言比对于“正常”婴儿更重要,因为与健康足月婴儿相比,这些婴儿屏障不太成熟并且更易渗透。
在一个实施方案中,所述营养组合物为婴儿配方食品、1段婴儿配方食品、较大或2段婴儿配方食品、成长乳、婴孩食品、婴儿谷物组合物、强化剂或补充剂,并且用于施用给婴儿或幼儿。
在本发明的一个特别有利的实施方案中,6′sl和lnt以一些特定量存在于营养组合物或成长乳中。
在另外的实施方案中,6′sl和lnt以3:1至1:3诸如2:1至1:2或2:1至1:1的6′sl:lnt重量比存在。在一个特别有利的实施方案中,该比率为2:1或约2.1,优选地该比率为1:1或约1:1。
在另外的实施方案中,6′sl以0.005g/l至5g/l或者基于干重计0.004g至3.8g/100g组合物的量存在。
在另外的实施方案中,lnt以0.005g/l至3g/l或者基于干重计0.004g至2.3g/100g组合物的量存在。
在另一个实施方案中,营养组合物包含:
-6′sl的量为0.24g/l或0.05g/l组合物,和/或其量为基于干重计0.18g或0.04g/100g组合物;和/或
-lnt的量为0.5g/l或0.1g/l组合物,和/或其量为基于干重计0.38g/100g组合物或0.08g/100g组合物。
在本发明的一个优选实施方案中,lnt以0.005-3g/l组合物的量存在于营养组合物或成长乳中。在一些实施方案中,lnt的量可为0.01-1.5g/l组合物,诸如0.04-1.2g/l或0.05-1g/l或0.09-0.8g/l组合物。在一个具体实施方案中,lnt的量为0.5g/l组合物。在另一个具体实施方案中,lnt的量为0.1g/l组合物。
lnt可以基于干重计0.004-2.3g/100g组合物的量存在于营养组合物或成长乳中,lnt可以0.008-1.2g/100g组合物诸如0.03-0.9g/100g或0.04-0.8g/100g或0.07-0.6g/100g组合物的量存在。在一个具体实施方案中,lnt以0.38g/100g组合物的量存在。在另一个具体实施方案中,lnt以0.08g/100g组合物的量存在。
lnt可采用酶转移法,即使用糖基转移酶将供体部分的糖单元转移到受体部分来化学合成,如例如美国专利号5,288,637和wo96/10086中所述。
在本发明的另一个优选实施方案中,营养组合物或成长乳可包含0.005-5g/l、或0.008-2.5g/l、或0.01-1g/l、或0.03-0.7g/l,例如0.04g/l或0.5g/l的6′sl。
根据本发明的营养组合物或成长乳可包含基于干重计每100g组合物0.004-3.8g的6′sl,例如基于干重计每100g组合物0.006-1.9g或0.008-0.8g或0.023-0.5g或0.031-0.4g,例如基于干重计每100g组合物0.18g或0.04g的6′sl。
可通过色谱技术或过滤技术从天然来源(诸如动物乳)中分离出6′sl。另选地,其也可使用特定唾液酸转移酶或唾液酸酶、神经氨酸苷酶,通过生物技术手段,通过基于酶(重组酶或天然酶)的发酵技术、通过化学合成或通过微生物发酵技术来产生。在后一种情况下,微生物可表达其天然酶和底物,或者可经工程化以产生相应的底物和酶。可使用单一微生物培养物或混合培养物。6′sl的形成可由起始于任意聚合度(dp)的受体底物(从dp=1开始)引发。另选地,6′sl可通过由乳糖和游离n′-乙酰神经氨酸(唾液酸)的化学合成来产生。
在本发明的一个具体方面,营养组合物或成长乳包含6′sl和lnt,其中:
-6′sl的量为0.005g/l至5g/l组合物,和/或其量为基于干重计0.004g至3.8g/100g组合物;和/或
-lnt的量为0.005g/l至3g/l组合物,和/或其量为基于干重计0.004g至2.3g/100g组合物。
在本发明的一个具体方面,营养组合物或成长乳包含6′sl和lnt,其中:
-6′sl的量为0.008g/l至2.5g/l组合物,和/或其量为基于干重计0.006g至1.9g/100g组合物;和/或
-lnt的量为0.01g/l至1.5g/l组合物,和/或其量为基于干重计0.008g至1.2g/100g组合物。
在另一个具体实施方案中,本发明的营养组合物或成长乳包含6′sl和lnt,其中:
-6’sl的量为0.01g/l至1g/l组合物,和/或其量为基于干重计0.008g至0.8g/100g组合物;和/或
-lnt的量为0.04g/l至1.2g/l组合物,和/或其量为基于干重计0.03g至0.9g/100g组合物。
在另一个具体实施方案中,本发明的营养组合物或成长乳包含6′sl和lnt,其中:
-6’sl的量为0.03g/l至0.7g/l组合物,和/或其总量为基于干重计0.023g至0.5g/100g组合物;和/或
-lnt的量为0.05g/l至1g/l组合物,和/或其量为基于干重计0.04g至0.8g/100g组合物。
在另一个具体实施方案中,本发明的营养组合物或成长乳包含6′sl和lnt,其中:
-6′sl的量为0.04g/l至0.5g/l组合物,和/或其量为基于干重计0.031g至0.4g/100g组合物;和/或
-lnt的量为0.09g/l至0.8g/l组合物,和/或其量为基于干重计0.07g至0.6g/100g组合物。
在一个具体实施方案中,根据本发明的营养组合物或成长乳包含6′sl和lnt,其中:
-6′sl的量为0.24g/l或0.05g/l组合物,和/或其量为基于干重计0.18g或0.04g/100g组合物;和/或
-lnt的量为0.5g/l或0.1g/l组合物,和/或其量为基于干重计0.38g/100g组合物或0.08g/100g组合物。
在一个具体实施方案中,6′sl以如下量提供于本发明的营养组合物或成长乳中:该量将向消耗其总日剂量为0.003g至6.5g,优选每天0.005-3.3g或0.006-1.3g或0.02-0.9g例如0.024-0.7g的婴儿或幼儿、相应地儿童提供营养组合物或成长乳的正常消耗。
在一个具体实施方案中,lnt以如下量提供于本发明的营养组合物或成长乳中:该量将向消耗其总日剂量为0.003-3.9g,优选每天0.006-2g或0.02-1.6g或0.03-1.3g例如0.05-1g的婴儿或幼儿、相应地儿童提供营养组合物或成长乳的正常消耗。
在本发明的具体实施方案中,本发明的营养组合物或成长乳可包含另外的人乳低聚糖和/或其前体。即使当此类人乳低聚糖不能有效激活gpr35受体时,也可添加这些人乳低聚糖以提供其他健康益处。
因此,在一个具体实施方案中,营养组合物或成长乳还包含至少一种岩藻糖基化低聚糖。可存在一种或若干种类型的岩藻糖基化低聚糖。岩藻糖基化低聚糖实际上可选自包括以下项的列表:2′-岩藻糖基乳糖、3′-岩藻糖基乳糖、二岩藻糖基乳糖、乳糖-n-岩藻五糖(诸如,乳糖-n-岩藻五糖i、乳糖-n-岩藻五糖ii、乳糖-n-岩藻五糖iii、乳糖-n-岩藻五糖v)、乳糖-n-岩藻六糖、乳糖-n-二岩藻六糖i、岩藻糖基乳糖-n-六糖、岩藻糖基乳糖-n-新六糖(诸如,岩藻糖基乳糖-n-新六糖i、岩藻糖基乳糖-n-新六糖ii)、二岩藻糖基乳糖-n-六糖i、二岩藻糖基-乳糖-n-新六糖、二岩藻糖基乳糖-n-新六糖i、二岩藻糖基乳糖-n-新六糖ii、岩藻糖基-对-乳糖-n-六糖、三岩藻基-对-乳糖-n-六糖i以及它们的任意组合。
在一些具体实施方案中,岩藻糖基化低聚糖包含2′-岩藻糖基表位。岩藻糖基化低聚糖例如可选自包括以下项的列表:2′-岩藻糖基乳糖、二岩藻糖基乳糖、乳糖-n-岩藻五糖、乳糖-n-岩藻六糖、乳糖-n-二岩藻六糖、岩藻糖基乳糖-n-六糖、岩藻糖基乳糖-n-新六糖、二岩藻糖基乳糖-n-六糖、二岩藻糖基-乳糖-n-新六糖、二岩藻糖基乳糖-n-新六糖、岩藻糖基-对-乳糖-n-六糖以及它们的任意组合。
在一个具体实施方案中,根据本发明的营养组合物、分别地成长乳包含2’-岩藻糖基乳糖(或2fl、或2’fl、或2-fl或2’-fl)。在一个具体实施方案中,不存在除2’-岩藻糖基乳糖以外的其它类型的岩藻糖基化低聚糖,即,本发明的营养组合物或成长乳仅包含2’-岩藻糖基乳糖作为岩藻糖基化低聚糖。
可通过色谱技术或过滤技术从天然源诸如动物乳来分离岩藻糖基化低聚糖。另选地,也可使用特定岩藻糖基转移酶和/或岩藻糖苷酶,通过生物技术手段,通过使用基于酶(重组酶或天然酶)的发酵技术或微生物发酵技术,来制备岩藻糖基化低聚糖。在后一种情况下,微生物可表达其天然酶和底物,或者可经工程化以产生相应的底物和酶。可使用单一微生物培养物和/或混合培养物。可以最初具有任意聚合度(dp)的受体底物开始形成岩藻糖基化低聚糖,从dp=1开始。另选地,可以通过由乳糖和游离岩藻糖化学合成来制备岩藻糖基化低聚糖。岩藻糖基化低聚糖也可从例如日本协和发酵工业株式会社(kyowa,hakko,kogyo)购得。
在本发明的另一个具体方面,除lnt之外,营养组合物或成长乳还可包含至少一种n-乙酰化低聚糖。可存在一种或若干种类型的n-乙酰化低聚糖。在一些具体实施方案中,n-乙酰化低聚糖为乳糖-n-新四糖(lnnt)、对-乳糖-n-新己糖(对-lnnh)或它们的任意组合。在一些具体实施方案中,n-乙酰化低聚糖为lnnt。在存在lnnt的一些具体实施方案中,营养组合物或成长乳可以lnt:lnnt介于5:1与1:2之间、或2:1至1:1、或2:1.2至2:1.6的比率包含lnt和lnnt。
n-乙酰化低聚糖可采用酶转移法,即使用糖基转移酶将供体部分的糖单元转移到受体部分来化学合成,如例如美国专利号5,288,637和wo96/10086所述。或者,lnnt可以通过将游离的或与低聚糖(例如,乳果糖)结合的酮-己糖(例如,果糖)化学转化成n-乙酰己糖胺或包含n-乙酰己糖胺的低聚糖来制备,如下文中所述:wrodnigg,t.m.;stutz,a.e.(1999)angew.chem.int.ed.38:827-828。然后可将用这种方式制得的n-乙酰基-乳糖胺转移到作为受体部分的乳糖。
在本发明的特别有利的实施方案中,营养组合物或成长乳包含2′-岩藻糖基乳糖(2fl)和/或乳糖-n-新四糖(lnnt)。
在一个具体实施方案中,除6′sl之外,根据本发明的营养组合物或成长乳还可包含其他唾液酸化低聚糖,诸如3′-唾液酸乳糖(3-sl)。
可通过色谱技术或过滤技术从天然源诸如动物乳分离唾液酸化低聚糖。另选地,也可使用特定唾液酸基转移酶或唾液酸酶、神经氨酸苷酶,通过生物技术手段,通过基于酶(重组酶或天然酶)的发酵技术、通过化学合成或通过微生物发酵技术,来制备唾液酸化低聚糖。在后一种情况下,微生物可表达其天然酶和底物,或者可经工程化以产生相应的底物和酶。可使用单一微生物培养物或混合培养物。可以最初具有任意聚合度(dp)的受体底物开始形成唾液酸基低聚糖,从dp=1开始。另选地,可通过由乳糖和游离n′-乙酰神经氨酸(唾液酸)的化学合成来产生唾液酸基乳糖。唾液酸基乳糖也可从例如日本的kyowahakkokogyo商购获得。
在一个实施方案中,该组合物还包含选自lnnt、2′fl、difl和3′sl的一种或多种hmo。
在另一个实施方案中,该组合物还包含选自lnnt、2′fl、difl和3′sl的一种或多种hmo,诸如包含选自lnnt、2′fl、difl和3′sl的两种或更多种hmo,诸如选自lnnt、2′fl、difl和3′sl的三种或更多种hmo,诸如还包含lnnt、2′fl、difl和3′sl中的全部。如实施例2中所述,lnt、6′sl、lnnt、2′fl、difl和3′sl的混合物保持由6′sl和lnt组成的组合的效果。
在一个具体实施方案中,本发明的营养组合物包含由6’sl、lnt、2’fl、difl、lnnt和3’sl组成的低聚糖混合物。
在另一个具体实施方案中,本发明的营养组合物包含由2’fl、lnnt、3’sl和6’sl组成的低聚糖混合物。
在另一个具体实施方案中,本发明的营养组合物包含由2’fl、difl、lnt、3’sl和6’sl组成的低聚糖混合物。
在组合物中不包含另外的hmo也可能是有利的。因此,在一个实施方案中,hmo或其不同于6′sl和lnt的前体不存在于营养组合物中,或者以小于0.1%(w/w),优选地诸如小于0.01%(w/w),或更优选地诸如小于0.001%的总量存在。如实施例2所示,由6′sl和lnt组成的组合对gpr35受体的激活具有协同效应。
根据本发明的营养组合物或成长乳还可包含其他类型的低聚糖(即,除上文所提及的人乳低聚糖之外)和/或至少其纤维和/或至少其前体。其他低聚糖和/或其纤维和/或前体可选自低聚半乳糖(gos)、低聚果糖(fos)、菊粉、低聚木糖(xos)、聚右旋糖以及它们的任意组合。它们的量可介于组合物的0重量%和10重量%之间。在一个具体实施方案中,营养组合物或成长乳还可含有至少一种bmo(牛乳低聚糖)。
可用于制备根据本发明的营养组合物或成长乳的合适商用产品包括fos与菊粉的组合,诸如由beneo公司以商标orafti出售的产品,或者由泰莱公司(tate&lyle)以商标
根据本发明的营养组合物或成长乳可任选地还包含至少一种低聚糖的前体。可存在一种或若干种低聚糖前体。例如,人乳低聚糖的前体为唾液酸、岩藻糖或者它们的混合物。在一些具体实施方案中,该组合物包含唾液酸。
在具体示例中,该营养组合物或成长乳包含0g/l至3g/l的低聚糖的前体,或0g/l至2g/l、或0g/l至1g/l、或0g/l至0.7g/l、或0g/l至0.5g/l、或0g/l至0.3g/l、或0g/l至0.2g/l的低聚糖的前体。以干重计,根据本发明的组合物可含有0g至2.1g低聚糖前体/100g组合物,例如以干重计0g至1.5g、或0g至0.8g、或0g至0.15g低聚糖前体/100g组合物。
本发明的营养组合物或成长乳可还包含至少一种益生菌(或益生菌菌株),诸如益生细菌菌株。
最常用的益生微生物主要是以下属的大部分细菌和酵母:乳酸杆菌属菌种(lactobacillusspp.)、链球菌属菌种(streptococcusspp.)、肠球菌属菌种(enterococcusspp.)、双歧杆菌属菌种(bifidobacteriumspp.)和酵母属菌种(saccharomycesspp.)。
在一些具体实施方案中,益生菌为益生细菌菌株。在一些特定实施方案中,其具体地为双歧杆菌(bifidobacteria)和/或乳酸杆菌(lactobacilli)。
合适的益生细菌菌株包括得自芬兰瓦利奥公司(valiooy,finland)的商标为lgg的鼠李糖乳杆菌(lactobacillusrhamnosus)atcc53103、鼠李糖乳杆菌cgmcc1.3724、副干酪乳杆菌(lactobacillusparacasei)cncmi-2116、约氏乳杆菌(lactobacillusjohnsonii)cncmi-1225、新西兰blis科技有限公司(blistechnologieslimited,newzealand)以商品名ki2销售的唾液链球菌(streptococcussalivarius)dsm13084、丹麦克里斯蒂安汉森公司(christianhansencompany,denmark)以商标bb12特别销售的乳酸双歧杆菌(bifidobacteriumlactis)cncm1-3446、日本森永乳业株式会社(morinagamilkindustryco.ltd.,japan)以商标bb536销售的长双歧杆菌(bifidobacteriumlongum)atccbaa-999、丹尼斯克公司(danisco)以商标bb-03销售的短双歧杆菌(bifidobacteriumbreve)、森永(morinaga)以商标m-16v销售的短双歧杆菌、宝洁公司(procter&gambieco.)以商标bifantis销售的婴儿双歧杆菌(bifidobacteriuminfantis),以及加拿大rosell生物研究所(institutrosell-lallemand)以商标r0070销售的短双歧杆菌。
基于干重,根据本发明的营养组合物或成长乳每g组合物可含有10e3cfu至10e12cfu的益生菌菌株、更优选介于10e7cfu和10e12cfu之间、诸如介于10e8cfu和10e10cfu之间的益生菌菌株。
在另一个实施方案中,所述营养组合物还包含至少一种益生菌,所述至少一种益生菌的量为103至1012cfu/g所述组合物(干重)。
在一个实施方案中,益生菌是活的。在另一个实施方案中,益生菌是非复制的或失活的。在一些其它实施方案中,可同时存在活的益生菌和失活的益生菌。还可添加益生菌组分和代谢物。
在一个实施方案中,本发明的营养组合物是完全营养组合物(满足个体全部或大部分营养需求)。在另一个实施方案中,营养组合物是用来例如补充人乳或者补充婴儿配方食品或较大/二段婴儿配方食品的补充剂或强化剂。
在一些具体实施方案中,本发明的组合物为可旨在针对4月龄、6月龄或12月龄的婴儿配方食品、强化剂或补充剂。在一个优选的实施方案中,本发明的营养组合物是婴儿配方食品。实际上据信,本发明的营养干预在生命的早期阶段(例如,出生后前1、4、6、12个月)进行时可能最有效。
在一些其他实施方案中,本发明的营养组合物是强化剂。强化剂可为母乳强化剂(例如,人乳强化剂)或配方食品强化剂(诸如婴儿配方食品强化剂或较大/二段婴儿配方食品强化剂)。
当营养组合物是补充剂时,其可以单位剂量的形式提供。在此类情况下,特别有用的是,根据施用给婴儿或幼儿的每日剂量来限定6’sl及lnt和任选其它低聚糖的量,诸如上文所述。
本发明的营养组合物可为固体(例如粉末)、液体或凝胶形式。
在一个具体的实施方案中,营养组合物是粉末形式的补充剂,并且以片剂、胶囊剂、锭剂或液体的形式提供在小袋中,诸如将作为液滴分配在母乳或营养组合物中或直接分配在婴儿或幼儿口中的液体。
在另一个实施方案中,补充剂可还含有载体、保护性亲水胶体(诸如胶类、蛋白质、改性淀粉)、粘结剂、成膜剂、包囊剂/材料、壁/壳材料、基质化合物、包衣、乳化剂、表面活性剂、增溶剂(油类、脂肪类、蜡类、卵磷脂类等)、吸附剂、载体、填充剂、共化合物、分散剂、润湿剂、加工助剂(溶剂)、流动剂、掩味剂、增重剂、胶凝剂和凝胶形成剂。补充剂可还含有常规的药物添加剂和佐剂、赋形剂和稀释剂,包括但不限于:水、任何来源的明胶、植物胶、木素磺酸盐、滑石、糖类、淀粉、阿拉伯树胶、植物油、聚亚烷基二醇、风味剂、防腐剂、稳定剂、乳化剂、缓冲剂、润滑剂、着色剂、润湿剂、填充剂等。当补充剂为粉末形式时,其可包含载体。然而,优选的是补充剂不含载体。当补充剂为糖浆形式时,hmo优选溶解或悬浮于用柠檬酸盐酸化的水中。
另外,补充剂可含有维生素、矿物质痕量元素和根据政府机构(诸如usrda)推荐的其它微量营养素。
本发明的营养组合物可为固体(例如粉末)、液体或凝胶形式。在一个具体实施方案中,营养组合物为以1:3至3:1的比率包含6′sl和lnt的补充剂,其中补充剂为粉末形式并且以小袋提供,优选地小袋具有1g至10g的6′sl和lnt的混合物/小袋,或者以糖浆形式提供,优选地糖浆具有5g至75g/100ml(5%至75%(w/v))的总固体浓度。当补充剂为粉末形式时,其可包含载体。然而,优选的是补充剂不含载体。当补充剂为糖浆形式时,hmo优选溶解或悬浮于用柠檬酸盐酸化的水中。
根据本发明的营养组合物或成长乳通常含有蛋白质源。蛋白质的量可为1.6g/100kcal至3g/100kcal。在一些实施方案中,特别是当组合物旨在用于早产婴儿时,蛋白质的量可介于2.4g/100kcal和4g/100kcal之间或超过3.6g/100kcal。在一些其他的实施方案中,蛋白质的量可低于2.0g/100kcal,例如介于1.8g/100kcal至2g/100kcal之间,或者量低于1.8g/100kcal。
只要满足必需氨基酸含量的最低要求并确保令人满意的生长,蛋白质的类型被认为对本发明无关紧要。因此,可使用基于乳清、酪蛋白以及其混合物的蛋白质源,也可使用基于大豆的蛋白质源。就所关注的乳清蛋白质而言,蛋白质源可基于酸乳清或甜乳清或其混合物,并且可包含任何所需比例的α-乳白蛋白和β-乳球蛋白。
在一些有利的实施方案中,蛋白质源以乳清为主(即超过50%的蛋白质来自乳清蛋白质,诸如60%或70%)。
该蛋白质可为完整的或水解的,或为完整蛋白质和水解蛋白质的混合物。所谓的术语“完整的”是指蛋白质的主要部分是完整的,即分子结构未发生改变,例如至少80%的蛋白质未发生改变,诸如至少85%的蛋白质未发生改变,优选至少90%的蛋白质未发生改变,甚至更优选至少95%的蛋白质未发生改变,诸如至少98%的蛋白质未发生改变。在一个具体实施方案中,100%的蛋白质未发生改变。
术语“水解的”是指在本发明的上下文中,蛋白质已被水解或分解成其组成氨基酸。该蛋白质可以是完全水解或部分水解的。例如,对于被认为处于发生牛乳变应性风险的婴儿或幼儿而言,提供部分水解的蛋白质(水解程度介于2%和20%之间)可能是可取的。如果需要水解的蛋白质,则可根据需要并且如本领域已知的那样进行水解过程。例如,可通过在一个或多个步骤中对乳清级分进行酶法水解来制备乳清蛋白质水解产物。如果用作原料的乳清级分基本上不含乳糖,则发现该蛋白质在水解过程期间经受少得多的赖氨酸封闭(lysineblockage)。这使得能够将赖氨酸封闭的程度从约15重量%的总赖氨酸减少至小于约10重量%的赖氨酸;例如约7重量%的赖氨酸,这大大地改善蛋白质源的营养质量。
在本发明的一个实施方案中,至少70%的蛋白质被水解,优选至少80%的蛋白质被水解,诸如至少85%的蛋白质被水解,甚至更优选至少90%的蛋白质被水解,诸如至少95%的蛋白质被水解,特别地至少98%的蛋白质被水解。在一个具体实施方案中,100%的蛋白质被水解。
在一个具体实施方案中,营养组合物的蛋白质是水解的、完全水解的或部分水解的。蛋白质的水解程度(dh)可为介于8和40之间、或介于20和60之间、或介于20和80之间,或超过10、20、40、60、80或90。
另选地,蛋白质组分可替换为混合物或合成氨基酸,例如用于早产或低出生体重婴儿。
在一个具体实施方案中,根据本发明的营养组合物或成长乳是低变应原组合物。在另一个具体实施方案中,根据本发明的组合物是低变应原营养组合物或成长乳。
根据本发明的营养组合物或成长乳通常含有碳水化合物源。这在本发明的营养组合物为婴儿配方食品的情况下是特别优选的。在这种情况下,可使用通常存在于婴儿配方食品中的任何碳水化合物源,诸如乳糖、蔗糖(sucrose)、糖精(saccharose)、麦芽糖糊精、淀粉以及它们的混合物,但是优选的碳水化合物源之一是乳糖。
根据本发明的营养组合物或成长乳通常含有脂质源。这在本发明的营养组合物为婴儿配方食品的情况下为特别相关的。在这种情况下,脂质源可为适合用于婴儿配方食品的任何脂质或脂肪。一些合适的脂肪源包括棕榈油、结构化甘油三酯油、高油酸葵花油和高油酸红花油、中链甘油三酯油。也可添加必需脂肪酸亚油酸和α-亚麻酸,以及少量含有大量预先形成的花生四烯酸和二十二碳六烯酸的油,诸如鱼油或微生物油。脂肪源中n-6脂肪酸与n-3脂肪酸的比例可为约5:1至约15:1;例如约8:1至约10:1。
本发明的营养组合物或成长乳可还含有被认为是日常饮食所必需的且以营养显著量的所必需的所有维生素和矿物质。已确定某些维生素和矿物质的最低需求。矿物质、维生素和任选地存在于本发明组合物中的其他营养物质的示例包括维生素a、维生素b1、维生素b2、维生素b6、维生素b12、维生素e、维生素k、维生素c、维生素d、叶酸、肌醇、烟酸、生物素、泛酸、胆碱、钙、磷、碘、铁、镁、铜、锌、锰、氯、钾、钠、硒、铬、钼、牛磺酸和左旋肉碱。矿物质通常呈盐形式添加。特定矿物质和其它维生素的存在和量将根据目标群体而有所不同。
如有必要,本发明的营养组合物或成长乳可含有乳化剂和稳定剂,诸如大豆、卵磷脂、柠檬酸甘油单酯和柠檬酸甘油二酯等。
本发明的营养组合物或成长乳可还含有可能具有有益效果的其它物质,诸如乳铁蛋白、核苷酸、核苷等。
本发明的营养组合物或成长乳可还含有类胡萝卜素。在本发明的一些具体实施方案中,本发明的营养组合物不包含任何类胡萝卜素。
根据本发明的营养组合物或成长乳可以任何合适的方式制备。现将以举例的方式描述组合物。
例如,可通过将蛋白质源、碳水化合物源和脂肪源以适当的比例共混在一起来制备配方食品诸如婴儿配方食品。如果使用,则乳化剂可在此时加入。可在此时添加维生素和矿物质,但其通常在稍后添加以避免热降解。在共混之前,可先将任何亲脂性维生素、乳化剂等溶解于脂肪源中。然后可混入水(优选经受反渗透的水),以形成液体混合物。水温适宜地在约50℃至约80℃的范围内以有助于分散成分。可使用可商购获得的液化剂来形成液体混合物。
尤其是如果最终产物是液体形式,则可在此阶段加入岩藻糖基化低聚糖和n-乙酰化低聚糖。如果最终产物为粉末,可根据需要同样在此阶段添加这些成分。
然后,例如以两个阶段对液体混合物进行均质化。
然后,可对液体混合物进行热处理以减少细菌载量,例如通过将液体混合物快速加热至约80℃至约150℃的范围内的温度持续介于约5秒和约5分钟之间的持续时间。这可通过蒸汽注入、高压灭菌器或热交换器(例如,板式热交换器)来进行。
然后,例如通过急速冷却将液体混合物冷却至介于约60℃至约85℃之间。然后再次例如分两个阶段对液体混合物进行均质化,其中第一阶段的压力为介于约10mpa至约30mpa,并且第二阶段的压力为介于约2mpa至约10mpa之间。然后可将均质化的混合物进一步冷却以添加任何热敏组分,诸如维生素和矿物质。此时便利地调节均质化的混合物的ph和固体含量。
如果最终产物将为粉末,则将该均质化的混合物转移至合适的干燥装置,诸如喷雾干燥器或冷冻干燥器且将其转化为粉末。该粉末的水分含量应小于约5重量%。还可以或作为替代在此阶段加入岩藻糖基化低聚糖和n-乙酰化低聚糖,方法是通过将其与益生菌菌株(如果使用)干混,或通过以晶体的糖浆形式与益生菌菌株共混,然后对混合物进行喷雾干燥或冷冻干燥。
如果优选液体组合物,可对该均质化的混合物进行灭菌,然后在无菌条件下将其填充至合适的容器中或者先将其填充至容器中并且然后进行蒸馏。
在另一个实施方案中,本发明的组合物可为补充剂。补充剂可以是例如片剂、胶囊、锭剂或液体的形式。补充剂可还含有保护性亲水胶体(诸如胶类、蛋白质、改性淀粉)、粘结剂、成膜剂、包囊剂/材料、壁/壳材料、基质化合物、包衣、乳化剂、表面活性剂、增溶剂(油类、脂肪类、蜡类、卵磷脂类等)、吸附剂、载体、填充剂、共化合物、分散剂、润湿剂、加工助剂(溶剂)、流动剂、掩味剂、增重剂、胶凝剂和凝胶形成剂。补充剂可还含有常规的药物添加剂和佐剂、赋形剂和稀释剂,包括但不限于:水、任何来源的明胶、植物胶、木素磺酸盐、滑石、糖类、淀粉、阿拉伯树胶、植物油、聚亚烷基二醇、风味剂、防腐剂、稳定剂、乳化剂、缓冲剂、润滑剂、着色剂、润湿剂、填充剂等。
另外,补充剂可含有适用于口服或非肠道施用的有机或无机载体材料,以及维生素、矿物质痕量元素和根据政府机构(诸如usrda)推荐的其它微量营养素。
本发明的营养组合物可还用于剖腹产出生或经阴道分娩的婴儿或幼儿。
在一些实施方案中,根据本发明的组合物可用于离乳期之前和/或离乳期期间中。
营养组合物的施用(或给予或喂食)年龄和持续时间可根据需要而确定。
营养组合物可例如在婴儿出生后立即提供。本发明的组合物可还在婴儿的生命的头1周期间、或在生命的头2周期间、或在生命的头3周期间、或在生命的头1个月期间、或在生命的头2个月期间、或在生命的头3个月期间、或在生命的头4个月期间、或在生命的头6个月期间、或在生命的头8个月期间、或在生命的头10个月期间、或在生命的头1年期间、或在生命的头2年期间、或甚至更长时间内给予。在本发明的一些特别有利的实施方案中,营养组合物在婴儿出生后头4、6或12个月内给予(或施用于)所述婴儿。在一些其他实施方案中,本发明的营养组合物在出生之后几天(例如,1天、2天、3天、5天、10天、15天、20天…)、或几周(例如,1周、2周、3周、4周、5周、6周、7周、8周、9周、10周…)或几个月(例如,1个月、2个月、3个月、4个月、5个月、6个月、7个月、8个月、9个月、10个月…)给予。这可以尤其指婴儿是早产儿的情况,但这并不是必需的。
在一个实施方案中,将本发明的组合物作为母乳的补充组合物给予婴儿或幼儿。在一些实施方案中,婴儿或幼儿在至少头2周、头1个月、头2个月、头4个月或头6个月期间接收母乳。在一个实施方案中,本发明的营养组合物在用母乳提供营养的这段时间之后给予婴儿或幼儿,或者在用母乳提供营养这段时间内与母乳一起给予婴儿或幼儿。在另一个实施方案中,在至少一段时间期间(例如,在生命的第1个月、第2个月、第4个月之后),在至少1个月、2个月、4个月或6个月期间,将该组合物作为唯一或主要的营养组合物给予婴儿或幼儿。
在一个实施方案中,本发明的营养组合物是完全营养组合物(满足个体全部或大部分营养需求)。在另一个实施方案中,营养组合物是用来例如补充人乳或者补充婴儿配方食品或较大/二段婴儿配方食品的补充剂或强化剂。
本申请所引用的所有专利和非专利参考文献均据此全文以引用方式并入。
现将在下面的非限制性实施例中进一步详细描述本发明。
实施例
实施例1
下表1给出了根据本发明的营养组合物(例如,婴儿配方食品)的组成的示例。该组合物仅以例证的方式给出。
表1:实施例1的婴儿配方食品的组成
实施例2
测定原理
在体外测定中,针对激活gpr35受体的能力筛选六种人乳低聚糖(lnnt、lnt、2’fl、difl、6′sl和3’sl)。通过discoverx(美国加利福尼亚州菲蒙市(fremont,ca,usa))使用pathhunterβ-arresin测定进行筛选。该测定使用以β-半乳糖苷酶(β-gal)作为功能性报告分子的酶片段互补来监测在培养的细胞中表达的gpr35的激活。酶分裂成两个无活性的互补部分,ea和pk,其在细胞中表达为融合蛋白。ea与β-抑制蛋白融合并且pk与gpr35融合。当gpr35被激活并且β-抑制蛋白募集到受体时,发生pk和ea互补,从而恢复β-gal活性,其使用化学发光检测试剂测量。
方法
gpr35细胞系从冷冻原液扩增并根据标准程序培养。将细胞以20μl的总体积接种到白壁384-孔微板中,并且在测试之前于37℃温育适当的时间。所有测试进行两次。
将hmo样品作为磷酸盐缓冲盐水中的浓缩原液运送到discoverx。在测试日,在pbs中制备5x化合物工作中间体。将5μl量的5x样品添加至细胞并且于室温温育3至5小时。
通过单次添加12.5μl(50%v/v)pathhunter检测试剂混合物,然后于室温温育一小时来产生测定信号。在信号产生后用perkinelmerenvisiontm仪器读取微板,该仪器用于化学发光信号检测。
将扎普司特(已知为gpr35的激活剂)用作阳性对照。
使用下式计算活性百分比:
%活性=100%x(测试样品的平均rlu–溶媒对照的平均rlu)/(平均最大对照配体–溶媒对照的平均rlu)。
通过将所测得的最高浓度(10mm)进行迭代3x稀释来产生剂量响应。
结论
lnt以4.5mm的ec50激活gpr35(图1)。6′sl以6.5mm的ec50激活gpr35(图2)。3’sl、2’fl、difl和lnnt未获得gpr35的激活。
由于发现lnt和6′sl为激活剂,因此组合测试这两种hmo。6′sl和lnt的等摩尔混合物以2.2mm的ec50激活gpr35(图3)。这些结果表明6′sl与lnt之间存在协同作用。
还测试了等摩尔比的所有六种hmo的混合物,其显示出与lnt和6′sl的组合类似的结果。这些结果表明,即使在与其他人乳低聚糖掺混时,lnt和6′sl的协同效果也得以保持。
结论
总之,所呈现的数据显示了6′sl和lnt的组合对gpr35受体激活的协同效应。即使在与其他人乳低聚糖混合时,这种协同效应也得以保持。如上所述,gpr35受体的激活与改善的肠屏障相关。
实施例3
通过消化lnt和6′sl并使用经消化的材料运行gpr35激活测定诸如验证实施例2的试验的结果来进行以下试验。
通过β-半乳糖苷酶消化lnt
使用以下方案,通过从黑曲霉纯化的β-半乳糖苷酶(megazyme,ref:e-aglan)消化lnt:在具有外螺纹的1.5ml螺帽管中,我们将84mg的lnt混合在900μl的100mm乙酸盐缓冲液(ph4.5)和100μl的酶(400u)中。将该管于55℃在thermomix摇动器中以450rpm摇动温育72h。酶的灭活通过于100℃热处理5分钟来完成。将经灭活的管储存于-20℃直至进一步分析。
通过神经氨酸苷酶消化6′sl
使用以下方案,通过从产气荚膜梭菌纯化的神经氨酸苷酶(megazyme,ref:e-sialcp)消化6′sl:在具有外螺纹的1.5ml螺帽管中,我们将78mg的6′sl混合在900μl的50mm磷酸盐缓冲液(ph6.0)和50μl的酶(50u)中。将该管于37℃在thermomix摇动器中以450rpm摇动温育72h。酶的灭活通过于100℃热处理5分钟来完成。将经灭活的管储存于-20℃直至进一步分析。
消化的对照
我们通过使用配有脉冲安培检测的高效阴离子交换色谱(hpaec-pad)对lnt和6′sl进行定量来证实它们消化完成。分析结果提供于图4中。峰清楚地证实lnt和6′sl两者均完全消化。
样品制备、样品测试和结果
将样品以5x浓度稀释于1xpbs(ph~7)中并送至discoverx。如实施例2所述执行gpr35激活测定。结果提供于图5中。gpr35对lnt和6′sl的经消化和未消化混合物的响应显示为对未消化混合物的响应以及对经消化混合物的背景响应,从而表明gpr35对lnt和6′sl的响应的特异性。
- 还没有人留言评论。精彩留言会获得点赞!