海洋红藻膳食纤维的改性方法及应用
1.本发明涉及食品加工技术领域,具体涉及一种海洋红藻膳食纤维的改性方法及应用。
背景技术:
2.海洋红藻如紫菜、江蓠、红毛藻、麒麟菜、龙须菜等是我国沿海特色的食用海藻资源,在江苏、浙江、福建、广东沿海分布较广。红藻富含蛋白质、多糖、氨基酸、游离脂肪酸和维生素,有较高的营养价值,在我国、日本、韩国及东南亚地区具有很长的食用传统。
3.糖基化终末产物(ages)是非酶糖基化反应(maillard反应)的终末产物,是指蛋白质、脂质或核酸等大分子在没有酶参与的条件下,自发的与葡萄糖或其他还原单糖反应所生成的稳定的共价加成物。大量研究表明,ages能加速机体衰老,引起各种慢性退化性疾病,如糖尿病、阿尔茨海默病、动脉粥样硬化等,因此,抑制加工食品中ages的生成和机体对ages吸收可以有效抵抗衰老和预防各种慢性退化性疾病。
4.膳食纤维(dietary fiber,df)主要存在于各种植物的细胞壁中,根据其在水中的溶解性质可将其分为水溶性膳食纤维(soluble dietary fiber,sdf)和水不溶性膳食纤维(insoluble dietary fiber,idf)。研究表明,膳食纤维是体内血糖和血脂代谢机制中的重要调节因子,具有预防心血管疾病、降血压、降血脂、抗氧化、促进肠胃蠕动,缓解胃排空等多种生理功效,因此被称为“第七营养素”。sdf在防治心血管疾病、糖尿病动脉硬化等方面具有良好的作用,并且sdf的生物活性优于idf。因此,对于df进行改性提高sdf含量成为很多研究的重点。
5.膳食纤维的化学结构中含有很多亲水基团,具有优良的持水性能。研究表明,膳食纤维的持水性可以增加人体排便的体积与速度,减轻直肠内压力;同时,也减轻了泌尿系统的压力,缓解了诸如膀胱炎、膀胱结石和肾结石这类泌尿系统疾病的症状。高持水力膳食纤维还可应用于肉制品、小麦粉、面团、面包、饮料等食品中,利于产品组织结构的形成,防止其脱水收缩。因此,提高膳食纤维的持水力(water holding capacity,whc),有利于充分发挥其生理功能,拓展膳食纤维在食品和生物医药领域的应用范围。
技术实现要素:
6.为了实现上述目的,本发明的实施例提出了一种海洋红藻膳食纤维的改性方法,其包括以下步骤:
7.将海洋红藻粉与水混合,倒入高压均质机中均质处理,得到均质后的海洋红藻;
8.向均质后的海洋红藻加入磷酸盐缓冲液混合后,加入热稳定α-淀粉酶溶液,于80-95℃水浴20-60min,冷却,加入蛋白酶液反应20-60min,调节ph至3.0-6.0,再加入淀粉葡糖苷酶,于40-60℃水浴振摇20-60min,得酶解液;
9.向酶解液中加入预热的95%乙醇,于室温下沉淀1-3h,离心,收集沉淀,用78%乙醇洗涤沉淀2-3次,用95%乙醇洗涤沉淀2-3次,丙酮洗涤沉淀2-3次,再将沉淀烘干至恒质
量,得高压均质处理的海洋红藻膳食纤维。
10.根据本发明实施例的一种海洋红藻膳食纤维的改性方法,该方法高压均质处理海洋红藻后,使得改性海洋红藻膳食纤维的水溶性膳食纤维的含量、持水力和持油力均显著提高;对葡萄糖的吸附能力下降;对葡萄糖的延迟透析作用提高;对胆固醇的吸附能力优于未改性的海洋红藻膳食纤维;高压均质改性海洋红藻膳食纤维抑制ages生成的效果高于未改性海洋红藻膳食纤维;高压均质改性海洋红藻膳食纤维对ages诱导的肠caco-2细胞损伤的保护作用优于未改性组。
11.可选地,高压均质时:均质压力400-800bar,均质时间为5-20min。
12.可选地,海洋红藻粉与水按照料液比1:40-1:10w/v混合。
13.可选地,酶解液与乙醇的比例为1:5-1:3。
14.可选地,95%乙醇预热至40-60℃。
15.根据本发明的实施例,本发明还提出上述的改性方法获得的海洋红藻膳食纤维在制备食品热加工过程中抑制ages生成的抑制剂中的应用。
16.根据本发明的实施例,本发明还提出上述的改性方法获得的海洋红藻膳食纤维在制备抑制肠壁细胞吸收ages的药物中的应用。
17.根据本发明的实施例,本发明还提出上述的改性方法获得的海洋红藻膳食纤维在制备控制餐后血糖升高和胆固醇吸收的药物中的应用。
18.由此,为海洋红藻作为热加工食品制品配方,减少美拉德反应潜在有害产物的生成提供了一定的数据支持和理论依据。揭示海洋红藻的食药用功效机理,为海洋红藻作为精准营养食品的开发利用提供理论参考。
19.本发明的附加方面和优点将在下面的描述中部分给出,部分将从下面的描述中变得明显,或通过本发明的实践了解到。
附图说明
20.图1为根据本发明实施例的红毛藻膳食纤维的葡萄糖吸附能力;
21.图2为根据本发明实施例的红毛藻膳食纤维对葡萄糖延迟透析系数的影响;
22.图3为根据本发明实施例的ph2时红毛藻膳食纤维的胆固醇吸附能力;
23.图4为根据本发明实施例的ph7时红毛藻膳食纤维的胆固醇吸附能力;
24.图5为根据本发明实施例的高压均质改性前后红毛藻膳食纤维扫描电子显微镜图;
25.图6为根据本发明实施例的高压均质改性前后bfpdf红外光谱;
26.图7为根据本发明实施例的不同稀释倍数ages对caco-2细胞活力的影响;
27.图8为根据本发明实施例的bfpdf对caco-2细胞活力的影响;
28.图9为根据本发明实施例的hph-bfpdf对caco-2细胞活力的影响;
29.图10为根据本发明实施例的bfpdf和hph-bfpdf体外抑制ages;
30.图11为根据本发明实施例的ages作用于caco-2细胞24h后用不同浓度df处理24h后细胞活力变化;
31.图12为根据本发明实施例的ages于不同浓度df共培养24h后细胞活力变化。
具体实施方式
32.以下通过特定的具体实例说明本发明的技术方案。应理解,本发明提到的一个或多个方法步骤并不排斥在所述组合步骤前后还存在其他方法步骤或在这些明确提到的步骤之间还可以插入其他方法步骤;还应理解,这些实施例仅用于说明本发明而不用于限制本发明的范围。而且,除非另有说明,各方法步骤的编号仅为鉴别各方法步骤的便利工具,而非为限制各方法步骤的排列次序或限定本发明可实施的范围,其相对关系的改变或调整,在无实质变更技术内容的情况下,当亦视为本发明可实施的范畴。
33.为了更好的理解上述技术方案,下面更详细地描述本发明的示例性实施例。虽然显示了本发明的示例性实施例,然而应当理解,可以以各种形式实现本发明而不应被这里阐述的实施例所限制。相反,提供这些实施例是为了能够更透彻地理解本发明,并且能够将本发明的范围完整的传达给本领域的技术人员。
34.本发明采用的试材皆为普通市售品,皆可于市场购得。
35.下面参考具体实施例,对本发明进行描述,需要说明的是,这些实施例仅仅是描述性的,而不以任何方式限制本发明。
36.实施例1红毛藻膳食纤维的提取
37.红毛藻高压均质预处理:称取20.0g红毛藻粉,按照料液比1:30(w/v)加入蒸馏水混匀,将物料倒进进料口,设置均质压力580bar,计时5min,计时结束收集均质后的溶液,于60℃烘箱中干燥至恒重,粉碎过筛得高压均质处理后的红毛藻粉。
38.红毛藻膳食纤维的提取:称取1.0g高压均质处理前或处理后的红毛藻,加入30mlph 6.0的磷酸盐缓冲液,混合均匀后加入热稳定α-淀粉酶溶液,95℃水浴35min,将溶液取出冷却至60℃后,加入蛋白酶液,振摇反应30min,取出溶液后用1mol/l氢氧化钠溶液或1mol/l盐酸溶液调节ph值至4.5,加入淀粉葡糖苷酶继续于60℃水浴中振摇30min。向每份试样酶解液中,按乙醇与试样液体积比4∶1的比例加入预热至60℃的95%乙醇于室温条件下沉淀1h,将酶解液4000rpm/min离心10min,弃除上清,分别用78%乙醇15ml洗涤沉淀2次,用95%乙醇15ml洗涤沉淀2次,丙酮15ml洗涤沉淀2次,将沉淀置于60℃烘箱中烘干至恒质量,得到高压均质处理前的红毛藻膳食纤维(bfpdf)和高压均质处理后的红毛藻膳食纤维(hph-bfpdf)。
39.实施例2红毛藻膳食纤维的性能测试
40.1、持水力:取高压均质处理前后的红毛藻膳食纤维于离心管中,加入去离子水充分混匀,37℃静置12h后离心(4200rpm/min、10min),弃上清液。
[0041][0042]
式中:m1为样品吸水后的湿质量/g;m为样品干质量/g。
[0043]
2、持油力:取高压均质处理前后的红毛藻膳食纤维于离心管中,加入橄榄油充分混匀,在37℃下静置12h后离心(4200rpm/min、10min),弃去上层油层。
[0044][0045]
式中:m1为样品吸油后的质量/g;m为样品干质量/g。
[0046]
3、膨胀力:取高压均质处理前后的红毛藻膳食纤维于量筒中,加入蒸馏水充分混
匀,在37℃下静置12h。
[0047][0048]
式中:v0为初始样品体积/ml;v1为水合样品体积/ml;m为样品干质量/g。
[0049]
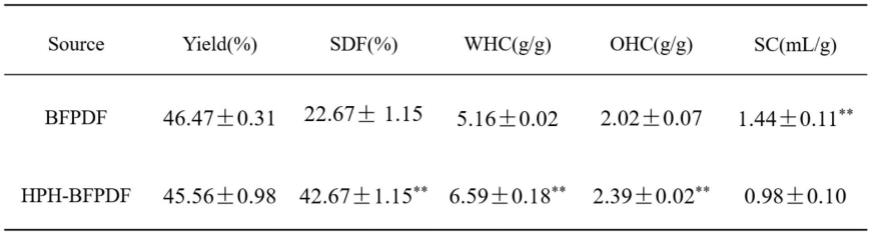
结果如表1所示,高压均质改性后红毛藻膳食纤维(hph-bfpdf)的水溶性膳食纤维的含量、持水力和持油力均显著提高。膳食纤维的大分子中含有许多—oh,可以与h2o分子形成配位键,形成持水力。高压均质改性促使红毛藻膳食纤维中形成了更多聚合度低、具有无定型结构的可溶性膳食纤维,同时,红毛藻膳食纤维的结构更加疏松,更多亲水基团(如—oh)暴露出来,红毛藻膳食纤维的持水力增加。hph-bfpdf由于其复杂的多孔结构使其具有较高持油力,对消化道中脂肪的吸收和排泄可以起到更大的促进作用。
[0050]
表1改性前后红毛藻膳食纤维的得率、水溶性膳食纤维的含量、持水力、持油力和膨胀力
[0051][0052]
4、葡萄糖吸收能力:取bfpdf或hph-bfpdf分别置于100mmol/l的葡萄糖溶液中,37℃孵育30-60min后离心(3000-4500rpm/min、20-30min),用3,5-二硝基水杨酸法测定上清液中葡萄糖含量,以不加样品作为空白对照。
[0053][0054]
式中:c0为葡萄糖溶液质量浓度,mg/ml;c1为上清液中葡萄糖质量浓度,mg/ml。。
[0055]
结果如图1所示,红毛藻膳食纤维对葡萄糖的吸附能力呈现先上升后下降的趋势,在一定浓度范围内,膳食纤维的浓度与其对葡萄糖的吸附能力呈正相关,在膳食纤维添加量为0.05mg/ml时,hph-bfpdf和bfpdf对葡萄糖的吸附率均达到最大,分别为35.05%和37.37%。随着膳食纤维的浓度继续增大,可溶性膳食纤维含量增加,溶液黏度增加,对不溶性膳食纤维吸附葡萄糖起到阻滞作用,导致红毛藻膳食纤维对葡萄糖的吸附能力下降。在相同的浓度下,bfpdf对葡萄糖的吸附能力优于hph-bfpdf,高压均质处理后,膳食纤维的粒径大幅度降低,但过小的粒径在一定程度上影响分子间的作用力,形成氢键,使不溶性膳食纤维形成网状结构导致吸附葡萄糖的能力降低。
[0056]
5、葡萄糖透析延迟指数:将bfpdf和hph-bfpdf加入100mmol/l的葡萄糖溶液中,彻底混合。混合液装入分子截留量为12000~14000da的透析袋中,放入去离子水中,在37℃下进行振荡透析,30-60min后收集透析液。用3,5-二硝基水杨酸法测定葡萄糖含量。没加样品的作为对照。
[0057]
[0058]
式中:c1为样品中葡萄糖扩散浓度,mg/ml;c2为空白对照中葡萄糖扩散浓度,mg/ml。
[0059]
葡萄糖延迟透析系数(gdri)是一个非常有效的预测人体胃肠道葡萄糖被膳食纤维延迟吸收的体外指标,gdri越大说明样品对餐后血糖升高的抑制效果越好。如图2可知,gdri与bfpdf和hph-bfpdf的浓度呈正相关。相比于未改性组,高压均质改性显著提高了红毛藻水膳食纤维的gdri,当df的浓度达到2mg/ml,hph-bfpdf组的gdri达到53.51%。研究发现,多糖黏度对葡萄糖在肠道吸收的延迟程度具有很大影响,高压均质改性一方面使红毛藻膳食纤维中水溶性膳食纤维的含量增加,由此增加的溶液黏度;另一方面高压均质改性后红毛藻水膳食纤维表面出现类似蜂巢状的多孔结构,内部比表面积和孔隙率明显增大,提高了红毛藻膳食纤维对葡萄糖的延迟透析作用。
[0060]
6、胆固醇吸附能力测定:将新鲜蛋黄与纯净水按料液比1:9(g/ml)混合,充分搅打成乳液状态。分别取bfpdf、改性hph-bfpdf与蛋黄乳液混合,将混合物分别调节至ph2.0和ph7.0,然后置于37℃孵育1-2h,3000-4500rpm/min离心15-20min,取上清液,以蛋黄乳液混合物作为空白对照品,550nm处测定吸光度。
[0061][0062]
式中:c0为对照组胆固醇含量/mg;c1为实验组胆固醇含量/mg。
[0063]
结果如图3和图4所示,在ph 2(模拟胃环境)和ph 7(模拟小肠环境)条件下,膳食纤维对胆固醇的吸附能力与膳食纤维的添加浓度呈正相关。当膳食纤维添加量为20mg/ml,bfpdf和hph-bfpdf在模拟胃环境和模拟小肠环境对胆固醇的吸附率到最大值,分别为97.25%,98.77%(ph2)79.85%和81.82%(ph7)。在添加浓度在1.25~10mg/ml的范围内,在相同的浓度条件下,hph-bfpdf对胆固醇的吸附能力优于bfpdf,当膳食纤维达到20mg/ml时,在模拟小肠环境和模拟胃环境的条件下,bfpdf对胆固醇的吸附效果均优于hph-bfpdf。高浓度的膳食纤维由于可溶性膳食纤维含量高,增加溶液粘度,对膳食纤维吸附性能起到阻滞作用,这与葡萄糖吸附实验结果一致。
[0064]
7、扫描电镜:在扫描电子显微镜下观察bfpdf和hph-bfpdf样品的表面和微观结构。将样品粘在双面胶带上并均匀地涂上一层金层,分别在5000倍和10000倍的放大倍数下拍摄显微照片。
[0065]
结果如图5所示,其中,a:未改性红藻膳食纤维(5000
×
);b:未改性红毛藻膳食纤维(10000
×
);c:高压均质红毛藻膳食纤维(5000
×
);d:高压均质红毛藻膳食纤维(10000
×
)。利用扫描电子显微镜对高压均质处理前后红毛藻膳食纤维的微观结构进行观察,未改性的红毛藻膳食纤维结构致密完整;而经高压均质处理后的红毛藻膳食纤维的致密结构被破坏,表皮出现解离断裂,碎片尺寸减小,孔洞数量增多;未高压均质处理的红毛藻膳食纤维整体呈块状,连接密实;高压均质处理后的红毛藻膳食纤维呈现尺寸较为均匀的颗粒结构,放大10000倍后能够清晰地看到类似蜂巢状的多孔结构,内部比表面积和孔隙率明显增大,以上结果表明高压均质处理对红毛藻膳食纤维的结构有明显影响。
[0066]
8、傅里叶红外光谱:样品分子结构的变化由傅立叶红外光谱仪进行检测。将不同的样品与kbr粉末1:100混合压片,在4000-400cm-1范围内以4cm-1的分辨率进行扫描。
[0067]
结果如图6所示,在3200~3500cm-1
内出现强而扩展的吸收峰源于o-h的伸缩振动,
说明在此区域范围内氢键数目较多。3426.51cm-1
处出现的宽吸收峰为纤维素结晶区-oh基团的分子内氢键,高压均质改性后,吸收峰形变宽,吸收强度强度减弱,表明高压均质处理破坏了红毛藻膳食纤维中纤维素晶体结构域的分子内氢键。在2930.01和2931.20cm-1
处的峰值是纤维素-oh基团的分子间氢键,高压均质处理降低了hph-bfpdf 2930cm-1
处的吸收强度。这些结果表明,高压均质改性可以破坏纤维素结晶结构中羟基之间的氢键,从而降低红毛藻膳食纤维的结晶度,增强无序区域。1645cm-1
附近出现强度较大的羧基-cooh吸收峰,是半纤维素羰基c=o非对称收缩振动产生,由半乳糖醛酸的存在引起,说明存在糖醛酸。1033和1032cm-1
处吸收峰,为纤维素或半纤维素c-o-c键特征吸收峰。说明高压均质处理可以有效提高红毛藻膳食纤维的sdf含量和持水力,可以更好的提高红毛藻的营养价值。
[0068]
9、红毛藻膳食纤维对ages生成的抑制作用:用pbs溶解葡萄糖和牛血清蛋白,以未加入红毛藻膳食纤维的为空白对照组,加入高压均质处理前后红毛藻膳食纤维(0.125、0.25、0.5、1、2μg/ml)的为实验组,80-100℃水浴反应1-2h,冷却至室温,9000-12000rpm离心10-20min,取上清液,测定荧光值,计算高压均质处理前后红毛藻膳食纤维对ages的生成抑制率。
[0069][0070]
式中:f0为空白对照组的荧光强度,f1代表实验组的荧光强度。
[0071]
结果如图10所示,ages生成抑制率与红毛藻膳食纤维和高压均质改性红毛藻膳食纤维的添加浓度呈正相关,在相同浓度条件下,hph-bfpdf抑制ages生成的效果高于bfpdf。当浓度达到2mg/ml时,hph-bfpdf对ages的抑制率达到26.77%,而bfpdf的抑制率为22.00%。
[0072]
10、ages对caco-2细胞活力的影响实验:
[0073]
(1)ages溶液制备:用pbs溶解葡萄糖和牛血清蛋白,80-100℃水浴反应1-2h,冷却至室温。
[0074]
(2)caco-2细胞经胰酶消化后,以3
×
105个/孔接种到96孔板中,37℃下孵育24h。孵育结束后,移除细胞上清液,用生长培养基将ages按不同倍数(0、2、4、8、16、32倍)稀释后加入细胞单层中于37℃下继续孵育24h。孵育结束,用磷酸盐缓冲液洗涤细胞后,加入二甲亚砜溶出细胞内甲瓒,振荡20-30min后,于570nm波长处测定光密度(opticaldensity,od)值。以不加ages处理的为对照组。
[0075]
结果如图7所示,不同稀释倍数ages加入caco-2细胞单层中培养24h后,caco-2细胞活力显著下降,随着ages稀释倍数降低,caco-2细胞活力越低。当ages的稀释倍数为8倍时,caco-2细胞活力达到80%以上,因此选择稀释8倍的ages溶液进行后续实验。
[0076]
11、bfpdf和hph-bfpdf对细胞活力的影响实验:
[0077]
caco-2细胞经胰酶消化后,以3
×
105个/孔接种到96孔板中,37℃下孵育24h。孵育结束后,移除细胞上清液,用含不同质量浓度(6.25、12.5、25、50、100、200μg/ml)的bfpdf和hph-bfpdf的生长培养基于37℃下继续孵育24h。孵育结束,用磷酸盐缓冲液洗涤细胞后,加入二甲亚砜溶出细胞内甲瓒,振荡20-30min后,于570nm波长处测定od值。以不加bfpdp和hph-bfpdf组分处理为对照组。
[0078]
结果如图8和图9所示,在6.25~200μg/ml的浓度范围内,红毛藻膳食纤维处理组
caco-2细胞活力均达到95%以上,红毛藻膳食纤维对caco-2细胞没有毒害作用。高压均质改性红毛藻膳食纤维处理组caco-2细胞活力均达到95%以上,红毛藻膳食纤维对caco-2细胞没有毒害作用。
[0079]
12、红毛藻膳食纤维抑制caco-2细胞吸收ages实验:
[0080]
(1)ages24h+df24h:caco-2细胞经胰酶消化后,以3
×
105个/孔接种到96孔板中,37℃下孵育24h。孵育结束后,移除细胞上清液,用生长培养基将ages稀释至原液的1/8后加入细胞单于37℃下继续孵育24h。孵育结束后,移除细胞上清液,用含不同质量浓度(6.25、12.5、25、50、100μg/ml)的bfpdf和hph-bfpdf的生长培养基于37℃下继续孵育24h。用磷酸盐缓冲液洗涤细胞后,加入二甲亚砜溶出细胞内甲瓒。振荡20-30min后,,于570nm波长处测定od值。以不加bfpdp和hph-bfpdf组分处理为对照组。
[0081]
(2)co-culture24h:caco-2细胞经胰酶消化后,以3
×
105个/孔接种到96孔板中,37℃下孵育24h。孵育结束后,移除细胞上清液,用含ages和不同质量浓度(6.25、12.5、25、50、100μg/ml)的bfpdf和hph-bfpdf的生长培养基于37℃下继续孵育24h。用磷酸盐缓冲液洗涤细胞后,加入二甲亚砜溶出细胞内甲瓒。振荡20-30min后,孵育结束后,于570nm波长处测定od值。以不加bfpdp和hph-bfpdf组分处理为对照组。
[0082][0083]
式中:a1、表示ages、bfpdf和hph-bfpdf处理组的od值,a0表示对照组的od值。
[0084]
将ages加入caco-2细胞单层中培养24h后,加入不同浓度未改性红毛藻膳食纤维和高压均质改性红毛藻膳食纤维培养24h,由图11可知,未改性红毛藻膳食纤维和高压均质改性红毛藻膳食纤维能够降低ages引起的caco-2细胞损伤,并呈现剂量依赖趋势。
[0085]
ages与不同浓度未改性红毛藻膳食纤维和高压均质改性红毛藻膳食纤维共同加入caco-2细胞单层中培养24h,由图12可知,未改性红毛藻膳食纤维和高压均质改性红毛藻膳食纤维对ages引起caco-2细胞损伤的保护作用呈现剂量依赖。在相同的浓度条件下,高压均质改性组对caco-2细胞的保护作用优于未改性组。
[0086]
综上,根据本发明的实施例,高压均质改性红毛藻膳食纤维的水溶性膳食纤维的含量、持水力和持油力均显著提高;对葡萄糖的吸附能力下降;对葡萄糖的延迟透析作用提高;对胆固醇的吸附能力优于未改性的红毛藻膳食纤维;高压均质改性红毛藻膳食纤维抑制ages生成的效果高于未改性红毛藻膳食纤维;高压均质改性红毛藻膳食纤维对caco-2细胞的保护作用优于未改性组。
[0087]
在本说明书的描述中,参考术语“一个实施例”、“一些实施例”、“示例”、“具体示例”、或“一些示例”等的描述意指结合该实施例或示例描述的具体特征、结构、材料或者特点包含于本发明的至少一个实施例或示例中。在本说明书中,对上述术语的示意性表述不应理解为必须针对的是相同的实施例或示例。而且,描述的具体特征、结构、材料或者特点可以在任何的一个或多个实施例或示例中以合适的方式结合。此外,本领域的技术人员可以将本说明书中描述的不同实施例或示例进行接合和组合。
[0088]
尽管上面已经示出和描述了本发明的实施例,可以理解的是,上述实施例是示例性的,不能理解为对本发明的限制,本领域的普通技术人员在本发明的范围内可以对上述实施例进行变化、修改、替换和变型。
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1