功能糖与羊乳清蛋白复合的微生态制剂、制备方法及应用
1.本发明属于微生态制剂技术领域,具体属于功能糖与羊乳清蛋白复合的微生态制剂、制备方法及应用。
背景技术:
2.茶源于中国,上古时代的神农就曾对其发现和利用,目前已传播至160多个国家,是全球消费最广泛的植物性饮料。茶叶中中具有多种生理活性活性成分,包括茶多糖,茶多酚,蛋白质,生物碱等物质。其中茶多糖是一类具有生理活性的复合多糖,是一种酸性糖蛋白,并结合有大量的矿质元素,多糖主要由阿拉伯糖、木糖、岩藻糖、葡萄糖、半乳糖等构成。茶多糖具有降血糖,降血脂,调节免疫等功效。茯砖茶是产自陕西,湖南地区的后发酵茶,其在后发酵过程中产生大量的冠突散囊菌(俗称金花菌)而被人们熟知,也形成了茯砖茶独特风味的口感,因此成了西南边疆地区藏族,维吾尔族和蒙古族每日的必须饮品。茯砖茶具有消食健胃,杀腥解腻,降脂减肥,降压降糖,生津御寒的功能,而且茯砖茶越泡越甜,主要因其内含有茶多糖有关。现有的茯砖茶中茶多糖含量处于较低水平,如果日常生活中直接泡饮,人体吸收率较低。
3.羊乳以其营养丰富、易于吸收等优点被视为乳品中的精品,被称为“奶中之王”,是世界上公认的最接近人奶的乳品。羊乳中含有大量的乳清蛋白,且不含牛奶中可致过敏的异性蛋白。所以羊乳比其他奶制品更易消化吸收,不会引起胃部不适、腹泻等乳制品过敏症状发生,是任何体质的人都可以接受的乳制品。羊乳中含有多种对人体有益的免疫球蛋白等活性物质,营养较植物蛋白更均衡,对提高免疫力和抗病毒感染具有一定作用,很适合中老年及患有慢性疾病的特殊人群食用。乳清蛋白是生产奶酪和凝乳过程中的副产品,其中含有一系列具有提高免疫力功效的生物活性物质,包括乳铁传递蛋白,β-乳球蛋白,α-乳白蛋白,糖聚肽和免疫球蛋白等。乳清蛋白在临床上具有广泛的应用,可以作为抗肿瘤,抗高血压,降血脂等疾病的辅助治疗产品。
4.水苏糖是在唇形科,豆科,玄参柯等多种植物中天然存在的功能性低聚糖,作为功能性低聚糖的一种,水苏糖具有gal-α-1,6-gal结构,研究证实这种结构在配合基接收器交感反应的分子机制基础上参与免疫病原体和细胞之间的吸附等生物过程,使得水苏糖具有预防病原体感染,中和毒素和调节免疫系统的功能。
技术实现要素:
5.为了解决现有技术中存在的问题,本发明提供功能糖与羊乳清蛋白复合的微生态制剂、制备方法及应用,将茯砖茶多糖,羊乳清蛋白,水苏糖进行复配制得,上述三种均可提高免疫力的活性物质按照比例进行混合,三者相互协同,体现出更强的免疫效果;
6.为实现上述目的,本发明提供如下技术方案:一种功能糖与羊乳清蛋白复合的微生态制剂,按质量百分比计,包括20%-70%的茯砖茶多糖,20%-70%的羊乳清蛋白和10%-20%的水苏糖。
7.进一步的,所述茯砖茶多糖为与茶色素结合的糖缀合物,所述茶色素含量为0.5%-10%。
8.进一步的,所述羊乳清蛋白为羊乳清蛋白粉末。
9.进一步的,所述水苏糖为地灵提取物,纯度为85%。
10.本发明还提供一种功能糖与羊乳清蛋白复合的微生态制剂的制备方法,将茯砖茶多糖、羊乳清蛋白,水苏糖按照比例混合后,加水复溶,过滤,滤液进行冷冻干燥,得到功能糖与羊乳清蛋白复合的微生态制剂。
11.进一步的,所述茯砖茶多糖的制备步骤具体如下:
12.s1将茯砖茶进行预处理,得到过程产物a;
13.s2过程产物a与水混合加热抽提得到上清液b;
14.s3对上清液b进行减压浓缩,减压浓缩过程中向上清液b中加入上清液b浓缩体积4倍的无水乙醇,静置,得到混合液c;
15.s4混合液c进行抽滤分离后得到多糖沉淀,将多糖沉淀加入水中复溶,得到液体d;
16.s5将液体d真空冷冻干燥,即得到茯砖茶多糖。
17.进一步的,步骤s1中,所述预处理为将茯砖茶粉碎过筛,将茶粉与无水乙醇按照1:(4-6)的料液比混合进行脱脂,得到过程产物a。
18.进一步的,步骤s2中,将得到的过程产物a与10倍体积的蒸馏水混合,在70℃-90℃下水浴1h-2h,抽提得到上清液,水浴2-3次,将两次水浴的上清液合并得到上清液b。
19.进一步的,所述冷冻干燥的温度为-45℃~-50℃,真空度为0.9kpa~1kpa。
20.本发明还提供一种功能糖与羊乳清蛋白复合的微生态制剂的应用,所述微生态制剂作为固体饮料,或成片剂或口服液剂型的保健食品。
21.与现有技术相比,本发明至少具有以下有益效果:
22.目前存在的技术当中,免疫增强剂产品的种类较为单一,效果不够理想,或是产品成分复杂,价格高昂,并且主要以粉末形式为主,产品剂型单一;本发明提供一种功能糖与羊乳清蛋白复合的微生态制剂,使用茯砖茶多糖与羊乳清蛋白,较佳地还添加水苏糖进行复配,各个组分配方简单,原料成本低廉,制备方法简单,致力于开发一种价格较为低廉且可以显著提高机体免疫力的产品。
23.本发明提供一种功能糖与羊乳清蛋白复合的微生态制剂,由茯砖茶多糖,羊乳清蛋白,水苏糖复配制得,该制剂利用茯砖茶已有的茶多糖,通过提取分离,提高了配方制剂内茶多糖的含量,作为一种天然存在的益生元—茯砖茶多糖(富含茶色素)不仅可以降血糖,调节血脂,更是可以调节机体的免疫功能;羊乳清蛋白更接近于人乳,因此较其他乳制品更易被人体消化吸收;水苏糖口感纯正,水溶性好,热稳定性佳,且不易与其他物质发生反应,适合与其他物质混合开发成冲剂,片剂,散剂等制剂,且水苏糖具有预防病原体感染,中和毒素和调节免疫系统的功能。上述三种均可提高免疫力的活性物质可以按照适当比例相互配伍,三者相互协同,相较与单独使用多糖,蛋白或者寡糖而言,能够显著提高机体的免疫应答能力。
24.进一步的,本发明的茯砖茶多糖为与茶色素结合的糖缀合物的褐色粉末,其茶色素含量0.5%-10%,茯砖茶多糖上结合的茶色素可被靶向载运至结肠,促进其多糖-琥珀酸等短链脂肪酸(scfas)的肠菌群依赖性代谢生成,发挥免疫等微生态营养作用;同时茯砖茶
多糖和水苏糖寡糖作为双益生元可选择性增殖乳酸菌等肠道有益菌,进而增强羊乳清蛋白-色氨酸-吲哚丙酸(ipa)等吲哚衍生物在机体肠道菌群中的代谢与营养作用,并增加羊乳清蛋白的胃肠道稳定性,同时羊乳清蛋白可以调节茯砖茶多糖或水苏糖在结肠内的多糖-琥珀酸肠菌群依赖性代谢,对肠道内稳态、粘膜免疫和体内免疫发挥协同增效作用,相较于只使用多糖或者蛋白或寡糖而言,能明显提高机体的免疫应答能力并缓解机体的组织损伤。
25.本发明提供一种功能糖与羊乳清蛋白复合的微生态制剂的制备方法,对复配后的产品使用了冷冻干燥技术,有效避免了茶多糖在进一步加工过程中的损失。除此之外,使用冷冻干燥技术可以提高最终产品组织的松散程度,使得产品具有良好的溶解性和溶解速度,让产品的品质得到大幅度提升。
26.本发明对免疫力低下小鼠的支持功效:与模型组小鼠相比,复合配方组的小鼠体重,脏器指数和形态,体液免疫,细胞免疫,免疫球蛋白水平,短链脂肪酸,琥珀酸,肠道有益菌丰度(乳酸杆菌和双歧杆菌),肠道代谢物紊乱程度等都得到了一定的恢复,由此可以得到本发明的微生态制剂可以增强小鼠的免疫力。
附图说明
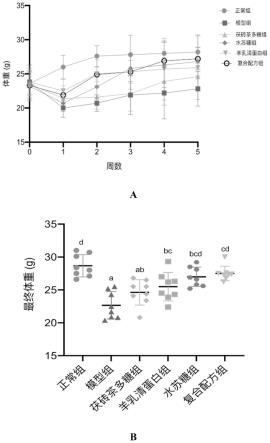
27.图1为本发明对小鼠的体重影响变化图;(a)为5周体重变化图;(b)为小鼠的最终体重图;
28.图2为本发明对小鼠胸腺指数影响图;
29.图3为本发明对小鼠脾脏指数影响图;
30.图4为本发明对小鼠胸腺,脾脏影响的h&e切片染色图;
31.图5为本发明对小鼠迟发性超敏反应影响结果图;
32.图6为本发明对小鼠血清溶血素影响结果图;
33.图7为本发明对小鼠血清igg水平影响结果图;
34.图8为本发明对小鼠血清igm水平影响结果图;
35.图9为本发明对小鼠肠道菌群的影响图;(a)乳酸杆菌,(b)双歧杆菌
36.图10为本发明对小鼠短链脂肪酸和琥珀酸的影响图;(a)总短链脂肪酸;(b)乙酸,丙酸,丁酸;(c)异丁酸,戊酸,异戊酸;(d)琥珀酸
37.图11为小鼠结肠内容物代谢物的聚类分析;
38.图12为小鼠结肠内容物差异代谢物的通路富集分析;
39.图13为小鼠粪便中色氨酸及其代谢物的含量测定;(a)色氨酸;(b)吲哚乙酰胺;(c)吲哚乙酸;(d)吲哚乙酸;(e)吲哚丙酸。
具体实施方式
40.下面结合具体实施例进一步阐述本发明。对于实施例中所用到的具体方法或材料,本领域技术人员可以在本发明技术思路的基础上,根据已有的技术进行常规的替换选择,而不仅限于本发明实施例的具体记载。
41.本发明提供一种功能糖与羊乳清蛋白复合的微生态制剂,按质量百分比计,原料组成为:茯砖茶多糖20%~70%,羊乳清蛋白20%~70%,水苏糖10~20%。
42.本发明提供一种功能糖与羊乳清蛋白复合的微生态制剂的制备方法,具体步骤如下:
43.步骤1:将茯砖茶充分粉碎并过200目标准检验筛,茶粉与无水乙醇按照1:(4~6)的料液比混合搅拌4h脱脂,脱脂后的残渣干燥以挥发尽乙醇,得到过程产物a备用;
44.步骤2:将得到的过程产物a与10倍体积的蒸馏水在烧杯中混合均匀,在70℃~90℃下水浴1~2h,抽提出上清液,水提2~3次,将水浴的上清液合并得到上清液b;
45.步骤3:将上清液b进行减压浓缩至合并前体积的1/5。边搅拌浓缩液边缓慢加入无水乙醇,加入乙醇的总量为浓缩体积的4倍,加入完成后放置于4℃的环境中12h,得到混合液c;
46.步骤4:将步骤3的混合液体c抽滤离心后得到多糖沉淀,离心速度为3500~7000rpm/min,然后将多糖沉淀用蒸馏水复溶,得到过程产物d;
47.步骤5:将液体d放置于玻璃皿中,-80℃环境下冷冻成固体后,放入真空冷冻干燥机中,冻干并收集,即得到茯砖茶多糖;
48.步骤6:取(1)制得的茯砖茶多糖,与羊乳清蛋白,水苏糖按照比例进行混合,加水复溶,待充分搅拌溶解后再次过滤去除不溶物,滤液进行冷冻干燥(冷阱温度为-45—-50℃,真空度为0.9—1kpa)36h,制得混合颗粒,即得到复合制剂。
49.进一步的,按质量百分比计,本发明的微生态制剂的原料组成还可以为:20%~40%的茯砖茶多糖,40%~70%的羊乳清蛋白,10~20%的水苏糖;
50.进一步的,按质量百分比计,本发明的微生态制剂的原料组成还可以为:50%~70%的茯砖茶多糖,20%~40%的羊乳清蛋白,10~20%的水苏糖;
51.进一步的,茯砖茶多糖为与茶色素结合的糖缀合物,所述茶色素含量为0.5%-10%。
52.进一步的,本发明选用的羊乳清蛋白是羊乳清蛋白粉末;
53.进一步的,本发明选用的水苏糖是地灵提取物,纯度为85%;
54.本发明采用具有高品质的冷冻干燥技术对茯砖茶多糖,羊乳清蛋白,水苏糖按比例复配后的复合物进行干制得到最终产品。
55.本发明的微生态制剂可作为固体饮料,或成片剂或口服液剂型的保健食品,应理解本发明微生态制剂的产品剂型可以是多种多样的,包括但不限于固体饮料,散剂,片剂等,应理解,只要能够将本发明在保持全部或部分活性的前提递下送到机体内部的剂型都是可取的。此外,本发明还可以包含其他合适的化学剂,微量元素,充填剂等合适组分,也可以含有一些其他活性物质,促消化剂等。
56.实施例1
57.本实施例提供了一种功能糖与羊乳清蛋白复合的微生态制剂,其中茯砖茶的制备过程包括以下步骤:
58.(1)制备茯砖茶多糖
59.步骤1:茯砖茶充分粉碎并过200目标准检验筛,茶粉与无水乙醇按照1:4的料液比混合搅拌4h脱脂,脱脂后的残渣干燥以挥发尽乙醇,得到过程产物a备用;
60.步骤2:将得到的过程产物a与10倍体积的蒸馏水在烧杯中混合均匀,在70℃下水浴2,抽提出上清液,水提2次,将水浴的上清液合并得到上清液b;
61.步骤3:将上清液b进行减压浓缩至合并前体积的1/5。边搅拌浓缩液边缓慢加入无水乙醇,加入乙醇的总量为浓缩体积的4倍,加入完成后放置4℃的环境中12h,得到混合液c;
62.步骤4:将步骤3的混合液体抽滤离心后得到多糖沉淀,离心速度为3500rpm/min,然后将多糖沉淀用蒸馏水复溶,得到过程产物d;
63.步骤5:将液体d放置于玻璃皿中,-80℃环境下冷冻成固体后,放入真空冷冻干燥机中,冻干并收集,即得到茯砖茶多糖;
64.(2)复配茯砖茶多糖,羊乳清蛋白和水苏糖
65.取步骤(1)制得的茯砖茶多糖,与羊乳清蛋白,水苏糖进行复配,以茯砖茶多糖40%,羊乳清蛋白40%,水苏糖20%进行混合,加水复溶,待充分搅拌溶解再次除去不溶物,滤液进行冷冻干燥滤液进行冷冻干燥(冷阱温度为-45℃,真空度为1kpa)36h,制得混合物颗粒,即得到复配制剂。
66.实施例2
67.本实施例提供了一种功能糖与羊乳清蛋白复合的微生态制剂,其中茯砖茶的制备过程包括以下步骤:
68.(1)制备茯砖茶多糖
69.步骤1:茯砖茶充分粉碎并过200目标准检验筛,茶粉与无水乙醇按照1:5的料液比混合搅拌4h脱脂,脱脂后的残渣干燥以挥发尽乙醇,得到过程产物a备用;
70.步骤2:将得到的过程产物a与10倍体积的蒸馏水在烧杯中混合均匀,在80℃下水浴1.5h,抽提出上清液,水提3次,将水浴的上清液合并得到上清液b;
71.将两次水浴的上清液合并得到过程产物b;
72.步骤3:将上清液b进行减压浓缩至合并前体积的1/5。边搅拌浓缩液边缓慢加入无水乙醇,加入乙醇的总量为浓缩体积的4倍,加入完成后放置4℃的环境中12h,得到混合液c;
73.步骤4:将步骤3的混合液体抽滤离心后得到多糖沉淀,离心速度为5000rpm/min,然后将多糖沉淀用蒸馏水复溶,得到过程产物d;
74.步骤5:将液体d放置于玻璃皿中,-80℃环境下冷冻成固体后,放入真空冷冻干燥机中,冻干并收集,即得到茯砖茶多糖;
75.(2)复配茯砖茶多糖,羊乳清蛋白和水苏糖
76.取(1)制得的茯砖茶多糖,与羊乳清蛋白,水苏糖进行复配,以茯砖茶多糖50%,羊乳清蛋白40%,水苏糖10%进行混合,加水复溶,待充分搅拌溶解再次除去不溶物,滤液进行冷冻干燥滤液进行冷冻干燥(冷阱温度为-45℃,真空度为1kpa)36h,制得混合物颗粒,即得到复配制剂。
77.实施例3
78.本实施例提供了一种功能糖与羊乳清蛋白复合的微生态制剂,其中茯砖茶的制备过程包括以下步骤:
79.(1)制备茯砖茶多糖
80.步骤1:茯砖茶充分粉碎并过200目标准检验筛,茶粉与无水乙醇按照1:6的料液比混合搅拌4h脱脂,脱脂后的残渣干燥以挥发尽乙醇,得到过程产物a备用;
81.步骤2:将得到的过程产物a与10倍体积的蒸馏水在烧杯中混合均匀,在90℃下水浴2h,抽提出上清液,水提2次,将水浴的上清液合并得到上清液b;
82.将两次水浴的上清液合并得到过程产物b;
83.步骤3:将上清液b进行减压浓缩至合并前体积的1/5。边搅拌浓缩液边缓慢加入无水乙醇,加入乙醇的总量为浓缩体积的4倍,加入完成后放置4℃的环境中12h,得到混合液c;
84.步骤4:将步骤3的混合液体抽滤离心后得到多糖沉淀,离心速度为7000rpm/min,然后将多糖沉淀用蒸馏水复溶,得到过程产物d;
85.步骤5:将液体d放置于玻璃皿中,-80℃环境下冷冻成固体后,放入真空冷冻干燥机中,冻干并收集,即得到茯砖茶多糖;
86.(2)复配茯砖茶多糖,羊乳清蛋白和水苏糖
87.取(1)制得的茯砖茶多糖,与羊乳清蛋白,水苏糖进行复配,以茯砖茶多糖60%,羊乳清蛋白20%,水苏糖20%进行混合,加水复溶,待充分搅拌溶解再次除去不溶物,滤液进行冷冻干燥滤液进行冷冻干燥(冷阱温度为-50℃,真空度为0.9kpa)36h,制得混合物颗粒,即得到复配制剂。
88.实施例4
89.本实施例提供了一种功能糖与羊乳清蛋白复合的微生态制剂,其中茯砖茶的制备过程包括以下步骤:
90.(1)制备茯砖茶多糖
91.步骤1:茯砖茶充分粉碎并过200目标准检验筛,茶粉与无水乙醇按照1:5的料液比混合搅拌4h脱脂,脱脂后的残渣干燥以挥发尽乙醇,得到过程产物a备用;
92.步骤2:将得到的过程产物a与10倍体积的蒸馏水在烧杯中混合均匀,在90℃下水浴2h,抽提出上清液,水提3次,将水浴的上清液合并得到上清液b;
93.步骤3:将上清液b进行减压浓缩至合并前体积的1/5。边搅拌浓缩液边缓慢加入无水乙醇,加入乙醇的总量为浓缩体积的4倍,加入完成后放置4℃的环境中12h,得到混合液c;
94.步骤4:将步骤3的混合液体抽滤离心后得到多糖沉淀,离心速度为5000rpm/min,然后将多糖沉淀用蒸馏水复溶,得到过程产物d;
95.步骤5:将液体d放置于玻璃皿中,-80℃环境下冷冻成固体后,放入真空冷冻干燥机中,冻干并收集,即得到茯砖茶多糖;
96.(2)复配茯砖茶多糖,羊乳清蛋白和水苏糖
97.取(1)制得的茯砖茶多糖,与羊乳清蛋白,水苏糖进行复配,以茯砖茶多糖70%,羊乳清蛋20%,水苏糖10%进行混合,加水复溶,待充分搅拌溶解再次除去不溶物,滤液进行冷冻干燥滤液进行冷冻干燥(冷阱温度为-48℃,真空度为1kpa)36h,制得混合物颗粒,即得到复配制剂。
98.实施例5
99.本实施例提供了一种功能糖与羊乳清蛋白复合的微生态制剂,其中茯砖茶的制备过程包括以下步骤:
100.(1)制备茯砖茶多糖
101.步骤1:茯砖茶充分粉碎并过200目标准检验筛,茶粉与无水乙醇按照1:5的料液比混合搅拌4h脱脂,脱脂后的残渣干燥以挥发尽乙醇,得到过程产物a备用;
102.步骤2:将得到的过程产物a与10倍体积的蒸馏水在烧杯中混合均匀,在75℃下水浴1,抽提出上清液,水提2~3次,将水浴的上清液合并得到上清液b;
103.步骤3:将上清液b进行减压浓缩至合并前体积的1/5。边搅拌浓缩液边缓慢加入无水乙醇,加入乙醇的总量为浓缩体积的4倍,加入完成后放置4℃的环境中12h,得到混合液c;
104.步骤4:将步骤3的混合液体抽滤离心后得到多糖沉淀,离心速度为6000rpm/min,然后将多糖沉淀用蒸馏水复溶,得到过程产物d;
105.步骤5:将液体d放置于玻璃皿中,-80℃环境下冷冻成固体后,放入真空冷冻干燥机中,冻干并收集,即得到茯砖茶多糖;
106.(2)复配茯砖茶多糖,羊乳清蛋白和水苏糖
107.取(1)制得的茯砖茶多糖,与羊乳清蛋白,水苏糖进行复配,以茯砖茶多糖40%,羊乳清蛋白50%,水苏糖10%进行混合,加水复溶,待充分搅拌溶解再次除去不溶物,滤液进行冷冻干燥滤液进行冷冻干燥(冷阱温度为-45℃,真空度为1kpa)36h,制得混合物颗粒,即得到复配制剂。
108.实施例6
109.本实施例提供了一种功能糖与羊乳清蛋白复合的微生态制剂,其中茯砖茶的制备过程包括以下步骤:
110.(1)制备茯砖茶多糖
111.步骤1:茯砖茶充分粉碎并过200目标准检验筛,茶粉与无水乙醇按照1:4的料液比混合搅拌4h脱脂,脱脂后的残渣干燥以挥发尽乙醇,得到过程产物a备用;
112.步骤2:将得到的过程产物a与10倍体积的蒸馏水在烧杯中混合均匀,在90℃下水浴1~2h,抽提出上清液,水提2~3次,将水浴的上清液合并得到上清液b;
113.步骤3:将上清液b进行减压浓缩至合并前体积的1/5。边搅拌浓缩液边缓慢加入无水乙醇,加入乙醇的总量为浓缩体积的4倍,加入完成后放置4℃的环境中12h,得到混合液c;
114.步骤4:将步骤3的混合液体抽滤离心后得到多糖沉淀,离心速度为5000rpm/min,然后将多糖沉淀用蒸馏水复溶,得到过程产物d;
115.步骤5:将液体d放置于玻璃皿中,-80℃环境下冷冻成固体后,放入真空冷冻干燥机中,冻干并收集,即得到茯砖茶多糖;
116.(2)复配茯砖茶多糖,羊乳清蛋白和水苏糖
117.取(1)制得的茯砖茶多糖,与羊乳清蛋白,水苏糖进行复配,以茯砖茶多糖20%,羊乳清蛋60%,水苏糖10%进行混合,加水复溶,待充分搅拌溶解再次除去不溶物,滤液进行冷冻干燥滤液进行冷冻干燥(冷阱温度为-45℃,真空度为1kpa)36h,制得混合物颗粒,即得到复配制剂。
118.实施例7
119.本实施例提供了一种功能糖与羊乳清蛋白复合的微生态制剂,其中茯砖茶的制备过程包括以下步骤:
120.(1)制备茯砖茶多糖
121.步骤1:茯砖茶充分粉碎并过200目标准检验筛,茶粉与无水乙醇按照1:5的料液比混合搅拌4h脱脂,脱脂后的残渣干燥以挥发尽乙醇,得到过程产物a备用;
122.步骤2:将得到的过程产物a与10倍体积的蒸馏水在烧杯中混合均匀,在90℃下水浴2h,抽提出上清液,水提3次,将水浴的上清液合并得到上清液b;
123.步骤3:将上清液b进行减压浓缩至合并前体积的1/5。边搅拌浓缩液边缓慢加入无水乙醇,加入乙醇的总量为浓缩体积的4倍,加入完成后放置4℃的环境中12h,得到混合液c;
124.步骤4:将步骤3的混合液体抽滤离心后得到多糖沉淀,离心速度为5000rpm/min,然后将多糖沉淀用蒸馏水复溶,得到过程产物d;
125.步骤5:将液体d放置于玻璃皿中,-80℃环境下冷冻成固体后,放入真空冷冻干燥机中,冻干并收集,即得到茯砖茶多糖;
126.(2)复配茯砖茶多糖,羊乳清蛋白和水苏糖
127.取(1)制得的茯砖茶多糖,与羊乳清蛋白,水苏糖进行复配,以茯砖茶多糖20%,羊乳清蛋白70%,水苏糖10%进行混合,加水复溶,待充分搅拌溶解再次除去不溶物,滤液进行冷冻干燥滤液进行冷冻干燥(冷阱温度为-45℃,真空度为1kpa)36h,制得混合物颗粒,即得到复配制剂。
128.实施例8
129.本实施例提供了一种功能糖与羊乳清蛋白复合的微生态制剂,其中茯砖茶的制备过程包括以下步骤:
130.(1)制备茯砖茶多糖
131.步骤1:茯砖茶充分粉碎并过200目标准检验筛,用无水乙醇1g(1:4)ml的料液比混合搅拌4h脱脂,脱脂后的残渣干燥以挥发尽乙醇,得到过程产物a备用;
132.步骤2:将得到的过程产物a与10倍体积的蒸馏水在烧杯中混合均匀,在90℃下水浴1h,抽提出上清液,水浴2次,将两次水浴的上清液合并得到过程产物b;
133.步骤3:将上清液b进行减压浓缩至合并前体积的1/5。边搅拌浓缩液边缓慢加入无水乙醇,加入乙醇的总量为浓缩体积的4,加入完成后放置4℃的环境中12h,得到混合液c;
134.步骤4:将步骤3的混合液体抽滤离心后得到多糖沉淀,离心速度为5000rpm/min;然后将多糖沉淀用蒸馏水复溶,得到过程产物d;
135.步骤5:将液体d放置于玻璃皿中,-80℃环境下冷冻成固体后,放入真空冷冻干燥机中,冻干并收集,即得到茯砖茶多糖;
136.(2)复配茯砖茶多糖,羊乳清蛋白和水苏糖
137.取(1)制得的茯砖茶多糖,与羊乳清蛋白,水苏糖进行复配,以茯砖茶多糖50%,羊乳清蛋白35%,水苏糖15%进行混合,加水复溶,待充分搅拌溶解再次除去不溶物,滤液进行冷冻干燥,制得混合物颗粒,即得到复配制剂。
138.实施例9
139.本实施例提供了一种功能糖与羊乳清蛋白复合的微生态制剂,其中茯砖茶的制备过程包括以下步骤:
140.(1)制备茯砖茶多糖
141.步骤1:茯砖茶充分粉碎并过200目标准检验筛,用无水乙醇1g(1:4)ml的料液比混合搅拌4h脱脂,脱脂后的残渣干燥以挥发尽乙醇,得到过程产物a备用;
142.步骤2:将得到的过程产物a与10倍体积的蒸馏水在烧杯中混合均匀,在90℃下水浴1h,抽提出上清液,水浴2次,将两次水浴的上清液合并得到过程产物b;
143.步骤3:将上清液b进行减压浓缩至合并前体积的1/5。边搅拌浓缩液边缓慢加入无水乙醇,加入乙醇的总量为浓缩体积的4,加入完成后放置4℃的环境中12h,得到混合液c;
144.步骤4:将步骤3的混合液体抽滤离心后得到多糖沉淀,离心速度为5000rpm/min;然后将多糖沉淀用蒸馏水复溶,得到过程产物d;
145.步骤5:将液体d放置于玻璃皿中,-80℃环境下冷冻成固体后,放入真空冷冻干燥机中,冻干并收集,即得到茯砖茶多糖;
146.(2)复配茯砖茶多糖,羊乳清蛋白和水苏糖
147.取(1)制得的茯砖茶多糖,与羊乳清蛋白,水苏糖进行复配,以茯砖茶多糖35%,羊乳清蛋白50%,水苏糖15%进行混合,加水复溶,待充分搅拌溶解再次除去不溶物,滤液进行冷冻干燥,制得混合物颗粒,即得到复配制剂。
148.实施例10
149.本发明制备出一种益生元复配羊乳清蛋白的微生态制剂,可以作为固体饮料,也可以做成片剂或口服液剂型的保健食品。
150.固体饮料的制备方法:将茶多糖,与羊乳清蛋白,水苏糖按照比例进行混合,经过蒸馏水复溶,待充分搅拌溶解后再次过滤去除不溶物,滤液进行冷冻干燥,制得混合颗粒,即得到为固体饮料。每袋袋重4g,每袋含有茯砖茶多糖1.6g,羊乳清蛋白1.6g,水苏糖0.8mg,该固体饮料的用法用量为:每日一次,每次1袋。
151.片剂的制备方法:将茶多糖,羊乳清蛋白,水苏糖固体颗粒按常规制片剂的方法压成片剂,辅料是常规药学上应用的辅料(如淀粉,硬脂酸镁,糊精等),每片片重为0.8g,每片含有茯砖茶多糖0.4g,羊乳清蛋白0.4g,水苏糖0.2g,该片剂的用法用量为:每日1次,每次3-5片。
152.口服液的制备方法为:将茶多糖,羊乳清蛋白,水苏糖按照比例混合均匀后,经过蒸馏水复溶,高压均质,过滤,按照常规口服液的方法加入药学上的辅助性成分(如调味剂)制成口服液,每瓶5ml,每瓶含有茯砖茶多糖0.8g,羊乳清蛋白0.8g,水苏糖0.4g。该口服液的用法用量为:每日1次,每次2瓶。
153.实施例11
154.为了验证本发明具有宣称的功效,利用本发明实施例1进行了调节小鼠免疫力功能的测定。
155.将72只balb/c小鼠随机分为6个小组(正常组,模型组,茯砖茶多糖组,羊乳清蛋白组,水苏糖组,复合配方组),每组12只,所有小鼠饲养在人工控制的实验室环境条件下,具有良好的卫生和通风条件,温度恒定为22
±
2℃,湿度恒定55-65%,采用12小时昼夜轮换采光。在实验期间,所有小鼠自由饮水和采食标准饲料。适应性饲养一周后,除正常组小鼠外,对其他组小鼠在实验开始的1-3天进行腹腔注射环磷酰胺(80mg/kg
·
bw),制造免疫力低下小鼠模型。造模结束后,正常组和模型组小鼠灌胃蒸馏水0.2ml/(只
·
d),其他组小鼠灌胃800mg/(kg
·
d),每周称量并记录体重,连续灌胃30天后处死,采集各组小鼠的血清,胸腺,
脾脏,肝脏,肠道标本进行各种指标检测。
156.小鼠的体重变化和免疫器官指数变化是评价本发明的指标之一,从图1a可以看出在环磷酰胺造模之后,除正常组小鼠外,其他组小鼠体重显著下降。随着实验的进行,小鼠的体重都有不同程度的增加,其中复合配方组回升最为明显,模型组小鼠体重增加最慢;图1b展示了小鼠最终的体重,可以看出模型组小鼠体重最轻,复合配方组小鼠体重和正常组小鼠的体重最为接近,其他3组小鼠的体重也有不同的回升,说明复合配方制剂无毒性作用,在一定程度上可以维持住小鼠的体重,并且也说明将三种物质复配在一起,比单独使用的效果显著。
157.图2、3可以看出,与正常组小鼠比较,模型组小鼠胸腺、脾脏指数均显著降低(p《0.01),而复合配方组与正常组间差异无统计学意义(p》0.05)。羊乳清蛋白组和水苏糖组在胸腺指数和脾脏指数上无明显差异(p》0.05)。茯砖茶多糖组、羊乳清蛋白组、水苏糖组在恢复小鼠脾脏指数方面无显著性差异。由此可见,茯砖茶多糖组、羊乳清蛋白组、水苏糖组和复合配方组均能不同程度的恢复小鼠免疫器官指数(胸腺、脾脏),其中复合配方组对提高免疫器官指数的效果最明显。
158.图4展示了小鼠胸腺,脾脏的形态学变化。模型组组胸腺皮质较正常组薄。茯砖茶多糖组、羊乳清蛋白组、水苏糖组和复合配方组小鼠皮层淋巴细胞密集,染色深,网状细胞清晰。复合配方组小鼠的胸腺组织与正常组比较接近,说明复合配方组干预可以促进淋巴细胞的发育,修复免疫缺陷引起的胸腺淋巴细胞的减少。模型组小鼠的脾脏滤泡和滤泡中的细胞比其他组小鼠少,且h&e切片显示模型组小鼠脾脏滤泡结构损伤,而茯砖茶多糖、羊乳清蛋白、水苏糖和复合配方均能保护脾滤泡免受ctx损伤,且图中可以看出复合配方组小鼠的胸腺和脾脏结构与正常组小鼠的组织结构最为接近。h&e切片说明茯砖茶多糖,羊乳清蛋白,水苏糖和复合配方制剂均能一定程度保护小鼠胸腺和脾脏结构免受环磷酰胺的作用,在一定程度上维持免疫器官的正常形态。
159.图5为本发明对小鼠迟发性超敏反应影响结果图。与正常组小鼠相比,模型组小鼠足跖骨增厚明显降低(p《0.01),茯砖茶多糖、羊乳清蛋白、水苏糖干预的免疫缺陷小鼠迟发性超敏反应(dth)水平无明显差异(p》0.05)。羊乳清蛋白和复合配方组的dth水平明显高于ctx组(p《0.01),其中复合配方组小鼠的迟发性超敏反应水最接近正常组小鼠(p》0.05)。迟发性超敏反应是ⅳ型细胞介导的迟发型变态反应,图5说明了茯砖茶多糖、羊乳清蛋白、水苏糖和复方配方组都能不同程度提高小鼠细胞免疫能力,其中羊乳清蛋白和复方制剂更显著增加小鼠的细胞免疫能力。
160.用绵羊红细胞(srbc)免疫后血清溶血素的形成显示其体液免疫能力。图6结果显示,免疫抑制组小鼠血清溶血素水平较正常组明显降低(p《0.05),而羊乳清蛋白组和复合配方组小鼠血清溶血素高于模型组(p《0.05)。这说明羊乳清蛋白和复合配方制剂具有提高免疫抑制小鼠体液免疫水平的能力,这可能与乳清蛋白的免疫修复功能的有关。
161.由图7、8可以看出,与正常组小鼠相比,模型组血清中免疫球蛋白(igm、igg)显著降低(p《0.01)。与模型组相比,茯砖茶多糖组、羊乳清蛋白组,水苏糖组和复合配方组血清中igm、igg水平均显著升高(p《0.05)。图7可以看出,茯砖茶多糖组和复合配方组回升血清igm水平最为明显,图8可以看出,羊乳清蛋白和复合配方组回恢复血清igg水平最为明显(p《0.01),且复合配方组血清igm、igg水平升高幅度最大。igm、igg属于机体产生的具有抗体
活力的糖蛋白,茯砖茶多糖、羊乳清蛋白、水苏糖和复方配方组都可以不同程度回升血清中igg、igm水平,其中复合配方组疗效最为显著,同时也说明复合配方制剂具有较好的免疫调节活性。
162.肠道共生菌在诱导机体免疫耐受,维持和促进机体健康方面发挥着至关重要的作用。乳酸杆菌和双歧杆菌作为益生菌,具有良好的免疫调节能力,在维持免疫稳态方面挥着重要的作用。由图9可以看出与正常组相比,模型组小鼠的乳酸杆菌丰度和双歧杆菌丰度都显著性降低(p《0.05),相反,在经过30天的实验干预之后,与模型组相比,茯砖茶多糖组,羊乳清蛋白组,水苏糖组和复合配方组的小鼠菌群丰度都有显著性升高(p《0.05),其中复合配方组恢复乳酸杆菌和双歧杆菌菌群丰度最为明显(p《0.01)。
163.短链脂肪酸和琥珀酸作为一种能量和信号分子,可促进肠上皮细胞增殖,修复受损的肠屏障,调节肠上皮细胞的免疫功能。短链脂肪酸通过调节免疫细胞的基因表达、趋化、分化、增殖和凋亡参与免疫调节测定结肠内容物中短链脂肪酸(乙酸、丙酸、丁酸、异丁酸、戊酸、异戊酸)的含量,结果如图10a-c所示。从图10a可以看出,与正常组相比,环磷酰胺处理导致结肠内容物中总短链脂肪酸(scfas)水平降低(p《0.05)。与模型组小鼠相比,茯砖茶多糖、羊乳清蛋白、水苏糖和复合配方组小鼠总scfas水平分别升高了78.74%、47.89%、66.16%、107.78%。在检测到的6种结肠短链脂肪酸中,乙酸、丙酸和丁酸含量最多,复合配方组处理显著提高了免疫抑制小鼠的这些短链脂肪酸和琥珀酸浓度(图10b和c,p《0.05)。从图10d可以看出羊乳清蛋白,水苏糖和复合配方均能显著提高小鼠肠道内琥珀酸的浓度,其中复合配方组的效果最为明显(p《0.05)。结果表明,茯砖茶多糖、羊乳清蛋白、水苏糖和复合配方均能减轻环磷酰胺诱导的短链脂肪酸和琥珀酸水平下降,其中复合配方组的效果最为显著。
164.图11通过pca(a)和opls-da(b)进行了聚类分析,并证明了免疫力低下模型的建立显著改变了小鼠结肠内容物的代谢谱。另外,复合配方组小鼠的结肠内容物代谢谱也与模型组之间存在显著的差异,表明复配物改善了免疫抑制小鼠体内的代谢物。
165.图12的代谢通路分析证明了免疫力低下模型的建立有可能影响色氨酸代谢和嘧啶代谢,其中最有可能通过影响色氨酸代谢来改善小鼠的免疫抑制的情况。
166.图13分析了色氨酸代谢及其相关的代谢物含量,与正常组比较,模型组,茯茶多糖组,羊乳清蛋白组和水苏糖组小鼠的色氨酸含量都显著性降低(p《0.05),复合配方组没有显著性变化(p》0.05),并发现与模型组比较,复配物的干预可以显著提高小鼠结肠内容物吲哚乙酸,吲哚乙醛和吲哚丙酸的含量,并降低色氨酸和吲哚乙酰胺的含量(p《0.05)。色氨酸作为一种必须从食物中摄取的必需氨基酸,会参与肠道内稳态维持和免疫调节等生理过程。在消化过程中,色氨酸主要在小肠中被吸收,而少部分未被消化和吸收的色氨酸会到达结肠并被肠道菌群分解代谢形成一系列吲哚类代谢物。上述结果表明,复配物可以促进色氨酸代谢形成吲哚乙酰胺,吲哚乙酸,吲哚乙醛和吲哚丙酸,并且这种调节作用可能是通过改变肠道菌群结构实现的。
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1